2. 中国科学院大学,北京 100049;
3. 长白山湿地与生态吉林省联合重点实验室,长春 130102
土壤碳库是陆地系统最的碳库,据估计,全球表层土壤中碳储量在700×1015~2 946×1015 g之间,占陆地生态系统碳储量的2/3[1]。土壤碳库作为大气碳库的汇/源功能的转换对维持全球碳循环过程平衡,减缓温室效应意义重大[2],并受到多种环境因素的制约,其中气候变化已经成为其中最主要、最强大的营力[3-4]。自有气象记录数据以来,气温升高及降水波动成为气候变化的主要特征。最近100年的全球温度线性趋势为0.74℃,其中陆地区域的增温速率要远高于海洋区域,降水在全球呈现波动变化,导致水热通量分配在全球尺度上发生深刻改变[5]。水热波动势必将影响陆地生态系统碳库储量及其与其他碳库的反馈机制。
目前已有的大部分研究从不同层面考察了气候变化对土壤碳库改变的驱动过程及作用机理,包括地表植被格局演变[6]、水文波动[7]、微生物群落变化[8]、土壤呼吸[9]、营养盐供给[10]、有机质分解的敏感性[3]等。虽然这些研究取得了丰富的成果,却鲜有从土壤碳库分子结构特征对气候变化响应机制角度的研究。由于不同的含碳官能团结构对分解的抗性不同,其在环境中的持留时间存在极大差异[11],因此,有机碳官能团结构组成特征在很大程度上决定了土壤中碳库的循环速率与稳定性。
在微观尺度上土壤碳库中化学官能团如何响应气候变化及由其导致的环境条件的改变?土壤中稳定性碳库与不稳定碳库的本质及区分特征是什么?稳定性碳库是否是真的稳定?这一系列重大科学问题目前依然缺乏微观尺度上的机理解读。阐明气候变化与土壤碳库分子结构特征之间的相互作用机制及反馈关系,也是目前气候变与陆地碳循环反馈过程研究中的热点与难点问题[12]。本质上,土壤碳库的输入与输出过程均可归结于分子尺度上含碳官能团结构的化学反应过程。从微观水平回答气候变化背景下土壤碳库分子结构特征及相互转化过程及驱动因素,对于评估未来气候变化情境下土壤碳库稳定性变,制定适应性管理对策具有重要科学意义和指导作用。基于此,本研究综述了目前相关领域研究进展,旨在揭示土壤碳库分子结构特征对气候变化等环境条件改变的响应过程及机理,以期为深入理解土壤碳循环机理提供科学支持,并前瞻未来研究热点。
1 气候变化直接效应对土壤有机碳库分子结构影响 1.1 气温升高气温升高是全球气候变化的最主要特征,其与土壤碳库之间存在极为复杂的或正或负反馈关系,并且已成为影响陆地生态系统碳循环过程的主要营力之一[3]。气温升高通过改变地表植被、土壤菌落及有机碳分解过程影响土壤碳库分子结构特征[13]。在全球尺度上,随着纬度的升高及气温的降低,可溶性有机质的分子结构组成具有规律性[14]。升温将通过改变植被及土壤中微生物碳循环过程影响土壤有机质(SOM)组成,在土壤升温过程中,来源于叶片表皮的角质组成显著增加,而同时其他主要SOM组分(如碳水化合物、软木脂类及木质素)保持相对不变或减少[15]。升温导致土壤中真菌数量增加,而真菌是土壤木质素的主要分解者,这促进了土壤中木质素的氧化程度,降低了碳库的稳定性[16]。气候变化会在分子水平上改变土壤SOM的组成,增加源于叶片表皮的碳在土壤中的累积。考虑到未来气候增温趋势,未来气候变暖将增加土壤中来自叶片表皮的碳累积,这一点在森林生态系统中尤为明显[15]。同时,升温也促进了脂肪族化合物、角质及环状化合物的分解,增强了微生物活性,导致土壤中植物源的烷基结构和微生物源有机质累积[12],虽然一些研究表明,当气温在0.7℃范围内变化时,土壤的性质尤其是SOM的总量对气候变化的响应不显著[17],然而在增温过程中SOM不同分子结构碳组分含量及比例的变化,将不可避免地影响土壤碳库稳定性[17-18]。这一点在室内模拟实验中得到证明,即在缓慢的土壤升温过程中,同土壤矿物相结合的有机碳分子结构特征发生明显变化,表现出多糖类和木质素类大幅减少,而脂类物质则大量增加[19]。
1.2 水文格局改变降水增加将改变地表水文格局,调节植物生长及减缓枯落物分解过程,进而影响土壤碳库储量及碳固定过程[20-21]。降雨量增加将促进湿地土壤固碳速率的增加[22],然而降水及湿地地表水文过程变化是否会影响土壤中有机质分子结构目前却鲜有研究。通过对比不同水源补给沼泽——矿质泥炭沼泽(多水源补给)与雨养泥炭沼泽(仅降水补给),发现前者土壤碳库中C-H键结构更少,表明矿质泥炭较雨养泥炭中具有更多的活性物质,排水及其导致的泥炭分解也影响到土壤SOM结构组成,在未排水的泥炭地中,含有极高的脂肪族化合物,而随着排水程度的增加,C-H键将减少,而C=O键增加,表明有机质分解程度增加,矿化过程加剧[23]。水文过程在根本上控制湿地生态系统关键结构、过程及功能的变化,降水增加或地表水的存在将限制土壤中枯落物及有机质的分解过程,促进土壤碳库的增加[24],然而在此过程中土壤碳库的分子结构特征的变化及其对碳稳定性可能的影响目前却少有研究。此外,水位的波动可通过影响土壤中Fe形态进而控制有机质的化学机构。对青藏高原湿地中水位波动与有机碳化学机构研究表明,土壤中酚类化合物的氧化活性受到Fe2+和水位的控制,随着水位降低,酚类的氧化活性在降低,导致可溶性的芳香族化合物累积[25]。
1.3 大气CO2浓度升高以CO2为代表的温室气体的增加是导致全球增温的主要驱动力,CO2增加不可避免的对土壤中有机碳库的稳定性产生影响。CO2增加作为“碳肥”,能够刺激植物光合作用,在一定程度上提高植物生物量,并增加土壤表层有机物输入。此外,CO2增加更多是通过“微生物泵”(microbial priming effect)影响土壤中的有机碳库稳定性[26]。底层土壤碳库的稳定性在相当大程度上受到碳供应的控制[27],而CO2促进生物量增加并进入土壤中后,随着微生物的分解,其产生的更多的纤维素及葡萄糖成分将促进土壤中“老”的有机碳(old carbon)的矿化,尤其是在草地生态系统中,CO2增加间接性导致土壤中纤维素的增加,将极大促进土壤中底层有机碳的分解,并且其促进作用超过了温度、氮素及氧气增加的贡献,而通常底层土壤中的有机碳被认为是相对稳定的[27-28]。CO2的增加同样可以通过根系和根系分泌物增加土壤中不稳定性碳的含量,并进一步促进微生物活性而导致碳矿化速率加快,从引起土壤中稳定性碳库的活化。大气中CO2浓度的升高将与土壤中“老”有机碳的分解之间形成正反馈关系,降低土壤中有机碳库的稳定性[26]。尽管如此,大气中的CO2增加与土壤碳库中分子结构之间的相互作用及耦合机制目前依然尚缺乏解答。
2 气候变化间接效应对土壤有机碳库分子结构影响 2.1 植被演替气候变化将不可避免的影响陆地生态系统地表植被的演替过程。例如在东北地区湿地中,随着气温升高及地表水位的降低,小叶章北侵趋势明显[29-30]。地表植被覆盖的变化,改变了土壤中植被来源的有机碳分子结构,并影响土壤中碳库的稳定性[31]。在相同的气候区中,优势植被群落的不同导致土壤有机碳的主要官能团差异明显。例如在加利福尼亚地区,橡树群落土壤有机质以羟基碳为主,常绿灌木群落土壤有机质以烷氧基碳为主,而松柏群落土壤有机质以烷基碳为主[32]。不同的植被群落组成,其木质素产生的酚类差异较大。裸子植物只产生香草基酚类,而被子植物则会产生等量的香草基和紫丁香基酚类[33]。这些酚类的差异,代表了木质素在土壤中的分解状况及稳定性。相比于森林而言,草地中土壤中通常具有较高的C/V比(肉桂基/香草基cinnamyl/vanillyl),这主要是由于草本植物中通常含有较高的肉桂基[34]。对瑞典地区沼泽与泥炭丘土壤研究表明,随着地表植被由禾本科演变为藓类,土壤中惰性碳组分,如烷基碳及芳香基碳在不断增加[35]。人类活动引起的地表植被演替,例如由牧场的自然植被转变为农作物甘蔗时,新鲜植物叶片对土壤中有机碳的贡献量明显增加[36]。
2.2 土壤动物扰动气候变化对土壤动物的群落、结构及组成具有显著影响[37],进而通过影响土壤动物群系改变土壤碳库分子结构组成。许多土壤动物,例如蚯蚓、蚂蚁、白蚁等作为土壤工程师,其在土壤中的运动、摄食、筑巢等行为将直接或者间接改变有机碳分子结构[38-39]。研究表明,蚂蚁窝土壤中的有机碳含量低于周围土壤,同时蚂蚁窝也是CO2、N2O等温室气体的排放热点[40-42]。与周围土壤相比,蚂蚁窝土壤中的腐殖酸裂解产物较少,基本在30~40种化合物之间,而对照土壤中腐殖酸的裂解产物较多,基本均在200~300种之间。二者之间除烷基碳差异不明显之外,蚂蚁窝土壤中脂肪族、芳香族、木质素、多糖及酚类化合物明显低于对照土壤,其中木质素与多糖类物质几乎已经完全消失,而含氮化合物和含硫化合物则远高于对照土壤(未发表数据)。尽管如此,土壤动物在土壤碳库的化学结构及稳定性维持中的作用缺乏认知。Snyder等[43]通过对比研究表明,经过引种蚯蚓的土壤与对照土壤中有机碳结构差异不明显,因此推断蚯蚓可能更多影响了通过物理保护机制而被保护的碳组分,然而其并未明确揭示二者的耦合与作用机制。
2.3 微生物活性气候变化通过改变土壤的温度、水分、透气性、营养盐供给等多种方式影响土壤中微生物群落及活性。细菌、真菌及放线菌是土壤中枯落物及有机质最主要的分解者,微生物群落与土壤有机质化学性质之间的相互作用控制着土壤的碳循环过程。Grandy和Neff[13]提出的概念模型指出,在植被残体逐渐分解并最终被保存的过程中,每一步都有微生物的参与,大部分的植物碳必须首先进入到微生物碳库中而后才能释放至其他碳库中,同时随着分解程度加深或者与有机碳被保护的程度不同,其主要的化合物结构也发生显著变化(图 1)。
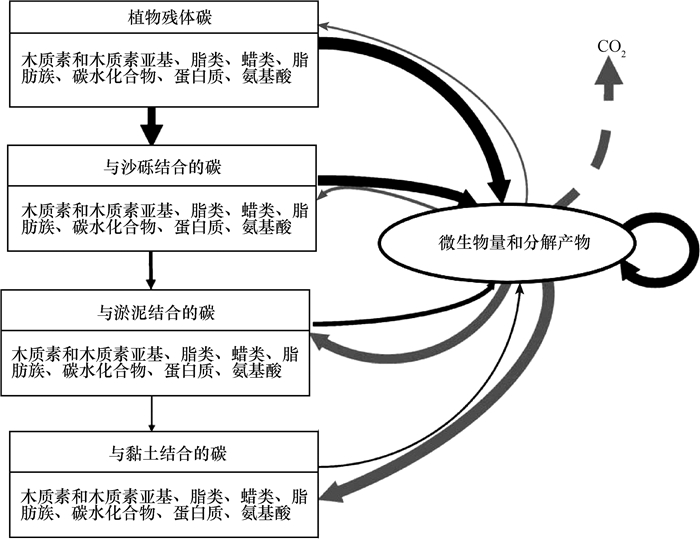
|
图 1 微生物在植被残体分解及与颗粒结合过程中的作用 Fig. 1 Effects of microbe on the processes of decomposition and combination of plant residue with soil particles 注:黑色箭头表示碳的输入,灰色箭头表示碳的输出,箭头的粗细表示碳通量的差异,在方框中的黑色加粗字体表示有机碳主要的化学结构,修改自文献[13] Note: Black arrows stand for input of carbon, grey arrows for output of carbon, thickness of the arrow for flux of the carbon flow, and the black bold letters in the box for main chemicalstructure of the organic carbon, and revision is cited from the literature[13] |
土壤中有机碳中含有N原子的结构通常与微生物有关。例如吡啶(pyridine)和吡咯(pyrrole)的丰度与真菌/细菌比例显著负相关,而木质素的派生物与真菌/细菌比例显著正相关[44]。真菌是土壤中木质素最主要的分解者[45],真菌数量及活性的增加,将导致土壤中木质素分解加剧,产生多种酚类并进入更深的分解阶段。此外,由于微生物的生命活动不同于植被,在其生命活动中通常产生一些分子标志物。例如具有支链的短链烷酸(< C20)、藿烷类、麦角固醇等均是微生物所产生的有机碳组分[46]。然而目前对于微生物种群结构与有机碳化学特征之间的关系依然缺乏足够的认知。
3 土壤碳库分子结构变化对碳库稳定性影响全球气候变化背景下土壤有机碳稳定性机制目前尚不清楚,其受到碳组分来源、结构特征、环境因子(气温、降水、地形等)、微生物活动等多种因素的交互影响[3, 12, 47-48]。一般而言,土壤碳组分活性越高,周转时间越短,碳库稳定性越差。在全球尺度上,随着温度与纬度的增加,土壤碳周转时间也在增加[49],土壤中最年轻的碳组分(107年以内)主要含有高含量的芳香基,低的O-烷基C/芳香C比例,而最老的碳(> 1000年)具有低的芳香族化合物和O-烷基碳[50],这表明土壤碳库分子结构特征可能对碳库稳定性具有本质上的调控作用。土壤中有机质主要来源于植被残体分解、根系分泌物释放及微生物过程等,由于形成有机质底物在分子结构结构及其性质的差异,导致不同来源有机质通常其分子组成差异巨大[51-52]。例如来源于植被根系的SOM含有大量的木质素组分,碳链长且多为偶数;而与黏土颗粒物(< 38 µm)相结合的碳组分含有大量的碳水化合物裂解物,包括糠醛、吡咯等,主要源于微生物释放的脂类化合物裂解过程[13]。这种差异导致通常可采用一些生物标志物(Biomarker)来判断土壤碳来源。例如偶碳原子数长链(> C20)的链烷酸和链醇类通常是源于植物的脂肪质化合物,而支化的短链烷酸(< C20)、麦角固醇等通常源于微生物过程[13]。由于SOM中不同化合物的分子结构对于气温、水文及微生物分解过程敏感性不同,从而决定了土壤中碳库稳定性的差异。土壤剖面上碳库分子结构也存在明显差异,土壤表层中存在的主要是脂肪族化合物,而随着深度的增加,烷基碳增加,而O-烷基碳、芳香族及脂肪族化合物在减少[53]。这种差异导致土壤底层碳库往往较表层碳库具有更高的稳定性[54]。开顶箱(OTC)CO2倍增及增温实验表明,增温过程中,脂肪酸(FAs)并未在土壤的细颗粒中累积,表明FAs并不能通过吸附与矿物组分结合而稳定化,同位素标定结果表明,土壤有机碳组分中只有短链的(C16+18)脂肪酸碳来源发生变化,表明短链的FAs较长链具有更高的更快的循环速率[55]。短链的脂肪酸一般指代源于微生物活动释放的碳,这表明气候变化可能会通过调控微生物活动影响湿地土壤碳库稳定性。
对土壤中碳组分及其分子结构不断深入的研究揭示甚至颠覆了对过去认为的一些稳定性碳组分性质的认识,例如木质素及腐殖质等。木质素代表了植物残体及较大颗粒(> 53µm)碳组分[56-57]。过去认为木质素是相对稳定的碳组分,对分解过程具有很强的抗性,能够被选择性的保留在碳库中。然而近来研究发现,在分解初期阶段木质素是相对稳定的,而气候变暖条件下,有机质分解加速,木质素并不会被被选择性保存下来[58]。而土壤中最为稳定的碳组分通常含有苯环结构,尤其是当芳香族化合物被氧化后与黏土矿物相结合将形成稳定的碳库[59]。腐殖质一般被认为是土壤中较为稳定的碳组分,过去的概念认为腐殖质是大分子物质[60-63],而近来的研究表明腐殖质本质上是低分子量有机化合物通过氢键和其他作用力结合在一起形成的不稳定聚合物[64]。这种概念上的改变带来对腐殖质稳定性的重新认识。尽管如此,Sutton和Sposito[64]针对腐殖酸结构组成的研究并未完全推翻传统对土壤腐殖质的认识,同时目前针对腐殖物质的分子结构组成及其对气候变化直接或间接影响的响应并无太多研究。尤其是胡敏素作为土壤中腐殖酸的主体,其化学结构、分子组成及其如何响应气候变化目前依然缺乏研究[11]。土壤环境及外界环境因子改变会打破将不同化合物胶联形成腐殖质的氢键及作用力(范德华力),并释放一些更低分子量的化合物(主要以可溶性有机碳形式),降低土壤碳稳定性[65]。对典型泥炭地土壤中的腐殖酸和富里酸分子结构研究表明,相比于深层土壤,表层土壤中的腐殖酸物质具有更高程度的芳香缩合度。随着土壤深度的增加,泥炭腐殖酸中的烷基碳的含量几乎不变,而含氧烷基碳组分显著减少[66]。考虑到泥炭表层与底层之间在含氧量、氧化还原电位、地温等方面的差异,可以推测气候变化可能将对土壤腐殖酸分子结构组成造成显著影响。也有研究表明,虽然增温能够提高土壤中腐殖酸、胡敏酸及溶解性有机碳(DOC)的含量,然而这种变化主要是由土壤中离子强度的减弱导致,而增温的贡献则相对较小[67]。
目前大多数研究认为土壤碳库中活性碳组分较惰性碳组分对气候变化更为敏感[4, 68-69],然而近来研究表明土壤惰性碳库对温度变化的敏感性与同活性碳库相比差异不大,两种碳库对于全球变暖具有类似的响应[70]。这表明土壤碳库结构组成、稳定性及其与气候变化相互作用机制远比目前的认识水平复杂,需要进一步深入研究。
4 研究展望综上,土壤碳库中的分子结构与气候变化及其所导致的后续环境/生态过程改变具有紧密联系,然而目前对于二者之间的关联认知及相互作用机制的阐释明显不足。目前亟待加强的相关研究可能有以下几个方面:
1)土壤有机碳分子标志物的识别与生态意义判读
由于土壤中的有机碳主要来源于受气候变化强烈影响的植被残体及微生物等生物量的输入,并且有机质、腐殖酸等形成与气温、降水、土壤环境条件等息息相关。寻找与气候变化中某些因子密切关联的分子标志物往往成为揭示气候变化的有效工具。同时,在剖面中,尤其是深层土壤中,由于土壤环境条件相对单一,不易变化,其中有机碳分子结构的组成特征,尤其是某些惰性结构的持留状态,往往反映了土壤形成时的环境特征。如何寻找、分析和挖掘有机碳分子结构特征所蕴含的气候或者环境信息是未来研究的一个热点与难点方向。
2)生物对土壤有机碳分子结构转换过程的调控作用及机制
虽然微生物在土壤有机碳形成过程的角色及作用已经得到广泛研究,然而土壤动物在此过程的作用依然未得到充分的重视。土壤动物通过摄食、筑巢等行为,直接或间接影响了有机碳的分子结构特征。土壤动物的生态特征,如种类、群落结构、生物量等与有机碳分子结构之间相互作用关系是未来研究的热点问题。此外,微生物与有机碳分子结构转换的关系尚不清楚,且目前的研究大多数停留在定性描述上,缺乏定量阐释,依然需要深入研究。
3)大尺度环境/生态过程与碳库分子结构转变的耦合机制
气候变化与碳库分子结构转换二者之间在空间尺度上存在巨大差异,因此如何将宏观尺度上的环境/生态过程与微观尺度上的化学过程相耦合是目前的难点问题。由于气候变化涉及多个气候因子,且不同气候因子之间相互联系并与陆地圈层之间存在极为复杂正负反馈关系,揭示土壤碳库有机碳分子结构如何响应多重环境因子变化也是未来研究的主要方向之一。
4)新的土壤有机碳分子结构辨识技术及判读
目前对于土壤中有机碳结构的主要基于热裂解—气质联机(Py-GC-MS)、傅里叶变换红外分析(FITR)以及魔角自旋交叉极化C-13核磁共振(CPMAS 13C-NMR)等技术,然而这些技术或多或少存在一定的缺陷。如CPMAS 13C-NMR技术虽然具有精度高的特点,然而其能够鉴定的结构有限;FITR技术更多是对化学成键进行鉴定,而对于有机碳结构的识别能力有限;而Py-GC-MS技术对样品混匀度具有较高要求,同时如果处理土壤的有机碳含量较低,则必须对土壤中有机碳进行相关的提纯、浓缩处理,而这势必会影响土壤中化学结构的测试结果。此外,由于土壤中有机质是极为复杂的多种有机化合物复合体,在裂解过程中所产生的种类更是繁杂,如何考量有机官能团的类型与土壤有机质物质组成之间的关系,正确由分子尺度的官能团结构、组成推测土壤有机质物质组成特征是认识生物标志物及有机碳循环过程的基础[71];如何快速、有效、正确识别所分析的有机碳结构是极为重要的。虽然目前借助于计算机判读技术能够代替部分人工识别工作,然而对于具有多种可能性的结构依旧需要研究者根据自身经验进行判读。发展新技术方法、构建丰富完整的土壤有机碳分子结构数据库、提高化合物自动判读的精确度与准确度是目前研究面临的巨大挑战。
| [1] |
Sakschewski B, von Bloh W, Boit A, et al. Resilience of amazon forests emerges from plant trait diversity . Nature Climate Change, 2016, 6(11): 1032-1036. DOI:10.1038/nclimate3109
(  0) 0) |
| [2] |
Scurlock J M O, Hall D O. The global carbon sink: A grassland perspective . Global Change Biology, 1998, 4(2): 229-233. DOI:10.1046/j.1365-2486.1998.00151.x
(  0) 0) |
| [3] |
Davidson E A, Janssens I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change . Nature, 2006, 440(7081): 165-173. DOI:10.1038/nature04514
(  0) 0) |
| [4] |
Melillo J, Steudler P, Aber J, et al. Soil warming and carbon-cycle feedbacks to the climate system . Science, 2002, 298(5601): 2173-2176. DOI:10.1126/science.1074153
(  0) 0) |
| [5] |
Solomon S. IPCC(2007): Climate change the physical science basis . Boulder, USA: American Geophysical Union, 2007, 123-124.
(  0) 0) |
| [6] |
Cao M, Woodward F I. Net primary and ecosystem production and carbon stocks of terrestrial ecosystems and their responses to climate change . Global Change Biology, 1998, 4(2): 185-198. DOI:10.1046/j.1365-2486.1998.00125.x
(  0) 0) |
| [7] |
D'odorico P, Laio F, Porporato A, et al. Hydrologic controls on soil carbon and nitrogen cycles. Ⅱ. A case study . Advances in Water Resources, 2003, 26(1): 59-70. DOI:10.1016/S0309-1708(02)00095-7
(  0) 0) |
| [8] |
Sulman B N, Phillips R P, Oishi A C, et al. Microbe-driven turnover offsets mineral-mediated storage of soil carbon under elevated CO2 . Nature Climate Change, 2014, 4(12): 1099-1102. DOI:10.1038/nclimate2436
(  0) 0) |
| [9] |
Schlesinger W H, Andrews J A. Soil respiration and the global carbon cycle . Biogeochemistry, 2000, 48(1): 7-20. DOI:10.1023/A:1006247623877
(  0) 0) |
| [10] |
Kirkby C A, Richardson A E, Wade L J, et al. Carbon-nutrient stoichiometry to increase soil carbon sequestration . Soil Biology & Biochemistry, 2013, 60: 77-86.
(  0) 0) |
| [11] |
Schmidt M W I, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property . Nature, 2011, 478(7367): 49-56. DOI:10.1038/nature10386
(  0) 0) |
| [12] |
Pisani O, Frey S D, Simpson A J, et al. Soil warming and nitrogen deposition alter soil organic matter composition at the molecular-level . Biogeochemistry, 2015, 123(3): 391-409. DOI:10.1007/s10533-015-0073-8
(  0) 0) |
| [13] |
Grandy A S, Neff J C. Molecular c dynamics downstream: The biochemical decomposition sequence and its impact on soil organic matter structure and function . Science of the Total Environment, 2008, 404(2/3): 297-307.
(  0) 0) |
| [14] |
Roth V N, Dittmar T, Gaupp R, et al. Latitude and pH driven trends in the molecular composition of DOM across a north south transect along the Yenisei River . Geochimica et Cosmochimica Acta, 2013, 123: 93-105. DOI:10.1016/j.gca.2013.09.002
(  0) 0) |
| [15] |
Feng X J, Simpson A J, Wilson K P, et al. Increased cuticular carbon sequestration and lignin oxidation in response to soil warming . Nature Geoscience, 2008, 1(12): 836-839. DOI:10.1038/ngeo361
(  0) 0) |
| [16] |
Chabbi A, Rumpel C, Grootes P M, et al. Lignite degradation and mineralization in lignite-containing mine sediment as revealed by 14C activity measurements and molecular analysis . Organic Geochemistry, 2006, 37(8): 957-976. DOI:10.1016/j.orggeochem.2006.02.002
(  0) 0) |
| [17] |
Purton K, Pennock D, Leinweber P, et al. Will changes in climate and land use affect soil organic matter composition? Evidence from an ecotonal climosequence . Geoderma, 2015, 253: 48-60.
(  0) 0) |
| [18] |
Bertrand O, Mansuy-Huault L, Montarges-Pelletier E, et al. Recent vegetation history from a swampy environment to a pond based on macromolecular organic matter(lignin and fatty acids)and pollen sedimentary records . Organic Geochemistry, 2013, 64: 47-57. DOI:10.1016/j.orggeochem.2013.09.008
(  0) 0) |
| [19] |
Pold G, Grandy A S, Melillo J M, et al. Changes in substrate availability drive carbon cycle response to chronic warming . Soil Biology & Biochemistry, 2017, 110: 68-78.
(  0) 0) |
| [20] |
Craft C B, Washburn C, Parker A. Latitudinal trends in organic carbon accumulation in temperate freshwater peatlands//VymazalJ. Wastewater treatment, plant dynamics and management in constructed and natural wetlands. New York: Springer, 2008: 23-31
(  0) 0) |
| [21] |
Lovelock C E, Adame M F, Bennion V, et al. Contemporary rates of carbon sequestration through vertical accretion of sediments in mangrove forests and saltmarshes of south east queensland, australia . Estuaries and Coasts, 2014, 37(3): 763-771. DOI:10.1007/s12237-013-9702-4
(  0) 0) |
| [22] |
Shang L N, Zhang Z S, Song X L, et al. Carbon sequestration and nutrient accumulation(N and P)in two typical wetlands in Sanjiang Plain, Northeast China . Fresenius Environmental Bulletin, 2015, 24(2): 422-428.
(  0) 0) |
| [23] |
Heller C, Ellerbrock R H, Rosskopf N, et al. Soil organic matter characterization of temperate peatland soil with FTIR-spectroscopy: Effects of mire type and drainage intensity . European Journal of Soil Science, 2015, 66(5): 847-858. DOI:10.1111/ejss.2015.66.issue-5
(  0) 0) |
| [24] |
Lal R. Soil carbon sequestration to mitigate climate change . Geoderma, 2004, 123(1/2): 1-22.
(  0) 0) |
| [25] |
Wang Y, Hao W, He J S, et al. Iron-mediated soil carbon response to water-table decline in an alpine wetland . Nature Communications, 2017. DOI:10.1038/ncomms15972
(  0) 0) |
| [26] |
Heimann M, Reichstein M. Terrestrial ecosystem carbon dynamics and climate feedbacks . Nature, 2008, 451(7176): 289-292. DOI:10.1038/nature06591
(  0) 0) |
| [27] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply . Nature, 2007, 450(7167): 277-280. DOI:10.1038/nature06275
(  0) 0) |
| [28] |
Fontaine S, Bardoux G, Abbadie L, et al. Carbon input to soil may decrease soil carbon content . Ecology Letters, 2010, 7(4): 314-320.
(  0) 0) |
| [29] |
布东方, 胡金明, 周德民, 等. 不同水位梯度下的小叶章种群密度. 生态学杂志, 2006, 25(9): 1009-1013. Bu D F, Hu J M, Zhou D M, et al. Calamogrostis angustifolia population density at different water levels (In Chinese). Chinese Journal of Ecology, 2006, 25(9): 1009-1013. (  0) 0) |
| [30] |
宗盛伟, 许嘉巍, 吴正方, 等. 长白山西坡小叶章侵入苔原带过程及影响. 生态学报, 2014, 34(23): 6837-6846. Zong S W, Xu J W, Wu Z F, et al. Analysis of the process and impacts of Deyeuxia angustifolia invasion on the alpine tundra, Changbai Mountain (In Chinese). Acta Ecologica Sinica, 2014, 34(23): 6837-6846. (  0) 0) |
| [31] |
Vancampenhout K, Wouters K, Caus A, et al. Fingerprinting of soil organic matter as a proxy for assessing climate and vegetation changes in last interglacial palaeosols(Veldwezelt, Belgium) . Quaternary Research, 2008, 69(1): 145-162. DOI:10.1016/j.yqres.2007.09.003
(  0) 0) |
| [32] |
Quideau S A, Chadwick O A, Benesi A, et al. A direct link between forest vegetation type and soil organic matter composition . Geoderma, 2001, 104(1/2): 41-60.
(  0) 0) |
| [33] |
Pisani O, Hills K M, Courtier-Murias D, et al. Molecular level analysis of long term vegetative shifts and relationships to soil organic matter composition . Organic Geochemistry, 2013, 62: 7-16. DOI:10.1016/j.orggeochem.2013.06.010
(  0) 0) |
| [34] |
Otto A, Simpson M J. Evaluation of cuo oxidation parameters for determining the source and stage of lignin degradation in soil . Biogeochemistry, 2006, 80(2): 121-142. DOI:10.1007/s10533-006-9014-x
(  0) 0) |
| [35] |
Normand A E, Smith A N, Clark M W, et al. Chemical composition of soil organic matter in a subarctic peatland: Influence of shifting vegetation communities . Soil Science Society of America Journal, 2017, 81(1): 41-49. DOI:10.2136/sssaj2016.05.0148
(  0) 0) |
| [36] |
Oliveira D M D, Schellekens J, Cerri C E P. Molecular characterization of soil organic matter from native vegetation-pasture-sugarcane transitions in Brazil . Science of the Total Environment, 2016, 548/549: 450-462. DOI:10.1016/j.scitotenv.2016.01.039
(  0) 0) |
| [37] |
Coyle D R, Nagendra U J, Taylor M K, et al. Soil fauna responses to natural disturbances, invasive species, and global climate change: Current state of the science and a call to action . Soil Biology & Biochemistry, 2017, 110: 116-133.
(  0) 0) |
| [38] |
Debruyn L A L, Conacher A J. The role of termites and ants in soil modification -A review . Australian Journal of Soil Research, 1990, 28(1): 55-93.
(  0) 0) |
| [39] |
Folgarait P J. Ant biodiversity and its relationship to ecosystem functioning: A review . Biodiversity and Conservation, 1998, 7(9): 1221-1244. DOI:10.1023/A:1008891901953
(  0) 0) |
| [40] |
Bierbaß P, Gutknecht J L M, Michalzik B. Nest-mounds of the yellow meadow ant(Lasius flavus)at the "alter gleisberg", central germany: Hot or cold spots in nutrient cycling? . Soil Biology & Biochemistry, 2015, 80: 209-217.
(  0) 0) |
| [41] |
Wu H, Batzer D P, Yan X M, et al. Contributions of ant mounds to soil carbon and nitrogen pools in a marsh wetland of northeastern china . Applied Soil Ecology, 2013, 70: 9-15. DOI:10.1016/j.apsoil.2013.04.004
(  0) 0) |
| [42] |
Wu H T, Lu X G, Wu D H, et al. Ant mounds alter spatial and temporal patterns of CO2, CH4 and N2O emissions from a marsh soil . Soil Biology & Biochemistry, 2013, 57: 884-891.
(  0) 0) |
| [43] |
Snyder B A, Boots B, Hendrix P F. Competition between invasive earthworms(Amynthas corticis, Megascolecidae)and native North American millipedes(Pseudopolydesmus erasus, Polydesmidae): Effects on carbon cycling and soil structure . Soil Biology & Biochemistry, 2009, 41(7): 1442-1449.
(  0) 0) |
| [44] |
Grandy A S, Strickland M S, Lauber C L, et al. The influence of microbial communities, management, and soil texture on soil organic matter chemistry . Geoderma, 2009, 150(3/4): 278-286.
(  0) 0) |
| [45] |
Hammel K. Fungal degradation of lignin//Casisch G, Giller K E . .
(  0) 0) |
| [46] |
Feng X J, Simpson M J. Molecular-level methods for monitoring soil organic matter responses to global climate change . Journal of Environmental Monitoring, 2011, 13(5): 1246-1254. DOI:10.1039/c0em00752h
(  0) 0) |
| [47] |
Esmeijer-Liu A J, Kurschner W M, Lotter A F, et al. Stable carbon and nitrogen isotopes in a peat profile are influenced by early stage diagenesis and changes in atmospheric CO2 and N deposition . Water, Air, and Soil Pollution, 2012, 223(5): 2007-2022. DOI:10.1007/s11270-011-1001-8
(  0) 0) |
| [48] |
Choi Y, Wang Y, Hsieh Y P, et al. Vegetation succession and carbon sequestration in a costal wetland in northwest Florida: evidence from carbon isotopes . Global Biogeochemical Cycles, 2001, 15(2): 311-319. DOI:10.1029/2000GB001308
(  0) 0) |
| [49] |
Davidson E A, Trumbore S E, Amundson R. Biogeochemistry: Soil warming and organic carbon content . Nature, 2000, 408(6814): 789-790. DOI:10.1038/35048672
(  0) 0) |
| [50] |
Kleber M, Nico P S, Plante A F, et al. Old and stable soil organic matter is not necessarily chemically recalcitrant: Implications for modeling concepts and temperature sensitivity . Global Change Biology, 2011, 17(2): 1097-1107. DOI:10.1111/gcb.2010.17.issue-2
(  0) 0) |
| [51] |
Lorenz K, Lal R, Preston C M, et al. Strengthening the soil organic carbon pool by increasing contributions from recalcitrant aliphatic bio(macro)molecules . Geoderma, 2007, 142(1/2): 1-10.
(  0) 0) |
| [52] |
van Hees P A W, Jones D L, Finlay R, et al. The carbon we do not see-the impact of low molecular weight compounds on carbon dynamics and respiration in forest soils: A review . Soil Biology & Biochemistry, 2005, 37(1): 1-13.
(  0) 0) |
| [53] |
Gonzalez-Perez M, Buurman P, Vidal-Torrado P, et al. Pyrolysis-gas chromatography/mass spectrometry characterization of humic acids in coastal spodosols from southeastern Brazil . Soil Science Society of America Journal, 2012, 76(3): 961-971. DOI:10.2136/sssaj2011.0178
(  0) 0) |
| [54] |
Rumpel C, Kögel-Knabner I. Deep soil organic matter-a key but poorly understood component of terrestrial C cycle . Plant and Soil, 2011, 338(1/2): 143-158.
(  0) 0) |
| [55] |
Griepentrog M, Eglinton T I, Hagedorn F, et al. Interactive effects of elevated CO2 and nitrogen deposition on fatty acid molecular and isotope composition of above-and belowground tree biomass and forest soil fractions . Global Change Biology, 2015, 21(1): 473-486. DOI:10.1111/gcb.2014.21.issue-1
(  0) 0) |
| [56] |
彭新华, 张斌, 赵其国. 土壤有机碳库与土壤结构稳定性关系的研究进展. 土壤学报, 2004, 41(4): 618-623. Peng X H, Zhang B, Zhao Q G. A review on relationship between soil organic carbon pools and soil structure stability (In Chinese). Acta Pedologica Sinica, 2004, 41(4): 618-623. DOI:10.11766/trxb200308110419 (  0) 0) |
| [57] |
朱姝, 窦森, 陈丽珍. 秸秆深还对土壤团聚体中胡敏酸结构特征的影响. 土壤学报, 2015, 52(4): 747-758. Zhu S, Dou S, Chen L Z. Effect of deep application of straw on composition of humic acid in soil aggregates (In Chinese). Acta Pedologica Sinica, 2015, 52(4): 747-758. (  0) 0) |
| [58] |
Kiem R, Kogel-Knabner I. Contribution of lignin and polysaccharides to the refractory carbon pool in C-depleted arable soils . Soil Biology & Biochemistry, 2003, 35(1): 101-118.
(  0) 0) |
| [59] |
Kramer M G, Sanderman J, Chadwick O A, et al. Long-term carbon storage through retention of dissolved aromatic acids by reactive particles in soil . Global Change Biology, 2012, 18(8): 2594-2605. DOI:10.1111/j.1365-2486.2012.02681.x
(  0) 0) |
| [60] |
Hatcher P G, Schnitzer M, Dennis L W, et al. Aromaticity of humic substances in soils . Soil Science Society of America Journal, 1981, 45(6): 1089-1094. DOI:10.2136/sssaj1981.03615995004500060016x
(  0) 0) |
| [61] |
Piccolo A. The supramolecular structure of humic substances: A novel understanding of humus chemistry and implications in soil science . Advances in Agronomy, 2002, 75: 57-134. DOI:10.1016/S0065-2113(02)75003-7
(  0) 0) |
| [62] |
Schimel J P, Schaeffer S M. Microbial control over carbon cycling in soil . Frontiers in Microbiology, 2012. DOI:10.3389/fmicb.2012.00348
(  0) 0) |
| [63] |
宋海燕, 尹友谊, 宋建中. 不同来源腐殖酸的化学组成与结构研究. 华南师范大学学报(自然科学版), 2009(1): 61-66. Song H Y, Yin Y Y, Song J Z. The chemical composition and structure of humic acids from different environments (In Chinese). Journal of South ChinaNormal University(Natural Science Edition), 2009(1): 61-66. DOI:10.6054/j.jscnun.2009.02.015 (  0) 0) |
| [64] |
Sutton R, Sposito G. Molecular structure in soil humic substances: The new view . Environmental Science & Technology, 2005, 39(23): 9009-9015.
(  0) 0) |
| [65] |
Porcal P, Koprivnjak J F, Molot L A, et al. Humic substances-Part 7: The biogeochemistry of dissolved organic carbon and its interactions with climate change . Environmental Science and Pollution Research, 2009, 16(6): 714-726. DOI:10.1007/s11356-009-0176-7
(  0) 0) |
| [66] |
Gondar D, Lopez R, Fiol S, et al. Characterization and acid-base properties of fulvic and humic acids isolated from two horizons of an ombrotrophic peat bog . Geoderma, 2005, 126(3/4): 367-374.
(  0) 0) |
| [67] |
Hruška J, Krám P, Mcdowell W H, et al. Increased dissolved organic carbon(DOC)in central european streams is driven by reductions in ionic strength rather than climate change or decreasing acidity . Environmental Science & Technology, 2009, 43(12): 4320-4326.
(  0) 0) |
| [68] |
Gu L H, Post W M, King A W. Fast labile carbon turnover obscures sensitivity of heterotrophic respiration from soil to temperature: A model analysis . Global Biogeochemical Cycles, 2004, 18. DOI:10.1029/2003GB002119
(  0) 0) |
| [69] |
Qiao N, Schaefer D, Blagodatskaya E, et al. Labile carbon retention compensates for CO2 released by priming in forest soils . Global Change Biology, 2014, 20(6): 1943-1954. DOI:10.1111/gcb.12458
(  0) 0) |
| [70] |
Fang C M, Smith P, Moncrieff J B, et al. Similar response of labile and resistant soil organic matter pools to changes in temperature . Nature, 2005, 433(7021): 57-59. DOI:10.1038/nature03138
(  0) 0) |
| [71] |
窦森. 土壤有机质. 北京: 科学出版社, 2010. Dou S. Soil organic matter (In Chinese). Beijing: Science Press, 2010. (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Joint Key laboratory of Changbai Mountain Wetland & Ecology, Changchun 130102, China
 2018, Vol. 55
2018, Vol. 55

