厌氧条件下湿地土壤中铁的还原氧化过程是一个直接或间接由铁还原微生物(Dissimilatory iron-reducting bacteria,DIRB)[1]、Fe(Ⅱ)氧化微生物(Ferrous oxidizing bacteria,FeOB[2])参与的还原氧化过程[3]。这一过程伴随着铁氧化物形态的改变和价态的转换,与土壤重金属的生物有效性、有机污染的降解及养分供应关系密切[1, 4-6],因而备受关注。
温度通过影响DIRB或者FeOB活性和菌落结构而影响铁的还原或者氧化过程。降低温度可以显著降低铁的还原和释放,As污染的潜育冲积土在5℃下避光培养33 d后铁的还原溶出量仅为23℃时的1/10[7]。FeOB亦有其最适生长温度,嗜中性FeOB如Leptothrix cholodnii和Leptothrix discophora的最适生长温度分别为35℃和25℃[8]。温度的变化可影响Fe(Ⅱ)的氧化速率和形成铁氧化物的形态[8]。温度较低时,Fe(Ⅱ)氧化速率低,纤铁矿形成量少而水铁矿形成量多[9]。在全球变暖背景下,湿地土壤铁还原氧化过程的关键参数对温度变化的敏感性如何,相关研究较少。
湿地土壤中铁氧化物的还原-氧化过程与有机碳的矿化关系密切。褐土厌氧培养过程中水溶性无机碳(Water soluble inorganic carbon, WSIC)含量与Fe(Ⅱ)之间存在极显著正相关关系[3]。也有研究认为铁还原可驱动碳转化[10-11],铁还原能够使超过50%的有机碳矿化,当活性Fe(Ⅲ)含量超过30 μmol cm-3时这一比例甚至可超过80%[10]。Fe(Ⅲ)的加入可使有机碳的矿化速率提高2倍~5倍,碳的矿化量与DIRB的生物量关系密切[12-13]。土壤微生物呼吸的温度敏感性(Q10)已被广泛研究[14-17]。研究发现氧化还原电位(ORP)是影响土壤呼吸Q10的重要因素[17]。然而与有机碳矿化、ORP关系密切的土壤铁氧化物的还原氧化过程的温度敏感性如何,尚不明晰。此外,光照条件可刺激光合型Fe(Ⅱ)氧化微生物的繁育,促进铁还原产生Fe(Ⅱ)的氧化,土壤中WSIC含量可降低70%,进而降低CO2排放的风险[3, 18-19],但光照条件下的铁还原及已还原Fe(Ⅱ)氧化与温度的关系亦不明晰。
黄河中下游湿地不仅铁氧化物含量较高,而且具有高碳酸钙含量(高达9%~20%)和低有机碳含量等特性[20]。黄河中下游湿地重金属污染日趋严重,生态环境承载能力大幅度下降[21-22]。鉴于此,本试验以采自黄河中下游地区新乡市原阳大米产区的湿地土壤为样品,采用控温培养方法分别在光照、黑暗条件下研究了温度对湿地土壤中铁还原氧化过程的影响,探索黄河中下游湿地中土壤铁还原氧化过程的温度敏感性,对深入理解土壤铁的生物地球化学循环及其环境效应具有重要意义。
1 材料与方法 1.1 供试土壤供试水稻土采自河南省新乡市原阳县太平镇李庄村(35°3′24″N, 114°06′55″ E),采样地属暖温带大陆性季风气候,年均气温14.4℃,年均降水量565.2 mm[23]。样品采集深度0~20 cm。土样自然风干后磨细,过1 mm筛备用。土壤基本理化性质如下:pH 8.12±0.04,有机碳16.61±0.10 mg g-1,水溶性总碳含量为19.03±0.22 μmol g-1,< 0.01 mm颗粒含量50.9%,< 0.002 mm颗粒含量26.3%;培养前0.5 mol L-1 HCl可提取Fe(Ⅱ)为1.47±0.04 mg g-1,Fe(T) 5.07±0.03 mg g-1。
1.2 厌氧泥浆培养试验试验分别设光照、避光条件下16 ℃、24 ℃、31 ℃、40 ℃四个温度处理。称取风干土壤样品3.000 g若干瓶,分别置于容积为10 ml的血清瓶中,控制土水比1:1(m:v)后充氮5 min除去瓶中氧气,加橡胶塞及铝盖密封后分为8份,4份分别置于多温区光照培养箱(宁波莱福,FPG3)不同温区(培养期间各温区温度分别为16.3±0.9 ℃、24.3±1.5 ℃、31.7±1.8 ℃和40.4±1.0 ℃)中连续光照培养(16根色温6 500 K日光灯管,光照强度2 000 Lx);另外4份分别置于多温区光照培养箱不同温区中连续避光培养(培养期间各温区温度分别为15.8±0.6 ℃、23.6±1.5 ℃、31.0±1.2 ℃和39.9±1.8 ℃)。培养过程间隔取样,监测培养过程中Fe(Ⅱ)含量变化。各处理随机取出1瓶,充分摇匀后打开铝盖和橡胶塞。用移液器吸取0.4 ml土壤泥浆,置于预先称重的含4.6 ml浓度为0.5 mol L-1的盐酸的10 ml塑料离心管后再次称重(二者质量差为泥浆质量),30±1℃下避光浸提24 h。浸提液过0.22 μm滤膜后测定滤液中Fe(Ⅱ)和Fe(T)浓度。试验3次重复。培养结束后测试体系中WSIC和顶空气体中CO2、O2含量。
1.3 分析指标与方法土壤样品基本性质分析均采用常规方法[24]。待测液中Fe(Ⅱ)直接采用邻菲罗啉比色法测试[24]。水溶性无机碳含量测定参考文献[3]。顶空气体CO2含量采用气相色谱测定(GC7900,上海天美,TCD检测器,载气H2,进样口温度110 ℃,柱温100 ℃,检测器温度150 ℃,桥电流90 mA)。顶空气体O2含量采用光纤测氧仪(PreSens Microx4,Germany Regensburg)测试。
1.4 数据处理避光时体系0.5 mol L-1 HCl可提取Fe(Ⅱ)与培养时间的关系采用Logistics方程拟合:
| $ {C_{\rm{t}}} = \frac{a}{{1 + b{e^{ - kt}}}} $ | (1) |
式中,Ct为培养时间t d时体系中0.5 mol L-1 HCl可提取Fe(Ⅱ)含量(mg Fe g-1土);a为还原容量(mg Fe g-1土);k为Fe(Ⅱ)累积速率常数(还原速率常数)(d-1);b为方程无量纲参数;据Tmax=ln(b)/k计算培养过程最大速率出现时间Tmax(d);据Vmax=ak/4计算Fe(Ⅱ)最大累积速率Vmax(mg g-1 d-1)。
避光条件下铁还原过程的Q10分别根据还原速率常数和Fe(Ⅱ)的最大累积速率计算,计算方法见式(2)和式(3):
| $ {Q_{10 - k}} = {\left( {\frac{{{k_2}}}{{{k_1}}}} \right)^{\frac{{10}}{{\left( {{T_2} - {T_1}} \right)}}}} $ | (2) |
| $ {Q_{10 - V\mathit{max}}} = {\left( {\frac{{{V_{\max 2}}}}{{{V_{\max 1}}}}} \right)^{\frac{{10}}{{\left( {{T_2} - {T_1}} \right)}}}} $ | (3) |
式中,Q10-k和Q10-Vmax分别为根据最大还原速率和还原速率常数计算得出的Q10;k1和k2分别为温度T1、温度T2时(T2>T1)的Fe(Ⅱ)累积速率常数(d-1)。
光照条件下铁还原阶段的平均还原速率由最大还原量(Fe(Ⅱ)最大累积量与初始值之差)与还原阶段持续时间之商表示(mg g-1 d-1);铁氧化阶段的平均氧化速率为氧化量(Fe(Ⅱ)最大累积量与培养结束时累积量之差)与氧化阶段持续时间之商(mg g-1 d-1)。
光照铁还原阶段和Fe(Ⅱ)氧化阶段的温度敏感系数根据式(2)利用铁还原阶段的平均还原速率和Fe(Ⅱ)氧化阶段的平均氧化速率计算,分别用Q10-RAv和Q10-OAv表示。
数据采用Microsoft Excel、SPSS 13.0和OriginPro 8.5分析处理。
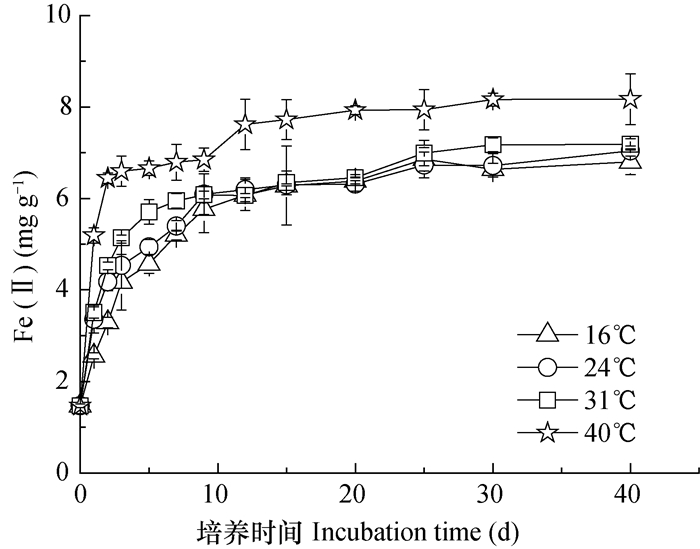
2 结果 2.1 温度对避光时土壤中Fe(Ⅱ)累积的影响供试土壤虽经风干粉碎,但土壤中依然存在1.47 mg g-1 0.5 mol L-1 HCl可提取Fe(Ⅱ),经过淹水充氮排氧密封后,Fe(Ⅱ)含量先快速增加,培养10 d后Fe(Ⅱ)含量基本趋于稳定(图 1)。采用Logistics模型对厌氧培养过程Fe(Ⅱ)随时间变化曲线进行非线性拟合分析(表 1),可以看出,培养过程Fe(Ⅱ)随时间的变化符合Logistics方程。从还原容量看,培养温度在31℃以下时温度对Fe(Ⅱ)的还原容量无显著影响,还原容量介于6.50~6.55 mg g-1之间;培养温度40℃时还原容量7.44 mg g-1,与培养温度16℃~31℃时差异显著,较之16℃增加了13.6%。升高培养温度可显著提高铁氧化物还原的速率常数,40℃时铁还原速率常数是16℃时的5.33倍。培养温度对铁还原最大速率的影响与其对速率常数的影响一致。从培养过程最大速率出现时间看,随着培养温度的升高,铁还原最大速率出现时间显著提前(表 1)。16℃时最大速率出现在避光培养2 d后,而40℃时最大速率出现在培养1 d以内。
|
图 1 避光培养过程土壤中0.5 mol L-1 HCl可浸提Fe(Ⅱ) Fig. 1 Content of 0.5 mol L-1 HCl extractable ferrous in the paddy soil under anaerobic incubation in darkness 注:图中误差线为标准偏差。下同 Note: Error bars represent standard deviation, The same below |
|
|
表 1 避光时不同温度下水稻土铁还原过程的关键参数 Table 1 Key parameters of iron reduction in the paddy soil incubated in darkness relative to temperature |
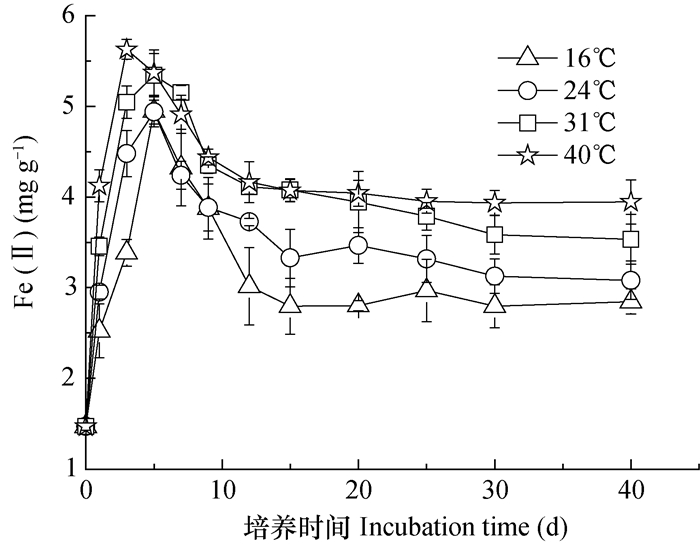
光照培养条件下,Fe(Ⅱ)随培养时间增加表现为先增后降的趋势(图 2),培养过程中Fe(Ⅱ)的降低说明体系中出现了还原产生Fe(Ⅱ)的氧化现象,显著有别于避光时(图 1)。培养温度影响Fe(Ⅱ)累积峰值的出现时间,40℃时峰值出现在培养第3天时,而31 ℃及以下则出现在培养第5天时(图 3)。据Fe(Ⅱ)最大累积量与初始值之差可得培养过程铁的最大还原量,光照培养时铁的最大还原量介于3.51~4.19 mg g-1,较之避光培养降低了20%左右。升高培养温度可提高铁的最大还原量,40℃时较之16℃增加了18.4%(表 1)。升高温度亦可提高40 d培养过程中的表观还原量(培养前后Fe(Ⅱ)含量差值,即培养结束时Fe(Ⅱ)含量与培养前Fe(Ⅱ)含量的差值),40℃时较之16℃增加了79.3%。据Fe(Ⅱ)最大累积量与培养结束时累积量之差可得培养过程。Fe(Ⅱ)的最大氧化量,最大氧化量在16℃时最大,为2.13 mg g-1,且随培养温度升高出现降低趋势,升高至40℃降低了21.1%。
|
图 2 光照培养过程土壤中0.5 mol L-1 HCl可浸提Fe(Ⅱ) Fig. 2 Content of 0.5 mol L-1 HCl extractable ferrous in the paddy soil under illuminated incubation |
|
|
表 2 光照条件下土壤中铁氧化物的还原氧化特征 Table 2 Characteristics of redox of the iron oxides in the paddy soil under illuminated incubation |
湿地土壤铁还原氧化过程的Q10如表 3所列,可以看出,避光时土壤中铁还原过程对培养温度敏感,据最大速率计算出的Q10-Vmax介于1.18~3.05之间,平均2.20,不同温度范围计算得出的Q10-Vmax之间存在显著差异,随温度升高而增大。据还原速率常数计算出的Q10-k介于1.18~2.62之间,平均2.07,不同温度范围之间亦存在显著差异,Q10-k亦随温度升高而增加。对避光条件下的铁还原过程而言,Q10-Vmax与Q10-k之间无显著差异(31 ℃~40 ℃范围除外)。
|
|
表 3 水稻土铁还原氧化过程的温度敏感系数 Table 3 Temperature-sensitivity coefficient of iron in redox process in the paddy soil |
光照时铁还原过程对培养温度敏感,据平均铁还原速率计算得出的Q10-RAv介于0.99~1.91之间,平均1.34,Q10-RAv亦随培养温度升高呈现升高趋势。与避光相比,光照可使铁还原Q10降低16.1%~52.6%,平均降幅39.0%。光照时Fe(Ⅱ)氧化的Q10-OAv介于0.82~0.97之间,平均0.90,表明Fe(Ⅱ)氧化过程对温度不敏感(Q10 < 1)。不同温度区间变异为5.98%,小于避光铁还原过程或者是光照铁还原过程不同温度区间温度敏感性的变异。
2.4 Fe(Ⅱ)氧化开始时体系中的O2由于前文分析可知,光照下土壤中Fe(Ⅱ)的氧化自培养3~5 d后开始。采用分析了培养3 d后体系中O2的产生量,结果如表 4所示。本试验条件充氮气5 min密封后体系O2含量在3.45 μmol L-1左右,避光处理略有降低,而光照处理培养3 d后顶空O2含量显著升高,产生量介于8.26~59.3 nmol g-1,且O2含量随培养温度升高而增加。16℃培养3 d泥浆中O2含量显著增加。
|
|
表 4 培养3 d后顶空和泥浆中的O2 Table 4 Contents of O2 in the headspace and slurry after 3 d's incubation |
不同温度下光照均降低了培养后土壤WSIC含量(表 5);培养后WSIC随培养温度增加而降低,40 ℃光照培养后土壤WSIC含量仅为培养前的29.4%。避光培养则显著增加了WSIC含量,培养后WSIC随培养温度增加而增加;40 ℃避光培养后土壤WSIC含量为培养前的8.16倍。
|
|
表 5 厌氧培养前后土壤中的水溶性无机碳含量和CO2累积量 Table 5 Content of water soluble inorganic carbon and CO2 accumulation after 40-days of anaerobic incubation |
培养前及光照时不同温度培养后培养瓶顶空气体均未检测到CO2。避光培养后顶空气体CO2累积量随培养温度升高而显著增加(表 5),经过40 d避光培养,40 ℃时CO2累积量为16℃时累积量的3.01倍。表 6列出了培养过程WSIC增加量和CO2累积量与铁还原关键参数的皮尔森相关系数(双侧),可知避光培养后CO2累积量与铁还原速率常数和最大速率之间均存在显著正相关关系;WSIC增加量与最大速率出现时间存在极显著负相关关系,表明最大速率出现越早,培养结束后WSIC增加越多(表 6)。
|
|
表 6 避光培养后水溶性无机碳增加量和CO2累积量与铁还原关键参数的关系 Table 6 Relationships of increment of WSIC and accumulation of CO2 under incubation in darkness with key iron redox parameters |
土壤或者沉积物中铁的异化还原被认为是一种古老的呼吸方式,DIRB利用矿化分解有机碳获得的能量将电子传递至Fe(Ⅲ),而使Fe(Ⅲ)还原为Fe(Ⅱ)[3]。这一过程由微生物驱动,而DIRB种类众多,且不同微生物均有其最适生长温度。本试验显示在16 ℃~40 ℃范围内,采自原阳的黄河中下游湿地土壤中Fe(Ⅱ)累积量在16 ℃至31 ℃之间无显著差异,温度升至40 ℃后较之16 ℃时增加13%,并未体现出最适温度曲线。其原因可能与土壤中嗜温性DIRB与嗜低温DIRB之间群落演替有关,比如采自四川、江西的水稻土中DIRB更适宜50 ℃,而采自吉林、天津、湖南的水稻土中DRIB经40 ℃~70 ℃范围处理1 h后铁还原能力逐渐降低[25]。此外,也可能与不同微生物对不同铁氧化物的还原能力之间存在差异有关[26]。但是Fe(Ⅱ)累积的速率常数和最大速率则随温度而增大(表 1),这可能是温度升高促进了Fe(Ⅲ)氧化物的溶解和Fe(Ⅱ)氧化物的溶解扩散,增加了Fe(Ⅲ)的微生物“可接触性”和还原产生Fe(Ⅱ)的快速脱离,加快可还原铁的还原,可促进不易还原铁的还原[13]。
光照条件下铁的还原过程与避光显著不同的是,光照促进了光合型FeOB的繁育,而使培养中后期出现了已还原产生Fe(Ⅱ)的氧化现象。FeOB和DIRB在厌氧的土壤和沉积物环境中共存[27],甚至在青藏高原冰川的冰柱中也可发现蓝细菌(Cyanobacteria)的存在[28]。光照条件下FeOB主要是光合型铁氧化菌[18],研究也发现东非基伍湖卡布诺湾的水体中光养铁细菌(Photoferrotrophys)数量可占全部微生物数量的30%左右,光合型FeOB在促进Fe(Ⅱ)的氧化的同时固定无机碳合成生物量[29]。光合型FeOB对Fe(Ⅱ)的氧化作用主要包括光合产氧微生物(Oxygenic photosynthetic bacteria,OPSB)产生的氧的氧化和光合不产氧微生物(Anoxygenic photosynthetic bacteria,APSB)的直接氧化[18]。前期同样采自黄河中下游孟津的水稻土培养试验中发现了蓝细菌的存在[3]。研究也发现蓝细菌对Fe(Ⅱ)的氧化主要是其产生O2的化学氧化,而非直接的酶促反应或者光合反应[30]。本试验在厌氧光照3 d后的培养瓶顶空气体中检测到O2且O2累积量随培养温度升高而增加;此外光照条件下CO2未检出,且WSIC随温度升高而降低,侧面证实了体系中光合产氧过程及光合产生O2对Fe(Ⅱ)氧化过程的存在。OPSB对Fe(Ⅱ)的间接氧化受生物产氧活性和氧在土壤溶液中的溶解和扩散影响。温度升高顶空气体O2量大,但随温升高O2溶解度降低,而降低与Fe(Ⅱ)接触的几率。这可能是本试验光照条件下Fe(Ⅱ)的氧化对温度不敏感的主要原因之一。但本试验并不能排除APSB的直接氧化作用的存在,直接氧化则受APSB的活性影响,而温度则可影响微生物活性而对氧化量或者速率产生影响。下一步可以通过加入抑制剂抑制产氧光合来探索APSB直接氧化作用是否存在及贡献大小。
鉴于光照可在不同温度下降低WSIC,并抑制CO2的排放,故而光照可能影响以WSIC增量或者CO2排放量表征的土壤有机碳矿化过程。光照培养过程中WSIC呈现先增加后降低趋势[3],且本试验条件下体系中存在光合产氧过程。可见,光照对土壤表现出来的有机碳矿化的抑制可能与土壤有机碳矿化产物被光合微生物消耗有关。
研究发现铁氧化物(针铁矿和赤铁矿)含量与自由水孔隙度可解释71%的CO2排放的空间非均质性[31-32]。Fe(Ⅲ)可以凝聚溶解有机质[33],且铁氧化物与有机碳的团聚可保护有机物免受微生物降解[11, 34]。此外,铁异化还原可驱动有机碳的释放而促进有机碳的矿化[10, 35]。在原位污水处理系统中添加不同种类的铁氧化物可使有机碳氧化为CO2的速率增加2倍~5倍;铁氧化物的形态也影响乙酸盐、葡萄糖、淀粉和油脂等有机碳矿化的速率[12],添加纤铁矿(Lepidocrocite)可使乙酸或脂肪的矿化率增加至90%以上,Fe(Ⅲ)EDTA可使淀粉矿化为CO2的比率提高至93%[12]。本试验也显示CO2累积量与铁还原速率常数和最大还原速率之间存在显著正相关关系。土壤铁氧化物的种类和数量可能也是影响土壤碳素矿化的因素之一。本试验避光铁还原Q10介于1.18~3.05之间,平均2.20,且随温度而升高。这与土壤异养呼吸Q10数值相近[15, 36]。但是,铁氧化还原的温度敏感性是否可以表征土壤的异养呼吸的温度敏感性,土壤中铁氧化物种类、含量及还原潜势的区域差异、土壤呼吸测试过程中光照条件差异,可否用以解释土壤异养呼吸Q10的区域差异[37],仍需要进一步研究。
4 结论在16 ℃~31 ℃范围内黄河中下游湿地土壤铁的还原容量不受温度影响,40 ℃时铁还原容量可增加13.6%。但在16 ℃~40 ℃之间升高温度可显著增加铁还原的速率常数。铁还原的温度敏感系数介于1.18~3.05之间,平均2.20,且随温度上升而升高。光照可降低铁还原的温度敏感性,Q10降幅16.1%~52.6%,平均降幅39.0%。光照时土壤中Fe(Ⅱ)的氧化量和氧化速率均随温度升高而降低,Fe(Ⅱ)氧化对温度不敏感。光照条件和铁氧化物的种类和数量可能是影响土壤有机碳矿化的原因之一。
| [1] |
Lovley D R. Dissimilatory Fe(Ⅲ) and Mn (Ⅳ) reduction . Microbiological Reviews, 1991, 55(2): 259-287.
(  0) 0) |
| [2] |
Laufer K, Nordhoff M, Roy H, et al. Coexistence of microaerophilic, nitrate-reducing, and phototrophic Fe(Ⅱ) oxidizers and Fe(Ⅲ) reducers in coastal marine sediment . Applied and Environmental Microbiology, 2015, 82(5): 1433-1447.
(  0) 0) |
| [3] |
孙丽蓉, 黄海霞, 王旭刚, 等. 褐土中铁的氧化还原与碳素转化. 土壤学报, 2013, 50(3): 540-547. Sun L R, Huang H X, Wang X G, et al. Relationship between anaerobic redox of iron oxides and carbon transformation in cinnamon soil (In Chinese). Acta Pedologica Sinica, 2013, 50(3): 540-547. (  0) 0) |
| [4] |
Li F B, Li X M, Zhou S G, et al. Enhanced reductive dechlorination of DDT in an anaerobic system of dissimilatory iron-reducing bacteria and iron oxide . Environmental Pollution, 2010, 158(5): 1733-1740. DOI:10.1016/j.envpol.2009.11.020
(  0) 0) |
| [5] |
Vink J P M, van Zomeren A, Dijkstra J J, et al. When soils become sediments: Large-scale storage of soils in sandpits and lakes and the impact of reduction kinetics on heavy metals and arsenic release to groundwater . Environmental Pollution, 2017, 227: 146-156. DOI:10.1016/j.envpol.2017.04.016
(  0) 0) |
| [6] |
Yu H Y, Li F B, Liu C S, et al. Iron redox cycling coupled to transformation and immobilization of heavy metals: Implications for paddy rice safety in the red soil of south China// Sparks D L. Advances in Agronomy, Chennai: Academic Press, 2016: 137, 279-317
(  0) 0) |
| [7] |
Weber F, Hofacker A F, Voegelin A, et al. Temperature dependence and coupling of iron and arsenic reduction and release during flooding of a contaminated soil . Environmental Science & Technology, 2010, 44(1): 116-122.
(  0) 0) |
| [8] |
Leroy F, Gogo S, Guimbaud C, et al. Vegetation composition controls temperature sensitivity of CO2 and CH4 emissions and DOC concentration in peatlands . Soil Biology & Biochemistry, 2017, 107: 164-167.
(  0) 0) |
| [9] |
Vollrath S, Behrends T, Koch C B, et al. Effects of temperature on rates and mineral products of microbial Fe(Ⅱ) oxidation by Leptothrix cholodnii at microaerobic conditions . Geochimica et Cosmochimica Acta, 2013, 108: 107-124. DOI:10.1016/j.gca.2013.01.019
(  0) 0) |
| [10] |
Hartland A, Andersen M S, Hamilton D P. Phosphorus and arsenic distributions in a seasonally stratified, iron-and manganese-rich lake: Microbiological and geochemical controls . Environmental Chemistry, 2015, 12(6): 708-724. DOI:10.1071/EN14094
(  0) 0) |
| [11] |
Pan W N, Kan J J, Inamdar S, et al. Dissimilatory microbial iron reduction release DOC(dissolved organic carbon)from carbon-ferrihydrite association . Soil Biology & Biochemistry, 2016, 103: 232-240.
(  0) 0) |
| [12] |
Azam H M, Finneran K T. Ferric iron amendment increases Fe(Ⅲ)-reducing microbial diversity and carbon oxidation in on-site wastewater systems . Chemosphere, 2013, 90(4): 1435-1443. DOI:10.1016/j.chemosphere.2012.09.002
(  0) 0) |
| [13] |
Ahmed M, Lin L. Ferric reduction in organic matter oxidation and its applicability for anaerobic wastewater treatment: A review and future aspects . Reviews in Environmental Science and Biotechnology, 2017, 16(2): 273-289. DOI:10.1007/s11157-017-9424-3
(  0) 0) |
| [14] |
范分良, 黄平容, 唐勇军, 等. 微生物群落对土壤微生物呼吸速率及其温度敏感性的影响. 环境科学, 2012, 33(3): 932-937. Fan F L, Huang P R, Tang Y J, et al. Altered microbial communities change soil respiration rates and their temperature sensitivity (In Chinese). Environmental Science, 2012, 33(3): 932-937. (  0) 0) |
| [15] |
Zhang J J, Peng C H, Zhu Q A, et al. Temperature sensitivity of soil carbon dioxide and nitrous oxide emissions in mountain forest and meadow ecosystems in China . Atmospheric Environment, 2016, 142: 340-350. DOI:10.1016/j.atmosenv.2016.08.011
(  0) 0) |
| [16] |
Bolscher T, Paterson E, Freitag T, et al. Temperature sensitivity of substrate-use efficiency can result from altered microbial physiology without change to community composition . Soil Biology & Biochemistry, 2017, 109: 59-69.
(  0) 0) |
| [17] |
Wang Q, He N P, Yu G R, et al. Soil microbial respiration rate and temperature sensitivity along a north‐south forest transect in eastern China: Patterns and influencing factors . Journal of Geophysical Research Biogeosciences, 2016, 121(2): 399-410. DOI:10.1002/2015JG003217
(  0) 0) |
| [18] |
Melton E D, Schmidt C, Kappler A. Microbial iron(Ⅱ)oxidation in littoral freshwater lake sediment: The potential for competition between phototrophic vs. nitrate-reducing iron(Ⅱ)-oxidizers . Frontier in Microbiology, 2012. DOI:10.3389/fmicb.2012.00197
(  0) 0) |
| [19] |
Widdel F, Schnell S, Heising S, et al. Ferrous iron oxidation by anoxygenic phototrophic bacteria . Nature, 1993, 362(6423): 834-836. DOI:10.1038/362834a0
(  0) 0) |
| [20] |
Zhang J, Huang W W, Liu M G, et al. Drainage basin weathering and major element transport of two large Chinese rivers(Huanghe and Changjiang) . Journal of Geographical Research, 1990, 95(8): 13277-13288.
(  0) 0) |
| [21] |
Bai J H, Xiao R, Zhang K J, et al. Arsenic and heavy metal pollution in wetland soils from tidal freshwater and salt marshes before and after the flow-sediment regulation regime in the Yellow River Delta, China . Journal of Hydrology, 2012, 450/451(11): 244-253.
(  0) 0) |
| [22] |
Cheng Q, Wang R, Huang W, et al. Assessment of heavy metal contamination in the sediments from the Yellow River Wetland National Nature Reserve(the Sanmenxia section), China . Environmental Science and Pollution Research, 2015, 22(11): 8586-8593. DOI:10.1007/s11356-014-4041-y
(  0) 0) |
| [23] |
原阳县国土资源局. 原阳县地理、地貌、水资源. (2015-02-11)[2017-07-24]. http://www.yyblr.gov.cn/ztzl/culture/20151210_6623.html Yuanyang Bureau of Land and Resources. Geography, geomorphology, water resources of Yuanyang county(In Chinese). (2015-02-11)[2017-07-24]. http://www.yyblr.gov.cn/ztzl/culture/20151210_6623.html (  0) 0) |
| [24] |
鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科学技术出版社, 2000. Lu R K. Analytical method for soil and agricultural chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. (  0) 0) |
| [25] |
张丽新, 曲东, 易维洁. 温度及AQDS对氧化铁微生物还原过程的影响. 西北农林科技大学学报(自然科学版), 2009, 37(3): 193-199. Zhang L X, Qu D, Yi W J. Effect of temperature and AQDS on ferric oxide microorganism reduction process (In Chinese). Journal of Northwest A & F University(Natural Science Edition.), 2009, 37(3): 193-199. (  0) 0) |
| [26] |
Lovley D R, Holmes D E, Nevin K P. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction . Advances in Microbial Physiology, 2004, 49: 219-286. DOI:10.1016/S0065-2911(04)49005-5
(  0) 0) |
| [27] |
Yu R, Gan P, Mackay A A, et al. Presence, distribution, and diversity of iron-oxidizing bacteria at a landfill leachate-impacted groundwater surface water interface . FEMS Microbiology Ecology, 2010, 71(2): 260-271. DOI:10.1111/fem.2010.71.issue-2
(  0) 0) |
| [28] |
Liu Y, Yao T, Jiao N, et al. Abundance and diversity of snow bacteria in two glaciers at the Tibetan Plateau . Frontiers of Earth Science in China, 2009, 3(1): 80-90. DOI:10.1007/s11707-009-0016-6
(  0) 0) |
| [29] |
Llirós M, García-Armisen T, Darchambeau F, et al. Pelagic photoferrotrophy and iron cycling in a modern ferruginous basin . Scientific Reports, 2015. DOI:10.1038/srep13803
(  0) 0) |
| [30] |
Swanner E D, Wu W F, Hao L K, et al. Physiology, Fe oxidation, and Fe mineral formation by a marine planktonic cyanobacterium grown under ferruginous conditions . Frontiers in Earth Science, 2015. DOI:10.3389/feart.2015.00060
(  0) 0) |
| [31] |
Bahia A S R D, Marques J, Panosso A R, et al. Iron oxides as proxies for characterizing anisotropy in soil CO2 emission in sugarcane areas under green harvest . Agriculture, Ecosystems & Environment, 2014, 192: 152-162.
(  0) 0) |
| [32] |
Panosso A R, Perillo L I, Ferraudo A S, et al. Fractal dimension and anisotropy of soil CO2 emission in a mechanically harvested sugarcane production area . Soil & Tillage Research, 2012, 124: 8-16.
(  0) 0) |
| [33] |
Linkhorst A, Dittmar T, Waska H. Molecular fractionation of dissolved organic matter in a shallow subterranean estuary: The role of the iron curtain . Environmental Science & Technology, 2017, 51(3): 1312-1320.
(  0) 0) |
| [34] |
Elberling B, Breuning-Madsen H, Knicker H. Carbon sequestration in iron-nodules in moist semi-deciduous tropical forest soil . Geoderma, 2013, 200/201: 202-207. DOI:10.1016/j.geoderma.2013.03.001
(  0) 0) |
| [35] |
Hyun J, Mok J, Cho H, et al. Rapid organic matter mineralization coupled to iron cycling in intertidal mud flats of the Han River estuary, Yellow Sea . Biogeochemistry, 2009, 92(3): 231-245. DOI:10.1007/s10533-009-9287-y
(  0) 0) |
| [36] |
Dai S, Li L, Ye R, et al. The temperature sensitivity of organic carbon mineralization is affected by exogenous carbon inputs and soil organic carbon content . European Journal of Soil Biology, 2017, 81: 69-75. DOI:10.1016/j.ejsobi.2017.06.010
(  0) 0) |
| [37] |
杨庆朋, 徐明, 刘洪升, 等. 土壤呼吸温度敏感性的影响因素和不确定性. 生态学报, 2011, 31(8): 2301-2311. Yang Q P, Xu M, Liu H S, et al. Impact factors and uncertainties of the temperature sensitivity of soil respiration (In Chinese). Acta Ecologica Sinica, 2011, 31(8): 2301-2311. (  0) 0) |
 2018, Vol. 55
2018, Vol. 55

