硒是人类和动物必需的微量元素, 适量的硒具有提高人体免疫机能、抗癌和抗衰老等功能[1-3]。硒的摄入量不足可引起克山病、大骨节病等疾病, 而过量的硒会出现脱发、指甲变脆、肝增大等中毒症状[2-3]。表生环境中不同形态的硒具有不同的环境行为和生物有效性[4-7]。可见, 人畜体内硒的供应状况受制于环境中硒的总量和赋存形态。亚硒酸盐(Se(Ⅳ))是土壤最常见的硒形态, 其生物有效性较高, 是植物的主要硒营养源[1, 5-6]。土壤金属氧化物、有机质等固相组分可与硒相互作用, 影响土壤硒的赋存形态和生物有效性[8-9]。氧化铁和腐殖酸是土壤的重要固相组分, 可与不同形态的硒发生多种界面作用, 从而改变土壤硒的形态分布[7, 10-13]。土壤中氧化铁和腐殖酸通常紧密相伴, 并通过一定的作用力结合形成复合体[14-15]。土壤腐殖质-氧化物复合体是土壤肥力的基础物质, 又是土壤中营养元素和环境污染物迁移转化的重要影响因子[16-18]。因此, 研究氧化铁-腐殖酸复合体与硒相互作用的过程和机制, 有助于深入认识土壤硒的地球化学行为。
针铁矿是最常见的土壤晶质氧化铁, 广泛分布于各类土壤中。针铁矿对Se(Ⅳ)的吸附数据符合Langmuir方程, 而Freundlich方程适合描述铁/铝复合氧化物的吸附过程[19-20]。针铁矿对Se(Ⅳ)的吸附约3 h即可平衡, 吸附过程符合二级动力学模型, 其平衡吸附数据符合扩散双电层模型(DDLM)[21-22]。针铁矿和赤铁矿对Se(Ⅳ)的吸附类型主要为单齿内圈配位, 而非晶质氧化铁对Se(Ⅳ)的吸附以双齿内圈配位为主[10, 23-24]。X-射线吸收精细结构(XAFS)分析表明, Se(Ⅳ)和Se(Ⅵ)均可与针铁矿表面两个单配位的羟基形成双核桥联配合, 其有效位点主要位于针铁矿(010)面[21, 25]。腐殖酸是土壤有机质的主体, 可与土壤营养元素和污染物相互作用形成稳定性的络合物[26-27]。Coppin等[28]研究显示, 相同条件下土壤腐殖酸对硒的吸附量低于铁/铝氧化物。腐殖酸对硒的吸附量随其分子质量减小而逐渐升高[29]。羧基、羟基、芳香碳含量高及C/O比例低的腐殖酸与硒有较强的结合能力[29-30]。研究显示, 腐殖酸中芳香碳和含氧基团在吸附硒的过程中起重要作用, 而表面负电荷会在一定程度上抑制吸附作用[29-30]。腐殖酸吸附硒的机制主要为表面配位, Se(Ⅳ)和Se(Ⅵ)能够在腐殖酸结构中相邻的两个羧基、羟基或羧基及羟基间螯合成键, 也可与一个羧基或羟基形成单齿配合物[30-31]。
可见, 有关氧化铁和腐殖酸与硒的相互作用已有较多研究成果。土壤中氧化铁和腐殖酸很少单独存在, 它们往往通过多种微观作用彼此胶结而复合[14-15]。研究表明, 氧化铁-腐殖酸复合体中腐殖酸可包被于氧化铁表面, 显著影响氧化铁的表面性质[14]。土壤腐殖酸通过改变氧化铁的表面理化性质, 影响矿物表面的吸附、溶解、沉淀等过程, 从而控制一些营养元素和环境污染物在土壤中的赋存形态、化学行为和生物有效性[14, 32-33]。可以推断, 氧化铁-腐殖酸复合体对硒的吸附作用应该不同于两种单体的独立效应, 然而, 迄今尚未见有关这方面的研究报道。为此, 本研究制备了针铁矿和针铁矿-胡敏酸复合体, 以对比的方式研究了它们与Se(Ⅳ)相互作用的机制。这些研究有助于深入理解土壤氧化铁-腐殖酸复合体与硒的相互作用过程, 以期为土壤硒生物有效性的合理调控提供基础资料和科学依据, 这在土壤化学、环境化学、农业科学等领域均有重要意义。
1 材料与方法 1.1 试验材料所用试剂均为分析纯级。超纯水由超纯水机(HK-UP-11-20, 浩康科技, 成都)制备。腐殖酸钠购自阿拉丁试剂(上海)有限公司。胡敏酸的提取程序见文献[14], 主要步骤为:用0.1 mol L-1 NaOH溶液将腐殖酸悬浮液调至pH=10.0, 搅拌至悬浮液溶解, 静置2 h, 弃去不溶物; 将所得棕褐色溶液继续静置2 h, 取上层棕褐色溶液, 重复操作3次; 用0.1 mol L-1 HCl溶液将所得棕褐色溶液调节至pH=1.0, 静置1 d, 弃去上清液, 沉淀物用超纯水洗涤并离心两次, 所得胡敏酸50℃真空干燥、研磨保存。
1.2 样品制备针铁矿的制备:根据文献[14]中的方法合成针铁矿, 主要步骤为:取50 ml 1 mol L-1 Fe(NO3)3溶液于1 L塑料烧杯中, 搅拌条件下迅速加入90 ml 5 mol L-1 NaOH溶液, 加超纯水至总体积为1 000 ml, 用保鲜膜将烧杯密封, 置于70℃油浴中老化60 h。将所得样品悬浮液冷却至室温, 充分搅拌悬浮液, 并将其分成两份。一份用超纯水洗涤并离心2次, 沉淀物50℃真空干燥、研磨、保存备用。另一份悬浮液用于合成针铁矿-胡敏酸复合体。
针铁矿-胡敏酸复合体的制备:根据文献[14]中的方法合成针铁矿-胡敏酸复合体, 主要步骤为:取胡敏酸0.9 g于50 mL超纯水中, 用1 mol L-1 NaOH溶液调节至pH=12.0, 搅拌至胡敏酸全部溶解。将已制备的针铁矿悬浮液超声分散处理10 min, 磁力搅拌状态下将胡敏酸溶液缓慢滴加至针铁矿悬浮液中, 继续搅拌2 h, 并用1 mol L-1 HCl和NaOH溶液调节悬浮液至pH=4.0, 室温静置2 d, 离心分离。沉淀物即为针铁矿-胡敏酸复合体, 50℃真空干燥、研磨、保存备用。
1.3 样品的表征方法2种样品的X-射线衍射(XRD)和透射电镜(TEM)分析及其结果见文献[14]。胡敏酸和针铁矿-胡敏酸复合体的总有机碳(TOC)在总有机碳分析仪(TOC-L, 岛津, 日本)上采用高温催化燃烧氧化法测定, 测试结果为腐殖酸样品的TOC含量为463.4 g kg-1, 复合体样品的TOC含量为96.5 g kg-1, 通过计算可得复合体中胡敏酸的理论含量为208.2 g kg-1。
样品表面电位用马尔文纳米粒度电位仪(Nano-ZS, 马尔文, 英国)测定。称取若干份0.01 g的供试样品, 加入15 mL 0.01 mol L-1 KCl溶液, 超声分散后, 用0.01 mol L-1 KOH和HCl溶液反复将样品悬浮液的pH分别调至预先设定的值, 用0.01 mol L-1 KCl溶液定容至20 mL, 再次超声分散后取2 ml悬液测定其Zeta电位。
样品表面X-射线光电子能谱(XPS)数据在X-射线光电子能谱仪(Escalab 250XI, 赛默飞, 美国)上测试。X射线源为单色Al Kα(hv =1 486.6 eV), 功率150 W, 500 μm束斑, 标准镜头模式, 元素扫描步幅0.05 eV, 实验中以C1s (284.6 eV)为标准进行能量校正。用XPSPEAK41软件进行数据处理, 背景信号用Shirley方法扣除, 采用Lorentzian-Gaussian方法进行分峰拟合。
1.4 吸附实验储备液制备:称取3.0 g样品于500 ml烧杯中, 加入400 ml 0.01 mol L-1 KCl溶液, 超声分散30 min, 搅拌条件下用1 mol L-1 KOH或HCl溶液将悬浮液的pH调至4.0, 并在12 h内使其pH稳定在4.0。将悬浮液全部转入500 ml容量瓶中, 用0.01 mol L-1 KCl溶液定容至500 ml, 获得6.0 g L-1样品悬浮液。称取1.729 4 g Na2SeO3于100 ml聚乙烯烧杯中, 加入90 ml 0.01 mol L-1 KCl溶液, 搅拌条件下用1 mol L-1 KOH或HCl溶液将其pH调至4.0, 并在12 h内使其pH稳定在4.0。将悬浮液全部转入100 ml容量瓶中, 定容至100 ml, 获得Se(Ⅳ)浓度为0.1 mol L-1的储备溶液。使用前将0.1 mol L-1 Se(Ⅳ)储备溶液稀释20倍, 得Se(Ⅳ)浓度为5 mmol L-1的使用溶液。
样品对Se(Ⅳ)的等温吸附实验:取若干份6.0 g L-1的样品悬浮液5 ml注入50 ml聚乙烯离心管中, 加入不同体积的Se(Ⅳ)使用溶液, 用0.01 mol L-1 KCl溶液调至总体积为30 ml, 使悬浮液中样品浓度均为1.0 g L-1, Se(Ⅳ)初始浓度依次为0.05、0.1、0.2、0.3、0.4、0.5、0.7、1.0、1.5和2.0 mmol L-1。在25℃、转速250 r min-1条件下震荡24 h。将震荡后的悬浮液在12 000 r min-1的转速下离心分离, 分别得到上清液和沉淀物。测定上清液的pH, 用氢化物发生-原子荧光分光光度计(AFS-8330, 北京吉天, 中国)测量上清液中Se(Ⅳ)浓度。实验设置重复3次, 取平均值。沉淀物在50℃鼓风干燥箱中烘干, 取Se(Ⅳ)初始浓度为2.0 mmol L-1的沉淀物进行Zeta电位和XPS测试。
1.5 数据处理样品对Se(Ⅳ)的吸附量计算表达式见式(1):
| $ Q = \frac{{\left( {{C_0}-C} \right) \cdot V}}{{{C_s} \cdot V}} $ | (1) |
式中, Q表示吸附剂对吸附质的吸附量, mmol g-1; C为吸附体系中吸附质的平衡浓度, mmol L-1; C0为吸附体系中吸附质的初始浓度, mmol L-1; Cs为吸附体系中吸附剂的浓度, g L-1; V为吸附体系的体积, L。
用Langmuir和Freundlich模型对样品吸附Se(Ⅳ)的等温吸附数据进行拟合, 2种模型的表达式分别见式(2)和式(3):
| $ Q = \frac{{{Q_m} \cdot b \cdot C}}{{1 + b \cdot C}} $ | (2) |
| $ Q = k \cdot {C^{\frac{1}{n}}} $ | (3) |
Langmuir模型中Qm表示吸附剂对吸附质的最大吸附容量, mmol g-1; b为与吸附亲和力及结合能有关的常数, L mmol-1。Freundlich模型中k为与吸附容量有关的常数, mmol1-(1/n) L1/n g-1; 1/n为与吸附强度相关的系数。
使用Origin 8.0软件对样品吸附Se(Ⅳ)的等温吸附数据模型进行拟合; 用XPSPEAK41软件对样品的XPS数据作分析处理, 背景信号用Shirley方法扣除, 采用Lorentzian-Gaussian方法进行分峰拟合。
2 结果与讨论 2.1 样品对Se(Ⅳ)的等温吸附及模型拟合针铁矿和复合体对Se(Ⅳ)的等温吸附曲线见图 1。可见, 在吸附体系初始pH为4.0的条件下, 当Se(Ⅳ)的平衡浓度相同时, 针铁矿的吸附量明显高于复合体, 且2种样品的吸附等温线类型差异较大。针铁矿吸附Se(Ⅳ)时, 当Se(Ⅳ)的平衡浓度从0升高至0.22 mmol L-1时, 吸附量也随之明显增加; 当Se(Ⅳ)的平衡浓度从0.22 mmol L-1升高至0.77 mmol L-1时, 吸附量的增加趋势明显减缓; 当Se(Ⅳ)的平衡浓度达0.77 mmol L-1时, 吸附量逐渐趋于饱和。复合体吸附Se(Ⅳ)时, 当Se(Ⅳ)的平衡浓度从0升高至1.31 mmol L-1时, 吸附量一直呈明显增加趋势; 当Se(Ⅳ)的平衡浓度达1.31 mmol L-1以后, 吸附量趋于稳定而不再增加。
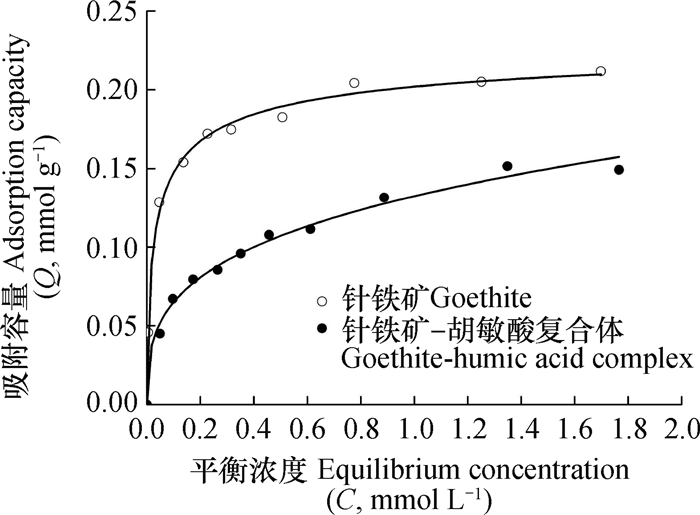
|
图 1 针铁矿和复合体对Se(Ⅳ)的等温吸附曲线 Fig. 1 Adsorption isotherms of Se(Ⅳ) by goethite and goethitehumic acid complex |
2种样品吸附Se(Ⅳ)的实验数据Langmuir和Freundlich模型拟合参数列于表 1。Langmuir模型的拟合结果中, 针铁矿和复合体对Se(Ⅳ)的最大吸附容量Qm分别为0.202 mmol g-1和0.159 mmol g-1, 常数b分别为34.72和5.42, 拟合度(R2)分别为0.970和0.932。Freundlich模型的拟合参数中, 常数k分别为0.206和0.132, 与二者对Se(Ⅳ)的吸附容量趋势一致, 与吸附强度相关的系数1/n分别为0.179和0.308, R2分别为0.914和0.980。可见, 与针铁矿比较, 复合体对Se(Ⅳ)的最大吸附容量和吸附亲和力均明显减小。根据文献[34-35], 针铁矿表面的正电荷位、铁原子和两性羟基均为吸附Se(Ⅳ)的有效位点。王锐等[14]研究显示, 针铁矿-胡敏酸复合体中部分胡敏酸颗粒包被在针铁矿表面。这种包被作用降低了针铁矿表面吸附位点的有效性, 致使复合体的表面吸附容量降低。2种等温吸附模型的拟合度表明, 针铁矿对Se(Ⅳ)的等温吸附数据更适合用Langmuir模型拟合, 而Freundlich模型适合描述复合体对Se(Ⅳ)的等温吸附过程。这表明针铁矿对Se(Ⅳ)的等温吸附属于匀质性表面单层吸附模式, 而异质性表面的多层吸附是复合体吸附Se(Ⅳ)的重要模型。
|
|
表 1 针铁矿和复合体吸附Se(Ⅳ)的等温吸附模型拟合参数 Table 1 Fitting parameters of isothermal adsorption models of Se(Ⅳ) by goethite and goethite-humic acid complex |
根据文献[36], 亚硒酸的一级、二级电离表达式及平衡常数分别见反应式(4)和式(5):
| $ {{\text{H}}_2}{\text{Se}}{{\text{O}}_3} \rightleftharpoons {\text{HSeO}}_3^-+ {{\text{H}}^ + }, {K_{{\text{a1}}}} = 2.7 \times {10^{-3}} $ | (4) |
| $ {\text{HSeO}}_3^-\rightleftharpoons {\text{HSeO}}_3^{2-} + {{\text{H}}^ + }, {K_{{\text{a2}}}} = 2.7 \times {10^{-7}} $ | (5) |
由反应式(4)和式(5)计算显示, 当pH=4.0时, 体系中[SeO32-]/[HSeO3-]=2.5×10-3, 而[HSeO3-]/[H2SeO3]= 27;当pH=5.0时, 体系中[SeO32-]/[HSeO3-]=2.5×10-2, 而[HSeO3-]/[H2SeO3]=2.7×102。本研究中吸附体系的初始pH为4.0, 吸附Se(Ⅳ)以后(Se(Ⅳ)的初始浓度为2.0 mmol L-1时)针铁矿和复合体的悬浮液pH分别为4.4和4.2。可见, 在2种样品的吸附体系中, Se(Ⅳ)主要以HSeO3-形态存在。与吸附体系的初始pH相比, 吸附Se(Ⅳ)以后针铁矿和复合体的悬浮液pH分别升高了0.4和0.2。其主要原因可解释为:样品表面铁羟基与HSeO3-之间存在表面配合反应, 导致吸附过程中OH-脱离固相表面进入溶液。可见, 反应体系中HSeO3-与样品表面铁羟基之间的配合反应是2种样品吸附Se(Ⅳ)的重要机制。与针铁矿比较, 复合体表面暴露的铁羟基密度较低, 对Se(Ⅳ)的吸附量较小, 因此, 复合体吸附Se(Ⅳ)以后体系的pH变化也相对较小。
样品表面的Zeta电位-pH关系曲线见图 2。吸附Se(Ⅳ)以前, 针铁矿的等电点(IEP)为7.0, 复合体的IEP < 3.0;pH=4.0时, 两种样品的Zeta电位分别为46.6 mV和-40.5 mV(图 2a)。可见, 吸附过程中针铁矿表面与阴离子之间存在较强的静电引力, 而复合体表面与阴离子之间有明显的静电排斥作用, 这也是复合体对Se(Ⅳ)的吸附容量低于针铁矿的原因之一。吸附Se(Ⅳ)以后, 针铁矿表面的IEP降低至4.5, 复合体的IEP仍然低于3.0;pH=4.0时, 其Zeta电位分别为7.52 mV和-38.7 mV(图 2b)。在吸附体系的初始pH=4.0的条件下, 吸附Se(Ⅳ)以后针铁矿表面Zeta电位降低了39.08 mV, 表明HSeO3-与针铁矿表面之间的静电引力是重要吸附机制。然而, pH=4.0时复合体吸附Se(Ⅳ)以后的表面Zeta电位反而升高了1.8 mV。这是由于HSeO3-与带负电荷的复合体表面活性羟基之间可能存在双齿配位, 导致吸附过程中脱离复合体表面的OH-为被吸附的HSeO3-的2倍。因此, 吸附作用导致复合体表面的Zeta电位略有升高。
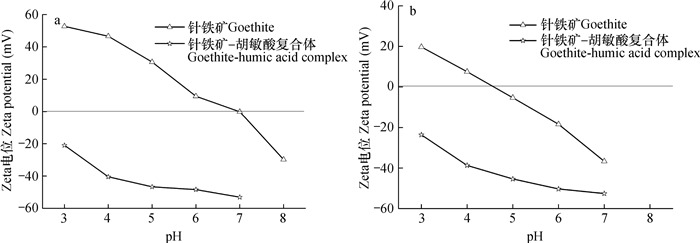
|
图 2 样品的Zeta电位-pH关系曲线(a为吸附Se(Ⅳ)以前的样品, b为吸附Se(Ⅳ)以后的样品) Fig. 2 Relationship curve of pH-Zeta potential of the samples (a. Samples before Se(Ⅳ) adsorption, and b. Samples after Se(Ⅳ) adsorption) |
图 3为吸附Se(Ⅳ)前后针铁矿表面Fe2p3/2的XPS谱图, 分峰拟合数据及归属列于表 2。吸附Se(Ⅳ)前针铁矿表面Fe2p3/2的XPS谱图(图 3a)中, Fe的电子结合能(B.E.)的峰值为711.4 eV, 表明针铁矿表面Fe均为正三价铁Fe(Ⅲ)。根据Fe(Ⅲ)的核外电子云密度的差异, 可将针铁矿表面的Fe(Ⅲ)分为3种不同的化学环境, 分别为本征Fe(Ⅲ)、氧化态偏低Fe(Ⅲ)和氧化态偏高Fe(Ⅲ)[37-40]。分峰拟合曲线中, B.E.峰值为711.5 eV的Fe(Ⅲ)可归属针铁矿表面本征Fe(Ⅲ), 其含量为49.1%。与本征Fe(Ⅲ)相比, B.E.峰值为710.5 eV的Fe(Ⅲ)的核外电子云密度增大, 为氧化态偏低Fe(Ⅲ), 其含量为13.6%;713.8 eV的Fe(Ⅲ)核外电子云密度减小, 为氧化态偏高Fe(Ⅲ), 其含量为37.3%。
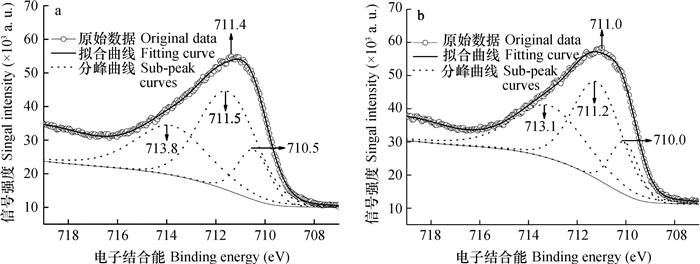
|
图 3 针铁矿表面Fe2p3/2的X-射线光电子能谱谱(a为吸附Se(Ⅳ)以前的样品, b为吸附Se(Ⅳ)以后的样品) Fig. 3 X-ray photoelectric spectroscopy (XPS) spectra of Fe2p3/2 on the surface of goethite (a. Samples before Se(Ⅳ) adsorption, and b. Samples after Se(Ⅳ) adsorption) |
|
|
表 2 针铁矿表面Fe2p3/2的分峰拟合数据 Table 2 Fitting data of sub-peaks of Fe2p3/2 XPS spectra of the surface of goethite |
针铁矿吸附Se(Ⅳ)以后表面Fe2p3/2的XPS谱图(图 3b)中, Fe2p3/2的B.E.峰值为711.0 eV, 表明吸附Se(Ⅳ)以后样品表面的Fe仍为Fe(Ⅲ)。分峰拟合曲线中, 氧化态偏低、本征和氧化态偏高Fe(Ⅲ)的B.E.峰值分别为710.0、711.2和713.1 eV, 其相对含量分别为13.3%、46.1%和40.6%。与吸附前相比, 吸附Se(Ⅳ)以后针铁矿表面氧化态偏低、本征和氧化态偏高Fe(Ⅲ)的B.E.峰值分别降低了0.5、0.3和0.7 eV。可见, 针铁矿与Se(Ⅳ)的相互作用增加了表面Fe的电子云密度。根据文献[41-43], 针铁矿与HSeO3-之间的相互作用机制主要包括表面≡FeOH中Fe与HSeO3-中Se或O之间的配位作用、带正电荷的针铁矿表面与HSeO3-之间的静电引力、表面吸附态阴离子与HSeO3-之间的离子交换以及氢键作用(针铁矿表面羟基H原子与HSeO3-中羟基O原子之间的氢键Ⅰ或针铁矿表面羟基O原子与HSeO3-中羟基H原子之间的氢键Ⅱ)等, 其中, 表面配位、静电引力和氢键Ⅰ可导致针铁矿表面Fe的电子云密度增加, 而阴离子交换和氢键Ⅱ可降低表面Fe的电子云密度。可见, 针铁矿吸附Se(Ⅳ)时, 有多种作用机制可引起表面Fe的B.E.发生不同的变化。图 3中的数据显示, 针铁矿吸附Se(Ⅳ)以后, 表面Fe的表观B.E.值有所降低。这表明表面配位、氢键Ⅰ和静电引力对针铁矿吸附Se(Ⅳ)有重要贡献。
图 4为亚硒酸钠和针铁矿表面吸附态硒的Se3d5/2的XPS谱图。亚硒酸钠和吸附态Se的Se3d5/2 B.E.峰值均为58.7 eV, 为正四价硒。Das等[10]研究表明, 针铁矿吸附Se(Ⅵ)时在其表面形成了键长为0.31 nm的Fe-Se键。本研究也表明针铁矿表面的Fe与HSeO3-中的Se之间存在配位作用。这类作用可降低Se的电子云密度, 导致3d5/2的B.E.峰值升高。图 4显示, 吸附在针铁矿样品表面Se3d5/2的B.E.峰值几乎未发生变化。这表明针铁矿吸附Se(Ⅳ)时还存在其他作用机制(如针铁矿表面羟基O原子与HSeO3-中羟基H原子之间的氢键Ⅱ)可使Se3d5/2的B.E.峰值降低。可见, 尽管吸附态Se3d5/2的表观B.E.峰值未变化, 但并不能说明HSeO3-中的Se原子在吸附过程中未直接参与作用。
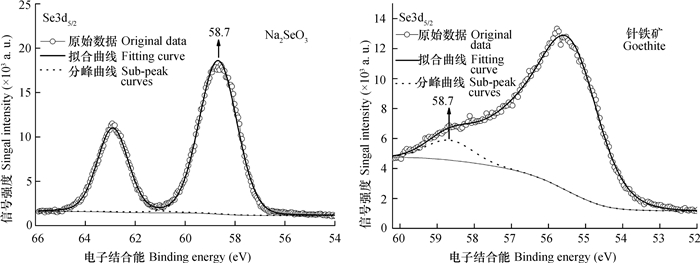
|
图 4 亚硒酸钠和针铁矿表面吸附态硒的Se3d5/2的XPS谱图 Fig. 4 XPS spectra of Na2SeO3 and Se(Ⅳ) adsorbed on the surface of goethite |
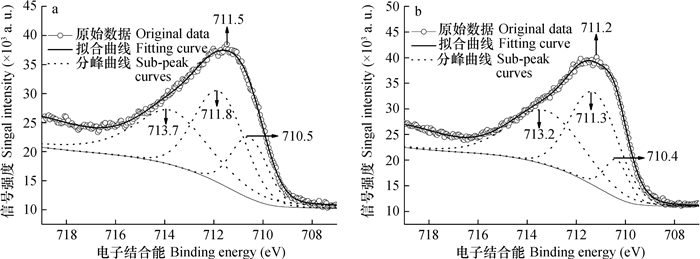
图 5为针铁矿-胡敏酸复合体表面Fe2p3/2的XPS谱图。吸附Se(Ⅳ)以前, 复合体表面Fe的B.E.峰值为711.5 eV, 较针铁矿表面Fe升高了0.1 eV, 但仍然为Fe(Ⅲ)。分峰拟合曲线中, 复合体表面氧化态偏低、本征和氧化态偏高Fe(Ⅲ)的B.E.峰值分别为710.5、711.8和713.7 eV, 其相对含量分别为18.1%、37.9%和44.1%。与针铁矿比较, 复合体表面本征Fe(Ⅲ)的B.E.峰值升高了0.3 eV, 含量降低了11.2%;氧化态偏低Fe(Ⅲ)的含量增加了4.5%;氧化态偏高Fe(Ⅲ)的B.E.峰值降低了0.1 eV, 其含量增加了为6.8%。总体而言, 针铁矿与胡敏酸复合后其表面Fe的氧化态有所升高。根据文献[14, 41], 其原因主要有2个: ①针铁矿表面≡FeOH与胡敏酸中羧酸基团的脱水作用, 致使复合体表面出现了形态为Fe-O-C=O的Fe(Ⅲ); ②针铁矿表面的活性氧与胡敏酸表面的活性氢之间存在氢键作用, 其诱导效应可导致复合体表面Fe的电子云密度降低。
|
图 5 针铁矿-胡敏酸复合体表面Fe2p3/2的XPS谱图(a为吸附Se(Ⅳ)以前的样品, b为吸附Se(Ⅳ)以后的样品) Fig. 5 Fe2p3/2 XPS spectra of goethite-humic acid complex (a. Samples before Se(Ⅳ) adsorption, and b. Samples after Se(Ⅳ) adsorption) |
吸附Se(Ⅳ)以后, 复合体表面Fe2p3/2的B.E.峰值为711.2 eV, 较吸附前降低了0.3 eV, 但仍为Fe(Ⅲ)。分峰拟合曲线中, 复合体氧化态偏低、本征和氧化态偏高Fe(Ⅲ)的B.E.峰值分别为710.4、711.3和713.2 eV, 其相对含量分别为10.6%、45.4%和44.0%。与吸附前相比, 吸附Se(Ⅳ)以后样品表面氧化态偏低、本征和氧化态偏高Fe(Ⅲ)的B.E.峰值分别降低了0.1、0.5和0.5 eV; 氧化态偏低Fe(Ⅲ)的含量降低了7.5%, 本征Fe(Ⅲ)的含量升高了7.5%, 氧化态偏高Fe(Ⅲ)的含量无变化。可见, 复合体和针铁矿吸附Se(Ⅳ)以后, 样品表面Fe2p3/2的B.E.峰值的变化较为类似。
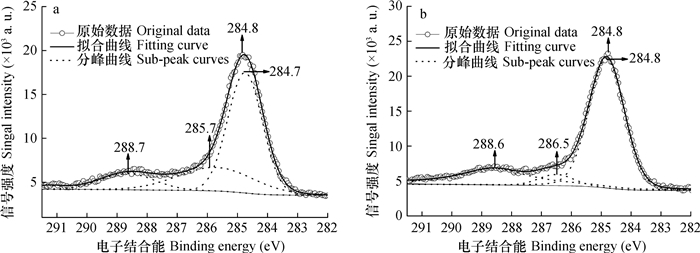
图 6为针铁矿-胡敏酸复合体表面C1s的XPS谱图。吸附Se(Ⅳ)前, 复合体表面C1s的B.E.峰值为284.8 eV。复合体表面C1s的分峰拟合曲线中出现了明显的3个拟合峰, B.E.峰值分别为284.7、285.7和288.7 eV, 相对含量分别为61.4%、25.8%和12.8%。根据文献[37, 44-48], 胡敏酸中的C1s按电子结合能由低至高可依次分为C=C、C-C、C-O和O-C=O/O-C-O共4种, 其B.E.峰值分别在284.4~284.8、285.1~285.5、285.7~287.5和288.4~289.5 eV范围内。图 6中, 复合体表面C1s的B.E.峰值为285.7 eV的拟合峰的峰形较宽(半高宽为3.0 eV), 且峰位与文献中C-C和C-O中C1s的B.E.峰值较接近。因此, 复合体表面C1s的B.E.峰值为285.7 eV的C可归属为C-C和C-O中的混合形态, 284.7 eV的C为C=C形态, 288.7 eV的C为O-C=O/O-C-O形态。
|
图 6 针铁矿-胡敏酸复合体表面C1s的XPS谱图(a为吸附Se(Ⅳ)以前的样品, b为吸附Se(Ⅳ)以后的样品) Fig. 6 C1s XPS spectra of goethite-humic acid complex (a. Samples before Se(Ⅳ) adsorption, and b. Samples after Se(Ⅳ) adsorption) |
样品吸附Se(Ⅳ)以后的分峰拟合曲线中, 出现了一个强峰和两个强度较弱的峰, 其B.E.峰值分别为284.8、286.5和288.6 eV, 相对含量分别为68.9%、6.4%和24.7%。与吸附前复合体表面C1s的XPS拟合数据相比, 吸附Se(Ⅳ)以后样品表面C-O中C的B.E.峰值升高了0.8 eV, 导致C-O与C-C中C的拟合峰分离而形成了独立的峰, 且其相对含量明显减少; 由于C=C和C-C中C的拟合峰重叠, 导致其B.E.峰值略高于吸附前C=C中C的B.E.峰值, 且相对含量也有所增加; O-C=O/O-C-O中C的B.E.峰值降低了0.1 eV, 其相对含量增加了11.9%。可见, 复合体与Se(Ⅳ)之间的作用明显降低了C-O中C的电子云密度, 其原因可归属为复合体表面C-O中O原子(酚羟基氧、醌基氧等)与HSeO3-中的H发生了氢键作用。此外, 吸附作用略微降低了复合体表面O-C=O/O-C-O中C的电子云密度, 其原因可归属为O-C=O/O-C-O中呈正电性的C与HSeO3-之间存在静电引力作用。
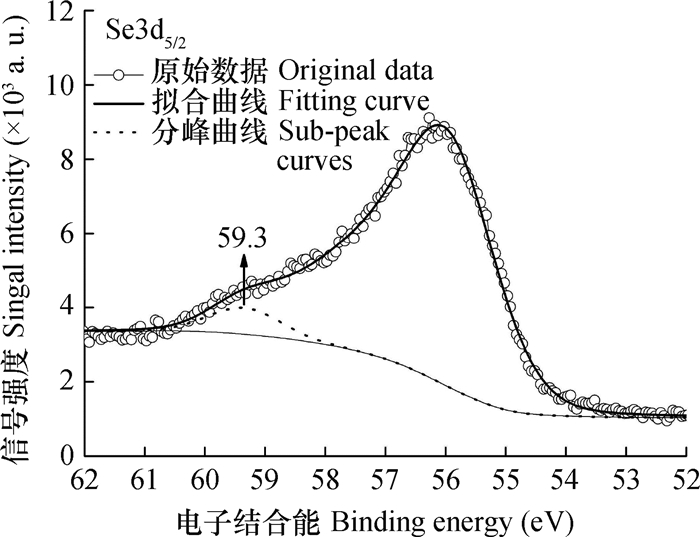
图 7为吸附Se(Ⅳ)以后, 针铁矿-胡敏酸复合体表面Se3d5/2的XPS谱图。Se3d5/2的XPS数据中, 拟合峰的B.E.值为59.3 eV。根据文献[49-50], 复合体表面吸附态Se仍为正四价硒, 表明复合体与HSeO3-之间并未发生明显的氧化还原作用。与亚硒酸钠中Se3d5/2的B.E.比较, 复合体表面吸附态Se3d5/2的B.E.升高了0.6 eV, 表明复合体与HSeO3-之间的作用明显降低了Se的电子云密度。根据文献[10], 导致吸附态Se的电子云密度减小的因素主要有: ①复合体表面Fe与HSeO3-中Se之间的配位作用, ②复合体表面铁羟基中H原子与HSeO3-中O原子之间的氢键Ⅰ, ③复合体表面活性氧(针铁矿的羟基氧和胡敏酸的酚羟基、羧基、醌基氧等)与HSeO3-中H之间的氢键Ⅱ, ④复合体表面呈正电性的Fe和C与HSeO3-之间的静电作用。与针铁矿单体表面吸附态Se相比, 复合体表面吸附态Se3d5/2的B.E.峰值变化更大, 这表明复合体表面吸附态Se(Ⅳ)同时与针铁矿和胡敏酸组分发生了作用, 形成了针铁矿-Se(Ⅳ) -胡敏酸三元体。结果显示, 针铁矿表面被胡敏酸包被以后不仅降低了针铁矿表面对Se(Ⅳ)的吸附容量, 而且影响了样品表面与Se(Ⅳ)的作用方式。可见, 针铁矿-胡敏酸复合体对硒的吸附容量和吸附机制均不同于针铁矿单体。这些研究结果可为认识土壤环境中Se(Ⅳ)的迁移转化和形态分布提供基础资料, 也可为硒的生物有效性调控提供一定的科学依据。
|
图 7 针铁矿—胡敏酸复合体吸附Se(Ⅳ)以后表面Se3d5/2的XPS谱图 Fig. 7 XPS spectra of Se3d5/2 on the surface of goethite-humic acid complex after adsorbing Se(Ⅳ) |
与针铁矿比较, 初始pH=4.0时复合体对Se(Ⅳ)的最大吸附容量和吸附亲和力均明显降低。针铁矿对Se(Ⅳ)的等温吸附数据适合用Langmuir模型拟合, 而Freundlich模型适合描述复合体对Se(Ⅳ)的等温吸附过程。这表明针铁矿对Se(Ⅳ)的等温吸附属于匀质性表面单层吸附模式, 而异质性表面的多层吸附是复合体吸附Se(Ⅳ)的重要模型。吸附Se(Ⅳ)以后, 针铁矿和复合体的pH都升高了; 针铁矿的Zeta电位明显降低, 复合体的Zeta电位反而略微升高; 针铁矿和复合体表面Fe(Ⅲ)的B.E.值都有所降低, 针铁矿表面吸附态Se(Ⅳ)的B.E.值无明显变化, 而复合体表面C-O中C和吸附态Se(Ⅳ)的B.E.值都升高了。吸附前后反应体系的pH和Zeta电位以及样品表面Fe、C和Se的B.E.变化表明, 复合体与HSeO3-之间的相互作用机制主要包括: ①表面≡FeOH与HSeO3-中Se或O之间的双齿配位作用, ②表面≡FeOH中H原子与HSeO3-中O原子之间的氢键Ⅰ, ③表面活性氧(针铁矿组分中的羟基氧和胡敏酸组分中的酚羟基、羧基、醌基氧等)与HSeO3-中H之间的氢键Ⅱ, ④表面呈正电性的Fe、C与HSeO3-之间的静电引力。此外, 复合体表面吸附态Se(Ⅳ)同时与针铁矿和胡敏酸两种组分发生了作用, 形成了针铁矿-Se(Ⅳ) -胡敏酸三元体。
| [1] |
Lanctôt C M, Cresswell T, Callaghan P D, et al. Bioaccumulation and biodistribution of selenium in metamorphosing tadpoles . Environmental Science & Technology, 2017, 51(10): 5764-5773.
(  0) 0) |
| [2] |
Fernández–Martínez A, Charlet L. Selenium environmental cycling and bioavailability: A structural chemist point of view . Reviews in Environmental Science and Bio/Technology, 2009, 8(1): 81-110. DOI:10.1007/s11157-009-9145-3
(  0) 0) |
| [3] |
Winkel L H, Johnson C A, Lenz M, et al. Environmental selenium research: From microscopic processes to global understanding . Environmental Science & Technology, 2011, 46(2): 571-579.
(  0) 0) |
| [4] |
Lessa J H L, Araujo A M, Silva G N T, et al. Adsorption-desorption reactions of selenium(Ⅵ)in tropical cultivated and uncultivated soils under Cerrado biome . Chemosphere, 2016, 164: 271-277. DOI:10.1016/j.chemosphere.2016.08.106
(  0) 0) |
| [5] |
Weng L, Vega F A, Supriatin S, et al. Speciation of Se and DOC in soil solution and their relation to Se bioavailability . Environmental Science & Technology, 2010, 45(1): 262-267.
(  0) 0) |
| [6] |
Wang S S, Liang D L, Wang D, et al. Selenium fractionation and speciation in agriculture soils and accumulation in corn(Zea mays L.)under field conditions in Shanxi Province, China . Science of the Total Environment, 2012, 427/428: 159-164. DOI:10.1016/j.scitotenv.2012.03.091
(  0) 0) |
| [7] |
Chen S S, Sun Y, Tsang D C W, et al. Insights into the subsurface transport of As(V)and Se(Ⅵ)in produced water from hydraulic fracturing using soil samples from Qingshankou Formation, Songliao Basin, China . Environmental Pollution, 2017, 223: 449-456. DOI:10.1016/j.envpol.2017.01.044
(  0) 0) |
| [8] |
Söderlund M, Virkanen J, Holgersson S, et al. Sorption and speciation of selenium in boreal forest soil . Journal of Environmental Radioactivity, 2016, 164: 220-231. DOI:10.1016/j.jenvrad.2016.08.006
(  0) 0) |
| [9] |
Li Z, Liang D, Peng Q, et al. Interaction between selenium and soil organic matter and its impact on soil selenium bioavailability: A review . Geoderma, 2017, 295: 69-79. DOI:10.1016/j.geoderma.2017.02.019
(  0) 0) |
| [10] |
Das S, Hendry M J, Essilfie-Dughan J. Adsorption of selenate onto ferrihydrite, goethite, and lepidocrocite under neutral pH conditions . Applied Geochemistry, 2013, 28: 185-193. DOI:10.1016/j.apgeochem.2012.10.026
(  0) 0) |
| [11] |
Szlachta M, Chubar N. The application of Fe-Mn hydrous oxides based adsorbent for removing selenium species from water . Chemical Engineering Journal, 2013, 217: 159-168. DOI:10.1016/j.cej.2012.11.100
(  0) 0) |
| [12] |
Li J, Peng Q, Liang D, et al. Effects of aging on the fraction distribution and bioavailability of selenium in three different soils . Chemosphere, 2016, 144: 2351-2359. DOI:10.1016/j.chemosphere.2015.11.011
(  0) 0) |
| [13] |
Jones C P, Grossl P R, Amacher M C, et al. Selenium and salt mobilization in wetland and arid upland soils of Pariette Draw, Utah(USA) . Geoderma, 2017, 305: 363-373. DOI:10.1016/j.geoderma.2017.06.028
(  0) 0) |
| [14] |
王锐, 朱朝菊, 向文军, 等. 针铁矿与胡敏酸的交互作用及其复合物的稳定性. 环境科学, 2017, 38(11): 4860-4867. Wang R, Zhu C J, Xiang W J, et al. Interactions between goethite and humic acid and stability of goethite-humic acid complex (In Chinese). Environmental Sciences, 2017, 38(11): 4860-4867. (  0) 0) |
| [15] |
Chen K Y, Chen T Y, Chan Y T, et al. Stabilization of natural organic matter by short-range-order iron hydroxides . Environmental Science & Technology, 2016, 50(23): 12612-12620.
(  0) 0) |
| [16] |
黄玉芬, 刘忠珍, 魏岚, 等. 土壤不同粒径有机无机复合体对丁草胺的吸附特性. 土壤学报, 2017, 54(2): 400-409. Huang Y F, Liu Z Z, Wei L, et al. Effect of soil orango-inorganic compounds different in particle size on butachlor sorption (In Chinese). Acta Pedologica Sinica, 2017, 54(2): 400-409. (  0) 0) |
| [17] |
周俊, 刘兆云, 孟立丰, 等. 土壤性质对土壤-水稻系统中硒迁移的影响. 土壤, 2016, 48(4): 734-741. Zhou J, Liu Z Y, Meng L F, et al. Selenium transport in soil-paddy system influenced by soil properties (In Chinese). Soils, 2016, 48(4): 734-741. (  0) 0) |
| [18] |
郑学博, 樊剑波, 周静, 等. 沼液化肥配施对红壤旱地土壤养分和花生产量的影响. 土壤学报, 2016, 53(3): 675-684. Zheng X B, Fan J B, Zhou J, et al. Effects of combined application of biogas slurry and chemical fertilizer on soil nutrients and peanut yield in upland red soil (In Chinese). Acta Pedologica Sinica, 2016, 53(3): 675-684. (  0) 0) |
| [19] |
Goh K H, Lim T T. Geochemistry of inorganic arsenic and selenium in a tropical soil: Effect of reaction time, pH, and competitive anions on arsenic and selenium adsorption . Chemosphere, 2004, 55(6): 849-859. DOI:10.1016/j.chemosphere.2003.11.041
(  0) 0) |
| [20] |
Nie Z, Finck N, Heberling F, et al. Adsorption of selenium and strontium on goethite: EXAFS study and surface complexation modeling of the ternary systems . Environmental Science & Technology, 2017, 51(7): 3751-3758.
(  0) 0) |
| [21] |
Rovira M, Giménez J, Martínez M, et al. Sorption of selenium(Ⅳ)and selenium(Ⅵ)onto natural iron oxides: Goethite and hematite . Journal of Hazardous Materials, 2008, 150(2): 279-284. DOI:10.1016/j.jhazmat.2007.04.098
(  0) 0) |
| [22] |
Sheha R R, El–Shazly E A. Kinetics and equilibrium modeling of Se(Ⅳ)removal from aqueous solutions using metal oxides . Chemical Engineering Journal, 2010, 160(1): 63-71. DOI:10.1016/j.cej.2010.03.004
(  0) 0) |
| [23] |
Zelmanov G, Semiat R. Selenium removal from water and its recovery using iron(Fe3+)oxide/hydroxide-based nanoparticles sol(NanoFe)as an adsorbent . Separation and Purification Technology, 2013, 103(15): 167-172.
(  0) 0) |
| [24] |
Börsig N, Scheinost A C, Shaw S, et al. Uptake mechanisms of selenium oxyanions during the ferrihydrite-hematite recrystallization . Geochimica et Cosmochimica Acta, 2017, 206: 236-253. DOI:10.1016/j.gca.2017.03.004
(  0) 0) |
| [25] |
Ling L, Pan B C, Zhang W X. Removal of selenium from water with nanoscale zero–valent iron: Mechanisms of intraparticle reduction of Se(Ⅳ) . Water Research, 2015, 71(15): 274-281.
(  0) 0) |
| [26] |
Liu J F, Zhao Z S, Jiang G B. Coating Fe3O4 magnetic nanoparticles with humic acid for high efficient removal of heavy metals in water . Environmental Science & Technology, 2008, 42(18): 6949-6954.
(  0) 0) |
| [27] |
Lenoble V, Dang D H, Cazalet M L, et al. Evaluation and modelling of dissolved organic matter reactivity toward As(Ⅲ)and As(V)-Implication in environmental arsenic speciation . Talanta, 2015, 134: 530-537. DOI:10.1016/j.talanta.2014.11.053
(  0) 0) |
| [28] |
Coppin F, Chabroullet C, Martin-Garin A. Selenite interactions with some particulate organic and mineral fractions isolated from a natural grassland soil . European Journal of Soil Science, 2009, 60(3): 369-376. DOI:10.1111/ejs.2009.60.issue-3
(  0) 0) |
| [29] |
Kamei–Ishikawa N, Nakamaru Y, Tagami K, et al. Sorption behavior of selenium on humic acid under increasing selenium concentration or increasing solid/liquid ratio . Journal of Environmental Radioactivity, 2008, 99(6): 993-1002. DOI:10.1016/j.jenvrad.2007.11.005
(  0) 0) |
| [30] |
Tolu J, Thiry Y, Bueno M, et al. Distribution and speciation of ambient selenium in contrasted soils, from mineral to organic rich . Science of the Total Environment, 2014, 479: 93-101.
(  0) 0) |
| [31] |
Dinh Q T, Li Z, Tran T A T, et al. Role of organic acids on the bioavailability of selenium in soil: A review . Chemosphere, 2017, 184: 618-635. DOI:10.1016/j.chemosphere.2017.06.034
(  0) 0) |
| [32] |
王磊, 应蓉蓉, 石佳奇, 等. 土壤矿物对有机质的吸附与固定机制研究进展. 土壤学报, 2017, 54(4): 805-818. Wang L, Ying R R, Shi J Q, et al. Advancement in study on adsorption of organic matter on soil minerals and its mechanism (In Chinese). Acta Pedologica Sinica, 2017, 54(4): 805-818. (  0) 0) |
| [33] |
扬子, 刘晓光, 宁静, 等. 典型黑土垄作区耕地沟蚀对土壤养分的影响研究. 土壤, 2017, 49(2): 379-385. Yang Z, Liu X G, Ning J, et al. Effects of gully erosion on soil nutrients in ridge area of typical black soil (In Chinese). Soils, 2017, 49(2): 379-385. (  0) 0) |
| [34] |
Cornell R M, Schwertmann U. The iron oxides: Structure, properties, reactions occurences and uses. Weinheim, Germany: Wiley-VCH, 2003
(  0) 0) |
| [35] |
Liu H, Chen T, Frost R L. An overview of the role of goethite surfaces in the environment . Chemosphere, 2014, 103: 1-11. DOI:10.1016/j.chemosphere.2013.11.065
(  0) 0) |
| [36] |
Petrucci R H, Harwood W S, Herring F G. General chemistry: Principles and modern applications. 8th ed. Upper Saddle River, NJ: Prentice Hall, 2002
(  0) 0) |
| [37] |
The U. S. Secretary of Commerce on behalf of the United States of America. http://srdata.nist.gov/xps/selEnergyType.aspx, 2012-09-15
(  0) 0) |
| [38] |
Bhargava G, Gouzman I, Chun C M, et al. Characterization of the "native" surface thin film on pure polycrystalline iron: A high resolution XPS and TEM study . Applied Surface Science, 2007, 253(9): 4322-4329. DOI:10.1016/j.apsusc.2006.09.047
(  0) 0) |
| [39] |
Descostes M, Mercier F, Thromat N, et al. Use of XPS in the determination of chemical environment and oxidation state of iron and sulfur samples: Constitution of a data basis in binding energies for Fe and S reference compounds and applications to the evidence of surface species of an oxidized pyrite in a carbonate medium . Applied Surface Science, 2000, 165(4): 288-302. DOI:10.1016/S0169-4332(00)00443-8
(  0) 0) |
| [40] |
Grosvenor A P, Kobe B A, Biesinger M C, et al. Investigation of multiplet splitting of Fe2p XPS spectra and bonding in iron compounds . Surface and Interface Analysis, 2004, 36(12): 1564-1574. DOI:10.1002/(ISSN)1096-9918
(  0) 0) |
| [41] |
Mikutta C, Kretzschmar R. Spectroscopic evidence for ternary complex formation between arsenate and ferric iron complexes of humic substances . Environmental Science & Technology, 2011, 45(22): 9550-9557.
(  0) 0) |
| [42] |
Chubar N, Gerda V, Szlachta M. Mechanism of selenite removal by a mixed adsorbent based on Fe-Mn hydrous oxides studied using X-ray absorption spectroscopy . Environmental Science & Technology, 2014, 48(22): 13376-13383.
(  0) 0) |
| [43] |
Martin R R, Smart R S C. X-ray photoelectron studies of anion adsorption on goethite . Soil Science Society of America Journal, 1987, 51(1): 54-56. DOI:10.2136/sssaj1987.03615995005100010010x
(  0) 0) |
| [44] |
Xiong J, Koopal L K, Weng L, et al. Effect of soil fulvic and humic acid on binding of Pb to goethite–water interface: Linear additivity and volume fractions of HS in the stern layer . Journal of Colloid and Interface Science, 2015, 457: 121-130. DOI:10.1016/j.jcis.2015.07.001
(  0) 0) |
| [45] |
Mangolini F, Rossi A, Spencer N D. Chemical reactivity of triphenyl phosphorothionate(TPPT)with iron: An ATR/FT-IR and XPS investigation . The Journal of Physical Chemistry C, 2010, 115(4): 1339-1354.
(  0) 0) |
| [46] |
Tan X, Fan Q, Wang X, et al. Eu(Ⅲ)sorption to TiO2(anatase and rutile): Batch, XPS, and EXAFS studies . Environmental Science & Technology, 2009, 43(9): 3115-3121.
(  0) 0) |
| [47] |
Okpalugo T I T, Papakonstantinou P, Murphy H, et al. High resolution XPS characterization of chemical functionalised MWCNTs and SWCNTs . Carbon, 2005, 43(1): 153-161. DOI:10.1016/j.carbon.2004.08.033
(  0) 0) |
| [48] |
Fan Q H, Tan X L, Li J X, et al. Sorption of Eu(Ⅲ)on attapulgite studied by batch, XPS, and EXAFS techniques . Environmental Science & Technology, 2009, 43(15): 5776-5782.
(  0) 0) |
| [49] |
付茂, 吴德礼, 张亚雷, 等. 多羟基结构态亚铁化合物预处理含亚硒酸盐工业废水的影响机制. 高等学校化学学报, 2016, 37(12): 2221-2227. Fu M, Wu D L, Zhang Y L, et al. Removal research of selenite in wastewater with the ferrous hydroxyl complex(FHC) (In Chinese). Chemical Journal of Chinese Universities, 2016, 37(12): 2221-2227. DOI:10.7503/cjcu20160435 (  0) 0) |
| [50] |
Papelis C. X-ray photoelectron spectroscopic studies of cadmium and selenite adsorption on aluminum oxides . Environmental Science & Technology, 1995, 29(6): 1526-1533.
(  0) 0) |
 2018, Vol. 55
2018, Vol. 55


