2. 山东农业工程学院国土资源与测绘工程学院,济南 250100;
3. 中国科学院沈阳应用生态研究所,沈阳 110016;
4. 沈阳农田生态系统国家野外科学观测研究站,沈阳 110016
全球气候变化以及人类活动的强烈干扰, 使得土壤盐渍化已成为全球干旱、半干旱以及滨海地区最主要和影响最广泛的土地退化问题之一[1-2]。由于盐渍化对土壤的物理、化学、生物学性质均有负面影响, 盐渍化土壤的肥力普遍较低, 从而制约了土地生产力[2]。微生物是驱动土壤元素生物地球化学循环的引擎。土壤微生物及其调控的一系列复杂生物化学过程主导了土壤养分循环过程和有机质的转化积累, 从而直接影响土壤生态系统的功能特性[3]。然而, 土壤盐渍化易造成土壤微生物的渗透胁迫, 减少微生物量和土壤酶的分泌从而影响土壤养分转化与循环[4-5]。因此, 充分认识盐渍土-微生物的相互作用是提高盐渍土地力及养分利用效率的前提。
土壤中微生物同化的碳氮主要用以构建微生物细胞组分, 如蛋白质、核酸、氨基糖(细胞壁成分)等, 同时也构成了土壤微生物量[6]。土壤微生物量碳氮仅占土壤总有机质碳氮库的1%~5%[7], 虽然微生物量具有库容小、周转速率高的特点, 但是采用微生物量的方法并不能准确评价土壤碳氮的微生物转化过程, 因为微生物量反映的只是土壤微生物过程的瞬时特征[8]。微生物残留物(氨基糖、蛋白质等组分)作为微生物生长和分解的副产物具有一定稳定性, 而且随着微生物的快速周转, 微生物利用外源氮素合成的有机组分不断的以微生物残留物的形式在土壤中累积[9]。在连续时间尺度上, 微生物残留物可以指示微生物的代谢和周转过程以及长期累积特征[10]。因此, 以微生物残留物的某种组分(氨基糖)作为标识物为深入研究和了解盐渍土养分循环特征及有机质形成和转化的内在微生物作用机制带来新的思路。
土壤氨基糖主要来源于微生物细胞壁, 是微生物残留物的重要组分且具有异源性[11]。在土壤中常见的四种土壤氨基糖中, 氨基葡萄糖(GluN)主要来源于真菌;氨基半乳糖(GalN)来源并不明确, 一般认为主要来自细菌的贡献;氨基甘露糖的含量极低且来源不很明确;胞壁酸(MurA)唯一来源于细菌[11-12]。因此, 氨基糖作为微生物残留物的标识物, 其积累和转化特性可以指示来源于真菌和细菌的同化碳氮的去向, 以及不同微生物群落在土壤碳氮转化、截获过程中的相对贡献[13]。然而, 土壤氨基糖的累积特征与盐渍化程度的关系尚不清楚。为此, 本文选取黄河三角洲典型滨海盐渍土为研究对象, 以氨基糖作为指示物质, 研究垦殖过程中不同盐渍化土壤氨基糖数量的变化特征, 探讨盐渍化程度对土壤氨基糖累积特征的影响以及真菌和细菌在氨基糖累积过程中的相对贡献。以期能从微生物标识物角度出发, 在具体化合物分子水平上, 认识盐渍土-微生物的相互作用对盐渍土肥力的调控机制。
1 材料与方法 1.1 研究区概况研究区位于山东省东营市利津县汀罗镇“渤海农场”(37.79°N, 118.63°E), 属于黄河三角洲典型盐渍土区。该地属暖温带大陆性季风气候, 多年平均气温12.8℃, 无霜期206 d。年平均降水量540 mm, 多集中在6-8月份, 占全年降水量的64%[14]。
1.2 样品采集与分析于2016年4月在“渤海农场”试验地进行土壤样品采集。选择连续种植冬小麦-夏玉米3年以上的轻度(LS)和中度(MS)盐渍土(平均全盐含量分别为1.82和3.69 g kg-1), 采用蛇形布点法采集两种盐渍土耕层(0~20 cm)混合土壤样品各4个。采集的土壤样品去除植物残体后, 在实验室通风处自然风干, 并适时压碎, 采用四分法取适量土壤研磨过60目细筛, 之后混匀以备用。土壤pH采用pH计测定, 水土比为2.5:1;土壤电导率(EC)采用水土比5:1浸提, 电导率仪测定;土壤有机碳(SOC)采用重铬酸钾氧化-外加热法测定;土壤全氮(TN)采用元素分析仪测定;土壤有效磷采用0.5 mol L-1 NaHCO3浸提-钼蓝比色法测定;土壤速效钾采用NH4OAc浸提-火焰光度法测定;土壤含盐量采用烘干残渣法测定;土壤颗粒组成采用吸管法测定[15-16]。
1.3 土壤氨基糖测定氨基糖含量的测定采用气相色谱法[17]:将含有约0.3 mg N的土壤样品置于水解瓶中, 加入10 mL 6 mol L-1 HCl, 在105 ℃下水解8 h。冷却至室温后, 加入100 μg的肌醇(内标1)振荡摇匀后过滤。用旋转蒸发仪将滤液蒸干, 残余物溶解于约20 mL的蒸馏水中并用0.4 mol L-1 KOH和0.1 mol L-1 HCl调pH范围至6.6~6.8, 以沉淀溶液中铁铝等金属离子和部分有机物, 然后以3 000 r min-1离心10 min以去除沉淀。上清液用冷冻干燥仪冻干, 残留的固体物质用4 ml的无水甲醇溶解, 再次以3 000 r min-1离心10 min以达到除盐的目的。将上清液转移到5 ml衍生瓶中, 在45℃下用N2吹干后, 加入1 ml水, 同时加入100 μg N-甲基氨基葡萄糖(内标2), 摇匀后再次进行冷冻干燥。同时, 做两个标准样品, 具体操作为:在衍生瓶中加入100 μg胞壁酸标准溶液, 用N2在45 ℃下吹干后, 加入其他3种氨基糖的标准溶液100 μg, 及100 μg的肌醇(内标1)和100 μg N-甲基氨基葡萄糖(内标2), 加入1 mL水摇匀后与样品一起在冷冻干燥仪上干燥。
衍生主要步骤为:将0.3 mL衍生试剂(4:1吡啶-甲醇的溶液, 含有32 mg mL-1盐酸羟胺和40 mg mL-1 4-二甲基氨基吡啶)加至含有氨基糖混合物的衍生瓶中, 加盖密封, 剧烈振荡数秒后, 在75℃~80℃条件下加热35 min, 其间振荡数次。冷却至室温后, 加入1 ml乙酸酐, 密封振荡后再次加热25 min。冷却后加入1.5 ml二氯甲烷, 用以提取氨基糖的衍生物质, 过量的乙酸酐可用1 mol L-1 HCl和蒸馏水按如下步骤洗除:加入1 ml 1 mol L-1 HCl后, 剧烈振荡约30秒, 静置一段时间后移除上层无机相。再用1 ml的蒸馏水以同样的方法洗涤3次, 在最后一次洗涤过程中尽可能地去除无机相。剩余的有机相在45℃下用N2吹干后, 用200 μl乙酸乙酯-正己烷混合溶剂(V:V=1:1)溶解后转移至气相色谱进样瓶中便可上机测定。气相色谱测定条件参考Zhang和Amelung[17]报道的条件。根据内标法原理, 计算土壤中氨基糖含量。每种氨基糖的含量(Cx, mg kg-1)可利用如下公式计算[18]:
| $ {C_{\rm{x}}} = {C_{\rm{i}}}\frac{{{A_{\rm{x}}}}}{{{A_{\rm{i}}}}}{R_{\rm{f}}} $ |
式中, Ci为内标1(肌醇)的浓度(mg kg-1);Ai和Ax分别为样品测定中肌醇和每种氨基糖的峰面积;Rf为每种氨基糖的相对校正因子, 由标准样品中氨基糖和肌醇的校正因子计算。
1.4 数据处理运用SPSS 16.0软件对数据进行统计分析, 采用独立样本T检验(Independent samples T test)比较不同盐渍化土壤间的差异;采用Pearson相关分析法进行相关性分析;使用SigmaPlot 12.5软件作图。
2 结果 2.1 不同盐渍土理化性质特征两种盐渍土理化性质有较大差异(表 1)。中度盐渍土pH显著高于轻度盐渍土(p < 0.01), 其土壤电导率较轻度盐渍土高75.1%, 差异达极显著水平(p < 0.01)。轻度盐渍土SOC、TN含量分别较中度盐渍土高62.2%和49.2%, 但两种土壤C/N无显著差异(p > 0.05)。中度盐渍土有效磷和速效钾含量均显著高于轻度盐渍土(p < 0.05)。两种土壤质地一致, 砂粒、粉粒、黏粒含量均无显著性差异(p > 0.05), 砂粒在颗粒组成上占绝对优势。
|
|
表 1 不同盐渍土的基本理化性质 Table 1 Physicochemical properties of the salinized soils in the Yellow River Delta |
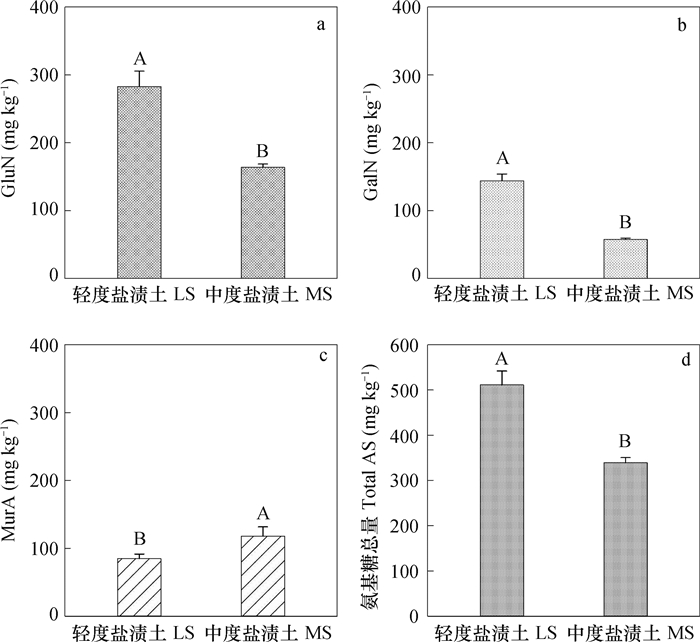
由图 1可见, 盐渍化程度对土壤氨基糖的积累有显著影响。GluN在3种氨基糖中含量最高。由图 1a可见, 轻度盐渍土中的GluN的含量为282.6 mg kg-1, 显著高于中度盐渍土, 高出比例达72.6%。就数量而言, GalN低于GluN, 显著高于MurA。从图 1b可以看出, GalN在轻度盐渍土中的含量为143.9 mg kg-1, 是中度盐渍土(57.6 mg kg-1)的2.5倍, 差异达极显著水平(p < 0.01), 这与GluN的累积特征相同。由图 1c可见, MurA的含量在不同盐渍化土壤上表现出与GluN和GalN相反的规律:中度盐渍土中MurA的含量达到117.7 mg kg-1, 较轻度盐渍土高39.0%(p < 0.01)。就氨基糖总量(以GluN、GalN和MurA含量的加和表示)而言, 轻度盐渍土较中度盐渍土高172.1 mg kg-1, 高出比例达到了50.7%(p < 0.01), 这与GluN、GalN的累积特征相同(图 1d)。
|
图 1 轻度和中度盐渍土中氨基葡萄糖GluN (a)、氨基半乳糖GalN (b)、胞壁酸MurA (c)含量以及氨基糖总量(d) Fig. 1 Contents of glucosamine (GluN), galacosamine (GalN), muramic acid (MurA) and total amino sugars in the light-and moderate-salinized soils in the Yellow River Delta 注:同一指标不同英文字母表示差异性显著(p < 0.01)。下同 Note: Different letters affixed to the same index mean for significant difference at 0.01 level. The same below |
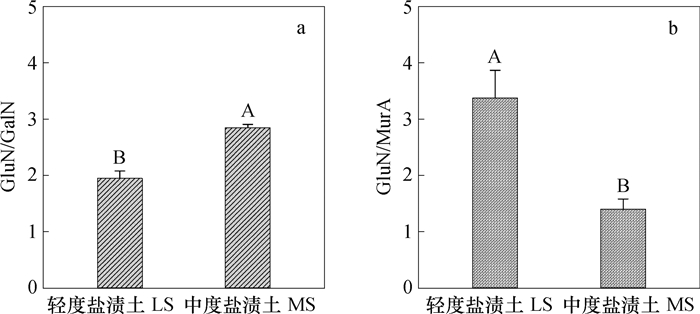
由图 2a可见, 在轻度盐渍土中, GluN/GalN仅为1.95, 显著低于中度盐渍土的2.85(p < 0.01);而由图 2b可见, 与前者相比, GluN/MurA呈现出相反的特征。在轻度盐渍土中, GluN/MurA达到3.38, 显著高于中度盐渍土的1.40(p < 0.01)。
|
图 2 轻度和中度盐渍土中氨基葡萄糖GluN与氨基半乳糖GalN (a)、胞壁酸MurA (b)比值的变化 Fig. 2 Ratios of glucosamine (GluN) to galacosamine (GalN) and to muramic acid (MurA) in the light-and moderate-salinized soils in the Yellow River Delta |
黄河三角洲不同盐渍化土壤氨基糖的各指标与土壤pH、EC、SOC、TN及C/N之间的关系, 见表 2。从中可知, GluN、GalN、氨基糖总量以及GluN/MurA与pH、EC均呈极显著负相关(p < 0.01), 与SOC、TN均呈极显著正相关(p < 0.01), 而与C/N的相关性不显著(p > 0.05)。然而, 对于MurA、GluN/GalN而言, 与前4个氨基糖指标相比, 这两个氨基糖指标与土壤理化性质的关系表现出相反的相关性。与pH、EC均呈显著或极显著正相关(p < 0.05或p < 0.01), 而与SOC、TN均呈显著或极显著负相关(p < 0.05或p < 0.01), MurA与C/N呈极显著负相关(p < 0.01), 而GluN/GalN与C/N的相关性不显著(p > 0.05)。
|
|
表 2 土壤氨基糖与土壤理化性质之间的相关性 Table 2 Correlation analysis of soil amino sugars and basic physicochemical properties of the salinized soils |
土壤中的氨基糖主要来源于土壤微生物, 其中微生物死亡残体的贡献最大, 占氨基糖总量的绝大部分[13, 19]。由于氨基糖在土壤中具有一定的稳定性和异源性, 因此, 其累积动态和土壤碳氮的微生物同化过程密切相关[20]。氨基糖作为重要的微生物标识物, 可以用来研究土壤微生物(真菌和细菌)对外界环境变化的响应和对土壤有机质的积累与碳氮周转的相对贡献。前人研究表明, 气候环境变化、土地利用方式、土壤理化性质等均会引起土壤氨基糖含量的变化[20-23]。本研究结果表明, 氨基糖在黄河三角洲垦殖区盐渍土中的累积特征受到盐渍化程度的显著影响, 不同微生物来源氨基糖的响应有显著差异(图 1), 这说明土壤中不同微生物对滨海土壤盐渍化程度的响应有所不同。
土壤中大部分GluN来源于真菌细胞壁几丁质。因此, GluN主要用来表征真菌残留物的累积特征。本研究中, 两种盐渍土GluN的含量在163~283 mg kg-1范围内, 与在黑土、棕壤、水稻土及森林土壤上的研究相比, 含量偏低[20-23]。有研究表明, 与普通农用土壤相比, 盐碱地的真菌、细菌等微生物数量普遍较低, 一般认为这是由于盐度导致的微生物生存适宜环境改变的结果[24]。尽管活体微生物数量只是一个瞬时指标, 但是在一定程度上活体微生物数量与其死亡残体的累积量是呈正相关的。因此, 本研究中GluN的累积量偏低可能是由真菌生物量较低导致的。此外, 有研究指出, 随着土壤含盐量的增加, 土壤微生物数量呈明显的下降趋势[25]。对于GluN而言, 轻度盐渍土的含量显著高于中度盐渍土, 这说明GluN的累积数量与盐渍化程度也成反比, 即盐渍化程度越高越不利于真菌来源的GluN的积累。此外, 与土壤理化性质的相关性分析表明, GluN的累积与土壤pH呈反比, 而与SOC、TN呈正比, 这与在其他生态系统的研究结果一致[26]。这主要是因为土壤pH是影响真菌生物量和活性的重要因素, pH升高会显著降低真菌的生物量, 从而影响GluN的积累。而微生物同化碳氮主要是以死亡残体的形式贡献于土壤有机质, 因此GluN与SOC、TN呈显著正相关。
目前, 有关土壤GalN的来源仍然存在着不同的推断, 一般认为土壤中GalN主要来源于细菌的贡献[11], 然而也有一些研究指出真菌对土壤GalN的贡献更大[13]。在本研究中, 轻度和中度盐渍土中GalN的含量均显著低于相应的GluN, 分别占氨基糖总量的28%和17%。尽管盐渍土中GalN含量较低, 但是其占氨基糖总量的比例与其他生态系统的相关研究结果一致。两种盐渍土中GalN的累积特征与GluN较为相似(图 1b), 即在轻度盐渍土中的累积量显著高于中度盐渍土。与土壤理化性状的相关性分析表明, GalN与EC、pH呈极显著负相关, 而与SOC、TN呈极显著正相关, 这与GluN一致。两种盐渍土中GalN的累积特征及其与理化性状的相关性, 可能暗示着在盐渍土中真菌对GalN的贡献不容忽视。
土壤中MurA唯一来源于细菌, 因此, MurA的积累特征与细菌的生长和代谢密切相关[13]。轻度和中度盐渍土中MurA含量分别达85和118 mg kg-1, 分别占氨基糖总量的17%和35%, 这高于在其他农田土壤上的研究结果[20-23]。目前, 关于盐渍土中微生物残留物(氨基糖)的相关研究很少, 但是关于滨海和内陆盐碱地的微生物种类和数量的研究相对较多。研究表明盐碱地中细菌数量占绝对优势, 其次为放线菌和真菌, 这与盐碱土具有较高的含盐量和pH有关[27]。因此, 在盐渍土中相对较高的细菌微生物量是维持MurA较高含量的主要原因。MurA与土壤EC和pH的正相关关系表明细菌残留物易在中度盐渍土中累积。何红波等[18]认为MurA具有平衡土壤碳源、氮源供给与需求的双重作用。同文献28, Muhammad等[28]研究表明土壤盐碱度的降低会促进微生物对有机质的分解作用。因此, 轻度盐渍土中MurA的含量较低, 可能是由于在轻度盐渍土中微生物代谢和活性相对较高, 促进了MurA分解以满足微生物对碳源和能源的需求, 从而降低其累积量;在中度盐渍土中较低的SOC和TN含量表明, 相对较低的微生物数量和活性显著降低了土壤有机质的合成累积[28], 但由于细菌在群落组成中占绝对优势[27], 因此, MurA表现出相对较高的累积量。MurA与SOC、TN呈显著负相关关系表明, 虽然在盐渍土中细菌残留物对有机质累积的贡献较高, 但是并未促进有机质总量的增加, 因此在对比不同农田土壤微生物残留物对有机质累积的贡献时, 应该充分考虑土壤微生物量和群落组成的差异。
3.2 盐渍化程度对真菌和细菌在土壤有机质累积过程中相对贡献的影响微生物是土壤碳氮循环的重要驱动力, 并最终决定土壤肥力和土壤生态系统的整体功能。微生物对土壤碳氮的转化主要有真菌和细菌主导的两种途径, 因此, 区分真菌和细菌在碳氮转化过程中的作用和相对贡献, 有利于更好地评价和预测土壤肥力变化及外源底物在土壤中的去向[29]。由于GluN主要来源于真菌, MurA唯一来源于细菌, 所以通常利用GluN/MurA的变化来反映真菌和细菌在土壤有机质累积、转化过程中的相对贡献。与在其他农田土壤上的相关研究对比发现, 该比值在滨海盐渍土中较低[18, 20-23], 这说明盐渍土中细菌对有机质积累的作用要大于其他农田土壤, 这与盐渍土微生物数量与种类的研究结果一致[27]。对比轻度和中度盐渍土的GluN/MurA发现, 随着盐渍程度加大, 该比值大幅降低则表明细菌残留物对土壤有机质积累的贡献显著提高, 从而也反映出不同盐渍土中微生物群落结构及其相对作用的变化。孙佳杰等[30]利用分子生物学手段研究表明, 盐渍程度是影响滨海盐碱土微生物群落结构的主导因子, 盐化程度越重, 细菌所占的比例越大, 本研究结果与之相吻合。此外, 通过对比本研究中GluN/MurA与GluN/GalN发现, 随着盐渍程度加大两个比值呈现出相反的变化规律, 分析其原因可能有两点:一是GalN和MurA的微生物来源不同, 真菌对GalN的贡献较大;二是GalN和MurA的分子结构不同可能造成两种氨基糖在土壤中的累积和周转过程不同[31]。因此, 在今后的研究中有必要对土壤GalN的微生物来源及其转化和累积特征做进一步研究[19-20]。
4 结论氨基糖在黄河三角洲垦殖区盐渍土中的积累特征受到盐渍化程度的显著影响, 各氨基糖的响应因微生物来源不同而有所差异。轻度盐渍土氨基糖总含量显著高于中度盐渍土。在两种盐渍土中, 真菌细胞壁残留物氨基葡萄糖和细菌细胞壁残留物胞壁酸的积累特征显著不同。在轻度盐渍土中真菌细胞壁残留物的积累具有明显优势, 暗示着真菌为优势群体;而细菌细胞壁残留物更易在中度盐渍土积累, 表明随着土壤盐渍程度加大, 细菌逐渐转为优势群体, 细菌残留物对土壤有机质积累的相对贡献显著增大。本研究表明, 氨基糖的变化可以作为盐渍土改良与培肥过程中有机质积累与转化过程的一个重要评价指标。
| [1] |
杨劲松. 中国盐渍土研究的发展历程与展望. 土壤学报, 2008, 45(5): 837-845. Yang J S. Development and prospect of the research on salt-affected soils in China (In Chinese). Acta Pedologica Sinica, 2008, 45(5): 837-845. (  0) 0) |
| [2] |
Rengasamy P. World salinization with emphasis on Australia . Journal of Experimental Botany, 2006, 57(5): 1017-1023. DOI:10.1093/jxb/erj108
(  0) 0) |
| [3] |
Rasche F, Cadisch G. The molecular microbial perspective of organic matter turnover and nutrient cycling in tropical agroecosystems-What do we know? . Biology and Fertility of Soils, 2013, 49(3): 251-262. DOI:10.1007/s00374-013-0775-9
(  0) 0) |
| [4] |
Elgharably A, Marschner P. Microbial activity and biomass and N and P availability in a saline sandy loam amended with inorganic N and lupin residues . European Journal of Soil Biology, 2011, 47(5): 310-315. DOI:10.1016/j.ejsobi.2011.07.005
(  0) 0) |
| [5] |
李玲, 仇少君, 陈印平, 等. 黄河三角洲区土壤活性氮对盐分含量的响应. 环境科学, 2014, 35(6): 2358-2364. Li L, Qiu S J, Chen Y P, et al. Response of active nitrogen to salinity in a soil from the Yellow River Delta (In Chinese). Environmental Science, 2014, 35(6): 2358-2364. (  0) 0) |
| [6] |
Schepers J S, Raun W R. Nitrogen in agricultural systems. Agronomy Monograph No. 49. American Society of Agronomy, Madison, 2008
(  0) 0) |
| [7] |
仇少君, 彭佩钦, 刘强, 等. 土壤微生物生物量氮及其在氮素循环中作用. 生态学杂志, 2006, 25(4): 443-448. Qiu S J, Peng P Q, Liu Q, et al. Soil microbial biomass nitrogen and its role in nitrogen cycling (In Chinese). Chinese Journal of Ecology, 2006, 25(4): 443-448. (  0) 0) |
| [8] |
李生秀. 中国旱地土壤植物氮素. 北京: 科学出版社, 2008. Li S X. Soil and plant nitrogen in dryland areas of China (In Chinese). Beijing: Science Press, 2008. (  0) 0) |
| [9] |
He H B, Zhang W, Zhang X D, et al. Temporal responses of soil microorganisms to substrate addition as indicated by amino sugar differentiation . Soil Biology & Biochemistry, 2011, 43: 1155-1161.
(  0) 0) |
| [10] |
Pan Y, Cassman N, De H M, et al. Impact of long-term N, P, K, and NPK fertilization on the composition and potential functions of the bacterial community in grassland soil . FEMS Microbiology Ecology, 2014, 90(1): 195-205. DOI:10.1111/fem.2014.90.issue-1
(  0) 0) |
| [11] |
Engelking B, Flessa H, Joergensen R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil . Soil Biology & Biochemistry, 2007, 39: 2111-2118.
(  0) 0) |
| [12] |
Liang C, Duncan D S, Balser T C, et al. Soil microbial residue storage linked to soil legacy under biofuel cropping systems in southern Wisconsin, USA . Soil Biology & Biochemistry, 2013, 57: 939-942.
(  0) 0) |
| [13] |
Glaser B, Turrión M A B, Alef K. Amino sugars and muramic acid-biomarkers for soil microbial community structure analysis . Soil Biology & Biochemistry, 2004, 36: 399-407.
(  0) 0) |
| [14] |
单晶晶, 陈小兵, 尹春艳, 等. 黄河三角洲盐碱土冬小麦氮磷肥料效应模型研究. 中国生态农业学报, 2017, 25(7): 1016-1024. Shan J J, Chen X B, Yin C Y, et al. Comparison of fertilizer-effect models on winter wheat response to nitrogen and phosphorus fertilizers in saline soils in the Yellow River Delta (In Chinese). Chinese Journal of Eco-Agriculture, 2017, 25(7): 1016-1024. (  0) 0) |
| [15] |
鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科学技术出版社, 2000. Lu R K. Analytical methods for soil and agro-chemistry(In Chinese) (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. (  0) 0) |
| [16] |
鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000. Bao S D. Soil and agricultural chemical analysis(In Chinese) (In Chinese). 3rd ed. Beijing: China Agriculture Press, 2000. (  0) 0) |
| [17] |
Zhang X D, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, galactosamine, and mannosamine in soils . Soil Biology & Biochemistry, 1996, 28: 1201-1206.
(  0) 0) |
| [18] |
何红波, 李晓波, 张威, 等. 葡萄糖和不同数量氮素供给对黑土氨基糖动态的影响. 土壤学报, 2010, 47(4): 760-766. He H B, Li X B, Zhang W, et al. Effect of glucose and nitrogen supply on dynamics of amino sugars in mollisol (In Chinese). Acta Pedologica Sinica, 2010, 47(4): 760-766. DOI:10.11766/trxb2010470423 (  0) 0) |
| [19] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage . Nature Microbiology, 2017, 2(8): 17105. DOI:10.1038/nmicrobiol.2017.105
(  0) 0) |
| [20] |
丁雪丽, 张旭东, 杨学明, 等. 免耕秸秆还田和传统耕作方式下东北黑土氨基糖态碳的积累特征. 土壤学报, 2012, 49(3): 535-543. Ding X L, Zhang X D, Yang X M, et al. Accumulation of amino sugar carbon affected by tillage in black soil in Northeast China (In Chinese). Acta Pedologica Sinica, 2012, 49(3): 535-543. DOI:10.11766/trxb201012210539 (  0) 0) |
| [21] |
王辛辛, 何红波, 胡国庆, 等. 底物添加对森林2个不同演替阶段土壤氨基糖动态的影响. 北京林业大学学报, 2016, 38(4): 86-93. Wang X X, He H B, Hu G Q, et al. Effects of substrates on dynamics of amino sugars in two different stages of succession in forest soil (In Chinese). Journal of Beijing Forestry University, 2016, 38(4): 86-93. (  0) 0) |
| [22] |
李响, 何红波, 张威, 等. 外源无机氮素形态对土壤氨基糖动态的影响. 应用生态学报, 2012, 23(5): 1153-1158. Li X, He H B, Zhang W, et al. Effects of extraneous inorganic nitrogen forms on the dynamics of soil amino sugars (In Chinese). Chinese Journal of Applied Ecology, 2012, 23(5): 1153-1158. (  0) 0) |
| [23] |
Shao S, Zhao Y, Zhang W, et al. Linkage of microbial residue dynamics with soil organic carbon accumulation during subtropical forest succession . Soil Biology & Biochemistry, 2017, 114: 114-120.
(  0) 0) |
| [24] |
Zhang Y B, Lin P, Wei X Y, et al. Effect of salin ity on microbial densities of soil in the dilution plate technique applied in mangrove areas . Acta Ecologica Sinica, 2008, 28(3): 1287-1295.
(  0) 0) |
| [25] |
牛世全, 杨建文, 胡磊, 等. 河西走廊春季不同盐碱土壤中微生物数量、酶活性与理化因子的关系. 微生物学通报, 2012, 39(3): 416-427. Niu S Q, Yang J W, Hu L, et al. Relationship with soil microbial quantity, soil enzyme activity and physicochemical factor between different saline-alkali soil in Hexi Corridor in spring (In Chinese). Microbiology China, 2012, 39(3): 416-427. (  0) 0) |
| [26] |
Khan K S, Mack R, Castillo X, et al. Microbial biomass, fungal and bacterial residues, and their relationships to the soil organic matter C/N/P/S ratios . Geoderma, 2016, 271: 115-123. DOI:10.1016/j.geoderma.2016.02.019
(  0) 0) |
| [27] |
孔涛, 张德胜, 徐慧, 等. 盐碱地及其改良过程中土壤微生物生态特征研究进展. 土壤, 2014, 46(5): 793-798. Kong T, Zhang D S, Xu H, et al. Microbial ecological characteristics of alkaline-saline lands and its amelioration process: A review (In Chinese). Soils, 2014, 46(5): 793-798. (  0) 0) |
| [28] |
Muhammad S, MuüLler T, Joergensen R G. Relationships between soil biological and other soil properties in saline and alkaline arable soils from the Pakistani Punjab . Journal of Arid Environments, 2008, 72(4): 448-457. DOI:10.1016/j.jaridenv.2007.06.016
(  0) 0) |
| [29] |
Six J, Frey S D, Thiet R K, et al. Bacterial and fungal contributions to carbon sequestration in agroecosystems . Soil Science Society of America Journal, 2006, 70(2): 555-569. DOI:10.2136/sssaj2004.0347
(  0) 0) |
| [30] |
孙佳杰, 尹建道, 解玉红, 等. 天津滨海盐碱土壤微生物生态特性研究. 南京林业大学学报(自然科学版), 2010, 34(3): 57-61. Sun J J, Yin J D, Xie Y H, et al. Microbial ecological characteristics of saline-alkali soil in coastal area of Tianjin (In Chinese). Journal of Nanjing Forestry University(Natural Science Edition), 2010, 34(3): 57-61. (  0) 0) |
| [31] |
Zhang W, He H B, Li Q, et al. Soil microbial residue dynamics after 3-year elevated O3, exposure are plant species-specific . Plant and Soil, 2014, 376(1/2): 139-149.
(  0) 0) |
2. College of Land Resources and Surveying Engineering, Shandong Agriculture and Engineering University, Jinan 250100, China;
3. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;
4. National Field Observation and Research Station of Shenyang Agroecosystems, Shenyang 110016, China
 2018, Vol. 55
2018, Vol. 55


