土壤中存在大量的矿物质、有机质及微生物,这些物质多为1~1 000 nm尺度范围的纳米/胶体颗粒,是土壤中最重要最活跃的成分,在土壤肥力和生态功能中扮演着关键角色[1-2]。土壤颗粒的聚集与分散是土壤中一种重要的物理化学过程[3]。土壤颗粒的聚集有利于扩大土壤孔隙度,增加土壤的通透能力,进而影响着土壤水分运动及土壤侵蚀以及农田面源污染等宏观现象,对土壤及环境保护具有重要意义。
土壤颗粒的聚集/分散主要受颗粒间相互作用的控制,包括颗粒间的静电斥力、水合斥力和范德华引力等。静电斥力决定于颗粒的表面电位[4],同时决定范德华引力大小的哈梅克常数同样与表面电位有关[5],而水合斥力为短程力(力程约2 nm)[6]。因此凡是影响表面电位的因素均会影响胶体颗粒的聚集/分散,包括电解质浓度、离子化合价、离子水化、量子涨落力以及极化作用等。对于同价离子引起的土壤胶体颗粒凝聚/分散出现的差异称为离子特异性效应[7]。大量研究表明[7-9],胶体颗粒的聚集/分散中的离子特异性效应受到上述因素的影响。
目前对土壤颗粒间相互作用研究主要通过理论预测与土壤宏观实验趋势相比较而定性反映颗粒间相互作用方式[10-11]。原子力显微镜(AFM)是一种研究颗粒聚集与黏附力比较直观的显微工具。原子力显微镜问世后,使得纳米微观研究得到长远发展。在矿物方面,研究者运用原子力显微镜观察矿物的聚集及表面电场等[12-13],为复杂的过程提供了前所未有的技术手段[14],同时为获得复杂土壤系统的特征提供了一个独特的实验能力[13]。
离子特异性是Hofmeister在120年前研究不同离子引起蛋白质凝聚的能力不同而存在的一个离子序列,这个序列即为Hofmeister序列[15]。Hofmeister序列下面蕴含着深刻的科学问题,并且将持续挑战所有相关理论[16]。大量研究认为离子大小、水化作用、量子涨落力或色散力[17-19]以及表面电荷[20-21]对Hofmeister效应起着决定性作用。在土壤体系中,这些因素可能同样对土壤/矿物颗粒相互作用起着重要作用,本研究利用原子力显微镜技术观察蒙脱石纳米颗粒在几种碱金属离子体系中聚集的情况。通过对凝聚体大小、形貌及颗粒与针尖的黏附力的直接观察,分析同价碱金属离子间的差异对颗粒聚集的影响,阐明蒙脱石颗粒表面黏附力和颗粒聚集中的离子特异性效应,为颗粒间相互作用力的理论研究提供技术佐证。
1 材料与方法 1.1 供试材料本实验所用的蒙脱石材料购买自内蒙古物华天宝矿物有限公司。称取10 mg研磨后过200目筛的蒙脱石,将其溶于超纯水中制备200 mg L-1的50 ml蒙脱石悬液,再向蒙脱石悬液中分别加入50 ml不同浓度的LiCl、KCl、NaCl、RbCl、CsCl、溶液,浓度设置为10 mmol L-1、30 mmol L-1、50 mmol L-1。将溶液在震荡仪上震荡10 h,将溶液静置30 min,取上部较清澈的悬液5 μl滴在清新的云母片上,在密闭的环境中自然晾干。
1.2 研究方法本实验所使用的原子力显微镜(AFM)是美国BRUKER公司的DIMENSION ICON WITH SCANASYST型。探针是SNL-10上的A针(f0:50-80 KHZ, k:0.35 NM-1),采用接触模式在室温大气环境下扫描。扫描前通过力曲线来调整激光光斑位置,以防止针尖压力过大划伤样品或压力过小导致图像失真。AFM图像是采用高程图像的方式记录样品在恒力下测得的,并被用来分析表面纳米形貌和颗粒分布情况[22]。在测得形貌图基础上选取图中蒙脱石颗粒,保持压电扫描器在X-Y平面不动,控制原子力显微镜压电陶瓷扫描器在Z方向做伸缩运动,这样探针就可以趋近蒙脱石颗粒表面,进而接触样品,然后远离样品,获取探针与颗粒间的力谱特征。探针远离蒙脱石颗粒过程中,需要克服样品对探针的吸引力,通常称为黏附力。最后运用NanoScope Analysis软件对形貌图和力谱进行分析并提取形貌和黏附力数据。
2 结果与讨论蒙脱石在不同电解质浓度下的吸附聚集情况分为两部分:首先,通过原子力显微镜的接触模式测得蒙脱石颗粒在不同电解质溶液中的Height图和Deflection Error图,通过这两种图可以直观地观察到蒙脱石聚集中的离子特异性效应;然后,基于Height图选取蒙脱石颗粒上的点位测得蒙脱石颗粒表面的黏附力,获得黏附力的离子特异性效应。
2.1 不同阳离子处理蒙脱石的聚集形态及离子特异性效应图 1显示不同浓度NaCl溶液处理的蒙脱石的形貌特征,图中a、b、c 3个系列分别表示10 mmol L-1、30 mmol L-1、50 mmol L-1的NaCl溶液处理的蒙脱石的形貌;1、2、3系列分别为Height图、Deflection Error图和3D图,图片范围为5 μm×5 μm。从图中可以发现随着浓度的增加,蒙脱石的聚集越明显。在观察范围内,低浓度下颗粒数量明显少于高浓度下的颗粒数量,3D图表明颗粒高度同样如此。类似地,Tian等[7]和贾明云等[23]运用光散射技术测得蒙脱石和黄壤胶体颗粒凝聚的水合直径及平均凝聚速率随着离子浓度的升高而增加,也与胶体化学的理论预测一致。尽管本研究利用原子力显微镜观察蒙脱石纳米颗粒的聚集与光散射技术研究颗粒凝聚的条件不尽相同,但是对于同样的材料与电解质类型,其特征参数的变化趋势应该一致。

|
图 1 NaCl溶液处理的蒙脱石颗粒的形貌图(范围为5 μm×5 μm) Fig. 1 Morphology of montmorillonite particles in NaCl solution(Scope of the image is 5 μm × 5 μm) 注:a、b、c分别表示10 mmol L-1、30 mmol L-1、50 mmol L-1的NaCl溶液处理的蒙脱石颗粒的形貌;1、2、3分别为Height图、Deflection Error图和3D图Note:a, b and c depicts the morphology of montmorillonite particles in NaCl solution 10 mmol L-1, 30 mmol L-1 and 50 mmol L-1, respectively, and 1, 2 and 3 stands for Height image, Deflection error image and 3D image |
图 2表明蒙脱石颗粒的聚集表现出强烈的离子特异性效应,横排1、2、3依次为10 mmol L-1、30 mmol L-1、50 mmol L-1 3种不同浓度的电解质溶液处理的蒙脱石的形貌图,竖排a、b、c、d、e依次为LiCl、NaCl、KCl、RbCl和CsCl 5种不同电解质溶液处理的蒙脱石的形貌图。10 mmol L-1和30 mmol L-1的LiCl、NaCl、KCl体系中蒙脱石颗粒的尺寸远远小于CsCl体系(图 2),因此它们主要表现为孤立的颗粒,即使颗粒被AFM观察到,也不能很好地说明颗粒的聚集情况。低浓度体系下,颗粒之间的相互作用表现为排斥力,颗粒很难发生聚集,液滴的表面张力可能会将未发生聚集的单粒带到液滴的边界位置。而在高浓度体系下,颗粒容易发生聚集,在重力作用下,表面张力可能不容易将聚集后的蒙脱石颗粒带到液滴边界位置。类似地,Hodges等[24]在研究胶体悬液干燥后的颗粒形状中发现矿物浓度低,液滴边界位置出现大量的颗粒,而浓度越高边界处颗粒越少。Cadene等[25]在研究Na-montmorillonite颗粒尺寸、形貌中发现蒙脱石颗粒在1 mmol L-1NaCl溶液中主要表现为孤立的颗粒。因此,30 mmol L-1体系中蒙脱石颗粒数多于10 mmol L-1。在10 mmol L-1浓度下5种阳离子中Cs+处理的蒙脱石颗粒出现了明显的吸附聚集情况(图 2e1),其他阳离子处理的蒙脱石颗粒处于分散状态。但Rb+体系(图 2d1)在5 μm×5 μm区域上的颗粒数明显多于Li+、Na+、K+体系下的蒙脱石颗粒。而10 mmol L-1和30 mmol L-1体系中Li+、Na+、K+处理的蒙脱石颗粒在数量上相差不大。然而,在30 mmol L-1浓度下Rb+和Cs+处理的蒙脱石颗粒出现明显的聚集情况(图 2d2和图 2e2),Rb+体系中的蒙脱石颗粒聚集程度小于Cs+体系。在50 mmol L-1的高浓度下,Li+、Na+、K+体系中蒙脱石颗粒数量显著增加。图中表明Na+对蒙脱石颗粒的聚集影响略强于Li+,但均可看成单粒。K+、Rb+、Cs+体系中部分蒙脱石颗粒出现叠加状态,而叠加程度K+ < Rb+ < Cs+。以上分析表明离子对蒙脱石颗粒的聚集影响表现为强烈的Hofmeister效应。

|
图 2 不同电解质溶液处理的蒙脱石的Height图(范围为5 μm×5 μm) Fig. 2 Height image of montmorillonite in different electrolyte solutions(Scope of the image is 5 μm× 5 μm) |
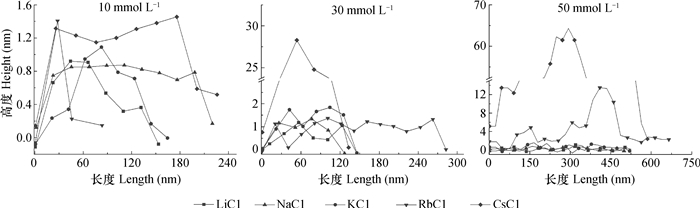
形貌图只能定性反映蒙脱石颗粒在不同电解质溶液中聚集的Hofmeister效应,因此需要运用离线软件进行定量分析,基于形貌图(图 2)利用选择(Section)选取一个颗粒而得到其截面图(图 3)。10 mmol L-1体系中蒙脱石颗粒高度均在1 nm左右,说明图 2中Li+、Na+、K+、Rb+体系蒙脱石单粒高约1 nm,未发生横向聚集,而Cs+体系中颗粒发生了横向聚集。30 mmol L-1体系中Li+、Na+、K+、Rb+体系下的蒙脱石颗粒高度在1~1.5 nm范围内,而Cs+体系下蒙脱石颗粒高度达到27 nm。结合图 2,Li+、Na+、K+体系中个别蒙脱石颗粒出现聚集体,而Rb+体系中出现了横向聚集的情况,Cs+体系中同时发生了横向和纵向聚集。50 mmol L-1体系中,Li+体系中蒙脱石颗粒的高度在0.7 nm左右,Na+体系中蒙脱石颗粒高度分布在0.8 nm左右。K+体系中蒙脱石颗粒高度也超过了2 nm,进一步说明K+体系出现微弱的叠加状态。Rb+体系中蒙脱石颗粒高度在2~14 nm之间,从而说明蒙脱石发生了强烈的聚集,纵向叠加最大可达10层左右。Cs+体系中,蒙脱石颗粒的聚集情况更加明显,颗粒高度达到了60 nm以上。
表 1显示在一定高度范围内蒙脱石颗粒数量比。10 mmol L-1体系中,Li+、Na+、K+处理的蒙脱石颗粒高度约90%分布在0.6~1.1 nm之间,Rb+体系下颗粒主要分布在1.1~2.0 nm之间,而Cs+体系中蒙脱石颗粒高度全部分布在2.0~3.0 nm之间。30 mmol L-1体系中Li+、Na+、K+处理的蒙脱石颗粒高度主要分布在1.0~2.2 nm之间,Rb+主要分布在1.0~6.0 nm之间,而Cs+体系中蒙脱石颗粒高度主要分布在6.0~50.0 nm之间。在低浓度中Li+、Na+、K+体系中未出现明显的聚集情况,然而同种体系中的蒙脱石颗粒的高度分布出现差异。类似地,研究者在测量许多不同系统的颗粒聚集高度时同样观察到差异,如生物分子[26-28]或黄金纳米团簇[29]。Balnois等[30]获得了蒙脱石邻近系统laponite的高度为1.2 nm,而中子散射测出为1 nm。在低浓度体系下蒙脱石颗粒高度满足:Li+≈Na+≈K+ < Rb+ < Cs+。从表中得到50 mmol L-1体系中,Li+和Na+体系中的蒙脱石颗粒高度分布在0.2~2.0 nm,K+作用的蒙脱石颗粒高度主要分布在0.6~3.0 nm,而Rb+作用的蒙脱石颗粒高度主要分布在3.0~5.0 nm,少数聚集体高度在10 nm左右,Cs+作用的蒙脱石颗粒高度显得更高,并且蒙脱石颗粒高度满足:Li+ < Na+ < K+ < Rb+ < Cs+。图 4显示的是颗粒横向聚集直径与纵向聚集高度的关系,其中10 mmol L-1、30 mmol L-1体系中Li+、Na+、K+处理的蒙脱石颗粒主要表现为单粒,蒙脱石颗粒尺寸相差不大,但10 mmol L-1体系中Cs+作用的蒙脱石颗粒直径达到300 nm左右,从而出现了图 2中蒙脱石颗粒发生横向聚集形貌,30 mmol L-1和50 mmol L-1体系中直径达到600 nm左右,高度达到30~50 nm,说明Cs+作用下蒙脱石颗粒出现横纵向聚集。30 mmol L-1体系中Rb+作用的蒙脱石颗粒最大,直径达到400 nm,高度最大达到4 nm左右,说明颗粒出现横向聚集,少部分出现横纵向聚集,而50 mmol L-1体系中直径达到600 nm,高度达到15 nm,说明颗粒出现横纵向聚集。类似地,Citeau等[31]在利用原子力显微镜测定自然土壤颗粒的直径为80~200 nm,少部分达到400 nm,高度为1~2 nm。Cadene等[25]在研究Na+蒙脱石颗粒尺寸、形貌中发现自然黏土颗粒高度主要分布在1.2 nm左右,直径主要在180 nm左右;合成黏土矿物颗粒高度主要为0.8~2.6 nm,直径主要为50~200 nm。说明颗粒聚集以横向为主,纵向上聚集程度较横向上小,各离子体系下蒙脱石的聚集能力强弱序列满足:Li+ < Na+ < K+ < Rb+ < Cs+。Tian等[7]利用光散射技术测定蒙脱石的凝聚中发现同样的离子特异性。
|
|
表 1 不同电解质溶液处理的蒙脱石颗粒高度特征 Table 1 Height characteristics of montmorillonite particles in the solution relative to type of electrolyte |

|
图 4 不同电解质溶液处理的蒙脱石颗粒直径-高度分布图 Fig. 4 Diameter-height distribution map of the particle in the solution relative to type of electrolyte |
通过以上统计分析进一步说明电解质浓度及类型对蒙脱石的聚集行为影响的不同。根据Hashemi和Jungwirth等[32-33]的研究,低浓度条件下的离子特异性效应运用离子色散力、体积效应、水化作用以及诱导力均不能很好地解释。Citeau等[31]研究结果表明带永久电荷的矿物颗粒的聚集由矿物表面电荷主导。根据Gauss定理,可得溶液中蒙脱石颗粒表面电场强度可达约2.2×108 V m-1。强电场作用下碱金属离子电子云构型发生改变而增大离子的偶极矩。碱金属离子电子层数越多,半径越大,中心原子对电子云的束缚越小,越容易出现离子电子云的偏转或改变,进一步增强离子极化作用,而离子极化作用越强反过来降低表面电位,从而导致不同离子处理的蒙脱石颗粒的聚集出现离子特异性效应[34]。蒙脱石颗粒聚集过程中,电解质溶液自然风干导致聚集过程中离子并不是处于低浓度条件,而是高浓度条件下。但是由于风干前颗粒悬液电解质浓度不同,会导致滴在云母片上的风干样品中颗粒密度存在差异,进而导致颗粒风干后观察到的聚集体特征存在差异。但是本研究更主要讨论的是同浓度下不同电解质类型对颗粒聚集的影响。许多研究表明[35-36],溶液浓度大于0.1 mol L-1时,颗粒间的相互作用力必须考虑离子量子涨落。风干过程中电解质浓度升高,颗粒双电层被强烈压缩,导致颗粒表面附近电场被强烈屏蔽,量子涨落与体积作用增大,因此本实验观察的离子特异性效应可能来源于离子量子涨落和离子体积效应等因素的综合结果。比如,Cs+和Na+处理的蒙脱石颗粒的聚集的差异,主要由于Cs+的离子半径大于Na+,意味着Cs+的电子云更软,量子涨落更强。Cs+更强的量子涨落导致更多Cs+可以被吸附在蒙脱石颗粒表面,增加单位体积分子数量,使得哈梅克常数增大[5]。因此,Cs+处理的蒙脱石颗粒之间的范德华引力较Na+更强,从而Cs+蒙脱石颗粒聚集能力更强。
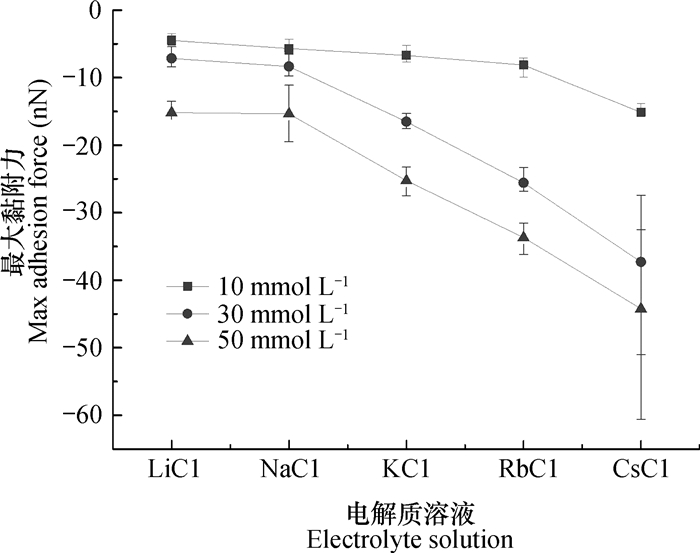
2.3 蒙脱石纳米颗粒聚集体的黏附力及离子特异性效应二氧化硅纳米胶体颗粒之间相互作用试验中,Morag等[12]推测可能是离子水合作用导致胶体颗粒相互作用出现离子特异性效应。但是,Liu等[34]利用著名胶体化学家Bolt[37]在0.000 1 mol L-1~0.6 mol L-1电解质范围内测定伊利石上的Ca2+/Na+交换平衡的试验严格证明了离子特异性效应不是来自离子水合。Colombo等[3]认为腐殖质的自然聚集结构的稳定性是靠分子间的极化力和范德华力的作用。根据经典DLVO(Derjaguin-Landau-Verwey-Overbeek)理论[38-39],胶体的稳定性主要取决于范德华力和静电力,但是不能解释颗粒聚集中的离子特异性效应。胶体颗粒的吸附聚集行为受到范德华力、静电力、水合斥力、色散力以及分子间极化力等影响,这是一个相当复杂的系统,而原子力显微镜测得的力可以提供关于颗粒表面有价值的信息[40-41]。本实验通过运用原子力显微镜测得的颗粒表面与探针之间的黏附力来解释形貌图出现的现象。图 5为每种电解质体系下蒙脱石颗粒表面对探针的最大黏附力的平均值。低浓度条件下, 离子体系间黏附力差异小,而高浓度体系下差异大。最大黏附力大小满足Li+ < Na+ < K+ < Rb+ < Cs+,其中Li+约小于Na+。电解质浓度为10 mmol L-1时,LiCl、NaCl和KCl、RbCl溶液处理的蒙脱石颗粒表面的最大黏附力约为5~7 nN,随着电解质浓度升高,不同电解质处理的蒙脱石颗粒表面对探针的黏附力增大,并且黏附力差异增大,而RbCl和CsCl处理的蒙脱石颗粒表面对探针的最大黏附力差异更大。本研究体系中不同浓度电解质处理的蒙脱石颗粒表面黏附力差异大,可能由于自然干燥后,离子高低浓度之间的差值放大,高浓度中蒙脱石颗粒表面吸附更多离子,离子色散力更强。同样的,不同离子处理的蒙脱石颗粒黏附力出现差异可能由于Cs+的离子半径大且电子层数多,离子的量子涨落效应远远大于其他离子。强的量子涨落力导致颗粒与颗粒之间黏附力变大,导致颗粒之间可以紧密的聚集,此结果为蒙脱石颗粒的聚集行为满足离子特异性效应提供了直接证据。
|
图 5 不同电解质溶液处理的蒙脱石颗粒的最大黏附力 Fig. 5 Maximum adhesive force of montmorillonite particles in the solution relative to type of electrolyte |
本文运用原子力显微镜观察不同浓度、不同阳离子处理的蒙脱石的聚集情况,蒙脱石颗粒聚集中存在强烈的离子特异性效应。在低浓度体系中颗粒主要发生横向聚集,随着浓度升高再进行纵向聚集。蒙脱石颗粒聚集情况的形貌特征和统计分析表明:蒙脱石颗粒的聚集的离子特异性效应可通过针尖与颗粒的黏附力来表征,其序列为Li+ < Na+ < K+ < Rb+ < Cs+。离子特异性效应主要来源于离子体积和离子量子涨落。在样品风干过程中,量子涨落及体积效应增强,AFM观测的颗粒聚集形貌及黏附力的离子特异性效应增大,本研究为蒙脱石颗粒的聚集行为满足离子特异性效应提供了直接证据。
| [1] |
Österberg R, Mortensen K. Fractal dimension of humic acids . European Biophysics Journal, 1992, 21(3): 163-167.
(  0) 0) |
| [2] |
Plette A C C, van Riemsdijk W H, Benedetti M F, et al. pH dependent charging behavior of isolated cell walls of a gram-positive soil bacterium . Journal of Colloid and Interface Science, 1995, 173(2): 354-363. DOI:10.1006/jcis.1995.1335
(  0) 0) |
| [3] |
Colombo C, Palumbo G, Angelico R, et al. Spontaneous aggregation of humic acid observed with AFM at different pH . Chemosphere, 2015, 138: 821-828. DOI:10.1016/j.chemosphere.2015.08.010
(  0) 0) |
| [4] |
Hou J, Li H, Zhu H, et al. Determination of clay surface potential:A more reliable approach . Soil Science Society of America Journal, 2009, 73(5): 1658-1663. DOI:10.2136/sssaj2008.0017
(  0) 0) |
| [5] |
Li H, Peng X, Wu L, et al. Surface potential dependence of the Hamaker constant . The Journal of Physical Chemistry C, 2009, 113(11): 4419-4425. DOI:10.1021/jp808372r
(  0) 0) |
| [6] |
Leng Y. Hydration force between mica surfaces in aqueous KCl electrolyte solution . Langmuir, 2012, 28(12): 5339-5349.
(  0) 0) |
| [7] |
Tian R, Yang G, Li H, et al. Activation energies of colloidal particle aggregation:Towards a quantitative characterization of specific ion effects . Physical Chemistry Chemical Physics, 2014, 16(19): 8828-8836.
(  0) 0) |
| [8] |
Oncsik T, Trefalt G, Borkovec M, et al. Specific ion effects on particle aggregation induced by monovalent salts within the Hofmeister series . Langmuir, 2015, 31(13): 3799-3807.
(  0) 0) |
| [9] |
Tian R, Yang G, Zhu C, et al. Specific anion effects for aggregation of colloidal minerals:A joint experimental and theoretical study . The Journal of Physical Chemistry 0C, 2015, 119(9): 4856-4864.
(  0) 0) |
| [10] |
Li S, Li H, Xu C Y, et al. Particle interaction forces induce soil particle transport during rainfall . Soil Science Society of America Journal, 2013, 77(5): 1563-1571.
(  0) 0) |
| [11] |
Hu F, Xu C, Li H, et al. Particles interaction forces and their effects on soil aggregates breakdown . Soil and Tillage Research, 2015, 147: 1-9.
(  0) 0) |
| [12] |
Morag J, Dishon M, Sivan U. The governing role of surface hydration in ion specific adsorption to silica:An AFM-based account of the Hofmeister universality and its reversal . Langmuir, 2013, 29(21): 6317-6322. DOI:10.1021/la400507n
(  0) 0) |
| [13] |
Kumar N, Zhao C, Klaassen A, et al. Characterization of the surface charge distribution on kaolinite particles using high resolution atomic force microscopy . Geochimica et Cosmochimica Acta, 2016, 175: 100-112.
(  0) 0) |
| [14] |
Siretanu I, Ebeling D, Andersson M P, et al. Direct observation of ionic structure at solid-liquid interfaces:A deep look into the Stern Layer . Scientific Reports, 2014, 4: srep04956.
(  0) 0) |
| [15] |
Kunz W, Henle J, Ninham B W. 'Zur Lehre von der Wirkung der Salze'(about the science of the effect of salts):Franz Hofmeister's historical papers . Current Opinion in Colloid & Interface Science, 2004, 9(1): 19-37.
(  0) 0) |
| [16] |
Tobias D J, Hemminger J C. Getting specific about specific ion effects . Science, 2008, 319(5867): 1197-1198. DOI:10.1126/science.1152799
(  0) 0) |
| [17] |
Boström M, Williams D R M, Ninham B W. Surface tension of electrolytes:specific ion effects explained by dispersion forces . Langmuir, 2001, 17(15): 4475-4478.
(  0) 0) |
| [18] |
Gurau M C, Lim S M, Castellana E T, et al. On the mechanism of the Hofmeister effect . Journal of the American Chemical Society, 2004, 126(34): 10522-10523.
(  0) 0) |
| [19] |
Parsons D F, Boström M, Nostro P L, et al. Hofmeister effects:Interplay of hydration, nonelectrostatic potentials, and ion size . Physical Chemistry Chemical Physics, 2011, 13(27): 12352-12367. DOI:10.1039/c1cp20538b
(  0) 0) |
| [20] |
Levin Y, Dos Santos A P, Diehl A. Ions at the air-water interface:An end to a hundred-year-old mystery? . Physical Review Letters, 2009, 103(25): 257802.
(  0) 0) |
| [21] |
Dos Santos A P, Levin Y. Ion specificity and the theory of stability of colloidal suspensions . Physical Review Letters, 2011, 106(16): 167801. DOI:10.1103/PhysRevLett.106.167801
(  0) 0) |
| [22] |
Colombo C, Palumbo G, Ceglie A, et al. Characterization of synthetic hematite (α-Fe2 O3) nanoparticles using a multi-technique approach . Journal of Colloid and Interface Science, 2012, 374(1): 118-126.
(  0) 0) |
| [23] |
贾明云, 朱华铃, 李航. 光散射技术在土壤胶体颗粒相互作用研究中的应用. 土壤学报, 2010, 47(2): 253-261. Jia M Y, Zhu H L, Li H. Application of light scattering technology in the study on interactions between soil colloid particle in suspension (In Chinese). Acta Pedologica Sinica, 2010, 47(2): 253-261. DOI:10.11766/trxb200901140024 (  0) 0) |
| [24] |
Hodges C S, Ding Y, Biggs S. The influence of nanoparticle shape on the drying of colloidal suspensions . Journal of Colloid and Interface Science, 2010, 352(1): 99-106.
(  0) 0) |
| [25] |
Cadene A, Durand-Vidal S, Turq P, et al. Study of individual Na-montmorillonite particles size, morphology, and apparent charge . Journal of Colloid and Interface Science, 2005, 285(2): 719-730. DOI:10.1016/j.jcis.2004.12.016
(  0) 0) |
| [26] |
Balnois E. Caractérisation de biopolymères des systèmes aquatiques par microscopie à force atomique . Switzerland: University of Geneva, 2001.
(  0) 0) |
| [27] |
Balnois E, Wilkinson K J. Sample preparation techniques for the observation of environmental biopolymers by atomic force microscopy . Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2002, 207(1): 229-242.
(  0) 0) |
| [28] |
Rippe K, Mücke N, Langowski J. Superhelix dimensions of a 1868 base pair plasmid determined by scanning force microscopy in air and in aqueous solution . Nucleic Acids Research, 1997, 25(9): 1736-1744. DOI:10.1093/nar/25.9.1736
(  0) 0) |
| [29] |
Vesenka J, Guthold M, Tang C L, et al. Substrate preparation for reliable imaging of DNA molecules with the scanning force microscope . Ultramicroscopy, 1992, 42: 1243-1249.
(  0) 0) |
| [30] |
Balnois E, Durand-Vidal S, Levitz P. Probing the morphology of laponite clay colloids by atomic force microscopy . Langmuir, 2003, 19(17): 6633-6637. DOI:10.1021/la0340908
(  0) 0) |
| [31] |
Citeau L, Gaboriaud F, Elsass F, et al. Investigation of physico-chemical features of soil colloidal suspensions . Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2006, 287(1): 94-105.
(  0) 0) |
| [32] |
Hashemi M, Chasteen T G. Hofmeister effect challenge . Analytical and Bioanalytical Chemistry, 2011, 400(3): 643-644. DOI:10.1007/s00216-011-4722-z
(  0) 0) |
| [33] |
Jungwirth P, Cremer P S. Beyond hofmeister . Nature Chemistry, 2014, 6(4): 261-263. DOI:10.1038/nchem.1899
(  0) 0) |
| [34] |
Liu X, Li H, Li R, et al. Strong non-classical induction forces in ion-surface interactions:General origin of Hofmeister effects . Scientific Reports, 2014, 4: 5047.
(  0) 0) |
| [35] |
Boström M, Williams D R M, Ninham B W. Specific ion effects:Why DLVO theory fails for biology and colloid systems . Physical Review Letters, 2001, 87(16): 168103. DOI:10.1103/PhysRevLett.87.168103
(  0) 0) |
| [36] |
Edwards S A, Williams D R M. Hofmeister effects in colloid science and biology explained by dispersion forces:analytic results for the double layer interaction . Current Opinion in Colloid & Interface Science, 2004, 9(1): 139-144.
(  0) 0) |
| [37] |
Bolt G H. Ion adsorption by clays . Soil Science, 1955, 79(4): 267-276. DOI:10.1097/00010694-195504000-00004
(  0) 0) |
| [38] |
Derjaguin B V, Landau L. Theory of the stability of strongly charged lyophobic sols and of the adhesion of strongly charged particles in solutions of electrolytes . Acta physicochim. URSS, 1941, 14(6): 633-662.
(  0) 0) |
| [39] |
Verwey E J W, Overbeek J T G. Theory of the stability of lyophobic colloids . Journal of Colloid Science, 1955, 10(2): 224-225. DOI:10.1016/0095-8522(55)90030-1
(  0) 0) |
| [40] |
Hassenkam T, Skovbjerg L L, Stipp S L S. Probing the intrinsically oil-wet surfaces of pores in North Sea chalk at subpore resolution . Proceedings of the National Academy of Sciences, 2009, 106(15): 6071-6076. DOI:10.1073/pnas.0901051106
(  0) 0) |
| [41] |
Skovbjerg L L, Hassenkam T, Makovicky E, et al. Nano sized clay detected on chalk particle surfaces . Geochimica et Cosmochimica Acta, 2012, 99: 57-70. DOI:10.1016/j.gca.2012.05.037
(  0) 0) |
 2018, Vol. 55
2018, Vol. 55