2. 扬州大学江苏省作物遗传生理重点实验室,江苏扬州 225009
酸枣(Ziziphus jujuba var. spinosa)为鼠李科(Rhamnaceae)枣属(Zizyphus Mill.)灌木或小乔木,生态适应性强,从湿润的东部海滨到干旱的西部荒漠均有分布[1]。酸枣根系分布深而广,垂直分布可达3 m,水平分布可达6 m,且末端细跟分支较多[2]。垂直方向上,枣根系主要分布于80 cm以内的土层中,2 mm以下的细根主要分布于0~40 cm的土层中,随干旱程度的增加,深土层中细跟分布的比例逐渐增大[3]。此分布范围内,酸枣根系的生物量、长度、表面积、细根长度分别占各自总量的90%以上[4]。水平方向上,酸枣根系主要分布于60 cm范围内,60~240 cm范围内根表面积和细根数量变化不大,二级侧根和细根分布比较均匀,接近侧根末端,长度、根表面积和细根长度数值明显增大,二级侧根数量增加[5]。此外,酸枣根系基端形成特异的纺锤形膨大结构,与其耐旱性密切相关[6]。酸枣根系生态分布的可塑性较大,这也是其耐旱性强、分布广的原因之一[2]。关于酸枣根系的研究主要集中于根系的形态结构与分布特征方面,而关于不同自然梯度干旱生境中酸枣根系导管结构可塑性方面的研究鲜见报道。
干旱是影响植物生长和分布的主要限制因子,根系是植物吸收水分和养分的主要器官,逆境条件下,植物根系的形态结构和机能必定发生改变以适应逆境而确保生存[7]。导管是植物水分生理最主要的结构基础[8],直接参与植物体内水分和无机盐的运输,对植物的生长至关重要。不同地区的气候条件、水分状况均可影响木质部导管的特征,使其产生协同进化而适应环境。Carlquist[9]提出木质部进化的生态学途径,认为现存植物的木质部结构上的差异是功能适应生长环境进化的结果,与湿度、蒸腾作用以及机械强度有关。对木材生态解剖与其功能性适应的研究表明,次生木质部中导管分子长度、导管频率等解剖性状的可塑性较大,而导管直径的可塑性较小[10]。然而,关于大尺度的自然环境形成的梯度干旱生境中植物导管的形态结构可塑性方面的研究较少。为此,本研究以烟台、石家庄、银川和吐鲁番不同地域气候、土壤环境形成的梯度干旱生境中生长的野生酸枣为试验材料,利用导管离析法和植物显微技术,研究酸枣根次生木质部导管对自然梯度干旱生境适应的可塑性特征,探讨酸枣导管结构与功能对不同气候环境的响应策略及机理,为酸枣资源的开发利用、植物抗旱机理的研究、生态建设及恢复提供基础资料。
1 材料与方法 1.1 研究区概况试验材料分别采自山东烟台(莱山区大庄村)、河北石家庄(赞皇县北沟村)、宁夏银川(贺兰山附近)、新疆吐鲁番(红星农场三队)4个天然居群。每个居群随机取10株树龄5年(依据芽鳞痕判断)、生长正常,未发现病虫害的酸枣植株,植株间的距离不小于5 m,以保证取样的均匀性,最大限度降低母树间的亲缘关系。采样地由东至西(烟台-石家庄-银川-吐鲁番),构成一个自然的梯度干旱环境。各采样地自然条件及土壤类型见表 1。
|
|
表 1 采样地区地理环境及气候特征 Table 1 Geographical environment and climatic characteristics of sampled areas |
按自然气候干旱梯度,分别选取上述4个生境5年生酸枣植株主根的次生木质部为材料(植株基部向下20 cm处,3~5 cm长的切段),随机选取10株取样后立即装入FAA固定液(70%乙醇90 ml,福尔马林5 ml,冰醋酸5 ml)中保存。
1.3 Jeffrey导管离析法各样地材料经FAA固定24h后,随机选取5个样品,将其切成0.5 cm×0.2 cm大小的木条,转入Jeffrey离析液(10%铬酸︰10%硝酸=1︰1)中,置于40℃的恒温箱离析3~5d。将离析好的材料置于载玻片上,番红染色5 min,在文献[11]的方法上略有改进,制成临时装片,Nikon E200光学显微镜下观察并拍照。随机取20张切片拍照,导管形态结构参数(包括导管长度、宽度、壁厚、尾长等指标)采用Motic Images Plus 2.0图像分析软件测定,每个样地每个参数测量统计50个数据。
1.4 数据处理利用Statistix 9.0和SigmaPlot 10.0软件统计分析数据、作图,对照组、处理组间的差异显著性分析采用t检验,不同处理水平之间采用单因素方差分析、多重比较采用LSD(最小显著差数法)法,各个指标之间进行相关性分析,检验差异显著性。
2 结果 2.1 四个样地酸枣根系中次生木质部导管类型及所占比例酸枣根系中导管的类型分为6种:孔纹导管、螺纹导管、网纹导管、环纹导管、梯纹导管及木纤维。导管类型及所占比例如表 2所示,烟台酸枣根系导管中,木纤维数量最多,占44.2%;其次为孔纹导管和网纹导管,分别占27.9%和16.2%;螺纹导管和环纹导管均为4.7%,梯纹导管最少为2.3%。石家庄酸枣根系中以孔纹导管数量最多达34.4%,木纤维次之为29.5%,网纹导管占14.8%,环纹导管和梯纹导管数量相当,各占7.1%和7.9%,螺纹导管数量最少为6.3%。银川样地植株根系导管以木纤维最多占48.7%,其次为孔纹导管为24.4%,梯纹导管、网纹导管、螺纹导管数量相差不大,各占8.3%、8.0%和7.7%,环纹导管数量最少仅占3.0%。而吐鲁番酸枣根系中木纤维数量最多为35.0%,网纹导管占27.5%,孔纹导管和梯纹导管数量相当各为12.4%和12.5%,环纹导管占10.1%,螺纹导管数量最少为2.5%(表 2)。
|
|
表 2 不同地区酸枣根系导管类型 Table 2 Types of vesselsin theroot of Ziziphus jujuba var. spinosa relative to regions |
按照管尾的有无又可将导管分为3种类型:无尾型、一端有尾型和两端有尾型。在4个生境的酸枣根系中,孔纹导管、环纹导管、木纤维的类型相同,孔纹导管均包括无尾型、一端有尾型、两端有尾型3种;环纹导管均为一端有尾型和两端有尾型;木纤维均为两端有尾型(表 2,图 1)。烟台、石家庄、吐鲁番样地酸枣根系的螺纹导管均为无尾型,而银川样地的螺纹导管3种类型兼具。银川样地的网纹导管为无尾型和一端有尾型2种,而其他样地的网纹导管均包含3种类型。梯纹导管在烟台样地为两端有尾型,石家庄样地为一端有尾型和两端有尾型,银川样地为无尾型和一端有尾型,而吐鲁番样地包括无尾型、一端有尾型和两端有尾型3种类型(表 2,图 1)。
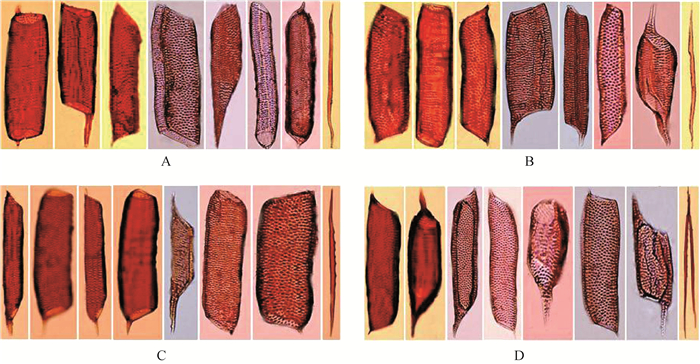
|
图 1 不同样地酸枣根系导管 Fig. 1 Root vessels of Ziziphus jujuba var. spinosa relative to ecotope A:烟台Yantai; B:石家庄Shijiazhuang; C:银川Yinchuan; D:吐鲁番Turpan |
在四个梯度干旱生境中,吐鲁番样地酸枣根系的网纹导管长度最大达674.5 µm,较烟台样地的增加16.8%,而石家庄样地网纹导管的长度最小为497.4 µm,较烟台样地减小13.9%。此外,银川样地的网纹导管长度较烟台样地的减小13.3%(p < 0.05)(图 2A)。各样地中网纹导管的宽度与长度的变化趋势相似,与烟台样地的相比,吐鲁番样地的网纹导管宽度增加5.0%(p < 0.05),而石家庄和银川样地的分别减小26.1%和26.9%(p < 0.05)(图 2A)。与烟台相比,其余样地酸枣根系的网纹导管直径均减小,石家庄、银川、吐鲁番样地的分别减小35.1%、33.1%和11.4%(p < 0.05)(图 2B);而管壁厚度石家庄样地的减小14.8%,银川和吐鲁番样地的分别增大21.6%和82.1%(图 2B)。网纹导管管尾长度逐渐减小,烟台样地的网纹导管管尾最长分别为68.6 µm和156.0 µm,石家庄样地的管尾最小,与烟台样地的相比,石家庄样地导管管尾分别减小42.0%和78.8%(p < 0.05);银川网纹导管为一端有尾型,尾长减小37.1%,吐鲁番样地的分别减小6.8%和58.6%(p < 0.05)(图 2C)。网纹导管管壁加厚,管尾变短。
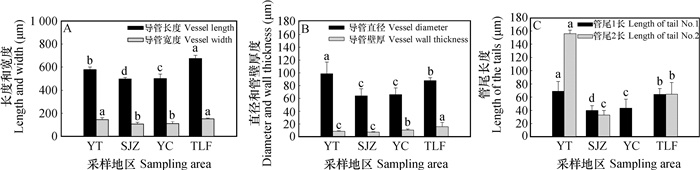
|
图 2 不同地区酸枣根系网纹导管变化特征 Fig. 2 Changes in structure of the reticulate vessel in the root of Ziziphus jujuba var. Spinosa relative to sampling area |
孔纹导管长度以烟台样地植株的最大,为575.1 µm,与烟台相比,石家庄、银川、吐鲁番样地的分别减小17.6%、11.2%和7.7%(p < 0.05)。孔纹导管宽度烟台和石家庄样地的相近,分别为171.4和175.5 µm,而银川和吐鲁番的宽度较小,较烟台样地的分别减小37.3%和2.7%(图 3A)。孔纹导管直径以石家庄样地的最大,为110.6 µm,高于烟台5.6%,银川样地的直径最小,与烟台样地的相比减小37.6%,而吐鲁番样地的则减小10.2%(图 3B)。孔纹导管管壁厚度以石家庄样地的最小,与烟台相比,石家庄样地的管壁厚度减小9.1%,而银川和吐鲁番样地的分别增加3.5%和31.1%(图 3B)。随梯度干旱加剧,各样地根系孔纹导管管尾逐渐加长,烟台的管尾最短,尾1、尾2分别为42.6和33.8 µm。与烟台样地相比,石家庄、银川和吐鲁番样地的孔纹导管管尾1分别增长了5.1%、54.4%和106.5%(p < 0.05),管尾2分别增加了112.0%、113.0%和202.0%(p < 0.05)(图 3C)。总体而言,孔纹导管长度、宽度、直径减小,壁厚增加,管尾变长。
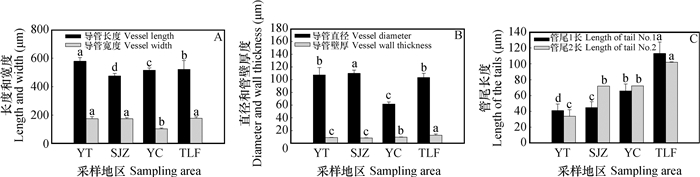
|
图 3 不同地区酸枣根系孔纹导管变化特征 Fig. 3 Changes in structure of the pitted vessel in the root of Ziziphus jujuba var. spinosa relative to sampling area |
根系螺纹导管的长度随干旱加剧总体下降,石家庄样地的导管长度最小,为492.7 µm,与烟台相比,石家庄样地的螺纹导管长度减小9.3%,银川和吐鲁番样地的减小2.9%和6.5%(图 4A)。螺纹导管的宽度先降后增,从烟台、石家庄至银川样地,螺纹导管的宽度依次降低,与烟台样地相比,石家庄和银川样地导管的宽度分别降低6.9%和37.7%,而吐鲁番样地的螺纹导管宽度则增大87.0%(p < 0.05)(图 4A)。螺纹导管直径与宽度的变化趋势相似,烟台样地的螺纹导管直径为66.0 µm,石家庄和银川样地的导管直径较烟台样地的分别减小38.9%和45.9%,而吐鲁番样地的则增加72.4%(p < 0.05)(图 4B)。螺纹导管的管壁厚度依次变小,烟台样地的管壁最厚为10.7 µm,与烟台样地的相比,石家庄、银川和吐鲁番样地的管壁分别减小20.2%、11.4%和14.6%(p < 0.05)(图 4B)。螺纹导管管尾长度的变化中,石家庄和吐鲁番样地的螺纹导管为无尾型,烟台和银川样地的为两端有尾型;与烟台样地的相比,银川样地的螺纹导管尾1和尾2长度变小,分别减小22.2%和10.2%(p < 0.05)(图 4C)。螺纹导管长度变小,管壁变薄,管尾变短。
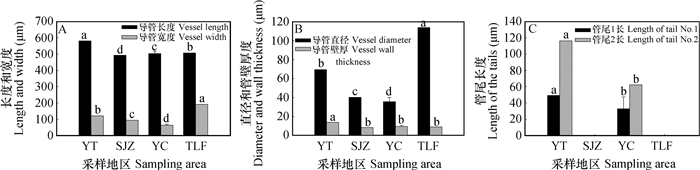
|
图 4 不同地区酸枣根系螺纹导管变化特征 Fig. 4 Changes in structure of the spiral vessel in theroot of Ziziphus jujuba var. spinosa relative to sampling area |
随梯度干旱增加,梯纹导管的长度、宽度变小。烟台样地的梯纹导管长度、宽度最大,分别为726.7 µm和237.2 µm,与烟台样地的相比,石家庄、银川和吐鲁番样地的梯纹导管长度分别减小29.1%、37.6%和31.4%(p < 0.05),宽度分别减小20.7%、48.5%和28.6%(p < 0.05)(图 5A)。梯纹导管直径总体呈减小的趋势,烟台样地的管径最大为142 µm,而银川的最小为60.7 µm,较烟台减小57.3%,石家庄和吐鲁番样地的管径相当,与烟台相比分别降低21.1%和21.0%。烟台样地的梯纹导管管壁厚度为11.7 µm,与烟台样地相比,银川样地的管壁增加56.7%,而石家庄和吐鲁番样地的分别减小16.1%和5.3%(图 5B)。烟台样地的梯纹导管为无尾型,石家庄和银川样地的为一端有尾型,而吐鲁番样地的为两端有尾型,导管管尾长度逐渐增大(图 5C)。在梯度干旱生境中酸枣根系梯纹导管长度、宽度和直径均降低,从无尾型向有尾型转变。

|
图 5 不同地区酸枣根系梯纹导管变化特征 Fig. 5 Changes in structure of the scalariform vessel in the root of Ziziphus jujuba var. spinosa relative to sampling area |
木纤维长度的变化如图 6所示,从烟台至吐鲁番,随干旱加剧,木纤维长度和宽度逐渐变小,烟台样地的木纤维长度和宽度最大,分别为775.2 µm和24.4 µm,与烟台样地相比,石家庄、银川和吐鲁番样地的木纤维长度分别减小0.7%、1.5%和2.6%,而宽度分别减小2.2%、4.7%和5.4%(图 6A,图 6B)。木纤维的直径以银川样地的最大,与烟台样地相比增加14.8%,而石家庄和吐鲁番样地的管径变小,分别减小8.2%和17.9%(p < 0.05)。木纤维的管壁厚度总体呈变小的趋势,烟台样地木纤维的管壁最厚为6.7 µm,石家庄、银川和吐鲁番样地的管壁厚度分别减小33.2%、29.3%和22.1%(p < 0.05)(图 6C)。烟台样地的木纤维管尾1和尾2长度分别为83.1和53.4 µm,银川样地的尾1长度较烟台增加12.5%,而石家庄和吐鲁番样地的则分别降低23.1%和20.7%(p < 0.05);管尾2长度整体呈增加的趋势,与烟台样地的相比,石家庄、银川和吐鲁番样地的木纤维管尾2分别增加27.8%、27.3%和13.7%(p < 0.05)(图 6D)。由此可见,随梯度干旱加剧,木纤维长度、宽度变小,管壁变薄,管尾加长。
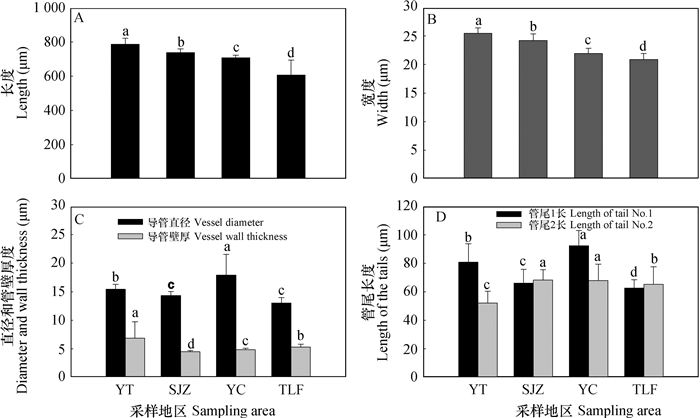
|
图 6 不同地区酸枣根系木纤维变化特征 Fig. 6 Changes in structure of the xylon vessel in the root of Ziziphus jujuba var.spinosa relative to sampling area |
从湿润的烟台、石家庄到干旱的西部内陆银川、吐鲁番,年降水量、湿润系数等构成一个连续的、大尺度的自然梯度干旱环境,酸枣为该区域的广生态幅物种,是研究植物抗旱性的理想实验材料。生长在不同气候、水分条件下的酸枣植株,其根次生木质部导管类型、导管比例、结构特点也必然受到这些因子的影响和制约,形成不同的生态适应特征,酸枣根系导管形态结构可塑性的巨大变化,是在长期进化过程中与环境协同进化的结果。
植物生长发育以及进化是对不同生境条件适应的结果,根系的次生木质部作为植物体的一部分,可以随土质、水分、养分、温度等外在因素的影响而改变其组织水平的表型,使其结构特征发生相应的变化,从而适应环境得以生存,并在进化和演替过程中处于有利地位[11]。根系是植物吸收水分和养分的主要器官,逆境中植物水分的再分配与植物的抗旱性密切相关[12],而导管是植物水分再分配的通道,与植物的生长发育密切相关。在多种植物中,环纹导管和螺纹导管出现在个体发育的早期,以适应器官的早期生长。但这两种导管的直径小,输水效率低[13]。梯纹和网纹导管直径大,输水效率高,是被子植物主要的输水组织[14]。有研究表明导管长度越短越进化,口径越大越进化[15],导管宽度越小,输导水分的阻力越大[16],水分长距离运输的阻力与导管长度倒数呈极显著的线性关系[17]。本研究发现从烟台到吐鲁番,随干旱程度加剧,根系次生木质部螺纹导管分子向着长度变小、管壁变薄和窄口径的方向进化,这种进化一方面保证了导管分子的抗负压、机械支持和高效输水的功能,另一方面是对干旱生境中植株各器官整体变小的结构适应,是逆境中植物结构与功能的协同进化,也是植物的生存策略之一。
网纹导管和梯纹导管属于进化的类型,从烟台至吐鲁番,根系次生木质部中网纹导管的长度、宽度先减后增,导管长度和宽度的增加,降低了水分运输的阻力,提高输水效率;管壁的加厚增强了抗压性能。而梯纹导管的长度、宽度和直径均降低,导管分子向着短、窄、小的形态结构演化,进一步提高了机械性能和抗磨损能力。宽导管的输导效率高,但较脆弱、易栓塞;窄导管的输导效率虽低,但抗负压强、不易倒塌,且单位面积上的数量多,即使有部分导管被气泡堵塞,并不影响整个输导系统的功能,这样即保证了水分运输的安全性又增强了根系的抗压、耐磨性能[18],有助于酸枣植株在干旱的生境中深扎根吸水生存。
木纤维是由管胞经过长度变短、管壁加厚而成[14]。梯度干旱生境中,酸枣根系次生木质部中木纤维的长度和宽度逐渐变小,管径变窄。口径窄的导管分子不但能增加其机械强度,而且能维持较高的水张力、提高管壁对水分的黏着力、增加管内水分的内聚力,减少管内产生气泡、防止栓塞化的发生,从而提高植物的抗旱能力[9]。此外,植物可以通过根系水分再分配以避免根系水势低于引起植株水力失效的程度,以恢复根系木质部栓塞[12]。木纤维在植株组织结构中的主要功能在于支撑、抗机械磨损,变小的木纤维增加了木材的致密性和硬度,有利于植株根系在银川、吐鲁番等沙质土壤中伸展,为保证植株在风沙环境中稳固和吸水奠定基础。因此,在各类型的导管中,酸枣根系次生木质部中木纤维所占比例最大。
导管分子的管尾是相邻导管首尾相结合的锚点。在干旱胁迫时,两端具尾导管和一端具尾导管的管径相对较小,导管管尾使导管分子首尾相连,增大了重叠面积和机械强度,能有效增加水分子的内聚力和抗张力能力,这有利于在水分输导过程中形成连续的水柱,保证植物体各部分对水分的需求[11]。在干旱区土壤水分状况对根系生长、发育的影响巨大,而良好的水分供应是干旱区植物生长发育的前提[19]。由此可见,生长在诸如银川和吐鲁番等西北极度干旱的生境中,酸枣根系次生木质部导管的长导管性、宽导管性和长尾管性,是长期以来对生长环境的适应,极大地提高了输导水分和无机盐的效率,从而来抵抗恶劣的环境,快速补充酸枣在干旱环境中蒸腾散失的水分,保证植株正常生长。
综上可知,酸枣根系次生木质部导管具有较高的可塑性,这种可塑性来自于其对不同梯度干旱生境的长期适应和协同进化。
4 结论酸枣根系次生木质部导管有6种类型,根据管尾情况可分为三类:无尾型、一端有尾型和两端有尾型导管, 且在结构上表现出特定的适应特征及规律。随干旱加剧,根系中网纹导管管壁加厚,管尾变短;孔纹和梯纹导管长度、宽度、直径减小,从无尾型向有尾型转变;螺纹导管和木纤维的长度变小,管壁变薄。酸枣植株根系导管的可塑性较大,导管形态和结构的变化利于水分和养分的高效吸收和转运。导管长度、管壁和管尾的变化增强了根系的韧性和伸展能力,利于根系深扎、吸收深层土壤中的水分并快速补充植株在干旱环境中的蒸腾散失,从而适应干旱生境,保证植株的正常生长和代谢。这种可塑性来自于其对不同梯度干旱生境的长期适应和协同进化。
| [1] |
康东东, 韩利慧, 马鹏飞, 等. 不同地理环境下酸枣叶的形态解剖特征. 林业科学, 2008, 44(12): 135-139. Kang D D, Han L H, Ma P F, et al. Comparison on characters of leaf anatomy of Ziziphus jujuba var. spinosa in different geography environment (In Chinese). Scientia Silvae Sinicae, 2008, 44(12): 135-139. (  0) 0) |
| [2] |
朱广龙, 邓荣华, 魏学智. 酸枣根系空间分布特征对自然干旱梯度生境的适应. 生态学报, 2016, 36(6): 1539-1546. Zhu G L, Deng R H, Wei X Z. Spatial distribution of the root system of Ziziphus jujuba var. spinosa in response to a natural drought gradient ecotope (In Chinese). Acta Ecologica Sinica, 2016, 36(6): 1539-1546. (  0) 0) |
| [3] |
战立花, 许阿美, 魏学智. 酸枣根系构型和活力对极端干旱气候的响应规律研究. 安徽农业科学, 2012, 40(20): 10435-10438. Zhan L H, Xu A M, Wei X Z. Responses of root system architecture and root activities of Ziziphus jujuba var. spinosa to arid climate (In Chinese). Journal of Anhui Agricultural Sciences, 2012, 40(20): 10435-10438. DOI:10.3969/j.issn.0517-6611.2012.20.030 (  0) 0) |
| [4] |
战立花. 黄土高原地区酸枣根系分布特征研究. 中国园艺文摘, 2016, 32(12): 46-48. Zhan L H. Root distribute of Ziziphus jujuba var. spinosa to Loess Plateau region (In Chinese). Chinese Horticulture Abstract, 2016, 32(12): 46-48. DOI:10.3969/j.issn.1672-0873.2016.12.015 (  0) 0) |
| [5] |
尹惠敏. 酸枣根系构型特征研究. 中国水土保持, 2012(10): 59-61. Yi H M. The study on the root system architecture of Ziziphus jujuba var. spinosa (In Chinese). Soil and Water Conservation in China, 2012(10): 59-61. DOI:10.3969/j.issn.1000-0941.2012.10.023 (  0) 0) |
| [6] |
刘学师, 刘新根, 任小林. 酸枣根系抗旱性研究. 河北农业大学学报, 2007, 30(6): 33-37. Liu X S, Liu X G, Ren X L. Study on drought resistance of the root for Ziziphus var. spinosa Hu (In Chinese). Journal of Agricultural University of Hebei, 2007, 30(6): 33-37. (  0) 0) |
| [7] |
鲁松. 干旱胁迫对植物生长及其生理的影响. 江苏林业科技, 2012, 39(4): 51-54. Lu S. Effects of drought stress on plant growth and physiological traits (In Chinese). Journal of Jiangsu Forestry Science & Technology, 2012, 39(4): 51-54. (  0) 0) |
| [8] |
刘冠志, 刘果厚, 兰庆, 等. 黄柳与小红柳导管分子形态特征及其生态适应性比较研究. 西北植物学报, 2016, 36(2): 316-322. Liu G Z, Liu G H, Lan Q, et al. Comparative study on morphological characteristics and ecological adaptability of vessel elements of Salix gordejevii and S. microstachya var. bordensis (In Chinese). Acta Botanica Boreali-OccidentaliaSinica, 2016, 36(2): 316-322. (  0) 0) |
| [9] |
Carlquist S. Wood anatomy of coriariaceae:Phylogenetic and ecological implications . Systematic Botany, 1985, 10(2): 174-183. DOI:10.2307/2418343
(  0) 0) |
| [10] |
Zimmermann M H. Hydraulic architecture of some diffuse-porous trees . Canadian Journal of Botany, 1978, 56(18): 2286-2295. DOI:10.1139/b78-274
(  0) 0) |
| [11] |
朱广龙, 邓荣华, 马茵, 等. 酸枣茎导管对自然梯度干旱生境响应的结构特征. 生态学报, 2015, 5(24): 8268-8275. Zhu G L, Deng R H, Ma Y, et al. Changes in the vessel morphology of Ziziphus jujuba var. spinosa plants in response to natural drought gradient ecotopes (In Chinese). Acta Ecologica Sinica, 2015, 5(24): 8268-8275. (  0) 0) |
| [12] |
朱丽, 黄刚, 唐立松, 等. 梭梭根系的水分再分配特征对其生理和形态的影响. 干旱区研究, 2017, 34(3): 638-647. Zhu L, Huang G, Tang L S, et al. Root internal hydraulic redistribution and its effects on the physiological form and plant growth of Haloxylon ammodendron (In Chinese). Arid Zone Research, 2017, 34(3): 638-647. (  0) 0) |
| [13] |
丁俊杰, 张鑫, 楚光明, 等. 三种荒漠植物导管特征及其可塑性研究. 干旱区资源与环境, 2016, 30(9): 171-177. Ding JJ, Zhang X, Chu G M, et al. Vessel characteristics and their plasticity in three desert plants (In Chinese). Journal of Arid Land Resources & Environment, 2016, 30(9): 171-177. (  0) 0) |
| [14] |
赵云云, 田汝岭. 木质部管状分子的结构及发生. 生物学通报, 1997, 32(3): 8-10. Zhao Y Y, Tian R L. Structure and development of tubular molecules in xylem (In Chinese). Bulletin of Biology, 1997, 32(3): 8-10. (  0) 0) |
| [15] |
Takhtajan A. Morphological evolution of the angiosperms . Moscow: Agricultural Press, 1984, 89-93.
(  0) 0) |
| [16] |
李吉跃, 翟洪波. 木本植物水力结构与抗旱性. 应用生态学报, 2000, 11(2): 301-305. Li J Y, Zhai H B. Hydraulic architecture and drought resistance of woody plants (In Chinese). Chinese Journal of Applied Ecology, 2000, 11(2): 301-305. (  0) 0) |
| [17] |
房凯. 植物导管输送水的实验室检测方法研究. 绵阳师范学院学报, 2003, 22(2): 56-60. Fang K. Laboratory examination of the water transportation of plant conduct (In Chinese). Journal of Mianyang Normal University, 2003, 22(2): 56-60. (  0) 0) |
| [18] |
Lindorf H. Wood and leaf anatomy in Sessea corymbiflora from an ecological perspective . IAWA Journal, 1997, 18(2): 157-168. DOI:10.1163/22941932-90001477
(  0) 0) |
| [19] |
郭京衡, 李尝君, 曾凡江, 等. 2种荒漠植物根系生物量分布与土壤水分、养分的关系. 干旱区研究, 2016, 33(1): 166-171. Guo J H, Li C J, Zeng F J, et al. , Relationship between root biomass distribution and soil moisture, nutrient for two desert plant species (In Chinese). Arid Zone Research, 2016, 33(1): 166-171. (  0) 0) |
2. Jiangsu Provincial Key Lab of Crop Genetics & Physiology, Yangzhou University, Yangzhou, Jiangsu 225009, China
 2018, Vol. 55
2018, Vol. 55


