2. 南京市蔬菜科学研究所,南京 210042
西瓜是我国重要经济作物,但因连作导致土传病害频发,对农业生产造成严重损失。西瓜枯萎病是一种分布广泛、危害严重、防治困难的典型土传病害[1]。Janvier等[2]研究发现,土壤微生物群落结构的破坏是诱发土传病害的主要原因[3]。当前,嫁接被广泛用于防控西瓜枯萎病。嫁接能够改变根系分泌物的组成,并通过分泌抑菌物质,组建健康的根际微生物群落,在根际形成化学屏障和生物屏障,有效抵抗病原菌入侵[4]。
土壤空间异质性导致不同类型土壤的微生物群落存在差异。Edwards等[5]研究表明,不同土壤上种植的水稻根际微生物群落显著改变。Peiffer等[6]也指出,不同地点玉米的根际微生物群落明显不同。吉林、海南、江苏、新疆分别位于我国北部、南部、东部和西部地区,地处不同气候类型带,土壤理化差异较大,且均为西瓜生产大省。因此,研究不同地区土壤上砧穗互作对根际微生物活性的影响不仅有利于综合了解不同西瓜种植地土壤微生物代谢活性现状,还可以探究嫁接对微生物活性的影响在不同土壤类型上是否存在普遍规律。
微生物的种类和特性决定了微生物对碳源的代谢能力[7],研究微生物功能多样性能够了解环境中微生物群落结构和功能变化[8]。Biolog技术通过监测微生物对单一能源碳的利用程度和变化,来反映微生物群体代谢特征。因其操作简单、灵敏度高和分辨力强而被广泛用于微生物群落结构和功能多样性研究[9]。目前,大量研究从根系分泌物和根际微生物群落组成来探究嫁接对根际微生物的影响,但对不同土壤、不同嫁接植物根际微生物碳代谢活性方面研究较少。本研究通过盆栽实验,在四种类型土壤上种植不同嫁接处理的植株,利用Biolog培养技术,探究不同土壤类型和嫁接方式对作物根际微生物碳代谢活性的影响,以期找到微生物碳源代谢与嫁接抗病的关系,为研究嫁接对西瓜枯萎病的抗性机制提供科学依据。
1 材料与方法 1.1 供试材料分别从吉林、海南、江苏和新疆四个省份采集土壤表层土(0 ~ 20cm)。风干后,过100目筛,进行基本理化性质测定。土壤pH和电导率用无CO2水以1︰2.5土水比测定,土壤总碳、全氮使用元素分析仪(Vario EL Ⅲ,elementar)测定,有效磷用碳酸氢钠法测定,速效钾用乙酸铵法测定。样地土壤基本情况见表 1。植株类型分别为自根葫芦、自根西瓜、嫁接西瓜(葫芦砧木)和嫁接葫芦(西瓜砧木)。葫芦品种为瓠子(Lagenaria siceraria (Molina) Standl. var. hispida (Thunb.) Hara),西瓜品种为早佳8424(Citrullus lanatus (Thunb.) Matsum. and Nakai var.Zaojia 8424)。嫁接方法采用插接法[10],所有植株幼苗均由南京市蔬菜科学研究所提供。
|
|
表 1 供试土样采样地点和理化性质 Table 1 Sampling sites and physicochemical properties of the soils tested |
试验于2016年7月在南京农业大学牌楼试验基地进行。具体如下:4个地点土样过10目筛,去除碎石、根等杂物。将土装入盆钵中,每盆土重约480 g。将植株幼苗根部清洗干净,移栽到盆钵中。期间适当浇水。种植45 d后采集样品,抖落根表松软的土,将紧紧附着在根表的土视为根际土。根和根际土一并放入冰盒中,运回实验室4℃保存。
BIOLOG生态板(ECO MICROPLATE Cat. No. 1506 HAYWARD, CA 94545 U.S.A)包含用于土壤微生物群落分析最常用的31种碳源,每种碳源设有3个平行。具体方法为,称取根和根际土共1 g于无菌50 ml离心管中,加入9 ml灭菌的0.85%NaCl溶液,放入摇床中250 rmin-1震荡30 min,取出后静置10 min,吸取2 ml上清液稀释至1 000倍。吸取稀释液接种到BIOLOG板中,每孔150 μl,放入恒温培养箱28℃培养[11]。使用Biolog自动微生物鉴定系统(BIOLOG MicroStation, USA)每隔12 h测定590 nm和750 nm波长下的吸光值,持续测量至168 h。
1.3 数据分析微生物代谢活性用590 nm吸光度数值减去750 nm吸光度数值表示[8]。
平均每孔颜色变化(Average well color development, AWCD)代表微生物对碳源的综合代谢能力[11]。
| $ {\rm{AWCD}} = \mathit{\Sigma }({A_i} - {A_1})/31 $ |
式中,Ai为第i个孔的相对吸光度,A1为对照孔的相对吸光度。
选取培养过程中第96小时测定的吸光度数据进行数据分析[12]。不同植物处理微生物的碳源利用单因素方差分析使用SPSS 19.0。使用R 3.3.3版本中的vegan、ggplot2程序包完成微生物碳源吸光度主成分分析,使用R 3.3.3版本中的permute、lattice、vegan、pheatmap程序包完成热图分析,使用R2.10.1版本的lattice、gbmplus程序包完成聚类推进树(Aggregated boosted tree, ABT)分析。
2 结果 2.1 微生物碳代谢活性差异不同土壤类型(p < 0.001)和不同植物类型处理之间(p= 0.047)AWCD值存在显著差异(图 1A)。土壤处理中吉林黑土微生物碳源代谢活性最高、江苏黄棕壤次之、新疆灰漠土和海南砖红壤最低。不同土壤上4种嫁接处理AWCD值呈现不同的变化趋势。四种土壤自根西瓜处理的AWCD值均大于自根葫芦处理。与自根西瓜处理相比,黑土处理的嫁接西瓜(葫芦砧木)AWCD值显著降低,而其余土壤上嫁接处理AWCD值没有显著变化。
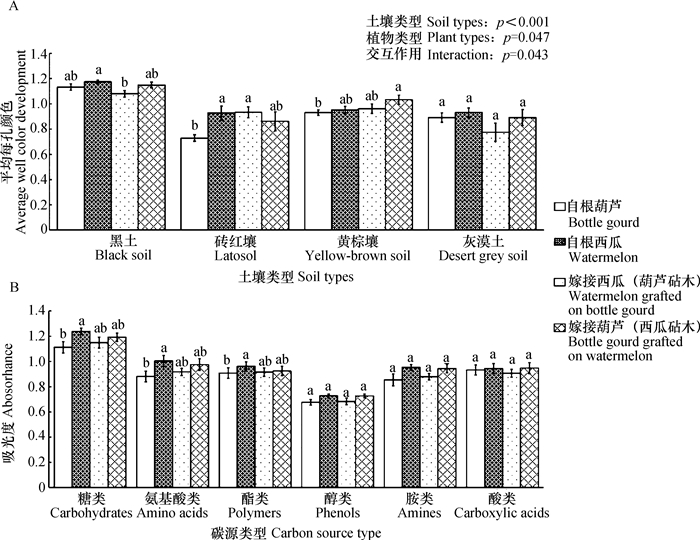
|
图 1 4种土壤4种根际微生物碳源代谢吸光度(A)及4种根际微生物利用6类碳源的吸光度(B) Fig. 1 AWCD of carbon sources utilization by microorganisms in rhizosphere relative totreatment (A) and relative to kind of carbon sources (B) 注:同一土壤或同一碳源不同字母表示植物类型之间根际微生物AWCD的差异显著(p < 0.05) Note: Different letters represent in the same column of soil or carbon source mean significant difference between treatments (p < 0.05) |
由不同嫁接处理根际微生物对六大类碳源利用程度(图 1B)可知,根际微生物对糖类、氨基酸类、酯类碳源的利用程度存在显著差异,但对醇类、胺类和酸类碳源利用差异不显著。4种嫁接处理微生物对六类碳源的利用程度有相同趋势。自根葫芦处理根际微生物碳源利用性最低,自根西瓜处理最高,两种嫁接植物根际微生物碳代谢活性处于中间水平。
2.2 土壤类型和植物类型对碳源利用的影响31种碳源吸光度数据的多因素置换方差分析(Permutational multivariate analysis of variance, PERMANOVA)结果表明(图 2A),土壤类型(R2 = 0.534,p < 0.001)和植株类型(R2 = 0.075,p < 0.001)对微生物碳源代谢均有显著影响,两者交互作用(R2 = 0.215,p < 0.001)显著改变微生物碳源代谢水平。
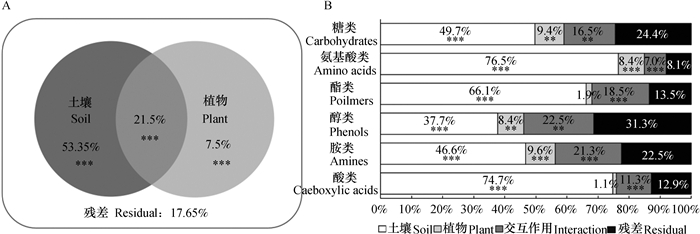
|
图 2 微生物对31种单一碳源利用吸光度的PERMANOVA分析(A)及六类碳源利用吸光度方差分析(B) Fig. 2 PERMANOVA of absorbance relative to sole carbon sources utilized by microorganisms (A) and ANOVA of absorbance relative to kind of carbon sources utilized (B) |
六类碳源吸光度数据方差分析(ANOVA)的结果表明(图 2B),土壤因素均显著影响微生物对六类碳源的代谢程度(p值均小于0.001);不同植物处理之间微生物对糖类(p < 0.05)、氨基酸类(p < 0.001)、醇类(p < 0.05)、胺类(p < 0.001)碳源的利用程度显著改变,对酯类(p= 0.09)和酸类(p= 0.25)碳源利用的影响不显著;土壤与植物处理的交互作用同样显著影响微生物对六类碳源的利用(p值均小于0.05)。
2.3 不同植物类型根际微生物的碳源利用模式为了解每种土壤上,不同嫁接处理根际微生物碳代谢差异,对31种单一碳源吸光度数据进行主成分分析(图 3)。可以看出,不同嫁接处理根际微生物对31种碳源的利用在主成分第一、二轴上分开(黑土p= 0.001、黄棕土p= 0.001、砖红壤p= 0.001、灰漠土p= 0.003),证明在不同土壤上,嫁接均改变根际微生物碳源利用模式。
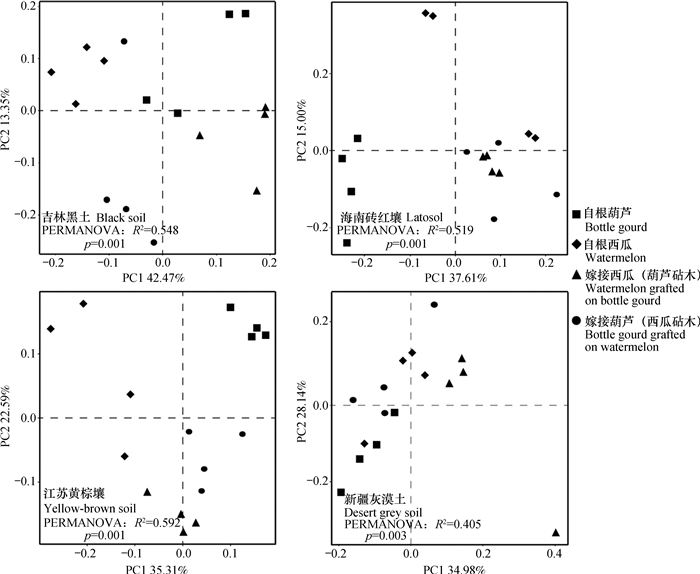
|
图 3 不同植物类型根际微生物碳源利用主成分分析 Fig. 3 PCA of carbon sources utilization by microorganisms relative to type of plant |
为进一步探究嫁接对根际微生物碳代谢活性的影响,将31种单一碳源的代谢吸光度数据标准化后,进行热图分析(图 4)。结果表明,自根葫芦处理不同碳源利用总体上呈蓝色或深蓝色,证明其根际微生物对大部分单一碳源利用程度相对偏低,对α-D-乳糖、I-赤藻糖醇、γ-羟基丁酸、衣康酸、α-丁酮酸等少数碳源利用程度较高;相反,自根西瓜处理大部分碳源代谢呈橘红色或红色,说明其根际微生物对多种碳源均有较高利用程度。嫁接西瓜(葫芦砧木)与自根西瓜处理相比,微生物对糖类(D-木糖、肝糖)、氨基酸类(除L-精氨酸以外其他氨基酸)、酯类(吐温40、吐温80)、醇类(I-赤藻糖醇、D-甘露醇、D, L-α-甘油)和胺类(苯乙基胺、腐胺、N-乙酰基-D-葡萄胺)碳源的利用程度普遍降低,而在对酸类碳源的利用程度上,嫁接西瓜(葫芦砧木)处理增加了对D-半乳糖醛酸、衣康酸的利用,对2-羟基苯甲酸、4-羟基苯甲酸和D-苹果酸的利用程度降低。嫁接葫芦(西瓜砧木)处理根际微生物对碳源的综合利用程度高于自根葫芦和嫁接西瓜(葫芦砧木)处理。与自根西瓜处理相比,嫁接葫芦(西瓜砧木)处理根际微生物对氨基酸类碳源的利用程度(除L-丝氨酸和甘氨酰-L-谷氨酸)增加;除4-羟基苯甲酸、γ-羟基丁酸外其他酸类碳源的利用程度均有所提高;糖类、酯类、醇类和胺类碳源的利用略有降低。

|
图 4 不同植物类型根际微生物对31种碳源代谢程度热图分析 Fig. 4 Heatmap analysis ofmetabolisms of 31 sole carbon sources by rhizospheric microorganisms relative to type of plant |
将31种碳源代谢吸光度数据进行主成分分析后,取PC1轴数据代表微生物对碳源的综合利用水平,与环境因子进行聚类推进树分析(图 5)。结果表明,土壤速效钾和有效磷对微生物碳源代谢的相对影响率最高,分别为27.3%和26.9%;其次是土壤电导率和pH,分别为21.8%和16.6%;而土壤全氮量、全碳量和土壤碳氮比对微生物活性的影响较小,分别为3.2%,2.3%和1.9%。

|
图 5 环境因子对微生物碳源利用的相对影响率 Fig. 5 Relative influence of environmental factors on carbon sources utilization by microorganisms |
六类碳源的代谢吸光度与不同环境因子的ABT分析表明,土壤有效磷和速效钾很大程度上影响微生物对糖类、氨基酸类、酯类、胺类及酸类碳源的代谢利用。土壤全氮和pH主要影响微生物对醇类物质的代谢(分别为31.0%和28.9%)。
3 讨论 3.1 不同土壤根际微生物碳代谢指纹特征与差异不同土壤类型处理中,吉林黑土的微生物带谢活性最高,江苏黄棕壤次之,海南砖红壤、新疆灰漠土最低。原因是黑土的肥力高,pH近中性,环境适宜微生物生存,微生物多样性水平高。而砖红壤属酸性土,土壤养分含量少,微生物数量和活性均被抑制。新疆灰漠土土壤电导率显著高于其他三种土壤,土壤电导率与含盐度呈正相关关系,高盐分抑制微生物的生长[13]。
聚类推进树分析(图 5)表明,土壤理化因子影响微生物活性。有效磷、速效钾是影响土壤微生物碳代谢活性的主要因子,pH和全氮主要影响微生物对醇类物质的代谢。有研究表明,土壤有效磷、速效钾、pH和全氮量均显著影响土壤中微生物数量[14]。因此可以推断,理化因子通过改变土壤微生物量进而影响微生物对碳源利用能力。
3.2 不同植物根际碳代谢差异及与土传病害之间的联系前期试验证明,自根葫芦、自根西瓜和嫁接西瓜(葫芦砧木)分泌不同的根系分泌物[15],且分泌物对微生物活性有刺激作用[16],因此可以推断,嫁接改变了根系分泌物的组成进而影响根际微生物活性。本试验中,嫁接显著改变了根际微生物代谢活性,不同嫁接处理微生物对糖类、氨基酸类和酯类碳源的利用存在显著差异,而对醇类、胺类和酸类的利用程度差异不显著(图 1B),原因是土壤因素对微生物碳源利用的影响远大于植物因素(图 2),使部分植物因素的影响效果被掩盖[7]。主成分分析表明,嫁接显著改变了根际微生物碳源代谢模式。通过热图分析结果显示,自根葫芦处理根际微生物对碳源利用普遍偏低,而自根西瓜处理大部分碳源利用程度高,两种嫁接处理微生物碳源利用程度处于中间水平。
根际中的糖类、氨基酸、酸类等物质主要来自于根系分泌物[17]。植物将5% ~ 21%的光合产物以根系分泌物的形式释放到土壤环境中[18],为微生物提供物质和能量。大量研究表明,根系分泌物中的糖、氨基酸等物质能够为土传病原菌提供生存必要的碳源和氮源,对病原菌的生长和孢子萌发有明显促进作用[17, 19]。尖孢镰刀菌是异养微生物,倾向于利用碳氮比高的物质。根际环境中糖类含量高,可为致病菌提供营养。氨基酸参与多种生命过程,是微生物重要的营养源之一,对土壤微生物群落结构和活性均有直接影响。前人研究表明,外源添加丙氨酸、谷氨酸、天冬氨酸、精氨酸、甘氨酸和苯丙氨酸对尖孢镰刀菌的生长有明显的刺激作用[17]。潘凯和吴凤芝[20]以5种对枯萎病不同抗性黄瓜品种为实验材料,发现其根系分泌物中总氨基酸水平与品种抗性呈负相关关系。本试验的西瓜品种早佳8424属于感病品种,从根系分泌物中检测出大量糖和氨基酸[17]。与其他植物处理相比,自根西瓜处理根际微生物对糖类、氨基酸类碳源代谢水平高(图 4)。因此,根际微生物对糖类、氨基酸类利用水平可能与枯萎病抗性存在一定关系。此外,酚酸作为根际中重要的化感物质,对土传病原尖孢镰刀菌的生长有很大影响。外源添加2-羟基苯甲酸在低浓度时促进孢子萌发,高浓度对孢子萌发起抑制作用;4-羟基苯甲酸对尖孢镰刀菌产孢、孢子萌发有一定的促进作用[17]。本研究中,自根西瓜处理的根际微生物对4-羟基苯甲酸代谢活性高,自根葫芦处理微生物对4-羟基苯甲酸代谢活性较低,砧穗互作降低了根际微生物对4-羟基苯甲酸的利用程度,这可能与嫁接之后植物向根际分泌4-羟基苯甲酸的量减少有关。
连作障碍是由根系分泌物介导下植物与微生物共同作用的结果[21]。植物通过分泌根系分泌物影响微生物的碳代谢活性,自根西瓜处理微生物碳源综合利用程度高,证明根际环境碳源种类丰富,能够为病原菌生长提供有利条件,可能诱导枯萎病产生;相反,自根葫芦根际环境中碳源物质相对贫乏,不利于病原菌大量繁殖。通过嫁接,改变了植物根系分泌物的组成,降低了根际微生物对部分碳源的代谢活性。嫁接西瓜(葫芦砧木)处理与自根西瓜相比,根际的微生物对碳源(尤其是糖类和氨基酸类)的利用普遍降低(图 4),在一定程度上解释了嫁接防控土传病害的原因。而嫁接葫芦(西瓜砧木)处理,对糖类、氨基酸类碳源的代谢程度仍处于较高水平,证明西瓜作为砧木不能达到病害防控的目的。
4 结论土壤类型和砧穗互作均显著改变微生物碳源代谢活性,土壤类型对微生物活性的影响更大。四种土壤处理中,吉林黑土微生物代谢水平最高,海南红壤和新疆灰漠土最低。土壤速效钾、速效磷养分的差异影响微生物对不同类型碳源的代谢活性。不同嫁接处理中,自根西瓜根际微生物代谢程度最高,自根葫芦最低。嫁接降低了微生物对糖类、氨基酸等有益于病原菌生长物质的代谢,表明根际微生物组成和化学环境发生变化,不利于病原菌大量繁殖。
| [1] |
雷娟利, 寿伟松, 董文其, 等. 嫁接对西瓜根际微生物种群数量及群落结构的影响. 中国蔬菜, 2011, 1(2): 62-66. Lei J L, Shou W S, Dong W Q, et al. Effects of Grafting on rhizosphere microorganisms quantity and community structure of watermelon (In Chinese). China Vegetables, 2011, 1(2): 62-66. (  0) 0) |
| [2] |
Janvier C, Villeneuve F, Alabouvette C, et al. Soil health through soil disease suppression:Which strategy from descriptors to indicators? . Soil Biology & Biochemistry, 2007, 39(1): 1-23.
(  0) 0) |
| [3] |
Ling N, Yang S, Raza W, et al. The response of root-associated bacterial community to the grafting of watermelon . Plant & Soil, 2015, 391(1/2): 253-264.
(  0) 0) |
| [4] |
Song Y, Zhu C, Raza W, et al. Coupling of the chemical niche and microbiome in the rhizosphere:Implications from watermelon grafting . Frontiers of Architectural Research, 2016, 3(3): 249-262.
(  0) 0) |
| [5] |
Edwards J, Johnson C, Santosmedellín C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice . Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(8): 911-920. DOI:10.1073/pnas.1414592112
(  0) 0) |
| [6] |
Peiffer J A, Spor A, Koren O, et al. Diversity and heritability of the maize rhizosphere microbiome under field conditions . Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(16): 6548-6553. DOI:10.1073/pnas.1302837110
(  0) 0) |
| [7] |
鲁顺保, 张艳杰, 陈成榕, 等. 基于BIOLOG指纹解析三种不同森林类型土壤细菌群落功能差异. 土壤学报, 2013, 50(3): 618-623. Lu S B, Zhang Y J, Chen C R, et al. Analysis of functional differences between soil bacterial communities in three different types of forest soils based on Biolog fingerprint (In Chinese). Acta Pedologica Sinica, 2013, 50(3): 618-623. (  0) 0) |
| [8] |
田雅楠, 王红旗. Biolog法在环境微生物功能多样性研究中的应用. 环境科学与技术, 2011, 34(3): 50-57. Tian Y N, Wang H Q. Application of Biolog to study of environmental microbial function diversity (In Chinese). Environmental Science & Technology, 2011, 34(3): 50-57. (  0) 0) |
| [9] |
Garland J L. Analysis and interpretation of community‐level physiological profiles in microbial ecology . FEMS Microbiology Ecology, 1997, 24(4): 289-300. DOI:10.1111/j.1574-6941.1997.tb00446.x
(  0) 0) |
| [10] |
郭双海. 西瓜嫁接苗接口愈合期管理措施. 现代农业科技, 2007(24): 57-57. GuoS H. Management measures during healing period of watermelon grafted seedings (In Chinese). Modern Agricultural Science and Technology, 2007(24): 57-57. DOI:10.3969/j.issn.1007-5739.2007.24.036 (  0) 0) |
| [11] |
党雯, 郜春花, 张强, 等. Biolog法测定土壤微生物群落功能多样性预处理方法的筛选. 中国农学通报, 2015, 31(2): 153-158. Dang W, Gao C H, Zhang Q, et al. Screening of preprocessing method of Biolog for soil microbial community functional diversity (In Chinese). Chinese Agricultural Science Bulletin, 2015, 31(2): 153-158. DOI:10.11924/j.issn.1000-6850.2014-2191 (  0) 0) |
| [12] |
Chen L, Li C, Feng Q, et al. Shifts in soil microbial metabolic activities and community structures along a salinity gradient of irrigation water in a typical arid region of China . Science of the Total Environment, 2017, 598: 64-70. DOI:10.1016/j.scitotenv.2017.04.105
(  0) 0) |
| [13] |
王国栋, 褚贵新, 刘瑜, 等. 干旱绿洲长期微咸地下水灌溉对棉田土壤微生物量影响. 农业工程学报, 2009, 25(11): 44-48. Wang G D, Chu G X, Liu Y, et al. Effects of long-term irrigation with brackish groundwater on soilmicrobial biomass in cotton field in arid oasis (In Chinese). Transactions of the Chinese Society of Agricultural Engineering, 2009, 25(11): 44-48. DOI:10.3969/j.issn.1002-6819.2009.11.009 (  0) 0) |
| [14] |
戴雅婷, 侯向阳, 闫志坚, 等. 库布齐沙地两种植被恢复类型根际土壤微生物和土壤化学性质比较研究. 生态学报, 2016, 36(20): 6353-6364. Dai Y T, Hou X Y, Yan Z J, et al. Soil microbes and the chemical properties of the rhizosphere and non-rhizospheresoil under two types of vegetation restoration in the Hobq sandy land of Inner Mongolia, China (In Chinese). Acta Ecologica Sinica, 2016, 36(20): 6353-6364. (  0) 0) |
| [15] |
Ling N, Zhang W W, Wang D S, et al. Root exudates from grafted-root watermelon showed a certain contribution in inhibiting Fusarium oxysporum f. sp. niveum . PLoS One, 2013, 8(5). DOI:10.1371/journal.pone.0063383
(  0) 0) |
| [16] |
Nannipieri P, Giagnoni L, Renella G, et al. Soil enzymology:classical and molecular approaches . Biology & Fertility of Soils, 2012, 48(7): 743-762.
(  0) 0) |
| [17] |
郝文雅. 西瓜、水稻根系分泌物中的化感物质对西瓜连作枯萎病的影响. 南京: 南京农业大学, 2010 Hao W Y. Effects of allelochemicals from watermelon and rice root exudates on fusarium wilt of watermelon(In Chinese). Nanjing: Nanjing Agricultural University, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10307-1012272777.htm (  0) 0) |
| [18] |
Bais H P, Loyola-Vargas V M, Flores H E, et al. Root-specific metabolism:The biology and biochemistry of underground organs . In Vitro Cellular & Developmental Biology-Plant, 2001, 37(6): 730-741.
(  0) 0) |
| [19] |
董艳, 董坤, 郑毅, 等. 不同抗性蚕豆品种根系分泌物对枯萎病菌的化感作用及根系分泌物组分分析. 中国生态农业学报, 2014, 22(3): 165-170. Dong Y, Dong K, Zheng Y, et al. Allelopathic effects and components analysis of root exudates of faba bean cultivars with different degrees of resistance to Fusarium oxysporum (In Chinese). Chinese Journal of Eco-Agriculture, 2014, 22(3): 165-170. (  0) 0) |
| [20] |
潘凯, 吴凤芝. 枯萎病不同抗性黄瓜(Cucumis sativus L.)根系分泌物氨基酸组分与抗病的相关性. 生态学报, 2007, 27(5): 1945-1950. Pan K, Wu F Z. Correlation analysis of amino acids components in cucumber root exudates and fusarium wilt resistance (In Chinese). Acta Ecologica Sinica, 2007, 27(5): 1945-1950. (  0) 0) |
| [21] |
吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望. 植物生态学报, 2014, 38(3): 298-310. Wu L K, Lin X M, Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates (In Chinese). Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. (  0) 0) |
2. Nanjing Institute of Vegetable Science, Nanjing 210042, China
 2018, Vol. 55
2018, Vol. 55


