2. 中国科学院大学, 北京 100049
磷作为一种维持植物生长发育所必需的大量营养元素, 不仅是植物体内核酸、磷脂、腺苷三磷酸等重要化合物的组成成分, 还以多种形式参与植物体内的各项代谢活动[1]。然而, 缺磷土壤在世界范围内广泛分布, 约占全球耕地面积的67%, 是农业生产中的一大制约因素[2-3]。尽管多数低磷土壤中的总磷含量很高, 可供植物直接吸收的有效磷含量却很低, 难以满足植物的正常生长所需。这是由于来源于土壤和肥料中的磷易被土壤中的矿物和有机质所固定, 降低了它们的生物有效性[4]。
植物在经历了长期的演化过程后, 形成了一系列的耐低磷机制。如通过改变根系构型[5]、由根系向外分泌质子或有机酸[6]以及与丛枝菌根共生[7]等措施来增强根系对土壤中难溶态磷的活化和吸收; 或通过改变体内的脂质代谢途径[8]、提高核糖核酸酶的活性[9]等手段提高对内源磷的再利用能力。近年来的研究表明, 在植物响应缺磷胁迫的过程中, 植物的细胞壁组分也参与了内源磷的再利用:缺磷条件下的拟南芥, 其细胞壁果胶和半纤维素含量均发生了显著变化, 暗示细胞壁组分可能参与了拟南芥对缺磷胁迫的响应[10];进一步的研究发现, 水稻在缺磷条件下, 根系细胞壁的果胶糖醛酸含量与根系中的可溶性磷水平存在显著的正相关关系, 即水稻根系细胞壁中的果胶糖醛酸含量越高, 其对细胞壁磷的再利用能力越强; 体外实验也表明, 细胞壁中的果胶组分可通过吸附FePO4中的Fe3+, 使部分PO43-游离出来, 从而活化了细胞壁中的难溶态磷[11]。
细胞壁主要由果胶、半纤维素和纤维素构成。与化学上相对惰性的纤维素及中性或略酸性的、可溶于碱的半纤维素不同, 果胶富含同聚半乳糖醛酸(Homogalacturonan, HG)[12-13]。HG在高尔基体中合成时, C6位的羧基(-COOH)被果胶甲基转移酶(Pectin methyltransferase, PMT)甲酯化, 因此, 运输至细胞壁中的HG以高度(约75%)甲酯化的形式存在[14-15]。在植物的生长过程中, 果胶的甲酯化度(Degree of methyl esterification, DE)会发生变化, 这是由果胶甲酯酶(Pectin methylesterase, PME)控制的[16]。PME催化果胶中的HG去甲酯化, 产生带负电荷的羧基, 同时释放出甲醇和质子[17]。
水稻根系细胞壁中的果胶含量与细胞壁磷的释放密切相关[11], 但其中的具体作用机制尚不清楚, 需要进一步的研究。本文选取粳稻品种Nipponbare(Nip)和籼稻品种Kasalath(Kas)作为试验对象, 研究了在缺磷条件下, 水稻内源磷可利用水平的变化及其差异, 并探究了产生这种差异的具体原因, 以期丰富水稻的耐低磷机制。
1 材料与方法 1.1 植物材料与培养条件选取对内源磷再利用能力有差异的水稻品种Nip和Kas为试验材料[11]。
将水稻种子用蒸馏水浸泡24 h, 然后移至带有浮板的滤网上。将滤网置于0.5 mmol·L-1的CaCl2溶液(pH 5.6)中, 30℃避光培养3 d, 使其生根发芽。然后将滤网移至木村(Kimura B)营养液中, 在人工气候室中培养, 白天28℃/14 h, 夜晚22℃/10 h, 光照强度为450 μmol·m-2· s-1, 相对湿度为60%。
处理方法:水稻发芽一周后, 转移至1.5 L黑色培养罐中木村营养液正常培养一周。然后选取生长一致的幼苗(Nip、Kas), 分别用正常(+P, 180 μmol·L-1)和缺磷(-P, 0 μmol·L-1)的木村营养液(pH 5.6)培养一周, 共得到四个处理(Nip+P、Nip-P、Kas+P、Kas-P)。所用营养液均用稀H2SO4和NaOH溶液调节至pH 5.6, 每天更换一次。
1.2 可溶性磷的提取与测定水稻可溶性磷的提取, 按照Delhaize和Randall[18]的方法进行:用去离子水反复冲洗根系, 再用吸水纸吸干水分, 然后迅速剪下根系和地上部并称重, 塞入放置有氧化锆珠的样品管中, 并用液氮冷冻。取出冷冻后的样品管, 置于组织研磨仪(净信JXFSTPRP-24, 上海)中粉碎, 然后分别向根系和地上部中加入200 μL、400 μL的5 mol·L-1的H2SO4溶液。再次研磨均匀后, 又分别加入4 mL和8 mL的去离子水, 震荡混匀。静置20 min后, 在3 000 r·min-1的条件下离心5 min(ThermoMicrocl17, 德国)。
吸取100 μL上清液和磷标准液(0、10、20、30、40、50、75、100 mg·L-1)至1.5 mL离心管中, 并加入100 μL钼锑抗显色剂和800 μL去离子水, 混匀后在37℃下静置30 min, 用酶标仪(Tecan, 瑞士)在880 nm处测定吸光度。
1.3 细胞壁的制备将处理后的水稻根系剪下, 根据Zhong和Lauchli[19]的方法提取细胞壁:首先将根系经液氮冷冻, 在研钵中研磨成粉末, 然后加入5 mL 75%的乙醇溶液, 洗入10 mL离心管中。室温下静置20 min后, 3 000 r·min-1离心5 min, 弃上清液。再分别加入5 mL的丙酮、甲醇︰氯仿(1︰1)和甲醇进行清洗, 重复上述静置、离心、弃上清液等步骤。最后得到的残渣即为细胞壁, 在烘箱中60℃烘干后保存备用。
1.4 细胞壁固着磷的提取与测定称取5 mg左右的细胞壁, 按照Zhu等[11]的方法提取固着态磷:将细胞壁样品置于1.5 mL离心管中, 加入1 mL 2 mol·L-1的HCl溶液。涡旋振荡24 h后, 15 000 r·min-1的条件下离心5 min。上清液中磷即为细胞壁固着磷, 磷的测定方法同上。
1.5 果胶提取及甲酯化度的测定称取5 mg左右的细胞壁, 按照Yang等[20]的方法提取果胶组分。将细胞壁样品置于1.5 mL离心管中, 并加入1 mL去离子水。在沸水中煮1 h后, 15 000 r·min-1的条件下离心5 min, 吸取上清液至5 mL离心管中。向残渣中继续加入1 mL去离子水, 重复提取两次。混合所得的3 mL上清液即为果胶提取液。
果胶羧基含量的测定, 根据Blumenkrantz和Asboehansen[21]提出的方法进行:吸取100 μL的果胶提取液和半乳糖醛酸标准液(0、10、20、30、40、50、75、100 mg·L-1)至1.5 mL离心管中。然后加入500 μL含0.0125 mol·L-1硼砂(Na2B4O7·10H2O)的浓H2SO4。置于沸水中煮5 min后, 立即置于冰上冷却, 2 min后迅速加入10 μL 0.15%的间羟基联苯(M-hydro-diphenyl, 溶于0.5%的NaOH溶液)。30℃下孵育20 min后, 用酶标仪在520 nm处测定吸光值。
果胶甲酯基含量的测定, 根据Klavons和Bennett[22]的方法进行:吸取125 μL的果胶提取液, 加入25 μL 4 mol·L-1的NaOH溶液, 震荡混匀。37℃下皂化30 min后, 加入50 μL 2 mol·L-1的HCl溶液使其酸碱中和。向200 μL甲醇标液(0、10、20、30、40、50、75、100 μmol·L-1)和水解样品中加入400 μL 200 mmol·L-1的磷酸缓冲液(pH 7.5)、0.01 units·μL-1乙醇氧化酶(Alcohol oxidase, AO, Sigma)。30℃下孵育10 min后, 加入800 μL 5 g·L-1的巯基拉曼染料(Purpald, 4-氨基-3-肼基-5-巯基-1, 2, 4-三唑, 4-anmino-3-hydrazino-5-mercapto-1, 2, 4-triazole, Sigma, 溶于0.5 mol·L-1的NaOH溶液), 30℃下孵育30 min后, 用酶标仪在550 nm处测定吸光值。
果胶甲酯化度(DE, %)=甲酯基含量/(羧基含量+甲酯基含量)×100。
1.6 果胶甲酯酶的提取及活性测定剪取生长三周的水稻幼苗根系, 用来提取果胶甲酯酶。根系样品经液氮冷冻后, 用组织研磨仪粉碎。然后加入500 μL提取液(1 mol·L-1 NaCl, 10 mmol·L-1 Tris-HCl, pH 7.5), 在冰上孵育30 min, 期间振荡3次。随后在15 000 r·min-1条件下离心5 min, 所得上清液即为待测样品[23-24]。
果胶甲酯酶活性的测定, 参照Anthon和Barrett [25]的方法进行:吸取100 μL样品和甲醇标液(0、10、20、30、40、50、75、100 μmol·L-1)至1.5 ml离心管中, 加入200 μL 200 mmol·L-1的磷酸缓冲液(pH 7.5)、0.64 mg·mL-1果胶(DE=90%, Sigma)、0.01 units·μL-1 AO。振荡混匀后, 在5 000 r·min-1下离心10 s, 30℃孵育10 min。然后加入400 μL 5 g·L-1的巯基拉曼染料, 振荡混匀。30℃孵育30 min后, 用酶标仪在550 nm处测定吸光值。
1.7 体外磷解析实验将50 mg不同甲酯化度的果胶溶于30 mL水中, 再分别加入30 mg FePO4·2H2O, 置于37℃摇床(ZWY-2102C, 智城, 上海)中震荡24 h。3 000 r·min-1条件下离心5 min后, 用钼锑抗比色法测定上清液中的磷含量。
1.8 数据处理数据处理和绘图在Microsoft Excel 2016软件中进行, 并采用SAS 8.1统计分析软件进行单因素方差分析和多重比较, 并用最小显著性差异(LSD)法检验处理间的差异显著性(P<0.05)。
2 结果 2.1 缺磷处理后水稻体内可溶性磷含量的变化为了探究水稻在缺磷后内源磷可利用水平的变化, 对Nip和Kas两个水稻品种进行不同时间的缺磷处理, 分别测定了地上部和根系中的可溶性磷含量。由图 1A可知, 随着缺磷时间的延长, Nip和Kas体内的可溶性磷含量均不断下降。根系中的可溶性磷含量在下降5 d后趋于稳定, 而地上部的磷下降趋势明显滞后, 且在缺磷第7天仍有下降趋势。
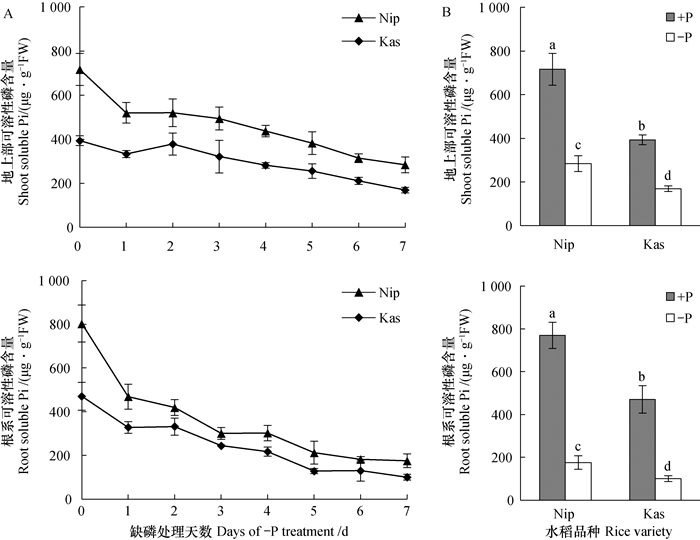
|
图 1 缺磷处理水稻体内可溶性磷含量的变化 Fig. 1 Variation of soluble P in rice shoot and root in treatment for one week 注:Nip、Kas分别表示水稻品种Nipponbare和Kasalath; +P、-P分别表示正常和缺磷处理。图中的数据为平均值±标准偏差, 不同的字母表示处理之间存在显著差异(P<0.05), 下同Note: Nip and Kas represent rice varieties Nipponbare and Kasalath respectively; +P and-P respectively indicate normal and phosphorus-deficient treatments. Data are means ± SD((n=4). Columns with different letters are significantly different at P < 0.05. The same below |
总体而言, 两个品种的可溶性磷含量的变化趋势基本一致, 但Nip体内的可溶性磷含量均一直高于Kas。为了比较两个品种间的差异, 选取了处理7 d后的样品进行分析。由图 1B可知, 正常处理7 d时, 在地上部和根系中, Nip中的可溶性磷含量均显著高于Kas; 缺磷处理7 d后, 可溶性磷含量均显著下降, 而Nip仍显著高于Kas。
2.2 缺磷处理后细胞壁固着磷含量的变化由图 2可知, 缺磷处理7 d后, Nip和Kas根系细胞壁固着磷含量均显著下降, 且达到相同水平。但由于正常处理时, Nip根系细胞壁的固着磷含量显著高于Kas, 说明Nip在缺磷处理后, 较Kas从根系细胞壁中释放出了更多的磷。
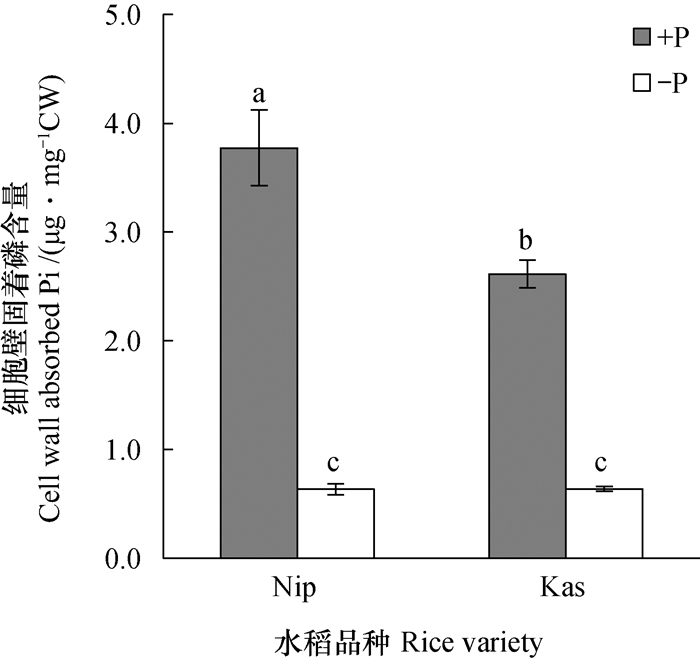
|
图 2 缺磷处理一周后水稻根系细胞壁固着磷含量 Fig. 2 Cell wall absorbed Pi in rice root after one week of -P treatment |
Zhu等[11]通过果胶的体外解析实验, 证明了果胶溶液能从难溶态的FePO4中释放出更多的Pi。而果胶在植物中是以不同甲酯化度存在的, 为了探究果胶释放难溶态磷的能力与其甲酯化度之间的关系, 本文选取了三种不同甲酯化度的果胶, 进行了同样的体外磷解析实验。图 3的结果显示, 随着甲酯化度的降低, 果胶从FePO4中释放出的无机磷(Pi)显著增加。这表明, 果胶释放难溶态磷的能力与其甲酯化度呈负相关关系。
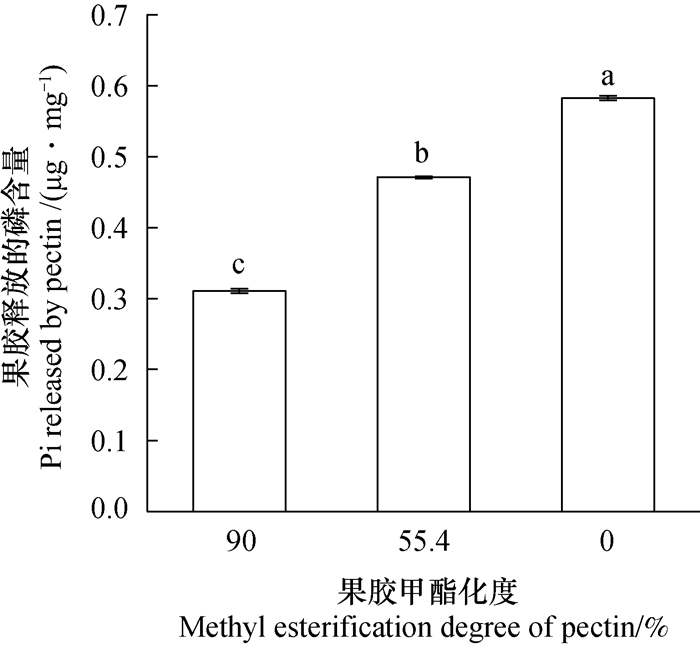
|
图 3 不同甲酯化度的果胶释放出的磷含量 Fig. 3 Pi content released by pectin relative to degree of methyl esterification of the pectin |
为了探究两个水稻品磷再利用能力的差异是否与其甲酯化度的变化有关, 测定了根系中细胞壁的果胶甲酯化度。由图 4可知, 正常培养时, Nip和kas根系中的果胶甲酯化度无显著差异。在缺磷处理7 d后, Nip根系中的果胶甲酯化度无明显变化, 而kas根系中的果胶甲酯化度显著升高。
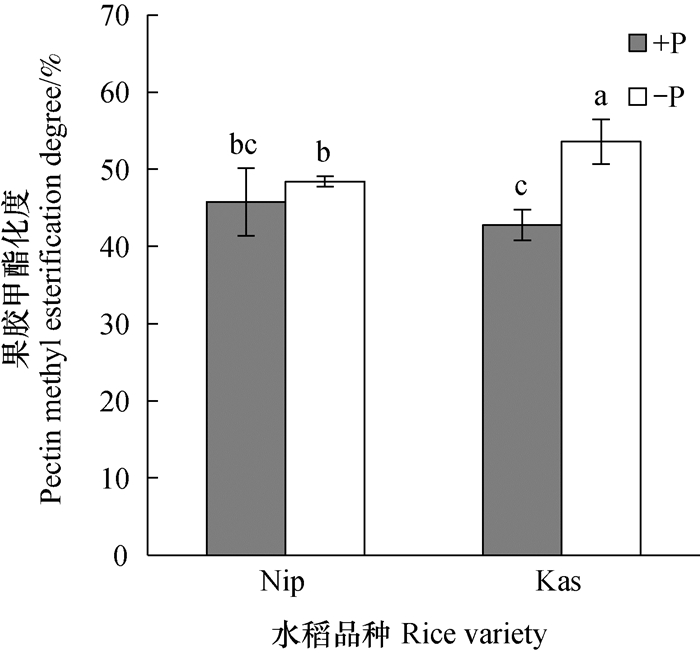
|
图 4 缺磷处理一周后水稻根系的果胶甲酯化度 Fig. 4 Methyl esterification degree of pectin in rice root after one-week of -P treatment |
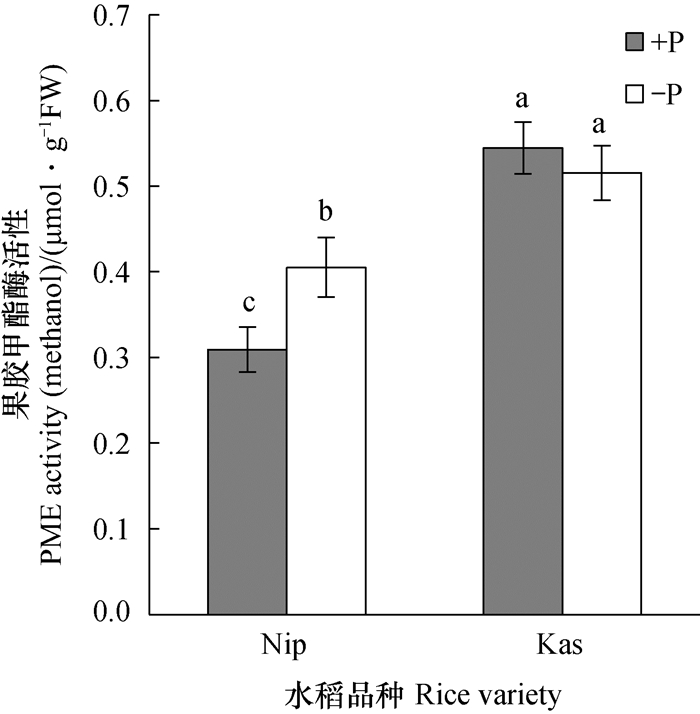
为了探究缺磷处理后两个水稻品种的根系果胶甲酯化度发生不同变化的原因, 又测定了水稻根系中与之相关的果胶甲酯酶(PME)活性。由图 5可知, 尽管Kas的PME活性在+P/-P处理后均显著高于Nip, 但在+P/-P处理间无显著差异, 而Nip在-P处理后PME活性显著升高。
|
图 5 +P/-P处理一周后水稻根系的果胶甲酯酶活性 Fig. 5 Pectin methylesterase (PME) activity of rice root after one week of -P treatmen |
作为植物抵御外界不良环境的第一道屏障, 细胞壁不仅在植物缓解铝毒、镉毒的过程中发挥着重要作用[26-29], 其在植物应对缺磷胁迫中所起的作用也逐渐受到关注。早在1965年, Hsu[30]就发现, 细胞壁能通过吸附Al3+/Fe3+进而吸附土壤中的磷, 将磷以诸如Al(OH)2H2PO4的形式结合于细胞壁上。根据Ae等[31]的报道, 与高粱和大豆等作物相比, 花生能从低磷土壤中吸收更多的磷。而这种能力的差异, 无法用根系的构型变化或根系分泌物的产生来解释。进一步研究发现, 花生和开花前的木豆, 其根系细胞壁表现出更高的难溶态磷溶解活性, 为高粱和大豆的两倍, 而这或许是它们能从低磷土壤中吸收更多磷的原因。由于这种新的土壤磷活化机制, 发生在根系与土壤颗粒的交界面, 而被称为“接触反应(Contact reaction)”[32]。Zhu等[11]通过体外实验证明, 细胞壁中的果胶组分可通过吸附FePO4中的Fe3+, 使部分PO43-游离出来, 从而活化难溶态磷。本次实验进一步表明, 果胶活化难溶态磷的能力与其甲酯化度有关。由图 3可知, 随着甲酯化度的降低, 果胶从FePO4中释放出的Pi显著增加。
除此之外, 植物的细胞壁组分还参与了根系中内源磷的再利用过程。Zhu等[11]的研究发现, 与水稻品种Kas相比, Nip体内磷的可利用水平较高。在缺磷处理5周后, Nip根系中的可溶性磷含量仍高于Kas, 而这可能与细胞壁磷的释放有关。本文也将这两个品种进行了一周的缺磷处理, 测定了水稻体内可溶性磷含量的动态变化。在缺磷胁迫下, 水稻体内的可溶性磷含量迅速下降, 而Nip根系和地上部中的可溶性磷含量均一直高于Kas(图 1B)。此外, 在缺磷处理7 d后, Nip和Kas的细胞壁磷均显著降低至同一水平(图 2), 但Nip在此期间释放出了83%的细胞壁磷, 而籼稻Kas仅释放出了76%的细胞壁磷, 说明粳稻Nip的内源磷再利用水平更高。
Zhu等[11]通过对缺磷处理后多个品种的回归分析表明, 水稻根系中可溶性磷含量与其根系细胞壁中果胶含量之间成正相关关系, 而与其中的半纤维素及纤维素含量无关。最近的研究还发现, 植物激素乙烯及信号分子NO、H2S均可通过提高水稻根系细胞壁中的果胶含量以及果胶甲酯酶的活性来提高细胞壁磷的释放, 从而增加缺磷条件下水稻体内的可溶性磷含量[33-36]。植物细胞壁中的果胶组分主要在高尔基体中形成, 此时形成的果胶因为高度的甲酯化而带有少量的负电荷, 因此, 与阳离子的结合能力较弱[16]。高度甲酯化的果胶经过分泌进入细胞壁后, 在果胶甲酯酶的催化下将甲酯基水解, 暴露出了其中的羧基(-COOH), 从而增加了对细胞壁中阳离子(如FePO4中的Fe3+)的吸附, 使得与之结合的PO43-释放出来, 供植物再利用。在缺磷处理后, 粳稻Nip根系中的PME活性升高了31%(P < 0.05, 图 5), 维持了较低的果胶甲酯化度(图 4), 即是维持了较高的难溶态磷活化能力, 从而释放出了更多的细胞壁磷(图 2)。而缺磷胁迫下的籼稻Kas, 其根系中的PME活性却未发生显著变化(图 5), 从而不能将果胶有效地去甲酯化, 进而导致细胞壁中果胶甲酯化度升高了25%(P < 0.05, 图 4), 使其活化难溶态磷的能力降低。
4 结论缺磷处理后, 水稻体内的可溶性磷含量迅速降低, 而与根系相比, 地上部的下降趋势明显滞后。缺磷胁迫下, Nip根系和地上部中可溶性磷含量均一直高于Kas, 而直到缺磷7 d后, Nip根系和地上部中可溶性磷含量均仍显著高于Kas。此外, 在缺磷处理后, Nip和Kas的细胞壁磷均显著降低, 但Nip释放出了更多的细胞壁磷。说明Nip的内源磷再利用水平高于Kas。进一步的体外解析实验表明, 低甲酯化度的果胶具有更强的活化难溶态磷的能力。而与同在缺磷条件下的Kas相比, Nip可以通过提高其根系中的PME活性, 来维持其细胞壁中的果胶甲酯化度处于相对较低水平, 即是维持了较高的难溶态磷活化能力, 从而将细胞壁磷更多地转化为可溶性磷。
| [1] |
Kamerlin S C L, Sharma P K, Prasad R B, et al. Why nature really chose phosphate . Quarterly Reviews of Biophysics, 2013, 46(1): 1-132. DOI:10.1017/S0033583512000157
(  0) 0) |
| [2] |
Gong Y, Guo Z, He L, et al. Identification of maize genotypes with high tolerance or sensitivity to phosphorus deficiency . Journal of Plant Nutrition, 2011, 34(9/11): 1290-1302.
(  0) 0) |
| [3] |
Kochian L V. Plant nutrition rooting for more phosphorus . Nature, 2012, 488(7412): 466-467. DOI:10.1038/488466a
(  0) 0) |
| [4] |
Wang X, Shen J, Liao H. Acquisition or utilization, which is more critical for enhancing phosphorus efficiency in modern crops? . Plant Science, 2010, 179(4): 302-306. DOI:10.1016/j.plantsci.2010.06.007
(  0) 0) |
| [5] |
Wu P, Ma L G, Hou X L, et al. Phosphate starvation triggers distinct alterations of genome expression in arabidopsis roots and leaves . Plant Physiology, 2003, 132(3): 1260-1271. DOI:10.1104/pp.103.021022
(  0) 0) |
| [6] |
Hinsinger P. Bioavailability of soil inorganic p in the rhizosphere as affected by root-induced chemical changes:A review . Plant and Soil, 2001, 237(2): 173-195. DOI:10.1023/A:1013351617532
(  0) 0) |
| [7] |
Graham J H, Eissenstat D M. Host genotype and the formation and function of va mycorrhizae . Plant and Soil, 1994, 159(1): 179-185. DOI:10.1007/BF00000107
(  0) 0) |
| [8] |
Yu B, Xu C C, Benning C. Arabidopsis disrupted in SQD2 encoding sulfolipid synthase is impaired in phosphate-limited growth . Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(8): 5732-5737. DOI:10.1073/pnas.082696499
(  0) 0) |
| [9] |
Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use:Critical adaptations by plants for securing a nonrenewable resource . New Phytologist, 2003, 157(3): 423-447. DOI:10.1046/j.1469-8137.2003.00695.x
(  0) 0) |
| [10] |
Zhu X F, Lei G J, Jiang T, et al. Cell wall polysaccharides are involved in p-deficiency-induced Cd exclusion in Arabidopsis thaliana . Planta, 2012, 236(4): 989-997. DOI:10.1007/s00425-012-1652-8
(  0) 0) |
| [11] |
Zhu X F, Wang Z W, Wan J X, et al. Pectin enhances rice(Oryza sativa)root phosphorus remobilization . Journal of Experimental Botany, 2015, 66(3): 1017-1024. DOI:10.1093/jxb/eru461
(  0) 0) |
| [12] |
Yang J L, Li Y Y, Zhang Y J, et al. Cell wall polysaccharides are specifically involved in the exclusion of aluminum from the rice root apex . Plant Physiology, 2008, 146(2): 602-611.
(  0) 0) |
| [13] |
Zhu X F, Shi Y Z, Lei G J, et al. XTH31, encoding an in vitro XEH/XET-active enzyme, regulates aluminum sensitivity by modulating in vivo XET action, cell wall xyloglucan content, and aluminum binding capacity in Arabidopsis . Plant Cell, 2012, 24(11): 4731-4747. DOI:10.1105/tpc.112.106039
(  0) 0) |
| [14] |
Cosgrove D J. Growth of the plant cell wall . Nature Reviews Molecular Cell Biology, 2005, 6(11): 850-861. DOI:10.1038/nrm1746
(  0) 0) |
| [15] |
O'Neill M A, Eberhard S, Albersheim P, et al. Requirement of borate cross-linking of cell wall rhamnogalacturonan ii for Arabidopsis growth . Science, 2001, 294(5543): 846-849. DOI:10.1126/science.1062319
(  0) 0) |
| [16] |
Micheli F. Pectin methylesterases:Cell wall enzymes with important roles in plant physiology . Trends in Plant Science, 2001, 6(9): 414-419. DOI:10.1016/S1360-1385(01)02045-3
(  0) 0) |
| [17] |
Moustacas A M, Nari J, Borel M, et al. Pectin methylesterase, metalions and plant cell-wall extension . The role of metalions in plant cell-wall extension. Biochemical Journal, 1991, 279: 351-354.
(  0) 0) |
| [18] |
Delhaize E, Randall P J. Characterization of a phosphate-accumulator mutant of Arabidopsis thaliana . Plant Physiology, 1995, 107(1): 207-213. DOI:10.1104/pp.107.1.207
(  0) 0) |
| [19] |
Zhong H L, Lauchli A. Changes of cell-wall composition and polymer size in primary roots of cotton seedlings under high salinity . Journal of Experimental Botany, 1993, 44(261): 773-778.
(  0) 0) |
| [20] |
Yang J L, Zhu X F, Peng Y X, et al. Cell wall hemicellulose contributes significantly to aluminum adsorption and root growth in arabidopsis . Plant Physiology, 2011, 155(4): 1885-1892. DOI:10.1104/pp.111.172221
(  0) 0) |
| [21] |
Blumenkrantz N, Asboehanse G. New method for quantitative-determination of uronic acids . Analytical Biochemistry, 1973, 54(2): 484-489.
(  0) 0) |
| [22] |
Klavons J A, Bennett R D. Determination of methanol using alcohol oxidase and its application to methyl-ester content of pectins . Journal of Agricultural and Food Chemistry, 1986, 34(4): 597-599. DOI:10.1021/jf00070a004
(  0) 0) |
| [23] |
Ren C W, Kermode A R. An increase in pectin methyl esterase activity accompanies dormancy breakage and germination of yellow cedar seeds . Plant Physiology, 2000, 124(1): 231-242. DOI:10.1104/pp.124.1.231
(  0) 0) |
| [24] |
Yang X Y, Zeng Z H, Yan J Y, et al. Association of specific pectin methylesterases with Al-induced root elongation inhibition in rice . Physiologia Plantarum, 2013, 148(4): 502-511. DOI:10.1111/ppl.12005
(  0) 0) |
| [25] |
Anthon G E, Barrett D M. Comparison of three colorimetric reagents in the determination of methanol with alcohol oxidase. Application to the assay of pectin methylesterase . Journal of Agricultural and Food Chemistry, 2004, 52(12): 3749-3753. DOI:10.1021/jf035284w
(  0) 0) |
| [26] |
Zhu X F, Lei G J, Wang Z W, et al. Coordination between apoplastic and symplastic detoxification confers plant aluminum resistance . Plant Physiology, 2013, 162(4): 1947-1955. DOI:10.1104/pp.113.219147
(  0) 0) |
| [27] |
Zhu X F, Wang Z W, Dong F, et al. Exogenous auxin alleviates cadmium toxicity in Arabidopsis thaliana by stimulating synthesis of hemicellulose 1 and increasing the cadmium fixation capacity of root cell walls . Journal of Hazardous Materials, 2013, 263: 398-403. DOI:10.1016/j.jhazmat.2013.09.018
(  0) 0) |
| [28] |
王斌, 张慧玲, 朱晓芳, 等. 水稻品种间铝耐性差异的探究. 土壤学报, 2017, 54(4): 958-966. Wang B, Zhang H L, Zhu X F, et al. Differences in aluminium tolerance between rice varieties (In Chinese). Acta Pedologica Sinica, 2017, 54(4): 958-966. (  0) 0) |
| [29] |
胡振民, 赵学强, 王超, 等. 细胞壁组分在红酵母RS1高耐铝中的作用研究. 土壤, 2017, 49(2): 256-260. Hu Z M, Zhao X Q, Wang C, et al. Role of cell wall components in high aluminum tolerance of Rhodotorula taiwanensis RS1 (In Chinese). Soils, 2017, 49(2): 256-260. (  0) 0) |
| [30] |
Hsu P H. Fixation of phosphate by aluminum and iron in acidic soils . Soil Science, 1965, 99(6): 398-402. DOI:10.1097/00010694-196506000-00008
(  0) 0) |
| [31] |
Ae N, Otani T, Makino T, et al. Role of cell wall of groundnut roots in solubilizing sparingly soluble phosphorus in soil . Plant and Soil, 1996, 186(2): 197-204. DOI:10.1007/BF02415514
(  0) 0) |
| [32] |
Ae N, Shen R F. Root cell-wall properties are proposed to contribute to phosphorus(P)mobilization by groundnut and pigeonpea . Plant and Soil, 2002, 245(1): 95-103. DOI:10.1023/A:1020669326602
(  0) 0) |
| [33] |
Zhu C Q, Zhu X F, Hu A Y, et al. Differential effects of nitrogen forms on cell wall phosphorus remobilization are mediated by nitric oxide, pectin content, and phosphate transporter expression . Plant Physiology, 2016, 171(2): 1407-1417.
(  0) 0) |
| [34] |
Zhu X F, Zhu C Q, Wang C, et al. Nitric oxide acts upstream of ethylene in cell wall phosphorus reutilization in phosphorus-deficient rice . Journal of Experimental Botany, 2017, 68(3): 753-760.
(  0) 0) |
| [35] |
Zhu X F, Zhu C Q, Zhao X S, et al. Ethylene is involved in root phosphorus remobilization in rice(Oryza sativa)by regulating cell-wall pectin and enhancing phosphate translocation to shoots . Annals of Botany, 2016, 118(4): 645-653. DOI:10.1093/aob/mcw044
(  0) 0) |
| [36] |
朱春权, 朱晓芳, 沈仁芳. 硫化氢促进缺磷条件下水稻根系细胞壁磷的再利用. 土壤, 2018, 50(1): 51-58. Zhu C Q, Zhu X F, Shen R F. Hydrogen sulfide promote rice(Oryza sativa)cell wall P remobilization under P starvation condition (In Chinese). Soils, 2018, 50(1): 51-58. (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2018, Vol. 55
2018, Vol. 55


