土壤微生物是土壤生态系统中最为活跃的部分,对生态系统的功能及其可持续性发挥着重要作用[1-2]。其中土壤细菌种类繁多,数量最多,约占土壤微生物总量的70%~90%[3],它直接或间接参与土壤生物化学循环,如分解与合成有机物质,土壤结构及腐殖质的形成等[4]。近年来,研究土壤微生物多样性的方法越来越多,基于16S rRNA分子生物技术能够快速、简便地获取包括土壤中可培养和未培养微生物的大部分信息,目前已被广泛地应用于土壤微生物遗传多样性的研究[5]。董立国等[6]研究发现,免耕秸秆覆盖的土壤细菌群落丰富度指数和多样性指数均显著高于传统耕作;林云红等[7]研究表明,随着小麦秸秆覆盖量的增加土壤细菌数量呈递增的趋势,且显著高于无覆盖处理。但也有研究表明,免耕和秸秆覆盖并未影响土壤细菌群落结构和多样性[8-9],这些差异可能是因研究区域、免耕和秸秆覆盖时间长短等不同引起。然而,关于长期不同耕作措施对陇中旱农区土壤性状的影响,以往研究主要集中在土壤肥力[10]、团聚体[11]、有机碳[12]等方面,而在分子水平上,尤其是利用16S rRNA基因测序技术分析长期不同耕作措施土壤细菌群落构成和多样性的研究鲜见报道[13]。因此,本研究应用高通量测序方法,对长期不同耕作措施下黄绵土土壤中细菌群落构成、物种丰度、物种多样性进行研究,以揭示不同耕作措施下土壤细菌群落组成与结构的差异,为保护农田土壤生态系统的提供合理了理论支撑。
1 材料与方法 1.1 研究区概况本研究于2016年在位于甘肃省定西市李家堡镇的甘肃农业大学旱作农业综合实验站进行,所依托田间定位试验始于2001年。该区属中温带半干旱偏旱区,太阳辐射量为592.9 kJ·cm-2,多年平均日照时数2 477 h;年均气温6.4℃,≥0℃积温为2 934℃,≥10℃积温为2 239℃,年均无霜期140 d;多年平均降水量391 mm,年蒸发量1 531 mm,为典型的一年一熟雨养农业区。试区土壤为典型黄绵土,土层深厚,土质较绵软质地较均匀,贮水性能良好。2001年和2016年豌豆地土壤主要理化特性见表 1。
|
|
表 1 研究区土壤主要理化特性 Table 1 Physical and chemical properties of the soil in the studied area |
试验采用春小麦和豌豆双序列轮作方式(豌豆-小麦、小麦-豌豆)。各序列分别设4个处理(表 2),3次重复,小区面积80 m2(4 m×20 m),随机区组排列。
|
|
表 2 试验处理及代码描述 Table 2 Description and code of the tillage treatments in the experiment |
春小麦播量187.5 kg·hm-2;豌豆播量100 kg·hm-2。麦行距20 cm,豌豆行距24 cm,播深均为7 cm。春小麦播期为每年3月中旬,7月下旬至8月上旬期间收获;豌豆于4月上旬播种,7月中下旬收获。小麦各处理均施氮105 kg·hm-2,P2O5105 kg·hm-2;豌豆各处理均施氮20 kg·hm-2,P2O5105 kg·hm-2,播种时作基肥混施。试验春小麦品种为“定西40号”,豌豆品种为“绿农2号”。
1.3 样品采集与分析土壤样品采集于2016年4月豌豆地,对角线五点法采集每个小区0~10 cm、10~30 cm土样,分层混匀后除去根系等杂物,各小区各层次土样(共24个土样)的一部分在田间立刻存入干冰箱带回实验室-80℃保存,用于分析土壤细菌群落结构;另一部分带回实验室,4℃保存,用于测定土壤有机碳(SOC)、土壤全氮(TN)、土壤微生物生物量碳(SMBC)、土壤微生物生物量氮(SMBN)。
SOC采用K2Cr2O7 -H2SO4氧化外加热法测定[14]。土壤全氮(TN)采用半微量开氏法测定[14]。SMBC、SMBN采用新鲜土样氯仿熏蒸法测定[15],0.5 mol·L-1 K2SO4提取,提取液用碳氮联合分析仪(Multi C/N 2100S德国耶拿)测定。
土壤微生物DNA提取采用美国(MOBIO Power Soil DNA Isolation Kit)强力土壤DNA提取试剂盒。按照试剂盒说明书进行。用0.7%琼脂糖凝胶电泳对土壤DNA的完整性进行检测。
土壤细菌16S rRNA基因V4-V5可变区PCR扩增以提取的土壤微生物DNA为模板,515F (5′ -ACTCCTACGGGAGGCAGCA-3′)和806(5′ -GGAC-TACHVGGGTWTCTAAT-3′)为引物,PCR扩增细菌16S rRNA基因序列的V4-V5区。PCR扩增程序:95 ℃5 min,95 ℃1 min,55 ℃ 1 min,72 ℃ 30 s,15个循环;72 ℃延伸7 min。PCR产物经1.8%琼脂糖凝胶电泳检测后,对16S rRNA基因序列V4-V5区通过Illumina Hiseq平台进行Paired-end测序。
1.4 数据处理与分析Paired-end测序得到的PE Reads首先根据overlap关系拼接应用软件Qiime和Mothur对连接上的序列进行过滤和去除嵌合体[16-17],然后对优质序列在相似性≥97%的水平上进行OTU (Operation taxonomic unit)聚类,并利用Greengene数据库[18]进行物种注释。采用Mothur软件计算细菌群落丰度指数(Observed species指数和Chao指数)和多样性指数(香农指数和辛普森指数),测序深度用Good-coverage指数表示; 应用R软件对OTU丰度进行主成分分析(PCA)并制图,利用SPSS 19进行方差分析及相关性分析。土壤微生物总DNA的提取、测序委托南京集思慧远生物科技有限公司完成。
2 结果 2.1 不同耕作措施对相关土壤理化性状的影响由表 3可知,秸秆覆盖效应对0~30 cm土层土壤有机碳(SOC)、微生物生物量碳(SMBC)、土壤全氮(TN)和微生物生物量氮(SMBN)含量的影响达到极显著和显著水平,耕作效应仅对10~30 cm土层的SMBC和0~30 cm土层SMBN含量影响达到显著水平,耕作、秸秆覆盖二者的互作效应对SOC、TN、SMBC和SMBN含量的影响不显著。同时,在0~10 cm土层中,各处理间SOC、SMBC、TN、SMBN含量呈现NTS处理最大,T、NT处理最小,NTS与T、NT处理差异显著,与TS差异不显著,NTS处理下SOC、SMBC、TN、SMBN含量较T处理分别提高28.27%、114.16%、13.51%,49.14%;10~30 cm土层SOC、SMBC、TN、SMBN含量同样NTS处理最高,T处理最低,NTS处理下SOC、SMBC、TN、SMBN含量较T处理分别提高39.86%、98.05%、10.78%、40.72%。
|
|
表 3 耕作措施对0~30 cm土层土壤理化性状的影响 Table 3 Effects of tillage practices on physical and chemical properties of the soil in the 0~30 cm soil layer |
Observed species指数和Chao指数反映样品中群落的丰度,其值越大表明群落物种的丰富度越高。香农指数和辛普森指数表示细菌群落多样性程度,香农指数和辛普森指数越大,说明群落多样性越高。
不同耕作措施对0~30 cm土壤细菌群落的丰度和多样性的影响(表 4),由表可知,10~30 cm土壤细菌丰度指数和多样性指数大于0~10 cm土壤细菌群落多样性指数,且秸秆覆盖效应对0~30 cm土壤细菌群落丰度和多样性影响大于耕作效应,互助效应不显著。同时,0~10 cm土壤细菌丰度指数(Observed species指数、Chao指数)和多样性指数(香农指数和辛普森指数)NTS最高,T或NT最低且NTS、TS与NT、T差异显著。10~30 cm土壤细菌群落的丰度和多样性指数大小也表现相同趋势,即NTS最大,TS次之,NT、T最小。表明秸秆覆盖能不同程度提高0~30 cm土壤细菌群落的丰度和多样性,尤其是免耕秸秆覆盖效果最佳。
|
|
表 4 不同耕作措施下0~30 cm土壤细菌丰度指数和多样性指数 Table 4 Bacterial abundance index and diversity index of 0~30 cm soil under different tillage practices |
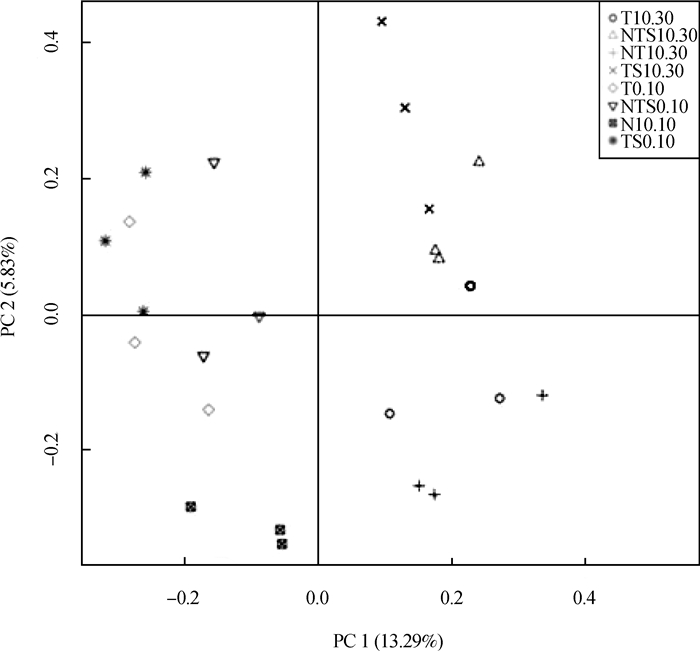
不同耕作措施对0~30 cm土壤细菌OTU丰度影响如(图 1)。主成分PC1和主成分PC2的样品差异性贡献率分别为13.29%和5.83%,合计达19.12%,是差异的主要来源。以这2个主成分为坐标轴构建的二维坐标系中,各处理在主成分分析图上分布差异显著。0~10 cm土层中,NTS、TS处理距离较近,位于PC1负值区域和PC2的正负两侧,NT、T处理位于PC1负值区域和PC2的正负两侧。10~30 cm土层NTS、TS和NT、T处理分布明显,NTS、TS位于PC1和PC2正值区域,NT、T位于PC1正值区域和PC2负值区域。这一结果表明,秸秆还田处理使0~30 cm土壤细菌群落分布与丰度发生显著变化。
|
图 1 不同耕作措施下0~30 cm土壤细菌OTU主成分分析 Fig. 1 Principal component analysis of soil bacterial OTU in the 30 cm soil layer relative to tillage practice |
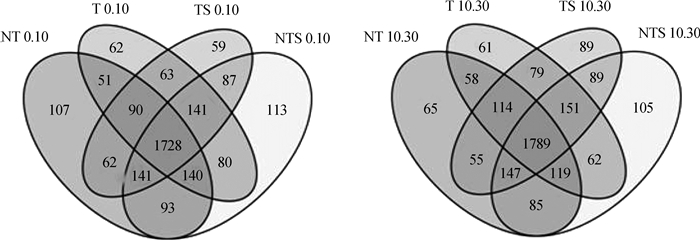
如图 2所示,不同耕作措施对0~30 cm土层土壤细菌OTU具有明显影响。0~10 cm土层中,T、NT、TS、NTS处理OTU分别为2 355、2 271、2 371、2 523,特有OTU为62、107、59、113,它们共同包含OTU为1 728。10~30 cm土层也是NTS处理OTU最多,为2547个;NT最少,为2 432。T、NT、TS、NTS处理特有OTU分别为61、65、89、105,它们共同包含OTU数为1 789。表明免耕秸秆覆盖有利于增加土壤细菌类群。
|
图 2 不同耕作措施下0~30 cm土壤细菌OTU韦恩图 Fig. 2 Soil bacterial OTU Venn diagram of the soil in the 0~30 cm soil layer relative to tillage practice |
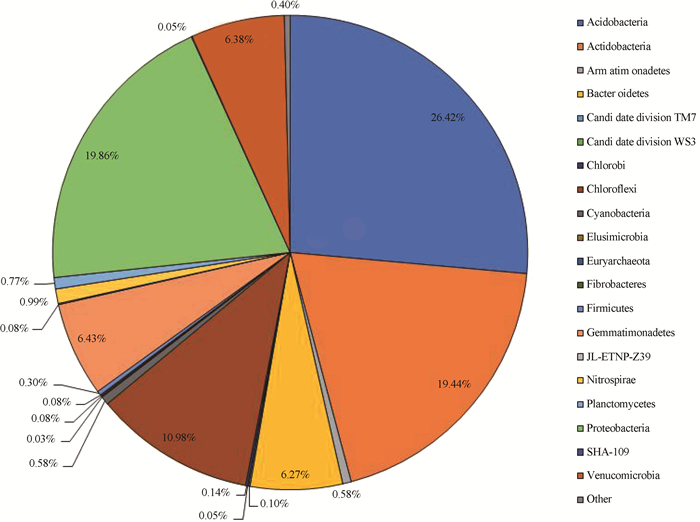
不同耕作措施下0~30 cm土壤样品高通量测序共获得20个门和未确定类群(图 3),其中主要优势类群为酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),分别占平均比率为26.42%、19.86%和19.44%,其次是绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)和拟杆菌门(Bacteroidetes),分别为10.98%、6.43%、6.38%和6.27%,剩余菌门占有比例相对较小,均小于1.0%,未被分类的细菌占0.4%。
|
图 3 门分类水平上土壤细菌群落分布比例 Fig. 3 Proportion of soil bacterial community distribution at the phylum level |
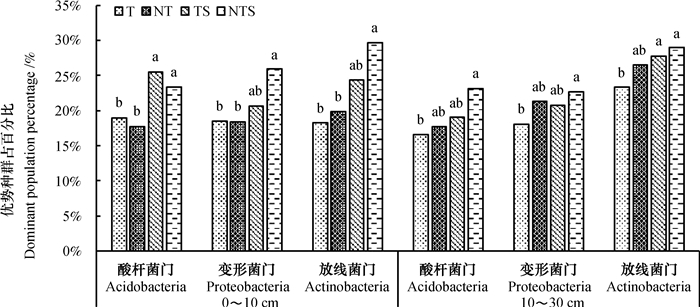
不同耕作措施对0~30 cm土壤细菌主要优势种群(酸杆菌门、变形菌门、放线菌门)结构与分布具有显著影响(图 4)。如图所示,在0~10 cm土层中,各处理中变形菌门所占百分比大小为:TS > NTS > T > NT,TS与NT、T处理差异显著,与NTS差异不显著,放线菌门、酸杆菌门在各处理中所占比例表现:NTS > TS > NT > T,NTS与NT、T处理差异显著,与TS处理差异不显著;不同耕作措施对10~30 cm土层中,变形菌门、放线菌门、酸杆菌门的影响与0~10 cm土层的影响基本一致,也表现为NTS处理最高,T最低,NTS与T处理差异显著。表明免耕秸秆覆盖显著提高了0~30 cm土层土壤细菌主要优势种群的丰度。
|
图 4 不同耕作措施下土壤细菌优势种群结构与分布 Fig. 4 Community structure and distribution of the dominant groups of soil bacteria relative to tillage practice |
将以上各层次3种优势种群所占比加权求和后分别得到0~30 cm土层中酸杆菌门、变形菌门、放线菌门所占百分比大小均表现为:NTS > TS > NT > T,其中NTS处理土壤细菌优势种群酸杆菌门、变形菌门、放线菌门较T处理分别提高35.11%、33.77%、30.17%,且差异达到显著水平。
2.6 土壤相关理化性质与细菌群落多样性间的相关关系分析不同耕作措施下土壤理化性质与细菌多样性指数的相关性(表 5),结果表明SOC、SMBN含量分别与Observed species指数、Chao指数和辛普森指数呈极显著和显著正相关,TN、SMBN含量与Observed species指数和香农指数呈显著正相关,表明提高土壤有机碳(SOC)、微生物生物量碳(SMBC)、土壤全氮(TN)和微生物生物量氮(SMBN)含量有利于土壤细菌群落的丰度与多样性提升。
|
|
表 5 土壤相关理化性质与细菌群落多样性相关性分析 Table 5 Correlation analysis of soil physical and chemical properties and bacterial community diversity |
土壤有机碳、微生物量碳、土壤全氮和微生物量氮是影响土壤肥力的重要因子[19],本研究结果表明,秸秆还田(NTS、TS)相比传统耕作有利于土壤有机碳、微生物量碳、土壤全氮和微生物量氮的累积。庞绪等[20]研究也表明免耕和秸秆还田能提高土壤表层有机碳和微生物生物量碳氮含量,这与本研究结果类似。其原因可能是保护性耕作减少了对农田土壤的翻动,从而避免深层土壤与空气接触的机会,减少了土壤有机质的氧化和矿化[21],而且秸秆还田增加了有机物质的输入,促进了土壤微生物的活动,使更多的秸秆分解转化为土壤有机质,从而提高了土壤中有机碳、全氮和微生物量碳氮的含量[22]。
3.2 耕作措施对土壤细菌群落构成的影响从OTU聚类Venn图中看出,相对于传统耕作,秸秆覆盖处理不仅提高了0~10、10~30 cm土壤细菌群落的丰度和多样性,且特有细菌类群也相对较高,其中尤以免耕秸秆覆盖最为突出;同时酸杆菌门、变形菌门和放线菌门为陇中黄土高原区麦豆轮作系统土壤细菌的主要优势种群,免耕秸秆覆盖处理下酸杆菌门、放线菌门和变形菌门丰度较传统耕作分别提高35.11%、33.77%和30.17%。其原因是秸秆还田为微生物的生长活动提供必要的能源和营养物质,刺激了土壤中微生物的活性[23],从而加快土壤中微生物的自身物质合成,并利用外源养分进行新陈代谢。同时,秸秆还田有利于土壤有机碳、土壤微生物生物量碳的累积,改善了土壤物理性状[24],有利于维持土壤微生物的多样性及活性的提高。
多样性指数是评价土壤微生物群落丰富度和多样性的重要指标,高的多样性指数表明高的微生物群落丰富度和多样性[25]。本研究结果表明,秸秆还田处理(NTS、TS)下土壤细菌丰富度和多样性指数(Observed species指数、Chao指数、香农指数、辛普森指数)均大于单纯的免耕和传统耕作,且达到差异显著水平,同时10~30 cm土壤细菌群落丰富度和多样性高于0~10 cm。这与Dick[26]传统耕作降低土壤细菌群落的多样性及袁铭章等[27]土壤长期施入秸秆可提升土壤细菌群落多样性及物种丰富度的结果相一致。可能是秸秆还田后为土壤微生物生命活动提供了有机能源[28],改善了土壤微生物生存的生态因素,增加土壤微生物的数量[29]。此外,传统耕作频繁的翻动土壤,造成土壤结构恶化,对土壤微生物动力学有负面影响,从而显著降低细菌的丰富度和多样性[30]。
4 结论相对于传统耕作,保护性耕作中秸秆还田不仅显著增加了0~30 cm土层土壤有机碳、全氮含量,也为微生物生命活动输入了更多的碳源和氮源,提高了土壤微生物量碳和微生物量氮,进而提高了0~10 cm、10~30 cm土层土壤细菌丰富度指数和多样性指数。同时,免耕秸秆覆盖下土壤细菌优势种群酸杆菌、门变形菌门、放线菌门丰度较传统耕作显著提高。因此,在陇中旱农区推广以免耕秸秆覆盖为主的保护性耕作措施有利于增加土壤碳氮固存、提高土壤细菌群落丰度和多样性和土壤的生物活性,促进农业的可持续发展。
| [1] |
Brussaard L, Ruiter P C D, Brown G G. Soil biodiversity for agricultural sustainability . Agriculture Ecosystems & Environment, 2007, 121(3): 233-244.
(  0) 0) |
| [2] |
Heijden M G A V D, Wagg C. Soil microbial diversity and agro-ecosystem functioning . Plant and Soil, 2013, 363(1/2): 1-5.
(  0) 0) |
| [3] |
王岳坤, 洪葵. 红树林土壤细菌群落16S rDNA V3片段PCR产物的DGGE分析. 微生物学报, 2005, 45(2): 201-204. Wang Y K, Hong K. Mangrove soil community analysis using DGGE of 16S rDNA V3 fragment polymerase chain reaction products (In Chinese). Acta Microbiologica Sinica, 2005, 45(2): 201-204. DOI:10.3321/j.issn:0001-6209.2005.02.009 (  0) 0) |
| [4] |
Kulmatiski A, Beard K H, Stevens J R, et al. Plant–soil feedbacks:A meta-analytical review . Ecology Letters, 2008, 11(9): 980-992. DOI:10.1111/ele.2008.11.issue-9
(  0) 0) |
| [5] |
Edgar R C. UPARSE:Highly accurate OTU sequences from microbial amplicon reads . Nature Methods, 2013. DOI:10.1038/nmeth.2604
(  0) 0) |
| [6] |
董立国, 袁汉民, 李生宝, 等. 玉米免耕秸秆覆盖对土壤微生物群落功能多样性的影响. 生态环境学报, 2010, 19(2): 444-446. Dong L G, Yuan H M, Li S B, et al. Influence on soil microbial community functional diversity for maize no-tillage with straw mulch (In Chinese). Ecology and Environmental Sciences, 2010, 19(2): 444-446. DOI:10.3969/j.issn.1674-5906.2010.02.036 (  0) 0) |
| [7] |
林云红, 查永丽, 毛昆明, 等. 小麦秸秆覆盖量对不同植烟土壤微生物数量的影响. 作物研究, 2012, 26(6): 664-667. Lin Y H, Zha Y L, Mao K M, et al. Effects of wheat straw mulching amount on the quantity of microorganisms in different tobacco planting soil (In Chinese). Crop Research, 2012, 26(6): 664-667. DOI:10.3969/j.issn.1001-5280.2012.06.12 (  0) 0) |
| [8] |
Petersen S O, Frohne P S, Kennedy A C. Dynamics of a soil microbial community under spring wheat . Soil Science Society of America Journal, 2002, 66(3): 826-833. DOI:10.2136/sssaj2002.8260
(  0) 0) |
| [9] |
Spedding T A, Hamel C, Mehuys G R, et al. Soil microbial dynamics in maize-growing soil under different tillage and residue management systems . Soil Biology & Biochemistry, 2004, 36(3): 499-512.
(  0) 0) |
| [10] |
罗珠珠, 黄高宝, 张仁陟, 等. 长期保护性耕作对黄土高原旱地土壤肥力质量的影响. 中国生态农业学报, 2010, 18(3): 458-464. Luo Z Z, Huang G B, Zhang R Z, et al. Effect of long-term conservation tillage on soil fertility in rain-fed areas of the Loess Plateau (In Chinese). Chinese Journal of Eco-Agriculture, 2010, 18(3): 458-464. (  0) 0) |
| [11] |
武均, 蔡立群, 罗珠珠, 等. 保护性耕作对陇中黄土高原雨养农田土壤物理性状的影响. 水土保持学报, 2014, 28(2): 112-117. Wu J, Cai L Q, Luo Z Z, et al. Effect of conservation tillage on soil physical properties of rainfed of the Loess Plateau in central of Gansu (In Chinese). Journal of Soil and Water Conservation, 2014, 28(2): 112-117. (  0) 0) |
| [12] |
王琳, 李玲玲, 高立峰, 等. 长期保护性耕作对黄绵土总有机碳和易氧化有机碳动态的影响. 中国生态农业学报, 2013, 21(9): 1057-1063. Wang L, Li L L, Gao L F, et al. Effect of long-term conservation tillage on total organic carbon and readily oxidizable organic carbon in loess soils (In Chinese). Chinese Journal of Eco-Agriculture, 2013, 21(9): 1057-1063. (  0) 0) |
| [13] |
何玉梅, 张仁陟, 张丽华, 等. 不同耕作措施对土壤真菌群落结构与生态特征的影响. 生态学报, 2007, 27(1): 113-119. He Y M, Zhang R Z, Zhang L H, et al. Effects of different tillage practices on fungi community structure and ecologic characteristics in loess soils (In Chinese). Acta Ecologica Sinica, 2007, 27(1): 113-119. (  0) 0) |
| [14] |
鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科学技术出版社, 2000. Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. (  0) 0) |
| [15] |
Wu J, Joergensen R G, Pommerening B, et al. Measurement of soil microbial biomass C by fumigation-extraction-An automated procedure . Soil Biology & Biochemistry, 1990, 22(8): 1167-1169.
(  0) 0) |
| [16] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data . Nature Methods, 2010. DOI:10.1038/nmeth.f.303
(  0) 0) |
| [17] |
Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur:Open-source, platform-independent, community-supported software for describing and comparing microbial communities . Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09
(  0) 0) |
| [18] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools . Nucleic Acids Research, 2013, 41(D1): D590-D596.
(  0) 0) |
| [19] |
邱建军, 王立刚, 李虎, 等. 农田土壤有机碳含量对作物产量影响的模拟研究. 中国农业科学, 2009, 42(1): 154-161. Qiu J J, Wang L G, Li H, et al. Modeling the impacts of soil organic carbon content of croplands on crop yields (In Chinese). Scientia Agricultura Sinica, 2009, 42(1): 154-161. DOI:10.3864/j.issn.0578-1752.2009.01.019 (  0) 0) |
| [20] |
庞绪, 何文清, 严昌荣, 等. 耕作措施对土壤水热特性和微生物生物量碳的影响. 生态学报, 2013, 33(4): 1308-1316. Pang X, He W Q, Yan C R, et al. Effect of tillage and residue management on dynamic of soil microbial biomass carbon (In Chinese). Acta Ecologica Sinica, 2013, 33(4): 1308-1316. (  0) 0) |
| [21] |
王燕, 王小彬, 刘爽, 等. 保护性耕作及其对土壤有机碳的影响. 中国生态农业学报, 2008, 16(3): 766-771. Wang Y, Wang X B, Liu S, et al. Conservation tillage and its effect on soil organic carbon (In Chinese). Chinese Journal of Eco-Agriculture, 2008, 16(3): 766-771. (  0) 0) |
| [22] |
苏永中, 赵哈林. 土壤有机碳储量、影响因素及其环境效应的研究进展. 中国沙漠, 2002, 22(3): 220-228. Su Y Z, Zhao H L. Advances in research on soil organic carbon storage, affecting factors and its environmental effects (In Chinese). Journal of Desert Research, 2002, 22(3): 220-228. DOI:10.3321/j.issn:1000-694X.2002.03.004 (  0) 0) |
| [23] |
郑有飞, 石春红, 吴芳芳, 等. 土壤微生物活性影响因子的研究进展. 土壤通报, 2009, 40(5): 1209-1214. Zheng Y F, Shi C H, Wu F F, et al. Research advances on the factors influencing the activity of soil microorganism (In Chinese). Chinese Journal of Soil Science, 2009, 40(5): 1209-1214. (  0) 0) |
| [24] |
Debosz K, Rasmussen P H, Pedersen A R. "Corrigendum to "Temporal variations in microbial biomass C and cellulolytic enzyme activity in arable soils: Effects of organic matter input" : [App. Soil Ecol. 13(1999)209–218]. " Applied Soil Ecology, 2000, 14(1): 81-82
(  0) 0) |
| [25] |
李玉洁, 李刚, 宋晓龙, 等. 休牧对贝加尔针茅草原土壤微生物群落功能多样性的影响. 草业学报, 2013, 22(6): 21-30. Li Y J, Li G, Song X L, et al. Effect of rest-grazing on soil microbial community functional diversity in Stipa baicalensis steppe (In Chinese). Acta Prataculturae Sinica, 2013, 22(6): 21-30. (  0) 0) |
| [26] |
Dick R P. Long-term effects of agricultural systems on soil biochemical and microbial parameters . Agriculture Ecosystems & Environment, 1992, 40(1/4): 25-36.
(  0) 0) |
| [27] |
袁铭章, 刘树堂, 陈延玲, 等. 16S rDNA扩增子测序揭示长期定位秸秆还田对土壤细菌群落的影响. 华北农学报, 2016, 31(6): 157-163. Yuan M Z, Liu S T, Chen Y L, et al. Illumina amplicon sequencing of 16S rDNA tag reveals bacteria community development of long-term straw returning soil (In Chinese). Acta Agriculture Boreali Sinica, 2016, 31(6): 157-163. (  0) 0) |
| [28] |
刘卉, 周清明, 黎娟. 秸秆还田对土壤改良及作物生长影响的研究进展. 中国农学通报, 2017, 33(32): 53-57. Liu H, Zhou Q M, Li J. Effect of straw returning on soil improvement and crop growth:research progress (In Chinese). Chinese Agricultural Science Bulletin, 2017, 33(32): 53-57. (  0) 0) |
| [29] |
范丙全, 刘巧玲. 保护性耕作与秸秆还田对土壤微生物及其溶磷特性的影响. 中国生态农业学报, 2005, 13(3): 130-132. Fan B Q, Liu Q L. Effects of conservation tillage and straw application on the soil microorganism and P-dissolving characteristics (In Chinese). Chinese Journal of Eco-Agriculture, 2005, 13(3): 130-132. (  0) 0) |
| [30] |
汪海静. 土壤微生物多样性的主要影响因素. 北方环境, 2011, 23(Z1): 90-91. Wang H J. The main affecting factors of soil microbial diversity (In Chinese). Northern Environmental, 2011, 23(Z1): 90-91. (  0) 0) |
 2019, Vol. 56
2019, Vol. 56


