2. 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085;
3. 新疆农业大学草业与环境科学学院,乌鲁木齐 830052;
4. 青岛农业大学资源与环境学院,山东青岛 266109
用速生外来树种(如:桉树、湿地松)取代原生森林人工造林是中国乃至全球的主要生态变化之一。原产于澳大利亚的桉树(Eucalyptus),由于其生长速度快,适应性强、轮伐期短,且用途广,经济效益高等特点,已成为我国南方地区主要造林树种之一。至2015年,我国桉树造林面积已超过450万hm2[1]。由于桉树对原生生态系统具有潜在的破坏性影响,随着桉树人工林面积的不断扩大,桉树种植对森林生态系统的影响越来越受到社会的关注。已有研究表明:桉树取代原生生态系统造林导致的生态退化通常表现为生物多样性减少及功能退化[2-4]、林地土壤退化[5-7]等,且在国外亦有关于桉树的类似报道[8-12]。但是,有关桉树对华南地区森林土壤微生物群落影响的研究较少,桉树种植影响下土壤微生物群落的变化以及由此导致的生态系统过程变化的机制和效应尚未阐明。探讨桉树对土壤微生物群落及其生态功能的影响,对于全面科学地评价桉树的生态影响,揭示桉树影响生态系统生物地球化学循环的机理具有重要意义。
桉树造林对土壤微生物群落的影响大致包括以下四种途径:(1)桉树高效的生长速率导致土壤养分的消耗,从而降低土壤微生物所需养分资源的可利用性;(2)通过凋落物分解和根系分泌物对土壤微生物产生影响;(3)通过影响林下植被多样性和丰富度间接影响土壤微生物;(4)林地管理措施,如施肥、炼山等对土壤结构和养分的直接影响进而改变土壤微生物群落结构和功能。以上各因素之间又相互联系并协同影响土壤微生物群落及功能。
野外研究发现,与天然次生林等原生森林相比,桉树取代原生森林造林导致林地土壤微生物群落的生物量、多样性以及酶活性下降[4, 13]。但是在野外条件下,人工林管理对森林生态系统的干扰较大,难以将桉树本身对土壤微生物群落的影响抽离出来。凋落物是森林生态系统土壤微生物群落食物的主要来源之一。本研究采用室内缩微模拟的方法,研究原生森林土壤微生物群落结构及其功能对桉树凋落物的响应,为阐明桉树通过凋落物途径导致的土壤微生物群落变化以及由此导致的生态系统过程变化的机制和效应提供依据。
1 材料与方法 1.1 研究区概况缩微模拟试验的土壤选自海南省白沙县细水乡龙村小流域。该区域属热带湿润季风性气候,年均降雨量约1725 mm,70%~80%的降水集中在5—10月。年均气温21.9~23.4℃,最高温度35~37℃,最低温度5~6℃。土壤母质属于花岗岩风化物,土壤类型为砖红壤。地带性森林群落为热带季雨林。该小流域天然次生林中物种丰富,乔木物种主要有厚皮树、对叶榕、银柴、木棉、倒吊笔、菲律宾合欢、海南红豆、海南蒲桃、枫香、黄牛木、毛果扁担杆、水锦树、越南山矾等。桉树是该区域的重要人工造林树种,速生人工造林以尾叶桉、巨尾桉等为主,造林方式通常为同一品种大面积种植,乔木层物种较为单一。
1.2 试验设计采用随机区组设计,用塑料盆钵进行乔木凋落物(叶凋落物)的分解模拟试验。供试土壤选自小流域中土壤肥力水平有差异的3片天然次生林的土壤,根据有机碳和全氮含量,土壤肥力水平分别为高、中、低(表 1)。土壤及凋落物的采集时间为2011年10月。
|
|
表 1 供试土壤性质 Table 1 Properties of the tested soils |
土壤去除碎砾、根系等杂质后过2 mm筛,混匀移至塑料方口小盆(边长8 cm、深度10 cm)中。每个小盆含有相当于200 g干土的鲜土,调整土壤含水量至30%。凋落物设置3个水平,分别为海南天然次生林的混合乔木叶凋落物(NSF,Natural secondary forests)和桉树人工林中收集的桉树新近叶凋落物(EP,Eucalyptus plantations),并设置不添加凋落物的对照(CK)。将凋落物弄碎成0.5 cm×0.5 cm大小,混匀后称取各凋落物2 g(风干后叶重)至各小盆中,并与土壤混匀。
按照土壤肥力水平分别设置高、中、低3个区组,每个区组设置9个小盆(3盆添加桉树叶凋落物,3盆添加天然次生林混合叶凋落物,3盆不添加凋落物),共27盆。添加凋落物后土壤培养在可控温控湿的培养箱内,培养箱温度设置为25℃,湿度设置为90%,每个光照周期为16 h光照,8 h黑暗。定期根据调整好含水量后的初始质量补充超纯水以保证土壤水分条件的一致性。
1.3 样品采集与测定培养实验共进行30 d,每10天取一次样,每次各土壤肥力水平下的3种凋落物处理各取1盆。采集的土壤样品过2 mm孔径的土壤筛再次匀质化,并去除还未腐解的大块凋落物。过筛后的土壤一部分冷冻干燥后,磨碎并过100目土壤筛,保存于-20℃用于土壤PLFA的提取;一部分放在4℃保存用于土壤微生物群落碳源代谢功能的测定。
供试土壤性质的测定参考《土壤农化分析》[14]。供试凋落物初始C、N的含量用德国Elementar公司生产的Vario Ⅲ分析仪测定。
1.4 土壤微生物磷脂脂肪酸谱图分析土壤微生物磷脂脂肪酸的分析方法在Buyer等[15]的方法上加以改进。所用实验用品和器皿均为玻璃或特氟龙(Teflon)材质,不使用清洗剂清洗,经10%的HCl浸泡后,于高温下烘干去除磷脂污染,并在使用前经过正己烷润洗。提取以及保存均避光、避热、避氧。
提取:4 g冻干土(100目)至40 mL玻璃离心管,依次加入3.2mL磷酸缓冲液(pH 7.4)、8 mL甲醇、4 mL氯仿;室温超声浸提10 min后避光水平震荡1h,2 500 r·min-1离心10 min,收集上清至100 mL分液漏斗;依次加入3.2 mL磷酸缓冲液及4 mL氯仿,充分混匀,置于分液漏斗架上,过夜避光分层;收集下层氯仿相至40 mL离心管,N2吹干。
分离:样品过硅胶柱(500 mg silica gel column,Part No.5982-2265,Agilent Technologies,Wilmington,DE,USA)前先加入5mL氯仿润湿硅胶柱;用10 mL氯仿分2次洗涤转移N2吹干的样品至硅胶柱内;待氯仿滴干后加入10 mL丙酮过硅胶柱;待丙酮完全滴干后,加入5 mL甲醇(色谱纯)过硅胶柱,收集甲醇相至10 mL Teflon离心管,N2吹干。
甲酯化:用1 mL甲醇-甲苯(1:1,v/v)溶液将N2吹干的脂类物质溶解;加入0.2 mol·L-1 KOH(现用现配,甲醇做溶剂)1 mL,混匀,35℃温育15 min;待样品冷却至室温后,依次加入2 mL氯仿-正己烷(1:4, v/v)、1 mL 1 mol·L-1醋酸、2 mL超纯水,充分震荡混匀;2 000 r·min-1离心5 min,转移上层正己烷相至另一干净的10 mL玻璃样品瓶;用2 mL氯仿-正己烷(1:4, v/v)重复提取一次,合并两次提取的正己烷相,N2吹干,-20℃保存。
上机前准备:样品过柱(NH2 SPE column,Part No. 8B-S009-EAK,Phenomenex,Torrance,CA)前先加入1 mL氯仿润湿柱子;用1 mL氯仿分2次洗涤转移吹干的样品至柱子内;收集氯仿相至2 mL棕色样品瓶,N2吹干;加入1 mL含有10 mg·L-1内标物(十九烷酸甲酯)的正己烷(农残级)溶液。
鉴定(GC-MS条件):HP6890/MSD5793(Agilent Technologies,Bracknell,UK),HP-5毛细管柱(30 m×0.25 mm×0.25 μm),不分流进样。进样口温度230℃;检测器温度270℃。升温程序:50℃持续1 min,以15℃·min-1增加至150℃,保持2 min,再以3℃·min-1增加至250℃,保持15 min。He作载气,流量为1 mL·min-1。
1.5 土壤微生物群落碳代谢功能分析微生物群落碳源代谢功能应用BIOLOG微生物自动分析系统进行测定[16]。称取相当于10 g干重的鲜土,加90 mL无菌的0.85% NaCl(质量比)溶液在摇床上180r·min-1往复式振荡30min,然后将土壤悬浊液再梯度稀释2次,每次稀释10倍;用多通道移液器吸取稀释1000倍后的土壤悬浮液接种至生态板(BIOLOG-ECO PLATE)的每一个孔中,每孔150μL。将接种好的生态板放置于25℃恒温箱中培养240h,每12h于BIOLOG仪上读取波长为590 nm处的OD值。
1.6 数据处理磷脂脂肪酸的定量用峰面积和内标(19:0)曲线法。PLFA含量用nmol·g-1表示。本研究共有24种PLFA被检出。这些脂肪酸主要由饱和脂肪酸、不饱和脂肪酸、带甲基支链的脂肪酸和带环丙基的脂肪酸组成。主要微生物类群的生物量通过以下PLFA的总量来估算:细菌(15:0、17:0、20:0、革兰氏阳性细菌:i15:0、a15:0、i16:0、i17:0、a17:0、i18:0;革兰氏阴性细菌:16:1ω9t、16:1ω7c、cy17:0、18:1ω9t、18:1ω7c、cy19:0);用16:1ω5c、18:2ω6, 9c、18:1ω9c的和来估算真菌的生物量;用10Me17:0、10Me18:0与10Me19:0的和来估算放线菌的生物量,14:0、16:0、18:0为通用脂肪酸[17-21]。
BIOLOG生态板的平均颜色变化率(Average well colour development,AWCD)计算公式为[22]:AWCD=∑(C-R)/n,C为每个有培养基孔的OD值,R为对照孔的OD值,n为培养基碳源种类,生态板n值为31。采用曲线整合方法[23]估计土壤微生物群落的碳代谢活性:梯形面积S=∑[(vi+vi-1)/2(ti+ti-1)],vi为i时刻的AWCD值。用培养72 h的数据来分析微生物群落的碳代谢多样性特征:包括利用碳源的丰富度(Richness,S)、香农多样性指数(Shannon index,H′)。香农多样性指数的计算公式为:H′=-∑PilnPi,其中Pi=ni/N,ni为第i种培养基的OD值,N为样品中所有培养基OD值的总和;利用碳源的丰富度以(C-R) > 0.25的数据为准。
用方差分析(analysis of variance, ANOVA)确定不同凋落物处理间土壤微生物群落的磷脂脂肪酸丰度、碳代谢活性及多样性是否有显著差异,用Duncan法进行多重比较。主成分分析(Principal component analysis,PCA)用于土壤微生物群落磷脂脂肪酸组成和碳代谢方式的差异性分析。统计分析通过SPSS 16.0统计软件实现。
2 结果 2.1 凋落物碳氮含量桉树凋落物单位质量的总碳含量显著高于天然次生林的混合凋落物(表 2,P < 0.01),总氮含量则显著低于天然次生林的混合凋落物(表 2,P < 0.01)。桉树凋落物的总碳和总氮含量分别为529.7 mg·g-1和6.94 mg·g-1,而天然次生林混合凋落物的总碳和总氮含量分别为474.8 mg·g-1和13.51 mg·g-1。天然次生林混合凋落物的碳氮比35.2,而桉树凋落物的碳氮比则有76.3,显著高于天然次生林的混合乔木凋落物(表 2,P < 0.01)。
|
|
表 2 供试天然次生林与桉树林凋落物的性质 Table 2 Properties of the litters of natural secondary forests and Eucalyptus plantations |
无论是革兰氏阳性菌,还是革兰氏阴性菌的特征脂肪酸丰度,桉树人工林凋落物处理的土壤均显著低于天然次生林混合凋落物处理的土壤(P < 0.05)。添加凋落物培养10、20、30 d,天然次生林混合凋落物处理土壤中细菌特征脂肪酸的总丰度分别较桉树人工林凋落物处理的土壤高13%、9%和5%,其中10d时(初期)达到显著水平(P < 0.05)(图 1a)。
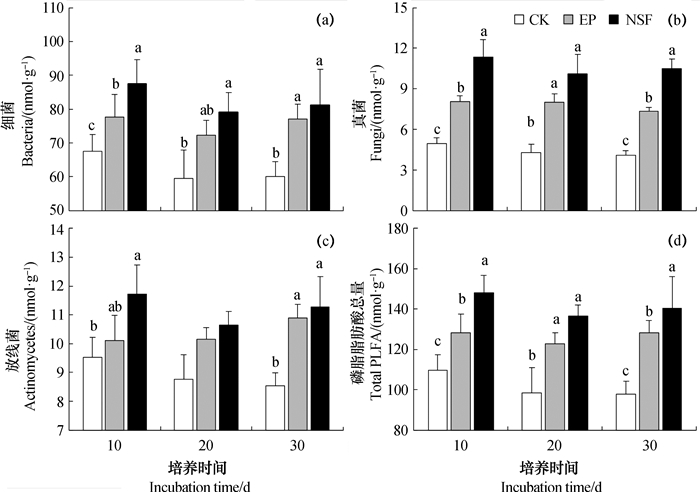
|
注:CK,对照;EP,桉树凋落物;NSF,天然次生林凋落物。不同小写字母表示凋落物处理间差异显著(P < 0. 05)。下同 Note: CK stands for control; EP for litter of Eucalyptus plantation; and NSF for litter of natural secondary forests. Different small letters mean significant difference at 0.05 levels between treatments. The same bellow 图 1 不同凋落物处理土壤微生物群落磷脂脂肪酸的丰度 Fig. 1 PLFA abundance in the soil relative to treatment |
不同凋落物处理土壤真菌特征脂肪酸的丰度差异较大。天然次生林混合凋落物处理土壤中真菌的丰度显著高于桉树凋落物处理的土壤,培养10、20、30 d时,分别比后者高41%,27%和43%(图 1b,P < 0.05)。天然次生林凋落物处理土壤的放线菌特征脂肪酸的丰度稍高于桉树凋落物处理的土壤,但是差异未达到显著水平(图 1c)。
添加凋落物的土壤磷脂脂肪酸总量显著高于未添加凋落物的土壤,两种凋落物处理土壤磷脂脂肪酸总量间的差异也达到显著水平(图 1d,P < 0.05)。凋落物培养10、20、30 d,桉树人工林凋落物处理的土壤中磷脂脂肪酸总量分别为128.2、122.7和128.3 nmol·g-1,而天然次生林的混合凋落物处理的土壤则为148.2,136.7和140.5 nmol·g-1,分别较桉树凋落物处理的土壤高16%、11%和9%(图 1d)。
2.3 土壤微生物群落磷脂脂肪酸结构对土壤微生物群落的磷脂脂肪酸组成进行主成分分析,结果表明:不同凋落物处理土壤微生物群落的磷脂脂肪酸组成存在显著差异(图 2a)。处理间的差异主要体现在PC1上,PC1能解释不同土壤微生物群落磷脂脂肪酸变异的84.02%。对PC1得分系数的方差分析结果表明:不同凋落物处理间的差异均达到显著水平(P < 0.05);PC2能解释不同土壤微生物群落磷脂脂肪酸变异的6.73%,不同凋落物处理在PC2上的差异主要体现在添加凋落物处理与对照之间(P < 0.05),而两种凋落物处理之间的差异不显著。
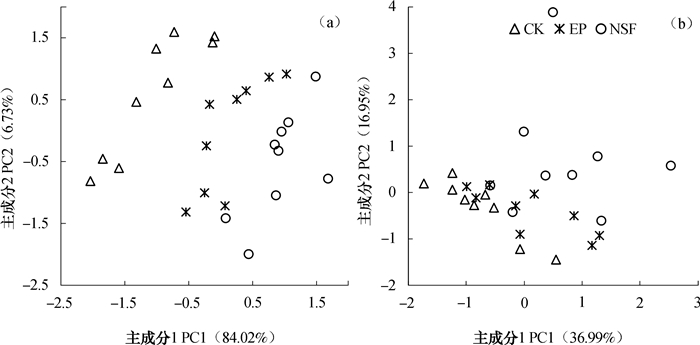
|
图 2 不同凋落物处理土壤微生物群落PLFA组成(a)和碳代谢功能(b)的主成分分析 Fig. 2 PCA of soil microbial PLFA compositions (a) and carbon metabolic profiles (b) relative to treatment |
应用主成分分析研究不同凋落物处理下土壤微生物群落对31种单一碳源的利用,发现不同凋落物处理土壤中微生物群落的碳源利用方式表现出明显分异(图 2b)。PC1能解释不同土壤微生物群落碳源代谢方式变异的36.99%,对得分系数的方差分析结果表明:不同凋落物处理间的差异都达到显著水平(P < 0.05);PC2能解释不同土壤微生物群落碳源代谢方式变异的16.95%,不同凋落物处理间在PC2上的差异主要表现为天然次生林凋落物处理在PC2的得分系数与桉树凋落物处理以及对照均存在显著差异(P < 0.05),但是桉树凋落物处理与对照之间的差异不显著。
不同凋落物处理下土壤微生物群落对六大类碳源的利用偏好存在显著差异(图 3)。添加天然次生林混合凋落物的土壤微生物群落比较偏好、利用率较高的碳源类型为糖类、聚合物类、胺类和氨基酸类,显著高于对羧酸类和其他类碳源的利用;添加桉树凋落物的土壤微生物群落对六大类碳源的利用率从高到低依次为:糖类、氨基酸类、胺类 > 聚合物类 > 羧酸类 > 其他;未添加凋落物的土壤微生物群落对六大类碳源的利用率从高到低则依次为:氨基酸类、胺类 > 糖类 > 聚合物类、羧酸类 > 其他。
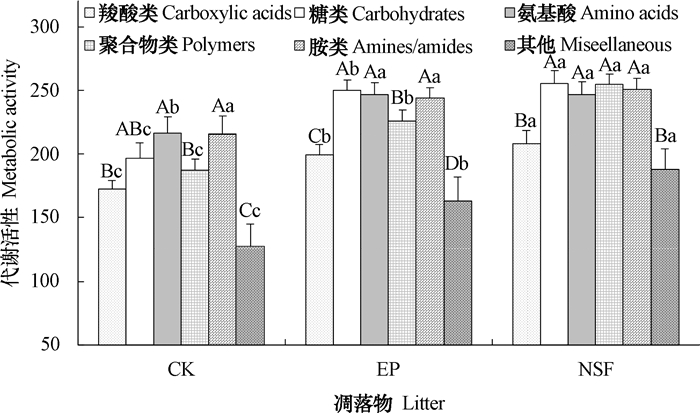
|
注:不同小写字母表示同种碳源不同凋落物处理间差异显著(P < 0.05)。不同大写字母表示同种凋落物不同碳源间差异显著(P < 0.05) Note: Different small letters mean significant difference at 0.05 levels between treatments. Different capital letters mean significant difference at 0.05 levels betweendifferent carbon sources 图 3 不同凋落物处理土壤微生物群落对不同类型碳源的利用 Fig. 3 Utilization of carbon source by soil microbial community relative to treatment and type of carbon source under different litters |
不同凋落物处理下土壤微生物群落对不同类型碳源的利用程度差异非常显著(图 3)。在整个培养期内,除了胺类以外,不同凋落物处理土壤微生物群落对其他五大类碳源的利用程度存在显著差异,未添加凋落物的土壤微生物群落对各类碳源的利用程度最低,而天然次生林混合凋落物处理的土壤微生物群落对羧酸类、糖类、聚合物类以及其他四大类碳源的利用程度均显著高于桉树凋落物处理,两种凋落物处理土壤微生物群落对氨基酸类碳源的利用没有显著差异。
2.5 土壤微生物群落碳代谢能力凋落物分解不同阶段,土壤微生物群落代谢活性在不同凋落物处理间的差异均表现为:不添加凋落物的对照土壤(CK)显著低于添加凋落物处理的土壤。而添加桉树凋落物(EP)的土壤显著低于添加天然次生林混合凋落物(NSF)的土壤,碳代谢活性从高到低依次为:NSF > EP > CK(图 4a)。
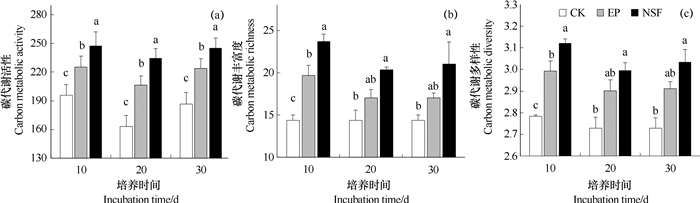
|
图 4 凋落物分解10、20、30 d后土壤微生物群落碳源代谢活性、丰富度及多样性 Fig. 4 Carbon metabolic activity, richness and diversity of the soil microbial community on D10, D20 and D30 relative to treatment |
图 4b、图 4c所示为土壤微生物在用BIOLOG生态板培养72 h后所利用碳源的丰富度和Shannon多样性指数。不同凋落物处理下土壤微生物群落利用碳源的丰富度和多样性差异显著。添加凋落物的土壤显著高于不添加凋落物的对照,两种凋落物处理之间,又以添加桉树凋落物的土壤低于添加天然次生林凋落物的土壤,并且在凋落物添加初期(10 d)的差异达到显著水平(P < 0.05)。
3 讨论人类活动包括炼山、翻耕、施除草剂、施肥、伐木等对森林生态系统的干扰较大,且凋落物原位分解会受到微气候、地上植被等因子的综合影响,难以明确桉树凋落物本身对土壤微生物群落的影响,所以本研究采用实验室缩微模拟试验,在微气候条件一致的情况下,选取3种碳、氮含量存在差异的天然次生林土壤,采用随机区组的实验设计开展实验,增强研究结果的可比性和说服力。
不同凋落物处理下土壤微生物群落的磷脂脂肪酸组成和碳代谢功能具有显著差异。添加桉树凋落物的土壤,其各类群微生物的磷脂脂肪酸含量以及总量虽然高于未添加凋落物的土壤,但是均显著低于添加天然次生林混合凋落物的土壤,表明与天然次生林的混合凋落物相比,单一桉树凋落物为土壤微生物群落提供生境和食物的能力较低,天然次生林的混合凋落物更容易被土壤微生物群落利用从而合成自身的生物量。这一结果与野外观测的结果相吻合:与天然次生林相比,桉树人工林土壤微生物群落的生物量碳、氮、各类群微生物以及磷脂脂肪酸总量均显著降低[13-24];此外,与添加天然次生林凋落物的土壤相比,桉树凋落物处理的土壤,无论微生物群落代谢的活性还是碳源利用的丰富度和多样性均显著较低,这一结果也与野外观测的结果相吻合:与天然次生林相比,桉树人工林土壤微生物群落碳源代谢活性、丰富度和多样性显著降低[13-24]。谭宏伟等[4]的研究也发现,桉树林土壤可培养微生物数量、微生物生物量碳、氮,细菌多样性和碳氮磷转化相关酶活性均低于天然阔叶林。
不同凋落物处理导致土壤微生物群落结构和功能产生差异的原因可能与凋落物的物种及化学组成有关。研究区域内的桉树人工林群落结构单一,乔木层通常只有桉树一个物种,而天然次生林中植物多样性高,乔木物种丰富,供试的混合凋落物的物种组成超过了10种,不同质地的凋落物混合在一起可改变凋落物组成,改善凋落物的养分状况,增加微生物可获得资源的变异度[25-26]。此外,高碳氮比的凋落物中通常含难降解结构化合物(如木质素等)的比例也较高,可供微生物生长的资源较为贫乏[25-26]。本研究结果显示桉树凋落物的碳氮比高达76.29,而天然次生林混合凋落物的碳氮比仅35.16。天然次生林凋落物较低的碳氮比显著增加了土壤微生物群落生物量、碳代谢活性、多样性和丰富度。此外,桉树可能通过凋落物分解过程释放化感物质,从而影响土壤微生物的生长发育[27]。大量研究发现,桉树叶片和果实等组织中含有几十种挥发性组分,如香树烯、α-水芹烯、1, 8-桉叶素、蓝桉醇等,具有较强化感作用。这些物质可通过凋落物分解进入土壤,并在土壤中不断积累,抑制某些微生物的活性[28]。
土壤微生物通过凋落物获取碳源,天然次生林的混合凋落物和桉树凋落物完全不同的物种组成也导致其化学成分的改变,尤其是C/N比的增加,因而引起土壤微生物食物种类和成分的变化。由于不同种类土壤微生物对这些变化的反应可能存在差异,并且土壤微生物群落的结构和功能之间存在相互影响[29],不同凋落物处理下的土壤微生物形成结构和功能差异显著的微生物群落。本研究用PLFA和BIOLOG方法分别研究了土壤微生物的群落结构和功能,两种方法得到一致的结果。尽管采用三种土壤碳、氮含量存在显著差异的土壤进行培养实验,并且在不同培养时期分别采样,主成分分析的结果表明凋落物类型依然是导致土壤微生物群落PLFA组成和碳代谢方式产生差异的主要原因,并且PC1PLFA和PC1BIOLOG之间存在显著相关性(r= 0.681,P < 0.001)。表明桉树可能通过凋落物途径打破原生植物与土壤微生物之间经过长期历史形成的平衡的共生关系,形成有利于自身的新的共生关系。
4 结论与展望土壤微生物是维系陆地生态系统地上-地下相互作用的纽带。土壤微生物在影响森林物质循环和能量交换的同时,本身也受到地上生态系统的影响。这一点在植物对土壤微生物群落多样性的影响上尤为突出。本研究中,与天然次生林混合物种的凋落物相比,桉树人工林单一物种的凋落物拥有完全不同的凋落物养分组成,桉树凋落物较低的物种多样性和较高的碳氮比也导致了较低生物量、多样性和代谢活性的土壤微生物群落。表明桉树凋落物为土壤微生物群落提供生境和食物的能力低于天然次生林的凋落物。该结果为深入理解桉树种植对土壤微生物群落的影响及其途径提供了依据。
本研究仅利用常规的PLFA分析法和BIOLOG微平板技术分析土壤微生物群落结构和功能的特征,这些方法不能完整反映土壤微生物群落的信息。此外,除了凋落物途径,桉树种植影响地下微生物群落的途径还有很多,如根系分泌物、人工林管理等。今后,可采用宏基因组学、转录组学和代谢组学等研究手段,围绕土壤微生物多样性和功能及其与桉树根际、桉树林植物多样性、土壤特征的关系等方面展开研究,将有助于从不同层面阐明桉树种植对土壤微生物群落组成及多样性、丰度、活性及其生态功能的影响。
| [1] |
谢耀坚. 论中国桉树发展的贡献和可持续经营策略. 桉树科技, 2016, 33(4): 26-31. XieY J. A discussion on the contribution and sustainable managementstrategy of eucalyptdevelopment in China (In Chinese). Eucalypt Science and Technology, 2016, 33(4): 26-31. DOI:10.3969/j.issn.1674-3172.2016.04.006 (  0) 0) |
| [2] |
刘平, 秦晶, 刘建昌, 等. 桉树人工林物种多样性变化特征. 生态学报, 2011, 31(8): 2227-2235. Liu P, Qin J, Liu J C, et al. Comparison of structure and species diversity of Eucalyptus community (In Chinese). Acta Ecologica Sinica, 2011, 31(8): 2227-2235. (  0) 0) |
| [3] |
马广超, 丁晖, 徐海根, 等. 桉树林取代马尾松树林后土壤动物组成变化研究. 热带农业科学, 2016, 36(4): 35-40. Ma G C, Ding H, Xu H G, et al. Soil animal composition change after Eucalyptus forest substituting Pinus massoniana forest (In Chinese). Chinese Journal of Tropical Agriculture, 2016, 36(4): 35-40. (  0) 0) |
| [4] |
谭宏伟, 杨尚东, 吴俊, 等. 红壤区桉树人工林与不同林分土壤微生物活性及细菌多样性的比较. 土壤学报, 2014, 51(3): 575-584. Tan H W, Yang S D, Wu J, et al. Comparison of Eucalyptus plantation with other forests in soil microbial activity and bacterial diversity in red soil region, China (In Chinese). Acta Pedologica Sinica, 2014, 51(3): 575-584. (  0) 0) |
| [5] |
黎宏祥, 王彬, 王玉杰, 等. 不同林分类型对土壤团聚体稳定性及有机碳特征的影响. 北京林业大学学报, 2016, 38(5): 84-91. Li H X, Wang B, Wang Y J, et al. Impact of different forest types on stability and organic carbon of soil aggregates (In Chinese). Journal of Beijing Forestry University, 2016, 38(5): 84-91. (  0) 0) |
| [6] |
谭长强, 彭玉华, 申文辉, 等. 广西都安地区5种森林类型土壤机械组成及其肥力比较. 生态科学, 2017, 36(2): 119-125. Tan Z Q, Peng Y H, Shen W H, et al. Study on soil the physical and chemical characteristics of 5 characteristic forestsin Du'an area, Guangxi (In Chinese). Ecological Science, 2017, 36(2): 119-125. (  0) 0) |
| [7] |
张凯, 郑华, 陈法霖, 等. 桉树取代马尾松对土壤养分和酶活性的影响. 土壤学报, 2015, 52(3): 646-653. Zhang K, Zheng H, Chen F L, et al. Impacts of replacement of Pinus with Eucalyptus on soil nutrients and enzyme activities (In Chinese). Acta Pedologica Sinica, 2015, 52(3): 646-653. (  0) 0) |
| [8] |
Banfield C C, Braun A C, Barra R, et al. Erosion proxies in an exotic tree plantation question the appropriate land use in central chile . Catena, 2018, 161: 77-84. DOI:10.1016/j.catena.2017.10.017
(  0) 0) |
| [9] |
Becerra P I, Catford J A, Inderjit, et al. Inhibitory effects of Eucalyptus globulus on understorey plant growth and species richness are greater in non-native regions . Global Ecology and Biogeography, 2018, 27(1): 68-76. DOI:10.1111/geb.2018.27.issue-1
(  0) 0) |
| [10] |
Berthrong S T, Schadt C W, Piñeiro G, et al. Afforestation alters the composition of functional genes in soil and biogeochemical processes in south american grasslands . Applied and Environmental Microbiology, 2009, 75(19): 6240-6248. DOI:10.1128/AEM.01126-09
(  0) 0) |
| [11] |
Cortez C T, Nunes L, Rodrigues L B, et al. Soil microbial properties in Eucalyptus grandis plantations of different ages . Journal of Soil Science and Plant Nutrition, 2014, 14(3): 734-742.
(  0) 0) |
| [12] |
Fierro A, Grez A A, Vergara P M, et al. How does the replacement of native forest by exotic forest plantations affect the diversity, abundance and trophic structure of saproxylic beetle assemblages? . Forest Ecology and Management, 2017, 405: 246-256. DOI:10.1016/j.foreco.2017.09.026
(  0) 0) |
| [13] |
Chen F L, Zheng H, Zhang K, et al. Changes in soil microbial community structure and metabolic activity following conversion from native Pinus massoniana plantations to exotic Eucalyptus plantations . Forest Ecology and Management, 2013, 291: 65-72. DOI:10.1016/j.foreco.2012.11.016
(  0) 0) |
| [14] |
鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000. Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed. Beijing: China Agriculture Press, 2000. (  0) 0) |
| [15] |
Buyer J S, Teasdale J R, Roberts D P, et al. Factors affecting soil microbial community structure in tomato cropping systems . Soil Biology & Biochemistry, 2010, 42(5): 831-841.
(  0) 0) |
| [16] |
Winding A. Fingerprinting bacterial soil communities using biolog microtitre plates// Ritz K, Dighton J, Giller K E. Beyond the biomass. Chichester: John Wiley and Sons, 1994
(  0) 0) |
| [17] |
Frostegård Å, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil . Biology and Fertility of Soils, 1996, 22(1/2): 59-65.
(  0) 0) |
| [18] |
Olsson P A. Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil . FEMS Microbiology Ecology, 1999, 29(4): 303-310. DOI:10.1111/fem.1999.29.issue-4
(  0) 0) |
| [19] |
Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil:A review . Biology and Fertility of Soils, 1999, 29(2): 111-129. DOI:10.1007/s003740050533
(  0) 0) |
| [20] |
Zelles L. Phospholipid fatty acid profiles in selected members of soil microbial communities . Chemosphere, 1997, 35(1/2): 275-294.
(  0) 0) |
| [21] |
Zelles L, Palojärvi A, Kandeler E, et al. Changes in soil microbial properties and phospholipid fatty acid fractions after chloroform fumigation . Soil Biology & Biochemistry, 1997, 29(9/10): 1325-1336.
(  0) 0) |
| [22] |
Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization . Applied and Environmental Microbiology, 1991, 57(8): 2351-2359.
(  0) 0) |
| [23] |
Hackett C A, Griffiths B S. Statistical analysis of the time-course of biolog substrate utilization . Journal of Microbiological Methods, 1997, 30(1): 63-69. DOI:10.1016/S0167-7012(97)00045-6
(  0) 0) |
| [24] |
陈法霖.桉树造林对土壤微生物群落结构和功能的影响.北京: 中国科学院生态环境研究中心, 2013 Chen F L. Impacts of afforestation by Eucalyputs on structure and function of soil microbial communities (In Chinese). Beijing: Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, 2013 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2368331 (  0) 0) |
| [25] |
陈法霖, 郑华, 欧阳志云, 等. 土壤微生物群落结构对凋落物组成变化的响应. 土壤学报, 2011, 48(3): 603-611. Chen F L, Zheng H, Ouyang Z Y, et al. Responses of microbial community structure to the leaf litter composition (In Chinese). Acta Pedologica Sinica, 2011, 48(3): 603-611. (  0) 0) |
| [26] |
陈法霖, 郑华, 阳柏苏, 等. 中亚热带几种针、阔叶树种凋落物混合分解对土壤微生物群落碳代谢多样性的影响. 生态学报, 2011, 31(11): 3027-3035. Chen F L, Zheng H, Yang B S, et al. The decomposition of coniferous and broadleaf mixed litters significantly changes the carbon metabolism diversity of soil microbial communities in subtropical area, southern China (In Chinese). Acta Ecologica Sinica, 2011, 31(11): 3027-3035. (  0) 0) |
| [27] |
Nasim G. Host allelopathy and arbuscular mycorrhizal fungi//Cheema Z A, Farooq M, Wahid A. Allelopathy: Current trends and future applications. Berlin, Heidelberg: Springer Berlin Heidelberg, 2013: 429-450
(  0) 0) |
| [28] |
Chander K, Goyal S, Kapoor K K. Microbial biomass dynamics during the decomposition of leaf litter of poplar and eucalyptus in a sandy loam . Biology and Fertility of Soils, 1995, 19(4): 357-362. DOI:10.1007/BF00336107
(  0) 0) |
| [29] |
Heemsbergen D A, Berg M P, Loreau M, et al. Biodiversity effects on soil processes explained by interspecific functional dissimilarity . Science, 2004, 306(5698): 1019-1020. DOI:10.1126/science.1101865
(  0) 0) |
2. State Key Laboratory of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;
3. College of Grassland and Environment Sciences, Xinjiang Agricultural University, Urumqi 830052, China;
4. College of Resources and Environment, Qingdao Agricultural University, Qingdao, Shandong 266109, China
 2019, Vol. 56
2019, Vol. 56


