长江三角洲(简称“长三角”)地区是我国主要的粮食生产区之一,也是氮肥施用量最高的地区之一,由此造成的地下水硝态氮(NO3--N)污染问题早有报道[1],但关于该地区农田地下水NO3--N的研究多集中于稻麦轮作稻田。近年来,随着城市化的发展,长三角地区越来越多的水稻田转变为蔬菜地和果园[2],已有的研究发现,蔬菜地和果园表层土壤存在明显的NO3--N累积[3-4]。由于NO3--N容易随水扩散,累积在表层土壤中的NO3--N会随降水或灌溉水淋洗出作物根层,直至进入地下水,或者累积于深层土壤[5]。例如,Zhou等[6]研究表明,中国北方半干旱农田土壤剖面普遍存在明显的NO3--N累积,其中最高值出现在果园土壤,在0~4 m土壤剖面NO3--N累积量高达2 155 kg·hm-2(以N计,下同),即便是累积量最小的小麦土壤,NO3--N累积量也高达453 kg·hm-2。
长三角地区降水充沛,地下水水位浅,表层土壤中的NO3--N极易随降水淋溶至地下水中。但迄今为止,关于蔬菜地和果园地下水NO3--N的研究较少[7],已有的研究多集中于根层(0~1 m),缺乏根层以下(> 1 m)土壤和地下水NO3--N浓度分布特征的研究[4]。因此,虽然现有的研究表明长三角地区菜地和果园表层土壤存在NO3--N累积,但不同土地利用方式下NO3--N剖面分布特征并不清楚,对于根层以下土壤或地下水中是否存在NO3--N累积尚不明确。
土壤及地下水中高浓度NO3--N可通过物理、化学和生物的手段降低其浓度,其中,反硝化作用能够将NO3--N转化成N2返回大气氮库,是NO3--N自然去除的主要途径[8]。近年来,长三角地区稻田土壤以及河流沉积物通过反硝化作用高效去除NO3--N的能力已被证实[9]。但关于地下水反硝化的研究是基于地下水中高浓度氧化亚氮(N2O)或同位素自然法(δ15N和δ18O-NO3--N)所做的推断[10-11],仅能证明反硝化的存在,难以量化其对地下水NO3--N的去除效率,因而无法明确反硝化在去除地下水NO3--N过程所起的作用。
地下水通常埋藏于地表之下,土壤的阻滞作用与水压的存在,使得地下水中的气体难以逸散至地表,因此,可通过测定地下水中溶解态N2总浓度及其自然溶解度,二者的差值可表示为反硝化所产生N2(以下简称“exN2”),该法被称之为N2直接定量法。Blicher-Mathiesen等[12]发现地下水中exN2的增加量与NO3--N的减少量相吻合,认为可利用N2直接定量法来研究地下水反硝化。Fox等[13]也发现exN2浓度与地下水反硝化速率之间有着很好的相关性,即高浓度的exN2出现在反硝化速率最高的河岸地区,而在反硝化较弱的农田缓冲带,地下水exN2浓度较低。其他研究者也发现了类似的规律,说明N2直接定量法能真实反映地下水反硝化的强弱[13]。膜进样质谱仪(MIMS)可通过测定水样中N2:Ar的变化,获得水中溶解性N2的浓度,与同位素质谱法(IRMS)相比,MIMS测定水中溶解态N2无需繁琐的前处理过程,测定过程简单快速,费用也大幅降低[14]。N2直接定量法不但可用来评估反硝化反应的强弱,还能推算出地下水NO3--N的初始浓度,因此,被广泛用于含水层土壤和地下水反硝化研究。
本研究以太湖地区3种典型农田为研究对象,通过两年的野外观测结合室内培养实验研究了不同种植模式下农田地下水NO3--N及exN2的浓度变化,目的在于:(1)探明不同种植模式下农田土壤及地下水NO3--N浓度剖面分布特征; (2)验证农田土壤剖面是否存在NO3--N累积现象; (3)明确反硝化对地下水NO3--N的去除效率及主要影响因素。
1 材料与方法 1.1 研究地点概况本研究依托中国科学院常熟农业生态实验站(31°32′N, 120°41′E)进行。该实验站隶属于太湖流域典型区域,农业种植制度从偏重粮食生产转向粮经作物(水果和蔬菜)协调发展。该地区气候类型为亚热带季风气候,年平均气温16.1℃,年平均降水1 100 mm。选择3种当地典型农业种植模式为研究对象,分别为水稻田、蔬菜地和葡萄园。水稻田为中国科学院常熟农业生态实验站长期试验用地,面积约3 hm2,为稻麦轮作模式,氮肥年投入量为470 kg·hm-2。蔬菜地位于中国科学院常熟农业生态实验站北侧1.5 km处,面积约4.5 hm2,2009年由水稻田转变为蔬菜地,主要以种植叶菜类蔬菜为主,氮肥年投入量约为600 kg·hm-2。葡萄园位于中国科学院常熟农业生态实验站南侧2 km处,面积约5 hm2,2005年由水稻田转变为葡萄种植园,氮肥年投入量约为590 kg·hm-2。供试土壤为当地有代表性的普通潜育水耕人为土(乌栅土)。
1.2 样品采集 1.2.1 原状土壤采集于2016年5月份进行土壤样品采集。在水稻田、蔬菜地和葡萄园各随机取3个采样点,利用单人手持式高频振动原状土壤取样钻机(VD51,澳大利亚)进行取样,每个采样点取0~4 m完整土柱。每个点连续采样4次,最后采至4 m深,共4根连续土柱。土壤采集后尽快带回实验站密封保存于4℃冰箱中,用于反硝化速率的测定。
1.2.2 地下水采样井布设2015年2月份建设地下水采样井。在水稻田、蔬菜地和葡萄园各随机确定3个采样点,选择管口直径为6 cm的三型聚丙烯(PPR)管作为地下水采样井,PPR管底部封口,四周开具直径3 mm的小孔,并用100目的尼龙纱网包裹,以过滤水样。选用与PPR管口径相同麻花钻在选定位置钻孔至相应深度,然后将PPR管插入钻孔,埋设好的PPR管高于地面0.5 m,便于采样。每个采样点布设4个采样深度,分别为1 m、2 m、3 m和4 m,共布设有36个地下水采样井,采样井分布见图 1。采样井布设完毕后48 h内抽空地下水5次以上,确保地下水取样的准确性。

|
图 1 地下水采样井点位分布 Fig. 1 Distribution of the wells for sampling groundwater |
2015年4月至2017年4月进行地下水采样,采样频次为每月2次,采样前提前24 h将监测井中的水抽干,以确保采集的水样为新鲜水样。利用可调速蠕动泵(BT100M,保定创锐泵业有限公司)采集地下水样,蠕动泵流速控制在50 mL·min-1以内,以减少采样过程水中溶解性气体的自然逸散,具体采样过程参照Weymann等[15]所述方法。采集好的样品存于7 mL螺口取样瓶(Labco Limited, 英国)中,放入4 ℃冰箱保存,用于测定地下水中溶解性N2和Ar含量。另取一份水样存于100 mL塑料瓶中用于测定地下水中N2O、溶解性有机碳(DOC)、NO3--N和NH4+-N浓度。水样采集的同时,利用手持式多参数水质分析仪(YSI Exo 1 multiparameter probe,美国)原位测定地下水温度(T)、pH、氧化还原电位(Eh)、盐度(Sal)、电导率(Cond)和溶解氧(DO)。降水数据和地下水水位数据来自中国科学院常熟农业生态实验站的自动观测数据。
1.3 样品测定 1.3.1 土壤无机氮测定土壤NO3--N和NH4+-N用2 mol·L-1氯化钾溶液浸提后,用自动化学分析仪(SmartChem 140 discrete auto-analyzer, Westco Scientific Instruments, 美国)测定。
1.3.2 土壤反硝化速率测定取不同深度的地下水5 L带回实验室,用作培养实验的上覆盖水。将采集好的0~4 m土柱样带回实验室后,将1 m长土层均分为3段,然后将其垂直置于装满原位上覆水的模拟培养装置中,使土样浸没入上覆水中,水面高出土柱6 cm,不盖盖子,预培养8 h,使微生物恢复活性[16]。8 h后分别采集培养罐上覆水水样,测定水中NO3--N浓度,根据上覆水NO3--N浓度,加入一定体积100 mg·L-1的硝酸钾溶液,使培养罐上覆水NO3--N浓度达到5 mg·L-1,然后拧紧盖子,开始进行培养实验,实验室温度调节至地下水年均温度(20℃)。培养体系调试完毕后,立即取第一个水样作为0 h样品,然后分别在2、4、6、8 h采样,每个样品取三个平行样,取样过程同Li等[9]所述方法。采集好的样品置于4℃冰箱保存,用于测定水中溶解性N2浓度。
1.3.3 水中N2O和溶解性N2浓度测定地下水中N2O浓度利用顶空取样-气相色谱法测定,具体过程见Terry等[17]所述方法。
利用MIMS(Bay Instruments, Easton, MD,美国)测定水中溶解性N2浓度。例如,MIMS测定N2和Ar的精度分别是小于0.5%、小于0.05%,而测定N2:Ar(物质的量比)精度小于0.03%。地下水水中N2源于生物过程(主要是反硝化)和物理过程(水气平衡),而Ar溶解度主要受温度、盐度条件控制(纯物理过程)。因此,可通过水样N2:Ar值计算其真实N2浓度,具体计算过程见Kana等[14]所述方法。
地下水水样带回实验室后过滤(0.45 μm滤膜),用自动化学分析仪(SmartChem 140 discrete auto-analyzer, Westco Scientific Instruments, 美国)测定NO3--N和NH4+-N浓度,用TOC(总有机碳)分析仪(N/C 3100 multi-analyzer, Analytik Jena AG, 德国)测定地下水DOC浓度。
1.4 反硝化对地下水NO3--N去除效率的计算地下水中来自反硝化产生的N2用exN2表示,参照Weymann等[15]所推荐的计算方法。
反硝化对地下水NO3--N的去除效率用RE(Reaction efficiency)表示,为反硝化产物和反硝化底物浓度的比值,计算过程如下:
| $ {\rm{RE}}\left( \% \right) = \frac{{{\rm{e}}{{\rm{x}}_{{\rm{N2}}}}{\rm{ + }}{{\rm{N}}_{\rm{2}}}{\rm{O}}}}{{{\rm{e}}{{\rm{x}}_{{\rm{N2}}}}{\rm{ + }}{{\rm{N}}_{\rm{2}}}{\rm{O + NO}}_3^ - {\rm{ - N}}}}{\rm{ \times 10}}0 $ | (1) |
采用Shapiro-Wilk法对所有数据进行正态检验,对不符合正态分布的数据先进行log转化,使其符合正态分布后,再进行统计分析,各参数间的相关性以斯皮尔曼(Spearman)相关系数表示。采用T检验比较不同种植模式及不同深度NO3--N、NH4+-N、DOC、溶解性N2O和exN2浓度等参数差异显著性,所有统计分析均由SPSS 18.0完成。
2 结果 2.1 降水量和地下水水位变化试验期间降水量及地下水位变化如图 2所示。2015-2017年的年均降水量为1 410 mm,降水主要集中在夏季,单次最大降水出现在2015年6月17日,降水量高达131 mm。地下水位变化范围为0.12~0.90 m,均值为0.57 m。地下水位主要受降水及灌溉的影响,因此,夏季地下水位通常较低,而秋冬季地下水水位较高。

|
图 2 试验期间降水量和地下水水位变化 Fig. 2 Precipitation and groundwater table during the observation period |
3种种植模式下不同深度农田土壤NO3--N和NH4+-N含量如图 3所示。水稻田、蔬菜地和葡萄园0~4 m土壤NO3--N平均含量分别为3.95、13.88和16.24 mg·kg-1,蔬菜地和葡萄园显著高于水稻田。水稻田各层次土壤NO3--N浓度较低,无明显差异。葡萄园和蔬菜地土壤NO3--N则有明显的层次差异,在0~1.5 m的深度内,随采样深度增加,NO3--N浓度急剧下降; 1.5~4 m的深度范围内,NO3--N浓度较低,随深度无显著变化,未见NO3--N在深层土壤存在累积现象。

|
图 3 农田土壤NO3--N和NH4+-N含量 Fig. 3 Soil NO3--N and NH4+-N concentrations in soil profile in paddy field, vegetable field and vineyard |
土壤NH4+-N变化范围为0.38~8.72 mg·kg-1,高浓度NH4+-N多出现于底层土壤(3~4 m),但土壤层次之间差异不显著(P > 0.05)。水稻田、蔬菜地和葡萄园0~4 m土壤NH4+-N平均含量分别为4.13、3.73和3.49 mg·kg-1,三者之间无显著差异。
2.3 三种种植模式下不同深度地下水NO3--N浓度3种种植模式下,不同深度地下水NO3--N浓度如图 4所示。总体而言,种植模式和采样深度显著影响NO3--N浓度,其中,水稻田地下水NO3--N浓度不存在剖面差异,各深度NO3--N浓度均低于1 mg·L-1。而葡萄园和蔬菜地1 m处地下水NO3--N浓度显著高于水稻田(P < 0.001)。但NO3--N浓度随着采样深度增加逐渐降低,至4 m处,3种植模式下农田NO3--N浓度差异不显著(P > 0.05)。地下水NO3--N浓度季节变化趋势见图 5,对于水稻田而言,小麦种植季(11月―次年4月)地下水NO3--N浓度高于水稻季(6月―12月),但差异不显著(P > 0.05)。葡萄园和蔬菜地1 m和2 m处地下水NO3--N浓度则存在明显的季节变化,高浓度NO3--N主要出现在春夏季(2月―7月),在此期间,NO3--N浓度呈现出脉冲式变化,观测期内出现多次峰值,最高值达81.9 mg·L-1。秋冬季(10月―12月)NO3--N浓度趋于稳定,维持在较低浓度,其中1 m和2 m处NO3--N < 2 mg·L-1,3 m和4 m NO3--N浓度均低于1 mg·L-1,与水稻田无异

|
图 4 农田地下水NO3--N含量 Fig. 4 Groundwater NO3--N concentration in soil profile in paddy field, vegetable field and vineyard |

|
图 5 农田地下水NO3--N含量时间变化规律 Fig. 5 Temporal variation of groundwater NO3--N relative to depth and land use type |
土壤反硝化速率范围为0.16~0.98 μg·g-1·d-1,最高值出现在葡萄园0~1 m土层(图 6)。3种种植模式下,土壤反硝化速率随着采样深度增加逐渐降低。0~1 m土层反硝化速率为3~4 m土层的3~5倍。3种农田土壤0~1 m土层反硝化速率差异显著(P < 0.05),至3~4 m土层,反硝化速率已无差异。0~4 m土层反硝化速率的平均值分别为0.30(水稻田)、0.37(蔬菜地)和0.44(葡萄园)μg·g-1·d-1,无显著差异(P > 0.05)。

|
图 6 农田土壤反硝化速率 Fig. 6 Soil denitrification rate relative to depth and land use type |
3种种植模式下地下水N2O浓度随着采样深度增加逐渐降低(图 7),其中,水稻田各深度N2O浓度差异不显著(P﹥0.05)。相同深度,N2O浓度由大到小依次为葡萄园、蔬菜地、水稻田。水稻田地下水N2O浓度无明显季节变化,葡萄园和蔬菜地1 m和2 m处地下水N2O浓度存在明显的季节变化和年际差异(图 8),高浓度N2O主要出现在春夏季(P < 0.01)。

|
图 7 农田地下水N2O和反硝化产应的N2(exN2)浓度 Fig. 7 Groundwater N2O and exN2 concentrations relative to depth and land use type |
地下水exN2浓度由高到低依次为葡萄园、蔬菜地、水稻田,但exN2浓度随采样深度变化不一,其中,水稻田地下水exN2浓度随采样深度而增加,而在葡萄园和蔬菜地,随着采样深度增加,exN2浓度呈现先增(1~2 m)后减(2~4 m)的趋势(图 7)。葡萄园和蔬菜地地下水exN2均呈现明显的季节变化,其中高浓度值均出现在春夏季,水稻田地下水exN2浓度季节变化不明显(图 8)。

|
图 8 农田地下水N2O和exN2季节变化 Fig. 8 Temporal variability of groundwater N2O and exN2 relative to depth and land use type |
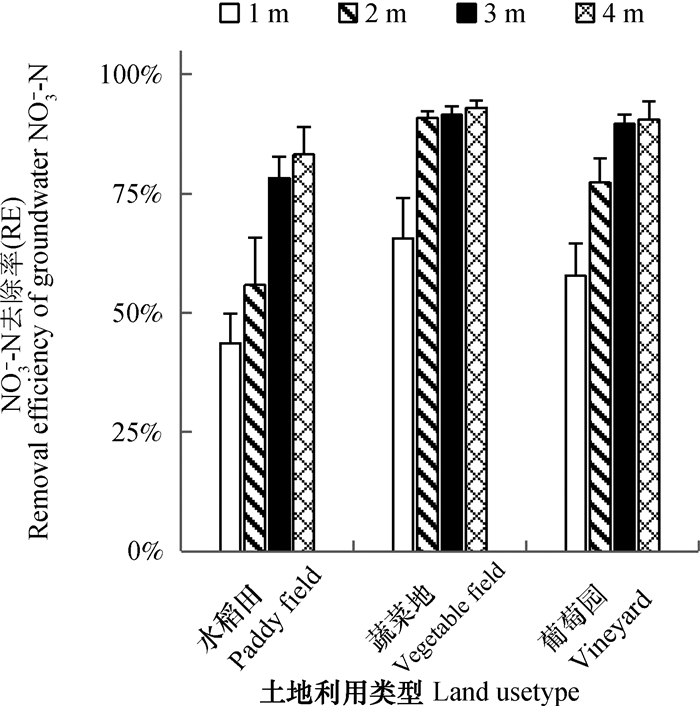
反硝化对地下水NO3--N的去除效率(RE)如图 9所示,在1~4 m深度范围内,水稻田、蔬菜地和葡萄园RE分别为65%、83%和76%。RE随着采样深度的增加而升高,表明反硝化对NO3--N的去除更为彻底。同一采样深度,RE值也存在显著差异(P < 0.01),由高到低依次为蔬菜地、葡萄园、水稻田。相关性分析表明,RE与地下水NH4+-N和DOC正相关,与NO3--N和DO负相关(表 1)。
|
注:RE=(N2O+exN2)/(N2O+exN2+NO3--N),表示反硝化对地下水NO3--N去除效率。下同Note: RE is the ratio between (N2O+ exN2) and(N2O+ exN2+ NO3--N), characterize the extent of NO3--N elimination by denitrification. The same below 图 9 反硝化对地下水NO3--N去除效率(RE) Fig. 9 Removal efficiency of groundwater NO3--N by denitrification relative to depth and land use type |
|
|
表 1 地下水exN2、N2O和RE与各参数之间的相关性(Spearman) Table 1 Spearman correction coefficient and significance matrix between the variables |
水稻田转变为葡萄园和蔬菜地之后,表层土壤及地下水NO3--N显著升高的原因如下:首先,水稻种植过程中,施肥后稻田表层土壤长期处于淹水状态,反硝化非常强烈,NO3--N在被运移至地下水之前已经被反硝化消耗掉[9],因此,太湖地区稻田NO3--N的淋溶损失非常少[18]。稻田改为旱作的葡萄园和蔬菜地之后,表层土壤长期处于干燥状态,促进了硝化作用,抑制了反硝化过程,造成NO3--N累积于表层土壤。
其次,3种种植模式下,虽然氮肥施用量不存在显著差异,但施肥方式却大为不同。在葡萄园,57%氮肥(340 kg·hm-2)作为基肥在3月份一次性施入,剩余氮肥(250 kg·hm-2)在接下来的4月-6月当作追肥施用。由于葡萄喜欢干旱的土壤环境,葡萄园施肥通常在雨前或灌溉前进行,短时间内(3月-6月)投入大量氮肥,加上太湖地区春夏季多雨的气候加剧了NO3--N的淋溶,因此,太湖地区果园土壤及表层地下水NO3--N通常高于菜地和稻田[2-4]。尤其是在3月份,此时葡萄正处于生长恢复期,对营养的需求不旺盛,大量基肥的施用,不但增加了土壤中NO3--N的累积[19],有机肥带入的大量有机物质还会促进表层土壤硝化过程,加剧了NO3--N的淋溶,因此,春季葡萄园地下水NO3--N远高于其他时期。蔬菜地一般是在播种前施用基肥,蔬菜生长季少量或者不追施氮肥,因此,高浓度NO3--N均出现在蔬菜播种期。虽然蔬菜地的施肥量与葡萄园相当,但单次施肥量较少(约为120 kg·hm-2),并且蔬菜种植过程中浇水较为频繁,更为湿润的水分条件使得蔬菜地表层土壤反硝化要强于葡萄园,因此,蔬菜地表层土壤及地下水NO3--N浓度低于葡萄园。
种植模式的转变还会改变表层土壤的氮素转化过程,王敬等[20]研究表明,太湖地区稻麦轮作农田转变为葡萄园后,提高了土壤硝化速率,导致更多的NO3--N累积于土壤中。由此可见,太湖地区水稻田改为旱作的葡萄园和蔬菜地,不仅改变了氮肥施用方式,同时也改变了表层土壤氮素转化过程,二者共同作用增加了NO3--N在表层土壤累积。
与其他研究者在中国华北及西北高氮投入农田的研究结果类似,本研究也发现蔬菜地和葡萄园表层土壤存在NO3--N累积现象[6],长三角地区氮肥投入量高,降水量大,加上较低的地下水位(图 2),表层累积的NO3--N极易向下迁移,更易对地下水水质构成威胁,因此,在作物施肥期可观察到地下水NO3--N浓度急剧上升的现象,但施肥过后,NO3--N浓度迅速下降,并维持较低值,直至下一次施肥。本研究还发现随着采样深度的增加,土壤及地下水中NO3--N浓度急剧降低,至4 m处,3种种植模式下土壤和地下水NO3--N已无差异。可见,虽然长三角地区高氮投入农田如蔬菜地和葡萄园表层土壤NO3--N浓度非常高,但深层土壤及地下水未出现NO3--N累积的现象,可能与该地区地下水中存在较强的反硝化作用有关。
3.2 反硝化对NO3--N的去除作用通过添加一定量NO3--NN作为反应底物,以此获得的反硝化速率,能在一定程度上反映土壤或沉积物的反硝化活性,常被用于反硝化的剖面分布特征及影响因子的比较研究。通常表层土壤反硝化速率高于底层土壤,这主要是因为与底层土壤相比,表层土壤氮源和碳源更为丰富,微生物活性也更高[21]。虽然本研究3~4 m土层反硝化速率(0.16 μg·g-1·d-1)显著低于0~1 m土层,但与其他研究者在1.2~1.3 m土层测定的反硝化速率相当[22],高于Khalil和Richards[23]利用MIMS法测定的两种草地0.6~0.7 m土层反硝化速率(0.11和0.13 μg·g-1·d-1),说明本研究区域深层土壤仍存在较强的反硝化活性。Fellows等[24]发现3.5 m深处土壤反硝化能有效去除NO3--N,在2天的时间内,去除率能达100%;Jarvis和Hatch[25]发现深达7 m的土壤仍有较高的反硝化活性,表明反硝化微生物普遍存在于底层土壤中,对减少NO3--N淋溶具有重要意义。
有研究者认为,与其他高氮投入区相比,长三角地区稻田地下水NO3--N浓度较低,可能与该地区稻田土壤存在较强的反硝化作用有关[7]。例如,Bu等[10]利用NO3--N消失法发现太湖地区农田缓冲带能消减67.5%~88%地下水NO3--N,同时伴随着δ15N-NO3--N升高,据此推断反硝化是消除地下水NO3--N的主要机制。但由于研究方法的限制,已有的研究仅能证明反硝化的发生,无法量化其对NO3--N的去除效率[10-11]。本研究利用N2直接定量法,首次量化了反硝化对地下水NO3--N的去除效率,在0~4 m的剖面范围内,3种种植模式下反硝化对NO3--N去除效率(RE)分别为65%、83%和76%。
土壤及地下水反硝化去除NO3--N的效率与地下水环境有关,在一些反硝化活性较高的区域,RE可达99%[13],而在反硝化活性弱的地区,RE仅为4%[26]。RE较高的区域多为河岸和自然湿地,而氮负荷量大的农田及牧场,由于迁移进入地下水中的NO3--N量大,反硝化去除能力有限,RE多低于50%,有的甚至低于10%[27]。相关分析表明,RE与NO3--N存在显著的负相关关系,表明反硝化是去除地下水NO3--N的重要机制(图 10)。长三角地区农田氮素投入高,但由于地下水反硝化作用强烈,NO3--N去除率可达65%~83%,是农田深层土壤未发生NO3--N累积的重要原因。

|
图 10 硝酸盐去除率(RE)与地下水NO3--N、DO和DOC的相关性 Fig. 10 Correlation of RE with NO3--N, DO and DOC concentration in groundwater |
影响反硝化速率的因素有很多,在地下水环境中,NO3--N、DO和DOC通常是影响反硝化的主要原因[8]。本研究相关分析结果也表明,exN2与NO3--N、NH4+-N和DOC最为相关(表 1)。一般认为当DO > 2 mg·L-1、DOC < 10 mg·L-1时,地下水反硝化会受到抑制[8]。例如,有研究发现在地下水DO高达6.5~10.4 mg·L-1的区域,反硝化仅能去除4%~9%的地下水NO3--N,这与高浓度DO抑制了反硝化有关[26]。而本研究地下水DO含量较低(< 2 mg·L-1),有利于反硝化进行(图 10)。
地下水丰富的有机物质也是该地区反硝化能有效去除地下水NO3--N的重要原因。丰富的有机物质不但可为微生物的活动提供碳源,同时也能消耗地下水DO,创造一个厌氧环境,从而有利于反硝化的进行。地下水中DOC含量通常低于5 mg·L-1,因此,碳源的缺乏通常是限制地下水反硝化的主要因子[8]。本研究中地下水DOC含量为14.2~29.7 mg·L-1,远高于其他研究报道的结果(图 10)。
根据化学计量法测算,1 mg DOC可消耗0.93 mg NO3--N,据此测算,本研究中地下水DOC含量足够反硝化微生物所需,理论上NO3--N去除效率应当接近100%,但实际NO3--N去除率仅有65%~83%。有研究发现地下水DOC含量仅为2 mg·L-1时,反硝化对地下水NO3--N的去除率(88%~95%)却高于本研究[26-28]。本研究也发现,虽然葡萄园地下水中DOC含量高于蔬菜地,但NO3--N去除效率却低于蔬菜地(图 9),这说明地下水中DOC含量高并不表示反硝化活性也高。Siemens等[29]认为地下水中反硝化微生物仅能利用来自作物根系分泌的有机物质,来自表层土壤分解产生的DOC难以被微生物利用。还有研究发现,土壤和沉积物反硝化速率与DOC含量相关性并不显著,而与颗粒态有机碳含量关系密切[30]。此外,不同种植模式下,根系深浅及根系分泌物种类存在差异,也会影响地下水反硝化过程[31]。这说明与浓度高低相比,DOC的生物有效性对地下水反硝化活性更为重要。
土壤类型也是影响反硝化活性的重要因素。本研究区域表层土壤多为壤质黏土,部分深层次土壤(2~3 m)为黏壤土。由于土壤黏粒含量高,造成土壤饱和导水率较低,NO3--N随水运移速度较慢,增加了反硝化进行的时间,有利于反硝化对NO3--N的去除[8]。
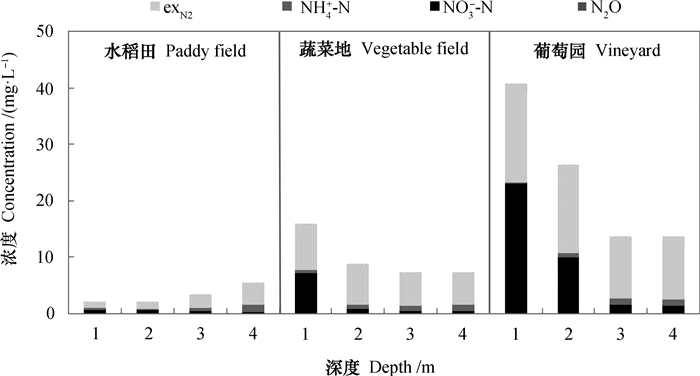
3.4 地下水反硝化对区域氮素平衡的影响NO3--N从地表淋溶进入地下水后,会被反硝化作用消耗,产生的N2和N2O因为土壤阻滞与水压的存在,短时间内无法逸散至大气中,因此,在地下水中能观测到高浓度气态氮(主要是exN2)(图 11)。在地下水反硝化较为强烈的区域,气态氮的浓度甚至超过了NO3--N浓度[13]。这些累积在地下水中的气态氮主要通过地下水交换进入临近河流,而不是向上扩散进入大气环境中。从区域氮素循环角度而言,这些气态氮是氮素淋溶损失的一部分。
|
图 11 不同深度地下水中各形态氮浓度 Fig. 11 Mean concentrations of exN2, NH4+-N, NO3--N and N2O in groundwater relative to depth and land use type |
Fox等[13]将以溶解性气态氮形式损失的氮定义为“消失的氮(Missing nitrogen)”,认为这一部分氮对于评估区域氮素平衡十分重要。Gardner等[28]利用经验模型估算了一个小流域氮素的各种去向,发现如果将“消失的氮”纳入其中,将极大地提高模型的准确度。就本研究而言,在葡萄园和蔬菜地,65%~83%地下水NO3--N被反硝化所消耗,以exN2的形式存在于地下水。鉴于NO3--N淋溶损失是太湖地区旱作农业氮素最大的损失途径(12%~20%)[32],由地下水反硝化造成的气态氮素流失也将非常可观,但现有的研究在计算氮素淋溶损失时,测定的地下水NO3--N实际是经反硝化消耗后残留的NO3--N,并非NO3--N初始浓度,因而会低估NO3--N淋溶损失量[30]。
朱兆良[33]曾对我国农田化肥氮去向进行了评估,认为有13%的氮素去向不明,以溶解性气态氮流失的氮可能就是尚不明确的去向之一。对于NO3--N淋溶损失严重的果园和蔬菜地,明确“消失的氮”的量将有助于区域氮素损失的准确估算。N2直接定量法通过exN2浓度反推地下水NO3--N初始浓度,有助于更为准确估算NO3--N淋溶损失量[28]。
4 结论地下水NO3--N浓度的时空变化规律表明,长三角高氮投入农田土壤剖面未出现NO3--N累积的现象,但是水稻田改为葡萄园和蔬菜地后增加了表层土壤NO3--N浓度,造成3种农田地下水NO3--N浓度剖面分布特征存在明显差异。其中,水稻田地下水NO3--N始终较低,不同深度之间无差异。蔬菜地和葡萄园1 m处地下水NO3--N浓度远高水稻田,但随着深度增加NO3--N浓度急剧下降,至4 m处与水稻田相同。蔬菜地和葡萄园高浓度NO3--N均出现在作物施肥期,施肥过后,NO3--N浓度迅速降低,并一直维持较低值,直至下次施肥的发生,这与长三角地区地下水中较强的反硝化活性有关。利用N2直接定量法,本文首次量化了反硝化对地下水NO3--N的去除效率,发现在0~4 m深度范围内,3种种植模式下反硝化对NO3-去除效率分别为65%(水稻田)、83%(蔬菜地)和76%(葡萄园),表明反硝化是长三角地区地下水NO3--N去除的主要机制。这主要是因为研究区域低DO和高DOC的地下水环境有利于反硝化的进行。由于反硝化活性较高,在各层地下水中均能观测到高浓度exN2和N2O。这些溶解性气态氮主要通过地下水流进入临近水域,未纳入当前的区域氮素平衡体系。在反硝化较为强烈的葡萄园和蔬菜地,溶解性气态氮流失量与NO3--N淋溶损失量相当,是不可忽略的氮素损失途径。
| [1] |
马立珊, 钱敏仁. 太湖流域水环境硝态氮和亚硝态氮污染的研究. 环境科学, 1987, 8(2): 60-65. Ma L S, Qian M R. Nitrate and nitrite pollution in water evironmental inTaihu lake basin (In Chinese). Environmental Sciences, 1987, 8(2): 60-65. (  0) 0) |
| [2] |
程谊, 贾云生, 汪玉, 等. 太湖竺山湾小流域果园养分投入特征及其土壤肥力状况分析. 农业环境科学学报, 2014, 33(10): 1940-1947. Cheng Y, Jia Y S, Wang Y, et al. Nutrient inputs and soil fetility status in orchards of Zhushan Bay in Taihu Lake watershed (In Chinese). Journal of Agro-Environment Science, 2014, 33(10): 1940-1947. DOI:10.11654/jaes.2014.10.010 (  0) 0) |
| [3] |
闵炬, 陆扣萍, 陆玉芳, 等. 太湖地区大棚菜地土壤养分与地下水水质调查. 土壤, 2012, 44(2): 213-217. Min J, Lu K P, Lu Y F, et al. Investigation of soil fetility and quality of ground water in greenhouse vagetable fields of Tai Lake region (In Chinese). Soils, 2012, 44(2): 213-217. (  0) 0) |
| [4] |
徐力刚, 王晓龙, 崔锐, 等. 不同农业种植方式对土壤中硝态氮淋失的影响研究. 土壤, 2012, 44(2): 225-231. Xu L G, Wang X L, Cui R, et al. Study of nitrate nitrogen leaching chractersistcs in different agricultural planted farmland (In Chinese). Soils, 2012, 44(2): 225-231. (  0) 0) |
| [5] |
Ju X, Kou C, Zhang F, et al. Nitrogen balance and groundwater nitrate contamination:Comparison among three intensive cropping systems on the North China Plain . Environmental Pollution, 2006, 143(1): 117-125.
(  0) 0) |
| [6] |
Zhou J, Gu B, Schlesinger W H, et al. Significant accumulation of nitrate in chinese semi-humid croplands . Scientific Reports, 2016(6): Article number 25088.
(  0) 0) |
| [7] |
Gu B, Ge Y, Chang S X, et al. Nitrate in groundwater of China:Sources and driving forces . Global Environmental Change, 2013, 23(5): 1112-1121. DOI:10.1016/j.gloenvcha.2013.05.004
(  0) 0) |
| [8] |
Rivett M O, Buss S R, Morgan P, et al. Nitrate attenuation in groundwater:A review of biogeochemical controlling processes . Water Research, 2008, 42(16): 4215-4232. DOI:10.1016/j.watres.2008.07.020
(  0) 0) |
| [9] |
Li X, Xia L, Yan X. Application of membrane inlet mass spectrometry to directly quantify denitrification in flooded rice paddy soil . Biology and Fertility of Soils, 2014, 50(6): 891-900. DOI:10.1007/s00374-014-0910-2
(  0) 0) |
| [10] |
Bu X L, Zhao C X, Han F Y, et al. Nitrate reduction in groundwater and isotopic investigation of denitrification in integrated tree-grass riparian buffers in Taihu Lake watershed, eastern China . Journal of Soil and Water Conservation, 2017, 72(1): 45-54. DOI:10.2489/jswc.72.1.45
(  0) 0) |
| [11] |
夏永秋, 李跃飞, 张心昱, 等. 太湖地区稻作系统不同水体硝态氮同位素特征及污染源. 中国环境科学, 2014, 34(2): 505-510. Xia Y Q, Li Y F, Zhang X Y, et al. Nitrogen isotopic characteristics and source attribution of nitrate in different water bodies in the paddy rice system of the Taihu Lake region (In Chinese). China Environmental Sciences, 2014, 34(2): 505-510. (  0) 0) |
| [12] |
Blicher-Mathiesen G, McCarty G, Nielsen L. Denitrification and degassing in groundwater estimated from dissolved dinitrogen and argon . Journal of Hydrology, 1998, 208(1/2): 16-24.
(  0) 0) |
| [13] |
Fox R, Fisher T, Gustafson A, et al. Searching for the missing nitrogen:Biogenic nitrogen gases in groundwater and streams . The Journal of Agricultural Science, 2014, 152(S1): 96-106. DOI:10.1017/S0021859614000070
(  0) 0) |
| [14] |
Kana T M, Darkangelo C, Hunt M D, et al. Membrane inlet mass spectrometer for rapid high-precision determination of N2, O2, and Ar in environmental water samples . Analytical Chemistry, 1994, 66(23): 4166-4170. DOI:10.1021/ac00095a009
(  0) 0) |
| [15] |
Weymann D, Well R, Flessa H, et al. Groundwater N2O emission factors of nitrate-contaminated aquifers as derived from denitrification progress and N2O accumulation . Biogeosciences, 2008(5): 1215-1226.
(  0) 0) |
| [16] |
Trimmer M, Risgaard-Petersen N, Nicholls J C, et al. Direct measurement of anaerobic ammonium oxidation(anammox)and denitrification in intact sediment cores . Marine Ecology-Progress Series, 2006, 326: 37-47. DOI:10.3354/meps326037
(  0) 0) |
| [17] |
Terry R, Tate Iii R, Duxbury J. The effect of flooding on nitrous oxide emissions from an organic soil . Soil Science, 1981, 132(3): 228-232. DOI:10.1097/00010694-198109000-00006
(  0) 0) |
| [18] |
朱兆良, 范晓晖, 孙永红, 等. 太湖地区水稻土上稻季氮素循环及其环境效应. 作物研究, 2004, 18(4): 187-191. Zhu Z L, Fan X H, Sun Y H, et al. The nitrogen cycle and environmental effects in rice paddy in Taihu Lake region (In Chinese). Crop Research, 2004, 18(4): 187-191. DOI:10.3969/j.issn.1001-5280.2004.04.002 (  0) 0) |
| [19] |
Di H, Cameron K. Nitrate leaching in temperate agroecosystems:Sources, factors and mitigating strategies . Nutrient Cycling in Agroecosystems, 2002, 64(3): 237-256. DOI:10.1023/A:1021471531188
(  0) 0) |
| [20] |
王敬, 张金波, 蔡祖聪. 太湖地区稻麦轮作农田改葡萄园对土壤氮转化过程的影响. 土壤学报, 2016, 53(1): 166-176. Wang J, Zhang J B, Cai Z C. Effects of conversion of paddy field into vineyard on soil nitrogen transformation in the Taihu Lake region of China (In Chinese). Acta Pedologica Sinica, 2016, 53(1): 166-176. (  0) 0) |
| [21] |
Yeomans J C, Bremner J M, McCarty G W. Denitrification capacity and denitrification potential of subsurface soils . Communications in Soil Science and Plant Analysis, 1992, 23(9/10): 919-927.
(  0) 0) |
| [22] |
Jahangir M M R, Khalil M I, Johnston P, et al. Denitrification potential in subsoils:A mechanism to reduce nitrate leaching to groundwater . Agriculture, Ecosystems & Environment, 2012, 147: 13-23.
(  0) 0) |
| [23] |
Khalil M I, Richards K G. Denitrification enzyme activity and potential of subsoils under grazed grasslands assayed by membrane inlet mass spectrometer . Soil Biology and Biochemistry, 2011, 43(9): 1787-1797. DOI:10.1016/j.soilbio.2010.08.024
(  0) 0) |
| [24] |
Fellows C S, Hunter H M, Eccleston C E A, et al. Denitrification potential of intermittently saturated floodplain soils from a subtropical perennial stream and an ephemeral tributary . Soil Biology and Biochemistry, 2011, 43(2): 324-332. DOI:10.1016/j.soilbio.2010.10.019
(  0) 0) |
| [25] |
Jarvis S C, Hatch D J. Potential for denitrification at depth below long-term grass swards . Soil Biology and Biochemistry, 1994, 26(12): 1629-1636. DOI:10.1016/0038-0717(94)90315-8
(  0) 0) |
| [26] |
McAleer E B, Coxon C E, Richards K G, et al. Groundwater nitrate reduction versus dissolved gas production:A tale of two catchments . Science of the Total Environment, 2017, 586: 372-389. DOI:10.1016/j.scitotenv.2016.11.083
(  0) 0) |
| [27] |
Zhou W, Ma Y, Well R, et al. Denitrification in shallow groundwater below different arable land systems in a high nitrogen-loading region . Journal of Geophysical Research:Biogeosciences, 2018, 123: 991-1004. DOI:10.1002/jgrg.v123.3
(  0) 0) |
| [28] |
Gardner J R, Fisher T R, Jordan T E, et al. Balancing watershed nitrogen budgets:Accounting for biogenic gases in streams . Biogeochemistry, 2016, 127(2/3): 231-253.
(  0) 0) |
| [29] |
Siemens J, Haas M, Kaupenjohann M. Dissolved organic matter induced denitrification in subsoils and aquifers? . Geoderma, 2003, 113(3): 253-271.
(  0) 0) |
| [30] |
Well R, Höper H, Mehranfar O, et al. Denitrification in the saturated zone of hydromorphic soils-laboratory measurement, regulating factors and stochastic modeling . Soil Biology and Biochemistry, 2005, 37(10): 1822-1836. DOI:10.1016/j.soilbio.2005.02.014
(  0) 0) |
| [31] |
Jahangir M M, Minet E P, Johnston P, et al. Mustard catch crop enhances denitrification in shallow groundwater beneath a spring barley field . Chemosphere, 2014, 103: 234-239. DOI:10.1016/j.chemosphere.2013.11.072
(  0) 0) |
| [32] |
Ti C, Luo Y, Yan X. Characteristics of nitrogen balance in open-air and greenhouse vegetable cropping systems of China . Environmental Science and Pollution Research, 2015, 22(23): 18508-18518. DOI:10.1007/s11356-015-5277-x
(  0) 0) |
| [33] |
朱兆良. 中国土壤氮素研究. 土壤学报, 2008, 45(5): 778-783. Zhu Z L. Research on soil nitrogen in China (In Chinese). Acta Pedologica Sinica, 2008, 45(5): 778-783. DOI:10.3321/j.issn:0564-3929.2008.05.003 (  0) 0) |
 2018, Vol. 56
2018, Vol. 56

