2. 广西农业科学院广西甘蔗遗传改良重点实验室,南宁 530007
广西是我国最大的秋冬蔬菜生产基地,其中辣椒的种植面积最大[1]。随着人民生活水平及对蔬菜品质要求的提高,辣椒生产中运用地膜越来越广泛。覆盖地膜不仅具有促进水土保持与防治杂草滋生等作用,也有利于提高土壤温度、促进土壤微生物对有机残体的分解,提高土壤有效养分含量[2],而且能保水保墒、抑制杂草、改善土壤结构[3]和提高土壤肥力,降低生产成本[4-5]。尽管地膜在调节地温方面发挥着重要作用,但长期覆盖地膜在提高土壤温度的同时往往也会加速土壤有机质降解,从而导致土壤有机质含量下降,进而影响土壤肥力和生态系统功能[6-7]。研究发现,覆盖地膜调控土壤温度主要取决于薄膜对光的透过率和反射率,即:很大程度上取决于薄膜的颜色:无色透明膜对促进地温升高效果最好,但容易滋生杂草;黑色地膜虽然能有效防止杂草,但升温效果不及透明膜[8]。这些结果表明,不同地膜的作用效果不同,而实际生产中如果盲目地使用地膜,长期连续或全程覆膜将有可能恶化土壤生态条件,导致土壤肥力下降[9]。近年来,虽然国内外对覆盖地膜影响辣椒生长、产量的研究较多,但大多数研究聚焦于地上部生理指标以及根系分泌物,而且涉及地膜的应用研究多集中在北方寒冷地区。目前,我国南方地区地膜使用量和地膜覆盖面积呈逐年增加的趋势[10],虽然地膜对作物生长发育、产量、品质及土壤理化性质、水分利用效率等方面至今已有较多的研究[11],但应用不同地膜对土壤微生物多样性的影响研究多集中于我国北方地区[12-13]。南方地区应用地膜对土壤微生物多样性的影响鲜见报道。
鉴于此,本文研究覆盖不同种类地膜对我国南方植椒土壤温度、理化性状及生物学特性的影响,旨在评价覆盖地膜对植椒土壤肥力与健康状况的影响,为我国南方地区科学利用地膜提供理论依据和技术支撑。
1 材料与方法 1.1 供试材料试验于2016年在广西大学农学院蔬菜生产基地(东经108º18′,北纬22º51′)进行,辣椒品种为“桂椒8号”,于2月下旬育苗,4月中旬定植。试验地土壤类型为赤红壤,试验前土壤pH6.08, 有机质含量7.30 g·kg-1,全氮0.82 g·kg-1,全磷0.51 g·kg-1,全钾14.57 g·kg-1,碱解氮57.60 mg·kg-1,有效磷3.22 mg·kg-1,速效钾82.94 mg·kg-1。
1.2 试验设计试验设五个处理:不覆膜对照(M1)和覆盖黑色聚乙烯地膜(黑色地膜,M2)、无色透明聚乙烯地膜(无色透明地膜,M3)、银色聚乙烯地膜(银色地膜,M4)、麻类材料地膜(M5),每个处理3个重复,随机排列。每个小区面积30 m2,株距30 cm×30 cm。辣椒定植后,施肥等日常管理按常规方法统一进行。
在辣椒采收期间(8月25日)按“S”型采集耕作层(0~30 cm)土壤样品。每个小区分别采集5~8个点,去除残根等杂物后充分混匀,并用无菌塑料袋装好带回实验室。一部分室内自然风干后过40目筛,用于土壤理化性状测定;另一部分过10目筛后,置于4℃冰箱保存,用于土壤生物学性状分析(其中用于高通量测序分析的样品在采集后按测序样品要求即时处理并包装送检)。
2016年6月1日至8月25日每天早上10:00,采用WQG-16曲管地温表读取不同深度(5、10、15、20 cm)土壤温度。土壤含水量、pH和有机质分别采用称重法、PHS-3C型精密酸度计和重铬酸钾容量法测定。
土壤微生物生物量碳、氮和磷测定采用氯仿熏蒸提取-容量分析法[14]、茚三酮比色法[15]和磷钼蓝比色法[16]。土壤β–葡糖苷酶、氨肽酶和磷酸酶活性测定采用Hayano[17]、Ladd[18]及Tabatabai和Bremner[19]的方法。
1.3 土壤细菌群落结构与多样性分析总DNA提取与PCR扩增:采用OMEGA土壤提取试剂盒提取总DNA,用Qubit2.0检测DNA浓度,琼脂糖凝胶检测DNA完整性。每个样品3次重复,将同一样品的DNA混合,作为每份土壤样品的总DNA。PCR扩增采用的是16S rRNA基因中V3-V4高变区通用引物341F(CCTACGGGNGGCWGCA)和805R(GACTACHVGGGTATCTAATCC)。扩增条件设置:94℃预变性3 min,94 ℃变性30s,45℃退火20 s,65 ℃延伸30s,5个循环;94 ℃延伸20 s,55℃退火20 s,72 ℃延伸30 s,20个循环。进一步采用匹配Illumina测序接头和标签引物扩增,采用生工琼脂糖回收试剂盒(cat:SK8131)对DNA进行回收。回收产物用Qubit2.0定量,根据测得的DNA浓度将所有样品按照1:1的比例进行混合,用于后续测序。
高通量测序:16S rRNA基因的PCR产物由北京百迈客生物科技有限公司完成测序,测序仪器为Illumina公司的新一代测序仪Hiseq 2500,测序所得结果,采用prinseq软件对reads1、reads2的3端进行质控,截掉质量低的数据,以提高后续序列融合比率。通过Flash软件融合双末端序列,使其形成一条序列。采用prinseq软件对各个样品进行去引物序列、短片段、低复杂度序列、低质量序列。
1.4 数据处理试验数据采用Excel 2010进行计算处理,采用SPSS 19.0软件进行方差分析,显著性检验采用邓肯(Duncan)法,不同字母表示在P < 0.05水平具有显著性差异。使用R语言工具进行微生物多样性数据统计及绘制样品各分类水平下的群落结构柱形图和维恩图。
2 结果 2.1 覆盖地膜对土壤温度、含水量和pH的影响表 1所示土壤温度为试验地夏季(6、7、8月份)每天上午10:00地温的观测平均值。由表 1可知,随着土壤深度的增加,覆盖地膜土壤温度均呈现先降低后增高的趋势,这与外界光照强度以及地膜的保温作用有关。其中,覆盖具有良好透水、透气效果的麻类材料(M5),土壤温度和对照相比无显著差异,而覆盖透水、透气性差的聚乙烯类地膜,土壤温度则显著升高。覆盖无色透明地膜,不同深度地温均显著高于对照,且在四种地膜中保温效果最好;覆盖黑色地膜对不同深度土壤温度的提升效果显著高于银色地膜、麻类材料。
|
|
表 1 覆盖不同种类地膜对植椒土壤温度、含水量和pH的影响 Table 1 Effects of mulching on soil temperature, water content, and pH in pepper fields relative to type of the mulching film |
与对照相比,覆盖除麻类材料外的地膜均显著提高了植椒土壤的含水量,并显著提高了土壤pH,即聚乙烯类材料地膜更有助于保持土壤水分含量和减缓土壤pH下降。
2.2 覆盖地膜对土壤微生物生物量及酶活性的影响由表 2可知,与对照相比,覆盖不同种类地膜不同程度地提高了植椒土壤的微生物碳、氮、磷。其中,覆盖不同种类地膜均显著提高了土壤微生物生物量碳,覆盖无色透明地膜和麻类材料地膜均显著提高土壤微生物生物量氮,覆盖除麻类材料外的地膜均显著提高了土壤微生物生物量磷。与此同时,覆盖除麻类材料外的地膜均显著提高了植椒土壤的β-葡糖苷酶、氨肽酶和磷酸酶活性,提升效果最佳的为无色透明地膜。覆盖地膜条件下土壤酶活性的变化与土壤温度的变化趋势相似。
|
|
表 2 覆盖不同种类地膜对植椒土壤微生物生物量及酶活性的影响 Table 2 Effects of mulching on soil microbial biomass and enzyme activities in pepper fields relative to type of the mulching film |
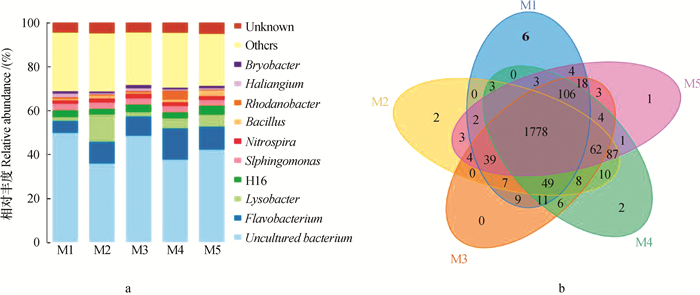
测序共获得有效序列348 687条,平均长度为422 bp,测序覆盖率在82.4%~84.8%。根据分类学分析结果,可以得知不同分组(或样本)在属分类水平上的群落结构组成情况(图 1)。未可培养细菌在所有土壤样品均占据优势,相对丰度最高的为M1(达53.78%)、最低的为M2(黑色地膜,为40.57%),表明覆膜降低了未可培养细菌的相对丰度。可鉴别的优势菌属依次为黄杆菌属、溶杆菌属、产碱杆菌属和鞘氨醇单胞菌属。其中,覆膜土壤黄杆菌属的相对丰度显著大于CK,且M4(银色地膜)处理最高。M4处理土壤pH显著高于其他处理(表 1),而且覆盖黑色和无色透明地膜处理土壤的pH亦显著高于CK,推测土壤酸化可能不利于黄杆菌属细菌的生存。姜英华等[20]研究发现溶杆菌对真菌、革兰氏阴性细菌、革兰氏阳性细菌和线虫都有突出的拮抗作用。覆膜处理(M3除外)土壤中溶杆菌属的相对丰度均显著高于CK,其中M2处理最高,表明遮光环境或更有利于溶杆菌的生长。芽胞杆菌是一类常见的根际促生细菌,其对促进植物生长和减少病害发生有积极作用[21]。覆膜处理中M5(麻类材料地膜)处理的芽胞杆菌相对含量最高,表明遮光与透气的地膜有助于土壤中芽胞杆菌的生存与繁衍。此外,产黄杆菌属(Rhodanobacter)、鞘氨醇单胞菌属、硝化螺菌属(Nitrospira)、产碱杆菌属、粘细菌属(Haliangium)、藓杆菌属(Bryobacter)等在覆膜条件下均发生了一定程度的变化,但变化幅度小于黄杆菌属和溶杆菌属。
|
图 1 土壤细菌属分类水平的组成和相对丰度(a)及在OTU水平的维恩图(b) Fig. 1 Composition and relative abundance of the soil bacteria at genus level (a) and Venn diagram of the soil bacteria at OTU level (b) |
维恩图可以反映环境样品的相似性及重叠情况,由图 1b可知,不同处理土壤样品的共有OTU值为1 778,占各样品总OTU的84.4%~88.1%。其中,M1所含的独立OTU数值最大为6,占该样品总OTU的0.29%;而其他样品所含独立OTU值分别为(2、0、2、1),占各样品总OTU的0%~0.10%,均小于对照(M1)。究其原因,可能是CK直接与空气接触从而产生土壤细菌与外界环境细菌之间的相互交换以及黏附于空气尘埃细菌的沉降有关;而其他处理由于地膜的物理阻隔作用使覆盖地膜区土壤微环境相对封闭。
微生物群落多样性特征分析中,Chao1、ACE、香农指数越大,说明样品的物种多样性越高[22];由表 3可知,Chao1指数与香农指数由高到低依次为无色透明地膜、麻类材料地膜、银色地膜、黑色地膜、CK;ACE指数由高到低的顺序为无色透明地膜、银色地膜、CK、麻类材料地膜、黑色地膜,表明除覆盖黑色地膜和麻类材料地膜会使土壤细菌群落中某些细菌种群繁殖较好、在群落中优势度上升而导致ACE指数下降外,覆盖银色和无色透明地膜并没有导致土壤细菌丰富度指数ACE下降。
|
|
表 3 覆盖不同种类地膜对植椒土壤细菌多样性的影响 Table 3 Effect of mulching on soil bacterial diversity in pepper fields relative to type of the mulching film |
地膜具有调节土温、保持水土、维持土壤结构、防治杂草与病毒病以及防止土壤盐类积累等作用,而且黑色和银色地膜提高土温效果不及透明地膜[8]。本试验结果发现南方地区应用地膜,其调节土温的效果与上述的研究结果相一致,即:无色透明地膜提升土温的效果最为显著;表明透气透水性差的聚乙烯类地膜均有助于提升土壤温度,但覆盖材料的透光性能亦是左右土壤温度的一个重要因素。另一方面,聚乙烯类材料地膜覆盖显著地减缓了土壤pH的下降,原因可能是聚乙烯类材料地膜透水性能不佳,从而减少了雨水或灌溉水对土壤盐基阳离子的淋溶,从而减缓了土壤pH的下降。由此推断,在南方植椒土壤中应用不同地膜(尤其是聚乙烯材料地膜)不仅有助于提高土壤温度与含水量,而且对减缓土壤pH下降亦具有显著效果。
土壤微生物活性与多样性的变化能敏感地反映出土壤生态系统的质量和健康状况[23]。其中,土壤酶参与土壤中几乎所有的有机物质和营养元素的循环[24],其活性大小不仅能指示土壤生态系统功能变化的多样性和稳定性[25],亦是评价土壤健康和肥力水平的重要指标[26]。本试验中,覆盖聚乙烯材料地膜均显著提高植椒土壤中β-葡糖苷酶、磷酸酶和氨肽酶活性,这一现象可能与地膜覆盖处理提高了土壤温度、土壤含水量以及细菌数量紧密相关。土壤微生物生物量同样是衡量土壤质量、维持土壤肥力和作物生产力的一个重要指标[27]。与对照相比,覆盖地膜均不同程度地提高了植椒土壤中的微生物生物量碳、氮、磷,表明南方地区当前应用地膜的模式不仅没有导致土壤质量劣化,而且还有助于维护植椒土壤肥力。
基于高通量测序技术分析发现,覆盖不同地膜还有利于提高植椒土壤细菌丰富度和多样性指数,尤其以无色透明地膜的提升效果尤为显著,其原因可能与无色透明地膜显著提高土壤温度、含水量和减缓土壤pH下降的作用紧密相关。根据位于北方地区的研究中发现,地膜覆盖显著影响土壤微生物的群落结构,其影响效果主要通过对土壤有机碳、总氮、有效磷、pH以及土壤水分的间接作用实现的[13]。本试验中,南方地区应用地膜覆盖,同样不同程度地具有影响土壤微生物丰富度和多样性的作用效果,尤其是无色透明地膜,呈现影响土壤微生物丰富度和多样性的显著效果。其原因可能与无色透明地膜显著提高了土壤温度,水分含量以及减缓土壤pH的下降紧密相关。另一方面,表明我国南、北方地区应用地膜对土壤微生物多样性的影响具有相似的作用效果。此外,属分类水平上,黄杆菌属、溶杆菌属、产碱杆菌属、鞘氨醇单胞菌属、芽胞杆菌属和未可培养细菌属细菌均为南方地区覆盖地膜植椒土壤中的优势菌属。已有的研究证实,溶杆菌属的大多数细菌对病原真菌、G+细菌、线虫和绿藻均有突出的拮抗作用[28];芽胞杆菌属细菌对促进诱导作物系统抗性和促进植物生长有积极作用[29];鞘氨醇单胞菌属的细菌对于土壤中多环芳烃的降解起到一定的调控作用[30];产碱杆菌属细菌(H16)参与土壤中氢化酶的合成调节,对土壤氢循环起到重要的作用[31]。
虽然在97%相似度的聚类分析还未能完全查明土壤细菌遗传多样性,但是基于高通量测序深度基本能够反映该区域细菌群落的种类和结构,完全可以定量比较整个群落组成和多样性的相对差异[32]。本试验的结果表明,南方地区当前辣椒实际生产中,应用不同地膜,尤其覆盖以聚乙烯为原料的黑色、银色或无色透明地膜不仅有助于提高土壤温度和保持水土、减缓土壤酸化进程,维护土壤肥力,提高植椒土壤中细菌丰富度和多样性指数,而且还助于形成以溶杆菌属、芽胞杆菌属细菌等为优势菌属的土壤环境,这些具有促进植物生长,维护土壤健康作用的优势菌属将有利于生态防控植椒菜园土传病害的发生与蔓延。
4 结论当前南方地区辣椒实际生产中,覆盖不同种类地膜(尤其以聚乙烯为原料的无色透明地膜、黑色地膜和银色地膜)不仅有助于提高辣椒菜园耕作层土壤温度与含水量,而且对减缓南方地区植椒土壤pH的下降、提高土壤微生物生物量以及酶活性具有显著的效果。同时,应用地膜还有助于提高植椒土壤中细菌的丰富度(Chao1)和多样性(Shannon)指数。另一方面,黄杆菌属、溶杆菌属、产碱杆菌属、鞘氨醇单胞菌属和芽胞杆菌属细菌等一些具有生防作用的益生细菌是覆盖地膜植椒土壤中的优势菌属,表明当前南方地区辣椒生产中应用地膜不仅没有导致植椒土壤质量劣化,而且还有助于提高土壤肥力和保持土壤健康。
| [1] |
王日生, 王萌, 赵虎, 等. 广西辣椒产业发展现状及对策. 中国蔬菜, 2015(4): 7-9. Wang R S, Wang M, Zhao H., et al. Current situation and countermeasure for pepper industry in Guangxi (In Chinese). China Vegetable, 2015(4): 7-9. DOI:10.3969/j.issn.1000-6346.2015.04.003 (  0) 0) |
| [2] |
李世朋, 蔡祖聪, 杨浩, 等. 长期定位施肥与地膜覆盖对土壤肥力和生物学性质的影响. 生态学报, 2009, 29(5): 2489-2497. Li S P, Cai Z C, Yang H, et al. Effects of long-term fertilization and plastic film covering on some soil fertility and microbial properties (In Chinese). Acta Ecologica Sinica, 2009, 29(5): 2489-2497. DOI:10.3321/j.issn:1000-0933.2009.05.036 (  0) 0) |
| [3] |
郭图强. 荒漠绿洲香梨园生草覆盖节水省肥效果研究. 中国农学通报, 2005, 21(2): 276-279. Guo T Q. Effect of growing and covering grass on water and fertilizer saving in pear orchard in desert oasisland (In Chinese). Chinese Agriculture Science Bulletin, 2005, 21(2): 276-279. DOI:10.3969/j.issn.1000-6850.2005.02.085 (  0) 0) |
| [4] |
Oelber M M, Voroney R P, Schlnvoigt A M, et al. Decomposition of Erythrina poeppigiana leaves in 3-, 9-, and 18-year-old alley cropping systems in Costa Rice . Agroforestry Systems, 2004, 63: 27-32. DOI:10.1023/B:AGFO.0000049430.52250.87
(  0) 0) |
| [5] |
Sommer R, Vlekp L G, Deabreus T D, et al. Nutrient balance of shifting cultivation by burning or mulching in the Eastern Amazon evidence for subsoil nutrient accumulation . Nutrient Cycling in Agroecosystems, 2004, 68: 257-271. DOI:10.1023/B:FRES.0000019470.93637.54
(  0) 0) |
| [6] |
汪景宽, 张继宏, 须湘成, 等. 长期地膜覆盖对土壤氮素状况的影响. 植物营养与肥料学报, 1996, 2(2): 125-130. Wang J K, Zhang J H, Xu X C, et al. Effect of long-term covering with plastic film on characteristics of nitrogen in soil (In Chinese). Plant Nutrition and Fertilizer Science, 1996, 2(2): 125-130. DOI:10.3321/j.issn:1008-505X.1996.02.005 (  0) 0) |
| [7] |
Insam H, Mmitchell C C, Dormaar J F. Relationship of soil microbial biomass and activity with fertilization practice and crop yield of three Ultisols . Soil Biology & Biochemistry, 1991, 23: 459-464.
(  0) 0) |
| [8] |
李式军, 郭世荣. 设施园艺学. 北京:中国农业出版社, 2016, 112-113. Li S J, Guo S R. Protected horticulture (In Chinese). Beijing:China Agriculture Press, 2016, 112-113. (  0) 0) |
| [9] |
于树. 长期不同施肥处理及地膜覆盖对棕壤有机碳组分及微生物学多样性的影响. 沈阳: 沈阳农业大学, 2009. Yu S. Effects of long-term different fertilization and plastic mulching on soil organic fractions and microbial diversity in brown earth (In Chinese). Shengyang: Shengyang Agricultural University, 2009. (  0) 0) |
| [10] |
蔡金洲, 张富林, 范先鹏, 等. 南方平原地区地膜使用与残留现状调查分析. 农业资源与环境学报, 2013, 30(5): 23-30. Cai J Z, Zhang F L, Fan X P, et al. The status of film application and residue in the southern plains of China (In Chinese). Journal of Agricultural Resources and Environment, 2013, 30(5): 23-30. DOI:10.3969/j.issn.1005-4944.2013.05.006 (  0) 0) |
| [11] |
李尚中, 樊廷录, 赵刚, 等. 旱地玉米不同覆盖栽培模式的土壤水热特征及产量品质效应. 草业学报, 2018, 27(4): 34-44. Li S Z, Fan T L, Zhao G, et al. Effect of different cultivation patters on soil moisture, temperature, yield and quality of dryland maize (In Chinese). Acta Prataculturae Sinica, 2018, 27(4): 34-44. (  0) 0) |
| [12] |
朱丽霞. 不同调控措施对旱作农田土壤碳氮及微生物学特性的影响. 陕西杨凌: 西北农林科技大学, 2018. Zhu L X. Effects of different managemeng practices on soil carbon and nitrogen and related microbial processes in rain-fed farmlands (In Chinese). Yangling, Shaanxi: Northwest A & F University, 2018. (  0) 0) |
| [13] |
Farmer J. Effects of long-term fertilization and plastic film mulching on soil microbial communities in a brown earth of northeast China . Shenyang: Shenyang Agricultural University, 2016.
(  0) 0) |
| [14] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C . Soil Biology & Biochemistry, 1987, 19(6): 703-707.
(  0) 0) |
| [15] |
Joergensen R G, Brookes P C. Ninhydrin-reactive nitrogen measurements of microbial biomass in 0.5 M K2SO4 soil extracts . Soil Biology & Biochemistry, 1990, 22: 1023-1027.
(  0) 0) |
| [16] |
吴金水, 肖和艾, 陈桂秋, 等. 旱地土壤微生物磷测定方法研究. 土壤学报, 2003, 40(1): 70-78. Wu J S, Xiao H A, Chen G Q, et al. Measurement of microbial biomass-P in upland soils in China (In Chinese). Acta Pedologica Sinica, 2003, 40(1): 70-78. DOI:10.3321/j.issn:0564-3929.2003.01.010 (  0) 0) |
| [17] |
Hayano K. A method for the determination of β-glucosidase activity in soil . Soil Science & Plant Nutrition, 1973, 19(2): 103-108.
(  0) 0) |
| [18] |
Ladd J N. Properties of proteolytic enzymes extracted from soil . Soil Biology & Biochemistry, 1972, 4(2): 227-237.
(  0) 0) |
| [19] |
Tabatabai M A, Bremner J M. Use of P-nitrophenyl phosphate for assay of soil phosphatase activity . Soil Biology & Biochemistry, 1969, 1(4): 301-307.
(  0) 0) |
| [20] |
姜英华, 胡白石, 刘凤权. 重要土传病原菌拮抗细菌的筛选与鉴定. 中国生物防治, 2005, 21(4): 260-264. Jiang Y H, Hu B S, Liu F Q. Selection and identification of antagonistic bacteria against soil borne plant pathogens (In Chinese). Chinese Journal of Biological Control, 2005, 21(4): 260-264. (  0) 0) |
| [21] |
李哲. 芽孢杆菌促生作用及具有促生作用的挥发物质研究. 南京: 南京农业大学, 2013. Li Z. Bacillus sp.promote growth and the volatile of the strains (In Chinese). Nanjing: Nanjing Agricultural University, 2013. (  0) 0) |
| [22] |
Grice E A, Kong H H, Conlan S, et al. Topographical and temporal diversity of the human skin microbiome . Science, 2009, 324(5931): 1190-1192. DOI:10.1126/science.1171700
(  0) 0) |
| [23] |
钟文辉, 蔡祖聪. 土壤管理措施及环境因素对土壤微生物多样性影响研究进展. 生物多样性, 2004, 12(4): 456-465. Zhong W H, Cai Z C. Effect of soil management practices and environmental factors on soil microbial diversity:A review (In Chinese). Biodiversity Science, 2004, 12(4): 456-465. DOI:10.3321/j.issn:1005-0094.2004.04.010 (  0) 0) |
| [24] |
杨宁, 杨满元, 雷玉兰, 等. 衡阳紫色土丘陵坡地土壤酶活性对植被恢复的影响. 生态环境学报, 2014, 23(4): 575-580. Yang N, Yang M Y, Lei Y L, et al. Response of soil enzyme activities to re-vegetation on sloping-land with purple soils in Hengyang of Hunan Province (In Chinese). Ecology and Environmental Sciences, 2014, 23(4): 575-580. DOI:10.3969/j.issn.1674-5906.2014.04.005 (  0) 0) |
| [25] |
Sowerb Y A, Emmet T B, Beie R C, et al. Microbial community changes in health and soil communities along a geographical gradient:Interaction with climate change manipulations . Soil Biology & Biochemistry, 2005(37): 1805-1813.
(  0) 0) |
| [26] |
Ahamadou B, Huang Q, Chen W, et al. Microcalorimetric assessment of microbial activity in long-term fertilization experimental soils of Southern China . FEMS Microbiology Ecology, 2009, 70(2): 186-195.
(  0) 0) |
| [27] |
Powlson D S, Brookes P C, Christensen B T. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation . Soil Biology & Biochemistry, 1987, 19(2): 159-164.
(  0) 0) |
| [28] |
Hayward A C, Fegan N, Fegan M, et al. Stenotrophomonas and Lysobacter:Ubiquitous plant-associated gamma-proteobacteria of developing significance in applied microbiology . Journal of Applied Microbiology, 2010, 108(3): 756-770. DOI:10.1111/j.1365-2672.2009.04471.x
(  0) 0) |
| [29] |
Kloepper J W, Ryu C M, Zhang S. Induced systemic resistance and promotion of plant growth by Bacillus spp . Phytopathology, 2004, 94(11): 1259-1266. DOI:10.1094/PHYTO.2004.94.11.1259
(  0) 0) |
| [30] |
Macchi M, Martinez M, Tauil R M N, et al.Insights into the genome and proteome of Sphingomonas paucimobilis strain 20006FA involved in the regulation of polycyclic aromatic hydrocarbon degradation.World Journal of Microbiology and Biotechnology, 2018.https: //doi.org/10.1007/s11274-017-2391-6
(  0) 0) |
| [31] |
Lenz O, Schwartz E, Dernedde J, et al. The Alcaligenes eutrophus H16hoxX gene participates in hydrogenase regulation . Journal of Bacteriology, 1994, 176(14): 4385-4393. DOI:10.1128/jb.176.14.4385-4393.1994
(  0) 0) |
| [32] |
Shaw A K, Halpern A L, Beeson K, et al. It's all relative:Ranking the diversity of aquatic bacterial communities . Environmental Microbiology, 2008, 10(9): 2200-2210. DOI:10.1111/j.1462-2920.2008.01626.x
(  0) 0) |
2. Guangxi Key Laboratory of Sugarcane Genetic Improvement, Guangxi Academy of Agricultural Sciences, Nanning 530007, China
 2019, Vol. 56
2019, Vol. 56


