土壤微生物是森林土壤的重要组成部分,在有机质形成与分解、养分循环与转化以及能量流动等方面具有重要地位[1]。其中,森林土壤微生物生态学研究,能深入了解森林土壤中营养元素的循环。微生物多样性和丰度是表征微生物生态学特征的重要指标[2]。它极易受环境参数的影响,而森林中林型、海拔、土壤性质、温度和水分均是至关重要的影响因子[3-4]。植被可以通过改变土壤的营养物质(有机碳和氮)含量、含水量、温度、通气性以及微环境pH等关键环境因子来间接影响土壤微生物的群落结构和丰度[5-6]。
目前,学者已展开植被与微生物群落相关的研究。如Ding等[7]对神农架林线附近灌木林和针叶林土壤微生物调查发现,灌木林土壤微生物群落多样性均高于针叶林。在研究川西亚高山云杉人工林土壤微生物发现:林龄的增加使土壤微生物香农多样性指数和Pielou均匀度指数均呈现先增后减的趋势[8]。此外,研究还发现不同植被土壤微生物的丰度存在显著差异[9]。可见植被差异对微生物群落结构和丰度有重要影响。
缙云山国家森林保护区位于重庆市北部,植物种类繁多,素有“川东小峨眉”之称。目前该区域的研究多侧重于土壤理化性质[10-11],少数涉及土壤微生物均采用单一分析技术或传统培养方法来研究某种植被土壤微生物群落[9, 12],难以系统全面地了解该地区微生物群落结构和丰度差异。结合该区域已有研究:表层土壤营养物质丰富,但易受外界环境影响[10-11]。本文运用多种分子技术(末端限制性片段多态性分析,克隆文库和荧光定量PCR技术)对该区域典型植被类型(常绿阔叶林、针叶林、毛竹林、针阔混交林)表层土壤细菌、真菌和古菌群落结构和丰度进行定性和定量的分析,有益于了解土壤微生物与森林生产力及其发展演替的关系,为天然林的保护和可持续经营提供科学依据。
1 材料与方法 1.1 研究区概况缙云山国家森林保护区位于重庆市北碚区境内(106°17′43″-106°24′50″E,29°41′08″-29°52′03″N; 面积7 600 hm2; 平均海拔951.5 m; 相对高差600 m),以下简称缙云山。属典型的北亚热带温暖湿润季风气候。年均气温13.6 ℃,年均降水量1 612 mm,年均日照1 294 h,年平均蒸发量777 mm。缙云山植被类型多样,有高等植物244科、973属、1 861种。土壤为三叠纪须家河砂岩发育的酸性黄壤(pH 4.0~4.5)。
1.2 研究方法2016年5月下旬选取马尾松针叶林(简称针叶林,Coniferous forest)、壳斗科阔叶林(简称阔叶林,Broadleaved-leaved forest)、马尾松针叶/壳斗科阔叶混交林(简称针阔混交林,Mixed broadleaf-conifer forest)以及毛竹林(P. pubescen forest)土壤为研究对象,每种植被类型选择3个取样点,在0~20 cm土层深度取样,按四分法进行混匀,分别取1 kg混后土样,得到三等份样品,用无菌PET树脂袋封装,放于冰盒中带回实验室。取50 g土样于-20 ℃冰箱保存以备分子实验分析,其余部分用于理化性质分析。采样点的详细情况见表 1。
|
|
表 1 采样点基本概况 Table 1 Outline of the sampling sites |
理化分析土样在室温下自然风干,然后研磨过筛(2 mm、1 mm、0.25 mm),基本理化性质采用文献[13]的方法进行分析。土壤基本理化性质见表 2。
|
|
表 2 土壤基本理化性质 Table 2 Physical and chemical properties of the soils at the sampling sites |
利用Fast DNA spin kit for soil试剂盒(MP BIO, Inc., Irvine, CA, USA)根据制造商提供的说明进行提取。洗脱后总DNA体积为50 μL。利用1%的琼脂糖凝胶电泳确认总DNA的提取质量(电泳条带的单一性),同时用NanoDrop ND-1000微光分光光度计(Thermo Fisher Scientific, USA)测定浓度。
1.4 荧光定量PCR荧光定量PCR技术作为核酸定量检测技术[14],用基因拷贝数来表征某种微生物或功能微生物的丰度,具体步骤如下:
标准样品的制作:选用荧光定量PCR引物扩增细菌16SrRNA(F357/R518)、古菌16SrRNA (U519/806R)和真菌ITS(NSI1/58A2R)区片段,对扩增产物进行纯化(Universal DNA Purification Kit,TIANGEN)并克隆(见1.6)。将测序成功的阳性克隆子提取菌液质粒DNA(TIANprep Mini Plasmid Kit,TIANGEN),并用NanoDrop ND-1000微光分光光度计、测定质粒DNA浓度并计算拷贝数,以10倍为间隔系列稀释成荧光定量PCR标准品。
样品测定:将样品与标准品同时进行qPCR检测,包括阴性对照在内每个样品设3个重复。反应体系为:ABI Prower SybrGreen qPCR Master Mix (ABI,USA)10 mL,细菌、真菌和古菌DNA模板分别为2、4和1 mL,引物各1、0.5和1 µL(10 pmol·µL-1),加ddH2O至终体积20 mL。每个循环中荧光收集在83 ℃下进行。荧光定量PCR分析由ABI 7500型实时荧光定量PCR系统进行。
1.5 末端限制性片段多态性分析末端限制性片段多态性分析(Terminal restriction fragment length polymorphism analysis,T-RFLP)[15]具体步骤如下:
基因片段的扩增:选用正向引物5′端带荧光物质FAM标记的引物扩增细菌16SrRNA(27F/1492R)、古菌16S rRNA (Arch109F/Arch958R)和真菌ITS(ITS1F/ITS4)区片段。扩增体系为50 mL,后扩增产物的纯化和浓度测定同1.4。
产物酶切:采用限制性内切酶HhaⅠ、HhaⅠ、RasⅠ(NEB,BioLabs)分别对细菌、真菌和古菌的纯化DNA进行单酶切,根据制造商提供的说明进行酶切。随后将酶切产物送至送生工生物工程有限公司(上海)进行毛细管电泳测序并输出末端限制性片段(Terminal restrictions fragments, T-RFs)图谱[16]。
1.6 克隆文库选用5′端不带荧光物质的引物对细菌16SrRNA、古菌16S rRNA和真菌ITS(相关引物序列和体系见1.5)扩增。对扩增PCR产物进行纯化(Universal DNA Purification Kit,TIANGEN),通过pGEM-T载体(Promega)进行克隆。根据“蓝白斑”(抑制剂:X-Gal、Ampr和IPTG)对克隆子进行筛选。每个样品各挑取15个阳性克隆子送至生工生物有限公司进行序列测定,每个样本正确测序约10条。序列登录号为:MG641100~MG641145;MG670412~MG670441;MG825386~MG825410;MH016246~MH016250。
1.7 数据分析土壤理化性质、微生物拷贝数的单因素方差分析和皮尔逊相关分析利用SPSS 21.0处理。基于T-RFLP数据,群落结构α-多样性指数分析,即丰富度指数(Richness,S)、均匀度指数(Evenness,J′)、香农-威尔指数(Shannon-Weiner index,H′),利用Excel 2003完成; 利用R语言的vegan软件包进行非度量多维尺度分析(Non-metric Multidimensional scaling,NMDS)和pheatmap软件包进行热图(Heatmap)的绘制。基于测序结果,利用Mothur软件对序列进行可操作分类单元(Operational Taxonomic Units,OTU)分析,通过Mega5.0软件对OTU进行系统发育树的建立。利用CANOCO软件对土壤环境因子和微生物群落结构进行冗余分析(RedundancyAnalysis, RDA),并运用蒙特卡罗置换检验(Monte Carlo permutation test)去检验约束排序模型的显著性(用F值作为统计量)。
2 结果 2.1 不同森林植被土壤微生物的丰度不同森林植被土壤微生物基因拷贝数,见图 1。细菌、古菌16S rRNA和真菌ITS基因拷贝数范围分别为:3.04×105~4.47×108、1.46×106~1.53×107和6.44×104~1.90×106 copies·µL-1。如图可知,真菌ITS基因拷贝数最低; 针叶林土壤微生物基因拷贝数最低。此外,由单因素方差分析可知:森林植被类型的变化对细菌和古菌影响显著(P < 0.05)。皮尔逊相关分析显示:细菌16S rRNA基因拷贝数与pH显著正相关(r=0.607,P < 0.05);古菌16S rRNA基因拷贝数与含水量值显著负相关(r=-0.919,P < 0.01)。

|
注:不同小写字母表示处理间差异显著(P < 0.05)Note:Different letters above the bars mean significant difference at the 0.05 level 图 1 不同森林植被的土壤微生物拷贝数 Fig. 1 Copy number of the soil microbes relative to vegetation |
基于T-RFLP分析图谱,利用多种а-多样性特征值表征不同森林植被土壤微生物群落结构多样性,见表 3。同一种特征值中,真菌的数值均最高。针-阔混交林土壤中细菌的群落特征值显著高于其他植被类型(P < 0.05)。此外,植被变化对古菌多样性的影响最为显著(P < 0.05)。
|
|
表 3 不同森林植被土壤微生物的群落特征值 Table 3 Characteristics of the soil microbial community structure relative to vegetation |
基于T-RFLP数据,NMDS分析通过二维排序图中样点间距离表征不同植被类型土壤中微生物群落结构的相似性。由图 2可知,微生物在不同森林植被土壤中的群落结构的相似性各异。在细菌和古菌群落结构中,针叶林的样点距离最远,即群落结构最不相似。而真菌的群落结构,针阔混交林和竹林的群落结构最为相似。
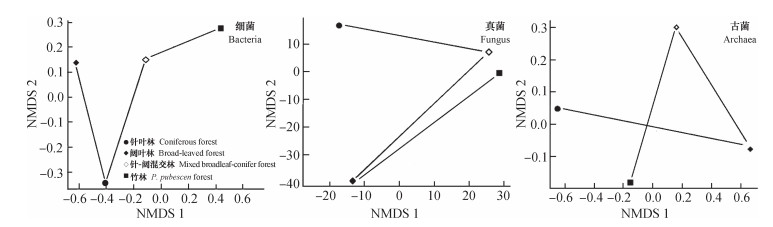
|
图 2 不同森林植被土壤微生物群落结构的NMDS分析 Fig. 2 NMDS analysis of the soil microbial community structure relative to vegetation |
热图分析能反映出不同森林植被土壤微生物群落结构的聚类分析和各群落组成的相对丰度。土壤微生物群落结构的聚类分析结果与NMDS结果相同(图 3)。阔叶林的细菌种群组成最为复杂,其次为针叶林,而竹林最为单一。针阔混交林的真菌群落组分最为单一。各植被类型间古菌的种群组成差异不明显。
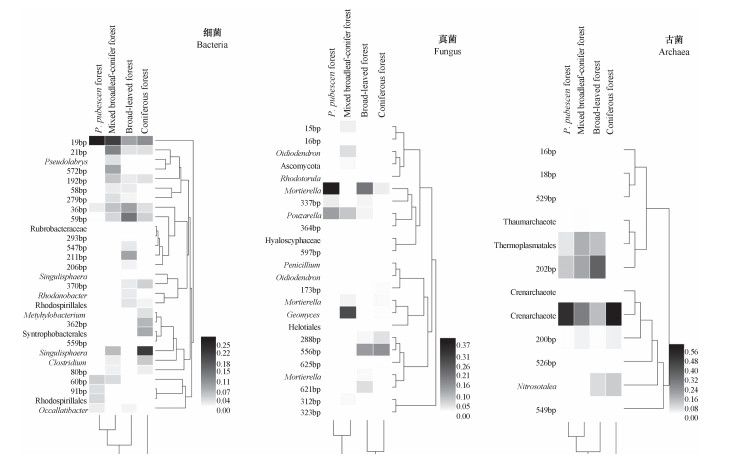
|
图 3 不同森林植被土壤微生物群落组成相对丰度分析 Fig. 3 Relative abundant analysis of the soil microbial community structure relative to vegetation |
不同森林植被土壤微生物群落结构与土壤理化性质的相关性分析,见图 4。细菌群落结构与pH、全磷和全钾显著相关(F分别为9.18、4.84和2.58,P < 0.05,蒙特卡罗算法); 真菌群落结构与全钾、有效磷和速效钾显著相关(F分别为2.28、2.15和5.83,P < 0.05,蒙特卡罗算法)。古菌群落结构与全磷、速效钾和全钾显著相关(F分别为2.56、1.20和1.35,P < 0.05,蒙特卡罗算法)。

|
TP,全磷Total phosphorus; TK,全钾Total potassium; AP,有效磷Available phosphorus; AK,速效钾Readily available K 图 4 不同森林植被土壤微生物群落的RDA排序图 Fig. 4 RDA ordination analysis of the soil microbial community structure relative to vegetation |
不同森林植被土壤微生物系统发育分析见图 5a-c。细菌有48个OTU; 真菌有33个OTU; 古菌有31个OTU; 由图 5a可知:缙云山地区的细菌种类十分丰富,包括9个细菌门。针叶林中包含的细菌种类最单一,无优势种类。阔叶林和针-阔混交林土壤细菌的优势种群分别为:Chloroflexi(4/13)和Acidobacteria(7/15)。竹林土壤细菌的种类最为丰富,其中Gamma-proteobacteria(4/15)为优势种群,且Firmicute和Bacteroidetes为独有种群。由图 5b可知,针阔混交林中真菌只有Ascomycota(7/7)。竹林和针叶林没有明显的优势种群。在阔叶林土壤中的优势种群为Zygomycota(8/10)。由图 5c可知,竹林中包括两个古菌门,优势古菌为Thaumarchaeota(7/11)。针阔混交林的古菌中Thaumarchaeota(7/14)在三种菌中占优势。针叶林和阔叶林分别包括2种和3种古菌门,且均与其他植被下古菌的种类有明显差别,尤其是针叶林,即它包括很大部分的未知古菌(5/10)。
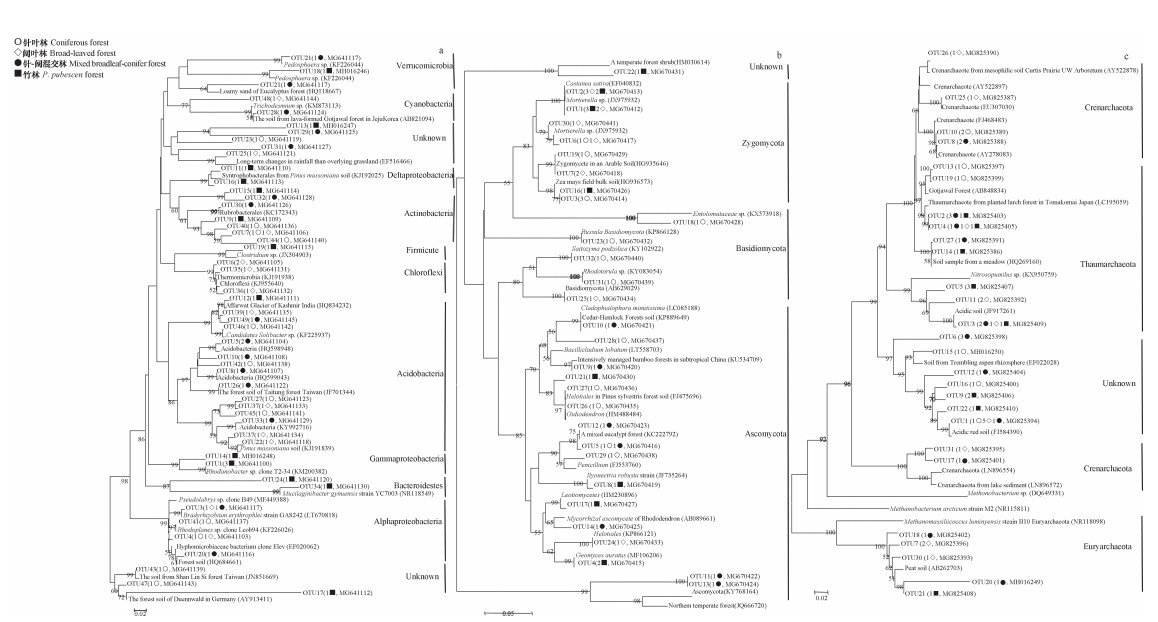
|
图 5 不同森林植被细菌(a)、真菌(b)和古菌(c)的系统发育分析 Fig. 5 Phylogeny analysis of the Bacteria(a), fungus (b)and Archaea(c) in the soil relative to vegetation |
本文采用荧光定量PCR技术定量分析不同森林植被类型土壤微生物丰度的差异。本文中不同植被土壤的微生物丰度不存在绝对优势,在已有森林土壤微生物丰度的研究中也得到相同结论[17-19]。Siles和Margesin[17]研究发现,高原森林土壤中细菌的拷贝数最高,真菌次之,古菌最低。而此结果与本文中细菌最高,古菌次之,真菌最低的结果相悖。这可能是由于微生物群落对环境条件(如水、气、热等生态因子)的偏好性以及不同气候区、不同森林类型下土壤性质的差异[20-21]。本研究中,针叶林各微生物丰度明显低于其他植被类型,这与传统微生物学方法研究缙云山不同林分下微生物的丰度结果类似[9]。微生物丰度与土壤理化性质间的相关性研究众多,Bardelli等[18]研究发现细菌的拷贝数受到pH的影响,而真菌几乎不受环境影响,以上结果与本文相同; 但古菌的拷贝数与pH和C/N含量显著有关,与本文相异。但已有研究给出合理解释:缙云山地区是季风气候,季节性降水直接影响土壤中的pH和C/N[11],所以古菌受水分含量显著影响也是可信的。
T-RFLP技术研究不同森林植被土壤微生物的群落结构。本文研究显示:真菌的群落结构最丰富,且香农-威尔多样性指数显示古菌多样性受植被影响最显著,该结果与已有研究存在差异[22]。一方面是因为高浓度氢离子抑制细菌生长[23]。本实验土壤偏酸性,这就解释了为何真菌群落结构略高于细菌。另一方面,植被品种有直接影响。如Lynch等[24]研究不同树种下微生物的群落结构发现:虽然木黄麻和桉树均为乔木,但桉树分泌的有毒的酚醛树脂和萜烯使其土壤中微生物群落更易受影响。本文中阔叶林的细菌群落结构最复杂,这与柳春林等[25]结果相似。不同森林植被土壤中细菌、真菌和古菌均表现出差异,但程度不同与前人研究相同[18, 22, 26]。
系统发育分析得出不同森林植被优势土壤微生物种群。本文阔叶林土壤微生物的优势种群(Chloroflexi、Zygomycota)与已有研究不一致,但已有研究也没有确定的结论[22, 27-28]。这直接表现出阔叶林植物品种对微生物的影响[24]。本文中针阔混交混林和竹林中优势种群(Acidobacteria、Gamma-proteobacteria; Ascomycota; Thaumarchaeota)与前人所得结果完全相异[16, 22],间接地表现出缙云山地区的针阔混交林和竹林的微生物群落有明显的特异性。文中T-RFLP和克隆技术在体现细菌群落组成上有一定程度的差异,主要是T-RFLP分析中自动排除了一些丰度较低的细菌种群,而克隆在挑取克隆子时可控性小,可能挑取到丰度低的种群。所以两种分子技术综合应用能帮助我们得到更可信的结果。
CANOCO软件中RDA分析可研究环境因子对微生物群落结构的影响[8, 26, 29]。微生物群落结构的环境因子多为pH、全氮和有机碳[8, 26, 29],因为有机碳是微生物的主要能源物质[30],而氮的有效性常抑制微生物的生长活性[31]。但本研究中影响微生物群落结构的主要环境因子除pH外还有钾、磷元素。首先,相对于有机碳和氮因素,钾、磷元素的限制掩盖了它们的作用。其次,缙云山森林地区受亚热带季风影响,雨水众多易造成土壤中盐基离子(K+)被淋洗,使土壤pH浓度普遍偏低[11]。而酸性环境会使P生成难溶性物质不能被微生物利用[32]。以上均可能是造成K、P元素成为抑制微生物群落结构发展的原因。
4 结论本研究利用多种分子技术得出缙云山国家森林保护区内4种植被类型土壤微生物群落结构和丰度的变化规律。针叶林土壤微生物的群落结构最为独特,但丰度最低。真菌的多样性最高,但丰度优势不明显。在众多森林土壤环境理化性质中,除了pH,K、P元素同样是制约微生物群落结构发展的主要环境因子。不同植被土壤微生物群落结构和丰度均存在明显地差异,这种差异与林型、土壤环境存在密切的关系,在一定程度上反映了各植被土壤有机质转化状况、土壤肥力水平和稳定性。对天然林的保护和持续经营有一定理论与实际意义。
| [1] |
鲁顺保, 张艳杰, 陈成榕, 等. 基于BIOLOG指纹解析三种不同森林类型土壤细菌群落功能差异. 土壤学报, 2013, 50(3): 618-623. Lu S B, Zhang Y J, Chen C R, et al. Analysis of functional differences between soil bacterial communities in three different types of forest soil based on Biolog fingerprint (In Chinese). Acta Pedologica Sinica, 2013, 50(3): 618-623. (  0) 0) |
| [2] |
林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能. 土壤学报, 2008, 45(5): 892-900. Lin X G, Hu J L. Scientific connotation and ecological service function of soil microbial diversity (In Chinese). Acta Pedologica Sinica, 2008, 45(5): 892-900. DOI:10.3321/j.issn:0564-3929.2008.05.016 (  0) 0) |
| [3] |
张于光, 宿秀江, 丛静, 等. 神农架土壤微生物群落的海拔梯度变化. 林业科学, 2014, 50(9): 161-166. Zhang Y G, Su X J, Cong J, et al. Variation of soil microbial community along elevation in the shennongjia mountain (In Chinese). Scientia Silvae Sinicae, 2014, 50(9): 161-166. (  0) 0) |
| [4] |
Shen C, Xiong J, Zhang H, et al. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai mountain . Soil Biology & Biochemistry, 2013, 57(2): 204-211.
(  0) 0) |
| [5] |
郑淑霞, 上官周平. 陆生植物稳定碳同位素组成与全球变化. 应用生态学报, 2006, 17(4): 733-739. Zheng S X, ShangGuan Z P. Terrestrial plant stable carbon isotope composition and global change (In Chinese). Chinese Journal of Applied Ecology, 2006, 17(4): 733-739. DOI:10.3321/j.issn:1001-9332.2006.04.034 (  0) 0) |
| [6] |
Liu Z F, Fu B J, Zhang X X, et al. Plant biomass, soil water content and soil N:P ratio regulating soil microbial functional diversity in a temperate steppe:a regional scale study . Soil Biology & Biochemistry, 2010, 42(3): 445-450.
(  0) 0) |
| [7] |
Ding J, Zhang Y, Deng Y, et al. Integrated metagenomics and network analysis of soil microbial community of the forest timberline . Scientific Reports, 2015. DOI:10.1038/srep07994
(  0) 0) |
| [8] |
罗达, 刘顺, 史作民, 等. 川西亚高山不同林龄云杉人工林土壤微生物群落结构. 应用生态学报, 2017, 28(2): 519-527. Luo D, Liu S, Shi Z M, et al. Soil microbial community structure in Picea asperata plantations with different ages in subalpine of western Sichuan, Southwest China (In Chinese). Chinese Journal of Applied Ecology, 2017, 28(2): 519-527. (  0) 0) |
| [9] |
李勇, 顾垚俊, 刘益军, 等. 缙云山森林土壤微生物数量与群落特征. 植物营养与肥料学报, 2012, 18(5): 1161-1167. Li Y, Gu Y J, Liu Y J, et al. Characteristics of microbial quantities and communities in forest soils of Jinyun Mountain (In Chinese). Plant Nutrition and Fertilizer Science, 2012, 18(5): 1161-1167. (  0) 0) |
| [10] |
李鉴霖, 江长胜, 郝庆菊. 缙云山不同土地利用方式土壤有机碳组分特征. 生态学报, 2015, 35(11): 3733-3742. Li J L, Jiang C S, Hao Q J. Distribution characteristics of soil organic carbon and its physical fractions under the different land uses in Jinyun Mountain (In Chinese). Acta Ecologica Sinica, 2015, 35(11): 3733-3742. (  0) 0) |
| [11] |
胡波, 张会兰, 王彬, 等. 重庆缙云山地区森林土壤酸化特征. 长江流域资源与环境, 2015, 24(2): 300-309. Hu B, Zhang H L, Wang B, et al. Analysis on the forest soil acidification and mechanisms in ChongQing Jinyun Mountain (In Chinese). Resources and Environment in the Yangtze Basin, 2015, 24(2): 300-309. DOI:10.11870/cjlyzyyhj201502017 (  0) 0) |
| [12] |
曾清苹, 何丙辉. 应用PLFA法分析氮沉降对缙云山马尾松林土壤微生物群落结构的影响. 环境科学, 2016, 37(9): 3590-3597. Zeng Q P, He B H. Effect of nitrogen deposition on soil microbial community structure determined with the PLFA method under the Masson pine forest from Mt.Jinyun, Chongqing (In Chinese). Environmental Science, 2016, 37(9): 3590-3597. (  0) 0) |
| [13] |
鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000: 14-24. Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed. Beijing: China Agriculture Press, 2000: 14-24. (  0) 0) |
| [14] |
张晶, 张惠文, 张成刚. 实时荧光定量PCR及其在微生物生态学中的应用. 生态学报, 2005, 25(6): 1445-1450. Zhang J, Zhang H W, Zhang C G. Real-time fluorescent quantitative PCR and its application in microbial ecology (In Chinese). Acta Ecologica Sinica, 2005, 25(6): 1445-1450. DOI:10.3321/j.issn:1000-0933.2005.06.032 (  0) 0) |
| [15] |
马万里, Tibbits J, Adams M, 等. 土壤微生物多样性研究的新方法. 土壤学报, 2004, 41(1): 103-107. Ma W L, Tibbits J, Adams M, et al. A new method for research on soil microbial diversity (In Chinese). Acta Pedologica Sinica, 2004, 41(1): 103-107. DOI:10.3321/j.issn:0564-3929.2004.01.017 (  0) 0) |
| [16] |
周永娜, 乔沙沙, 刘晋仙, 等. 庞泉沟自然保护区华北落叶松与桦树林土壤微生物群落结构. 应用与环境生物学报, 2017, 23(3): 520-526. Zhou Y N, Qiao S S, Liu J X, et al. Characteristics of the soil microbial community structures of Betula platyphylla and Larix principis-rupprechtii forests in the Pangquangou Reserve (In Chinese). Chinese Journal of Applied and Environmental Biology, 2017, 23(3): 520-526. (  0) 0) |
| [17] |
Siles J A, Margesin R. Abundance and diversity of bacterial, archaeal, and fungal communities along an altitudinal gradient in Alpine forest soils:What are the driving factors? . Microbial Ecology, 2016, 72(1): 207-220. DOI:10.1007/s00248-016-0748-2
(  0) 0) |
| [18] |
Bardelli T, Gómez-Brandón M, Ascher-Jenull J, et al. Effects of slope exposure on soil physico-chemical and microbiological properties along an altitudinal climosequence in the Italian Alps . Science of the Total Environment, 2016, 575: 1041-1055.
(  0) 0) |
| [19] |
赵丽丽.汶川大地震对四川理县岷江柏林土壤理化性质及微生物多样性的影响.北京: 中国林业科学研究院, 2015 Zhao L L. The effect of wenchuan earthquake on the physical and chemical properties and microbial diversity of the soil in the Minjiang River in Lixian County, Sichuan Province(In Chinese). Beijing: Chinese Academy of Forestry, 2015 (  0) 0) |
| [20] |
徐文熙, 王继华, 张雪萍. 我国森林土壤微生物生态学研究现状及展望. 哈尔滨师范大学自然科学学报, 2009, 25(3): 96-100. Xu W X, Wang J H, Zhang X P. Research progress on microbiological ecology of forest in China (In Chinese). Natural Sciences Journal of Harbin Normal University, 2009, 25(3): 96-100. DOI:10.3969/j.issn.1000-5617.2009.03.027 (  0) 0) |
| [21] |
黄志宏, 田大伦, 粱瑞友, 等. 南岭不同林型土壤微生物数量特征分析. 中南林业科技大学学报, 2007, 27(3): 1-5. Huang Z H, Tian D L, Liang R Y, et al. Quantitative characteristics of soil micro-organisms of different stands in Nanling Mountains, South China (In Chinese). Journal of Central South University of Forestry and Technology, 2007, 27(3): 1-5. (  0) 0) |
| [22] |
Ma B, Dai Z, Wang H, et al. Distinct biogeographic patterns for archaea, bacteria, and fungi along the vegetation gradient at the continental-scale in Eastern China . mSystems, 2017. DOI:10.1128/mSystems.00174-16
(  0) 0) |
| [23] |
Rousk J, Brookes P C, Bååth E. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization . Applied and Environmental Microbiology, 2009, 75(6): 1589-1596. DOI:10.1128/AEM.02775-08
(  0) 0) |
| [24] |
Lynch H B, Epps K Y, Fukami T, et al. Introduced canopy tree species effect on the soil microbial community in a montane tropical forest . Pacific Science, 2007, 66(2): 141-150.
(  0) 0) |
| [25] |
柳春林, 左伟英, 赵增阳, 等. 鼎湖山不同演替阶段森林土壤细菌多样性. 微生物学报, 2012, 52(12): 1489-1496. Liu C L, Zou W Y, Zhao Z Y, et al. Bacterial diversity of different successional stage forest soils in Dinghushan (In Chinese). Acta Microbiologica Sinica, 2012, 52(12): 1489-1496. (  0) 0) |
| [26] |
Chu H, Neufeld J D, Walker V K, et al. The influence of vegetation type on the dominant soil bacteria, archaea, and fungi in a low arctic tundra landscape . Soil Science Society of America Journal, 2011, 75(5): 1756-1765. DOI:10.2136/sssaj2011.0057
(  0) 0) |
| [27] |
王璇, 李慧敏, 曹婷婷, 等. 不同林龄木麻黄林地土壤真菌多样性及特有真菌代谢产物化感潜力. 应用与环境生物学报, 2017, 23(4): 670-677. Wang X, Li H M, Cao T T, et al. The diversity of soil fungi and allelopathic potentials of special fungal metabolites in Casuarina equisetifolia woodlands of different stand ages (In Chinese). Chinese Journal of Applied and Environmental Biology, 2017, 23(4): 670-677. (  0) 0) |
| [28] |
李巍, 刘洋, 罗钦, 等. 武夷山常绿阔叶林土壤微生物多样性的季节动态. 热带亚热带植物学报, 2017, 25(2): 115-126. Li W, Liu Y, Luo Q, et al. Seasonal dynamics in soil microorganisms diversity of evergreen broadleaved forest in Wuyi Mountains, Southeastern China (In Chinese). Journal of Tropical and Subtropical Botany, 2017, 25(2): 115-126. (  0) 0) |
| [29] |
字洪标, 向泽宇, 王根绪, 等. 青海不同林分土壤微生物群落结构(PLFA). 林业科学, 2017, 53(3): 21-32. Zi H B, Xiang Z Y, Wang G X, et al. Profile of microbial community under different stand types in Qinghai Province (In Chinese). Scientia Silvae Sinicae, 2017, 53(3): 21-32. (  0) 0) |
| [30] |
Griffiths B S, Ritz K, Ebblewhite N, et al. Soil microbial community structure:Effects of substrate loading rates . Soil Biology & Biochemistry, 1998, 31(1): 145-153.
(  0) 0) |
| [31] |
Craine J M, Morrow C, Fierer N. Microbial nitrogen limitation increases decomposition . Ecology, 2007, 88(8): 2105-2113. DOI:10.1890/06-1847.1
(  0) 0) |
| [32] |
胡红青, 贺纪正, 李学垣, 等. 有机酸对酸性土壤吸附磷的影响. 华中农业大学学报, 1997, 16(1): 37-42. Hu H Q, He J Z, Li X Y, et al. Effect of organic acids on phosphate adsorption by acid soil (In Chinese). Journal of Huazhong Agricultural University, 1997, 16(1): 37-42. (  0) 0) |
 2019, Vol. 56
2019, Vol. 56


