2. 浙江大学环境与资源学院,杭州 310058
生物质炭是指生物质经过热解/碳化后得到的稳定富碳产物[1]。生物质经热解形成了稳定的芳香结构, 可以作为固碳材料储存碳素, 减缓大气-生物圈之间的碳循环; 生物质炭化被认为是缓解全球气候变暖的良好策略。同时, 生物质炭具有多孔性、巨大的表面积以及表面大量的含氧官能团(如羧基、羟基、羰基等)等特性, 可以吸附固定土壤中的多种污染物, 被广泛用于环境修复领域[2-3]。因此, 生物质炭在环境中的稳定性对其储碳及环境修复功能的持久性具有重大意义, 是评价生物质炭潜在功能以及应用前景的重要指标之一。
生物质炭能够较好地抵抗微生物的降解, 与土壤中其他有机质相比更加稳定[4], 估算的生物质炭中碳在环境中的平均停留时间可达90~1 600年[5]。但是事实上, 当生物质炭添加到土壤后仍有部分有机碳和无机碳会从生物质炭中释放, 造成一定的碳流失, 可能影响全球C循环[6-7]。生物质炭在环境中能以微粒的形式(胶体)和可溶性有机碳(DOC)在土壤中迁移, 造成碳素流失[8]。研究指出, 相比于生物质炭大颗粒, 可溶性生物质炭和胶体态生物质炭具有更强的移动性、吸附性和光化学反应活性, 它们在环境中将参与更多的生物地球化学过程[9-10]。因此, 生物质炭的稳定性是生物质炭作为储碳材料和土壤修复剂的关键因素。生物质炭一旦进入环境, 将与环境介质发生各种相互作用。影响生物质炭在环境中稳定性的主要过程包括物理分解、化学分解和生物分解。物理分解过程主要是以物理侵蚀为主而引起的生物质炭破碎分解过程以及由于雨水淋洗和径流作用下的物理迁移过程, 如干-湿循环、冻-融循环和根的穿透作用引起的破碎分解、地表径流的冲刷迁移作用等。化学分解过程主要包括水溶液作用下生物质炭的溶解过程, 以及以氧化作用为主造成的生物质炭结构性质改变的化学氧化过程, 如可溶性生物质炭的释放, 生物质炭表面含氧官能团的增加以及亲水性的增强等。生物分解过程是生物质炭因土壤生物的新陈代谢以及酶的催化降解作用而被利用的过程, 如微生物矿化等。虽然以往也有研究者对生物质炭的稳定性方面作过综述报道, 但他们主要总结了生物质炭稳定性评价和预测方法[11-15]、以及生物质炭的分子结构对生物质炭环境行为和稳定性的影响[8]。目前, 关于生物质炭在环境中流失过程及其影响因素尚未作详细阐述。因此, 本综述的目的是系统阐述环境中关乎生物质炭稳定性的物理分解、化学分解和生物分解三大作用过程及其影响因素, 并提出生物质炭稳定性研究领域未来值得关注的方向。
目前人们表征生物质炭稳定性的主要指标有:(1)可溶性生物质炭(粒径小于0.45µm)的释放量, 即单位质量生物质炭所释放的可溶性生物质炭的量, 单位mg·g-1; (2)碳截留指数(R50), 即在热重(TGA)分析测试中, 生物质炭与石墨烯质量下降50%时, 相应温度的比值[16]; (3)抗氧化性, 即各氧化剂(K2Cr2O7/H2SO4、H2O2、KMnO4、NaClO和Fenton试剂氧化法)对生物质炭进行氧化, 氧化前后C的损失率; (4)生物利用率(与C/N、芳香度、可利用组分有关), 即在生物质炭中, 因微生物作用而损失的C的质量占原生物质炭总质量的百分数, 通常以培养体系中二氧化碳的释放量来计算, 单位mg·g-1[17]。
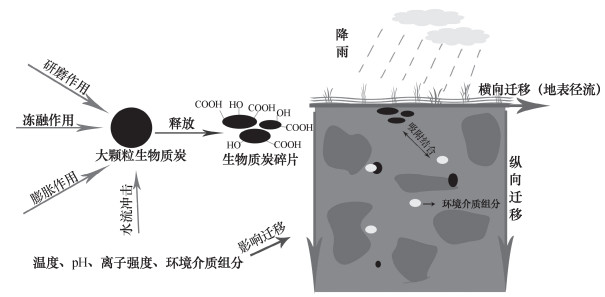
1 生物质炭的物理分解过程生物质炭在土壤中的物理分解主要包括物理侵蚀和物理迁移作用, 物理侵蚀作用所形成的碎片在淋溶和地表冲刷作用下发生迁移, 造成一定的C流失, 其主要作用途径及影响因素总结如图 1所示。
|
图 1 环境中生物质炭的物理分解与迁移过程 Fig. 1 Physical decomposition and migration processes of biochar in the environment |
生物质炭在土壤中将受到研磨作用、冻融作用和膨胀作用等发生物理性破碎。生物质炭颗粒属于易碎颗粒。Ponomarenko和Anderson[18]发现生物质炭在土壤中的粒径分布相对均一, 且随着时间的推移, 生物质炭颗粒的外形会变得更圆, 这种变化的速率取决于土壤的研磨性。他们还发现嵌入生物质炭孔隙中的黏粒矿物随着时间的推移而增加。在干湿循环的环境中, 生物质炭中元素O/C比增大, 使得生物质炭加速破碎; 生物质炭吸收了水分使得生物质炭的石墨单元放热膨胀, 对其物理结构造成压力, 碳结构破碎, 从大颗粒分解成微小颗粒[19]。Brodowski等[20]发现土壤中一小部分的生物质炭颗粒与微团聚体的形成有关, 与其他颗粒有机质相比, 这部分生物质炭作用形成的微团聚体含碳比例更高, 并认为这种团聚体形式有利于生物质炭抵抗物理分解作用。在更早的研究中人们发现在亚马逊黑土中很大部分的生物质炭都是以非聚合体的形式存在[21]。虽然生物质的来源决定了制备过程中生物质炭的物理碎片构成, 但是在土壤环境下生物质来源对生物质炭碎片化的影响并没有那么重要, 因为土壤环境中的温度、压力、根系、水分渗透等物理风化作用, 以及生物质炭与土壤组分的相互作用更为重要[22]。野外条件下的老化作用使得石灰性土壤中的木屑及污泥来源生物质炭物理性碎片显著增加, 土壤矿物进入生物质炭的微孔隙中[22]。生物质炭在土壤中受到的物理侵蚀作用如同地质风化作用一样, 是一个缓慢的过程。然而, 利用新制备的生物质炭进行的实验室研究显示, 在几天到几年的时间内, 生物质炭出现了一定的质量损失, 有时候损失甚至偏高[23]。Spokas等[19]研究发现在水流冲击下, 生物质炭也易磨损, 其表面不仅有流水侵蚀的遗迹, 还有从生物质炭颗粒释放的微米及亚微米级的碎片。这些微米及亚微米级碎片的形成可能与环境中生物质炭的初期质量损失相关。水流作用形成的生物质炭微米级碎片有着与生物质炭本体不同的物理化学性质, 如玉米秸秆中高温(300~600 ℃)制备的生物质炭微粒较本体生物质炭具有更高的含氧官能团和矿物元素组成、更高的比表面积和孔隙体积[10]。生物质炭热解温度对其抗物理分解作用也有一定的影响。高温制备的生物质炭在水流作用下形成的物理碎片较小, 最终的物理质量损失率较低[19]。低温制备的生物质炭(<500 ℃)在环境中的物理分解作用通常比较明显, 大于50%的生物质炭质量损失来自于物理分解作用[24]。生物质炭原料也会影响其物理稳定性。从宏观上看, 用木质原料生产的生物质炭绝大多数表现为粗糙而坚硬的结构, 且碳含量较高, 而用草、玉米和粪肥作为原料生产的生物质炭通常是粉末状的, 含碳较低, 但富含矿物质和营养物质。一般而言, 后者的抗物理分解作用较前者弱。目前, 关于土壤中生物质炭的物理侵蚀作用研究信息不多, 生物质炭哪些性质有利于抗物理侵蚀作用、生物质炭与土壤矿物的结合是否与其抗物理侵蚀作用相关、水流侵蚀带来的生物质炭微粒的初期释放机制是什么等问题均不得而知。
1.2 环境中生物质炭微粒的迁移过程在土壤中, 生物质炭由于物理侵蚀形成的生物质炭微粒在水流作用下会发生迁移流失。田间试验和实验室研究均表明在灌溉、降水和地表径流等作用下生物质炭能发生显著的原位流动和运移。Guggenberger等[25]证实生物质炭中的胶体态和溶解态是其发生移位迁移的主要形态。通过分析不同深度土壤中生物质炭的浓度, 人们发现生物质炭可以向下迁移10~140 cm[26-27]。实验室柱淋溶实验表明较小的水溶液离子强度、较高pH、腐殖酸存在、较低生物质炭热解温度、较小粒径等因素均能显著引发生物质炭胶体在土柱中的较强迁移[28-31]。土柱实验表明, 溶液pH越小, 450 ℃制备的硬木来源生物质炭微粒表面负电荷量越少, 与土壤颗粒之间的电荷排斥作用越小, 生物质炭微粒的迁移越弱[28]。通常生物质炭颗粒粒径越小, 迁移能力越强[30]。当生物质炭微粒粒径大于土壤孔径时, 在土壤表面会发生机械过滤, 应变使得颗粒在多种界面上截留, 如水膜、气-水-固界面。而不饱和介质流相对于饱和介质流, 由于水含量低, 受制于较小的土壤孔隙、砂粒周围的水膜以及气-水-固界面的扩张, 使得生物质炭颗粒的沉积率增加, 迁移性降低[28]。水稻土填充的饱和水柱迁移实验表明, 较低的离子强度下, 500 ℃制备的木片生物质炭微粒迁移性较强[31]。这是因为溶液离子强度的增加, 使得颗粒间的双电层被压缩, 厚度减小, 削弱了静电排斥作用。生物质炭的热解温度也会影响生物质炭颗粒表面的电荷特征, 从而影响其物理迁移性。实验室柱淋溶试验表明, 小麦秸秆和松针制备的生物质炭微粒的迁移能力随着生物质炭热解温度的升高而降低(350~550 ℃), 这主要是由于热解温度升高, 生物质炭颗粒表面电负性减弱以及酸—碱吸引作用的增强, 减小了生物质炭与多孔介质之间的斥力作用, 使得截留作用增强[30]。玉米秸秆制备的生物质炭微粒表面电负性也随着热解温度的升高而降低(450~600 ℃), 因而其在多孔介质中的迁移能力也随着热解温度的升高而降低[32]。
生物质炭也会因吸附其他物质, 使得电荷作用改变, 进而影响其迁移行为。腐殖酸可增强生物质炭表面的负电荷, 增强其迁移性; 而带正电荷的羟基氧化铁与生物质炭之间的静电引力作用以及萘在生物质炭表面吸附产生的负电荷遮蔽效应, 均会减少生物质炭微粒与介质颗粒间的电荷斥力作用, 使生物质炭微粒易于截留在土壤中[29, 33]。此外, 干-湿循环、冻-融循环能够增加生物质炭微粒的迁移性, 且冻-融循环较干-湿循环更能促进生物质炭微粒的迁移性。在冰冻过程中, 由于冰晶的膨胀作用, 使得生物质炭更易破碎[34]。尽管目前人们对生物质炭微粒在土壤中的物理迁移行为有了一定的认识, 但是以往大多数的研究是基于均质多孔介质试验, 对于生物质炭微粒在普遍存在的非均质多孔介质中迁移行为的研究很少, 生物质炭微粒与土壤组分如黏土矿物、生物膜、细胞外聚合物、有机质等界面作用机制研究尚不充分。
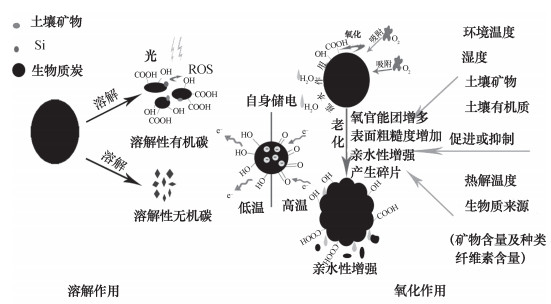
2 生物质炭的化学分解过程生物质炭的化学分解主要包括溶解作用和化学氧化作用, 其主要作用途径和影响因素总结如图 2所示。
|
图 2 环境中生物质炭的化学分解过程及影响因素 Fig. 2 Chemical decomposition process of biochar in the environment and its influencing factors |
环境温度、pH、矿物、生物质炭热解温度、生物质炭来源等对可溶性生物质炭的释放量有着重要影响。较高的环境温度以及碱性环境中, 500 ℃制备的麦秆来源生物质炭中溶解性有机质释放量大, 其组成主要以胡敏酸与富里酸为主[35]。可溶性生物质炭相较于大尺寸生物质炭有着不同的结构性质, 其表面分布着更为丰富的含氧官能团以及矿物质, 比表面积更大, 更高的负zeta电位[36]。由于可溶性生物质炭表面芳香簇被羧基与酚基取代, 其芳香度降低, 而亲水性增强, 因而反应性、迁移性有很大提高[37]。可溶性生物质炭有较高的光分解能力, 且大分子量的可溶性生物质炭的光解能力强于小分子量的可溶性生物质炭[38], 并能以溶解性生物质炭中的酚类结构为电子供体, 以矿质硅为媒介进行电子传递, 产生活性氧族(ROS), 如单线态氧以及过氧化物[9]。环境pH升高, 能够加强可溶性有机质从生物质炭本体释放; 同时环境温度升高使得可溶性有机质具有较高的溶解性, 并能促进生物质炭中固定碳的解吸[35]。土壤矿物能够通过盐离子桥梁作用以及范德华力作用吸附可溶性生物质炭, 从而降低可溶性生物质炭的流失, 其作用方式与矿物种类以及可溶性生物质炭浓度有关[39]。高温下制得的生物质炭表面氧官能团含量低, 亲水性弱, 不易释放可溶性生物质炭, 造成溶解流失。当热解温度从350 ℃升至800 ℃的过程中, 生物质炭释放的可溶性有机碳(DOC)浓度逐渐降低, 并且DOC的组成结构也发生变化。当热解温度低于350 ℃时, DOC中以类富里酸多酚以及水溶性的芳香结构为主; 当热解温度升至500 ℃时, 以富含羧基以及其他热化学转化过程产生的中间体物质为主; 当热解温度更高时, 则是以富含木质素的生物质热解产生的稳定DOC为主[40]。低热解温度有助于水溶性有机质形成, 而当热解温度升高后(> 450 ℃), 部分物质发生二次反应, 使得DOC含量降低[41]。热解温度低, 生物质炭中挥发性有机碳(VOCs)含量较大, 渗透的水流容易将其溶解[42], 造成C流失。研究表明, 杏仁壳生物质炭释放的DOC要明显高于棉花籽、木质素以及山核桃壳生物质炭。杏仁壳中木质素含量低于山核桃壳, 且其碳水化合物含量较大, 而山核桃壳中可滤出的酚含量较低[40]。而生物质炭中溶解性有机质含量不仅受到生物质中木质素含量的影响, 同时也受到灰分含量的调控。灰分能够促进木质纤维素热解过程中的的热化学反应, 较低的热解温度使得溶解性有机质(主要以腐殖酸和低分子量中性粒为主)的含量增加[41]。此外, 生物质炭中可溶性盐的溶解也是生物质炭质量损失的重要原因之一。有研究表明450 ℃制备的硬木来源生物质炭中溶解性无机碳的释放量约为61±15 mg·kg-1, 约占总溶解性碳的15%±1%[6], 其组成包括可溶性盐及离子, 如K、Na的碳酸盐及氧化物。可溶性盐的溶解, 使得生物质炭自身的碱性降低, 而颗粒周围水膜的pH及电导率上升[22], 这可能影响生物质炭自身的氧化还原活性, 从而影响其在环境中的氧化还原作用。
2.2 环境中生物质炭的氧化作用目前人们通常用生物质炭的抗氧化性来作为评价生物质炭化学氧化作用的指标。氧化作用发生于生物质炭表面(包括外表面和孔隙内表面)。氧化作用使得洋槐木来源生物质炭(350 ℃)表面的O及H的含量增加, 促进含氧官能团的形成(如OH, -COOH和C=O)[43]。同时, 氧化作用还能提高生物质炭的表面活性和亲水性, 增强生物质炭的分解和生物可利用性[8]; 还会在生物质炭的石墨结构周围产生自由基[44-45]。影响生物质炭化学氧化反应过程的条件有湿度、氧暴露时间、温度、土壤矿物、天然有机质、生物质炭热解温度、生物质炭灰分含量等。(1)湿度:不饱和或者饱和-不饱和交替的环境能够增加生物质炭上羧基及羟基数量, 利于生物质炭的分解[46]。(2)暴露时间:生物质炭在有氧环境下的暴露时间影响生物质炭的化学稳定。例如, 地下水位较高时, 生物质炭淹没在水中, 长期的厌氧环境使得其碳含量较高、氧含量较低、羧基官能团减少, 最终矿化速率降低[47]。(3)温度:较高的环境温度会加速生物质炭的氧化进程, 提升氧化速率。这是因为在较低的环境温度下, 氧化只发生在生物质炭颗粒的表面, 而随着环境温度的升高, 生物质炭颗粒的内部也逐渐被氧化[43]。然而, 当土壤中矿物、有机质含量较大时, 环境温度的升高, 使得有机质-生物质炭-矿物间的作用加强, 反而减少了生物质炭的矿化[48]。通常环境温度升高, 生物质炭在土壤中的稳定性降低, 平均停留时间减少[49], 但土壤类型不同, 环境温度对生物质炭稳定性的影响也不同。(4)土壤矿物及天然有机质:土壤矿物及有机质对生物质炭抵抗化学氧化作用有着积极影响。在土壤中, 生物质炭会与矿物和有机质反应[50]。土壤矿物在500 ℃制备的胡桃壳来源生物质炭-矿物质界面上形成诸如Fe-O-C等金属-有机复合体, 起到了物理隔离的作用, 提高了抗氧化性, 并减少了生物质炭中C-O、C=O以及COOH的含量, 增加生物质炭的稳定性[51]。天然有机质通过疏水吸附、氢键作用、电子供体-受体作用等, 联结到生物质炭上[8], 保护生物质炭组分不被氧化或溶解。土壤矿物质与生物质炭之间的作用与矿物自身性质有关。有机质-矿物反应与生物质炭所含矿物种类、表面官能团以及无机元素有关。比如, 鸡粪生物质炭含有较多的含氧官能团(羧基、酚基), 土壤矿物直接与生物质炭表面进行反应; 而造纸污泥生物质炭首先通过Ca2+、Al3+的桥梁作用吸附土壤有机质, 再通过土壤有机质促进生物质炭-土壤矿物复合体的形成[52]。土壤团聚体对生物质炭微粒也有物理保护作用, 通过物理隔离减少生物质炭与外界的接触[53], 这也许能减少其氧化作用和其他侵蚀作用, 从而增强生物质炭的稳定性。(5)热解温度:在热解过程中, 随着热解温度的升高, 生物质炭中的H/C和O/C下降, 表明其与脱水反应有关, 并存在以下关系:H/C=2.281×O/C+0.151(n=207, R2=0.873)”; “H/C=2.512×O/C+0.0804(n=32, R2=0.902)”[12]。生物质炭中H:C和O:C越高, C的流失率越大[54]。较低的H/C和O/C, 能够减小C的流失率, 并提高生物质炭的抗氧化性。研究表明, 当热解温度从300 ℃升至700 ℃时, H:C和O:C分别下降了69%和81%, 竹屑生物质炭抗K2Cr2O7氧化能力显著增强[55]。(6)生物质炭灰分含量:生物质炭中灰分含量的高低也能影响其抗氧化性。低灰分生物质炭, 其抗氧化性受芳香性控制; 而高灰分生物质炭, 还受到矿物等其他物质的调控, 灰分中的矿物相在生物质炭的抗氧化能力方面起到重要作用[56]。矿物能促进水稻秸秆生物质炭中芳香碳的形成, 提升生物质炭的抗氧化性[57]。P在麦秆生物质炭的形成过程中, 由于偏磷酸盐或者是C-O-PO3的形成, 占据C键上的活性位点, 阻止C与O2的接触, 从而提高了抗氧化性能[58]。在松树锯末生物质在热解过程中, P-O-P会插入到C晶格中, 促进无定形碳的形成并起到交联作用, P和C的作用加强了生物质炭中碳骨架的稳定性, 减小碳的流失率[59]。水稻秸秆生物质在热解过程中, Si在450~500 ℃时, 其结构会从亚稳态的α-石英结构变为稳定的β-石英结构, 并缠绕包裹在C周围, 影响C的排列以及结构, 这种包裹形式使得生物质炭有更强的稳定性, 增强生物质炭的碳截留能力[60]。在竹屑生物质的热解过程中, 铁黏土矿物在低温下抑制纤维素的分解, 在高温下则有促进作用, 影响芳香C的产率[61]。在450 ℃的热解温度下, 生物质中的无定型C与无定型Si所形成的稠密结构中, C-Si键的形成使得C免受氧化, 抗氧化性显著增强[56]。矿物易通过破坏生物质炭芳香结构, 降低花生壳和牛粪生物质炭的稳定性[62], 但也有研究认为Ca(OH)2可以促进无定型C向石墨C的转化, 并可提高污泥生物质炭的抗氧化性[63]。除矿物元素外, 高灰分的生物质中还含有其他物质, 如蛋白质、脂肪酸、灰烬等, 这些组分含量越多, 生物质炭所形成的结构更加复杂, 在土壤中的抗氧化机理更加多元化[56]。
生物质炭的化学氧化过程与其在环境中的老化及矿化过程均有着很大的关系。生物质炭的老化是指随着时间的推移, 生物质炭受到各种环境作用而破碎、降解, 使得理化性质发生改变的过程。生物质炭老化后, 表面粗糙度增加, 亲水性增强, 稳定性降低[64], 并能产生大量的物理碎片[22]。酸性环境更容易加速柳树和麦壳来源(400~525 ℃)生物质炭的老化[64]。氧化作用能够促进木材来源(550 ℃)生物质炭的老化[65]。生物质炭在环境中的矿化过程是指在环境作用下, 生物质炭分解成简单化合物的过程, 矿化率的高低反映了生物质炭稳定性强弱。氧化作用能加强生物质炭的物理、化学、生物等风化作用, 加速生物质炭的矿化速率[43]。
有研究指出, 生物质炭本身具有储存电子的作用, 在厌氧环境中, 硬木片来源(550 ℃)生物质炭可作为可再充电的生物电子库, 其生物电子储存能力可达0.85~0.87 mmol·g-1[66]。生物质炭由于具有片层石墨结构, 也可通过π-π作用传递电子; 表面的官能团也能作为电子供体、受体进行电子传递, 如低热解温度得到的生物质炭以酚基的电子供体为主, 而在高温热解生物质炭则以醌基的电子受体作用为主[67]。这说明生物质炭本身就是一个极好的氧化还原反应场所, 具有氧化还原活性。然而, 目前关于生物质炭自身氧化还原活性与生物质炭氧化作用之间的关系尚未可知, 物理作用产生的生物质炭微粒在环境中的抗化学氧化性能是否与大颗粒生物质炭有差异也未可知, 这两方面均值得深入研究和探讨。
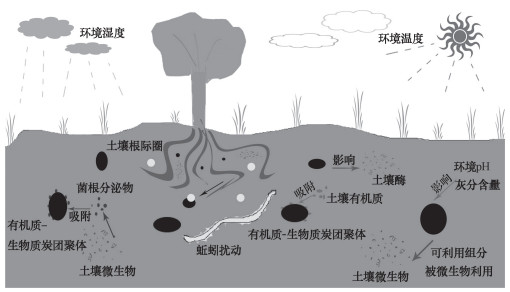
3 生物质炭的生物分解过程生物质炭的生物分解过程主要包括土壤生物利用、新陈代谢以及酶的催化降解过程, 其作用途径和影响因素总结如图 3所示。
|
图 3 环境中生物质炭的生物分解过程 Fig. 3 Biological decomposition process of biochar in the environment |
在土壤和沉积物中, 微生物降解是生物质炭分解的重要途径之一[68]。目前生物质炭的生物代谢作用主要通过生物质炭的生物利用率来衡量[17]。在土壤中, 微生物对生物质炭的降解可分为两个阶段:快速分解阶段与慢速分解阶段。生物质炭的可利用组分及易降解物质可在短期内迅速降解。生物质炭的可利用部分对微生物而言是一个很好的能量来源, 尤其是所含的N素。在草地土壤中添加10%须芒草根来源生物质炭经过112 d的培养实验表明, N可以提升微生物对生物质炭的利用率, 促进生物质炭中C的矿化[69]。虽然生物质炭中的芳香C难以被分解, 但是仍能被一些菌类(如白腐真菌、担子菌、子囊菌、木腐菌等)利用, 只是这部分难分解的压缩芳香环碳的分解很慢[70]。
生物质炭的生物稳定性受到自身性质与环境条件两方面的影响, 自身性质主要有以下几个影响因素。(1)热解温度:生物质炭中C的形式与热解温度有关。热解温度升高, 不仅能降低生物质炭中VOCs的含量[71], 还能使生物质炭固定态碳(FC)的含量增加[72], 不稳定的有机碳及溶解性有机碳减少[73], 从而影响微生物对生物质炭的利用效率。有时, 人们也用挥发性物质(VM)与FC的比值来预测生物质炭的半衰期。当VM/FC<0.88时, 生物质炭的半衰期超过1 000年; 而当0.88<VM/FC<3时, 生物质炭的半衰期为100~1 000年[12]。此外, 热解温度的升高使得生物质炭的R50指数增大。R50是评价生物质炭碳截留能力的重要指数, 其与生物质炭稳定性存在量化关系。通常可以将生物质炭稳定程度分为三类(表 1):A类生物质炭的碳截留能力相当于石墨烯, 实验室条件下最不易生物降解; B类生物质炭的碳截流能力介于A类与C类之间, 有一定的生物降解能力; C类生物质炭的碳截流能力相当于生物质, 最易生物降解。热解温度越高, R50越大, 生物稳定性越强[16]。(2)可溶性成分含量。生物质炭中的可溶性有机质(DOM)由于含有剩余的极性芳香热解产物, 含有大量的极性有机小分子以及短链羧酸[75], 这些均极易被微生物代谢利用。生物质炭释放的可溶性有机质越多, 其生物稳定性越弱。(3)C/N。N能促进生物质炭中C的生物矿化[69], C:N影响生物质炭的生物可利用性。一般地, C:N > 100, 矿化率较低, 如木料类来源生物质炭; 当C:N<10时, 生物质炭矿化率较高, 如鸡粪来源生物质炭[76]。根据C:N, 草本植物来源生物质炭的生物可利用性高于硬木来源生物质炭[77]。因此, 生物质炭中的C:N显著影响着土壤生物对生物质炭的降解作用, 影响其生物稳定性。(4)木质素和纤维素含量。木质素和纤维素是生物质中含量较大的C组分, 通过热解最终转化为稳定的芳香C, 其含量对芳香C的产率有很大的影响, 并且与生物质炭的R50指数有关。生物质原料中纤维素含量越高, R50指数越大, 制备的生物质炭稳定性越好[78-79]。此外, 也有研究表明, 椰枣树生物质分别与沸石、Si混合, 在600 ℃下制出的复合型生物质炭的R50值分别为0.75, 0.5~0.7, 相较于原始生物质炭(R50<0.4), 其生物稳定性有明显提升[80]。因此, 对于一些不太稳定的生物质炭, 可采取改性的方式, 增强生物质炭稳定性。
|
|
表 1 常见的生物质炭稳定性评价等级分类方法 Table 1 Common grading method for evaluation stability of biochar |
生物质炭能通过与环境组分间的作用, 增强生物稳定性。生物质炭能够通过表面吸附有机质, 并与土壤颗粒作用或被菌根的分泌物、菌丝体以及多糖固化形成稳定的有机质-生物质炭团聚体[70]。虽然在生物质炭加入后的前期, 由于生物质炭的可利用组分会触发土壤微生物的活性, 有一定的正启动效应; 但长期而言, 生物质炭表面会吸附有机质, 形成的团聚体产生物理保护作用, 其对生物质炭的降解有负启动效应[81]。但是也有研究发现, 在稻田土耕作层中添加2.5%水稻秸秆制备(500 ℃)的生物质炭, 经过一年的培养实验土壤中总有机碳含量高, 表明其能够促进微生物的共代谢作用, 加强生物质炭中C的矿化[82]。除微生物作用外, 土壤中的动植物也能促进生物质炭的分解。蚯蚓通过摄取以及生物扰动使得生物质炭更均匀地分布于土壤中, 原生动物、线虫、白蚁等对生物质炭的分解也有很重要的作用[70]。植物的根系活动, 也会促进生物质炭的分解[83]。水稻植株根系的分泌物和植株的吸收作用加强了生物质炭颗粒的表面氧化和土壤微生物对生物质炭的作用, 降低了生物质炭的稳定性, 且土壤中生物质炭的生物氧化作用一般发生在生物质炭的外表面[84]。生物质炭所含不稳定碳的可利用性、营养物质、孔隙体积与比表面积、颗粒尺寸、氧化程度, 以及自由基的产生, 均会影响生物质炭与微生物之间的作用[8]。
同时, 生物质炭也会对微生物组成和活性产生一定的影响, 从而影响微生物对生物质炭的降解。在砂壤土中添加20~49 t·hm-2木料制备(400~500 ℃)的生物质炭, 经过2个月培养实验表明生物质炭的添加并不会阻碍微生物的活动[85]。生物质炭对土壤微生物的作用受其热解温度的影响, 300 ℃下制得的大豆秸秆和松针来源生物质炭含有较多的溶解性有机碳及活性有机碳, 会促进土壤中的细菌、真菌、放线菌、丛枝菌根真菌的数量上升; 300 ℃的花生壳来源生物质炭能提高土壤酶活(如脲酶、荧光素二乙酸水解酶); 而700 ℃制得的大豆秸秆和松针来源生物质炭中的固定碳或不可利用态碳的含量较高, 对土壤微生物数量影响有限[86-87]。生物质炭中的灰分含量对其生物降解作用有很大影响。灰分中含有大量的常量与微量元素, 有利于土壤微生物对生物质炭的降解作用, 尤其在酸性土壤中, 高灰分生物质炭的石灰效应(liming effect)显著, pH的提升有利于微生物的生长[88]。生物质炭还可通过电子供体受体作用, 促进微生物与天然有机质、土壤矿物以及污染物之间的电子传递, 如麦秆制备的生物质炭-针铁矿团聚体会影响细菌对Fe(III)还原[89], 以及通过电子传递促进微生物对赤铁矿的还原[90]。
尽管人们对生物质炭和生物之间的作用有了较多的认识, 但是对于生物质炭氧化还原作用对微生物转化和分解生物质炭的影响缺乏系统研究, 对植物根际圈内生物质炭的化学及生物分解作用尚缺乏深入的研究。此外, 生物质炭尺寸也可能会影响生物质炭与微生物之间作用。小尺寸的生物质炭(如生物质炭微粒)可能更易被植物根系吸附或者被微生物利用。然而, 目前关于生物质炭尺寸对微生物分解作用的影响尚未可知。
4 总结与展望本文归纳总结了生物质炭在环境中可能经历的物理分解、化学分解和生物分解三大作用过程, 分析了环境因素和生物质炭自身性质与生物质炭在环境中稳定性的关系。生物质炭在土壤中的物理分解作用主要包括物理侵蚀和物理迁移。土壤中生物质炭在研磨作用、冻融作用、膨胀作用、水流冲击等侵蚀作用下发生物理性破碎形成生物质炭的微粒, 并发生移位迁移造成物理流失。生物质炭的化学分解作用主要包括溶解作用和化学氧化作用。在土壤-水介质中, 生物质炭中的可溶性有机碳和可溶性盐组分被水溶解, 同时生物质炭在氧的作用下发生氧化反应。生物质炭的生物分解作用主要包括生物利用、新陈代谢以及酶的催化降解等。环境中物理、化学和生物分解作用同时存在且相互促进, 其作用强度与生物质炭自身性质密切相关。
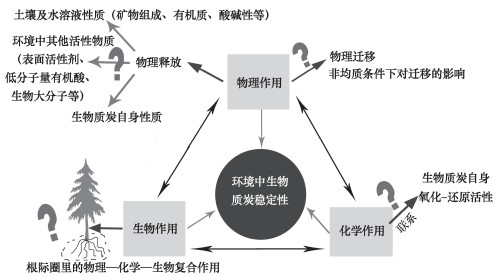
尽管目前人们对环境中生物质炭稳定性有了一定的认识, 但过去的研究对生物质炭在环境中的化学分解和生物分解作用关注较多, 对环境中物理分解作用关注较少; 对生物质炭受到环境中的氧化作用关注较多, 对其自身氧化还原活性作用关注较少; 对生物质炭在理想环境下的分解作用关注较多, 对复杂条件如植物根际、土壤溶液环境下的分解作用关注较少。关于未来生物质炭在环境中的稳定性方面值得进一步研究的方向总结如图 4所示。
|
图 4 关于生物质炭在环境中稳定性研究的建议 Fig. 4 Suggestions for the research on stability of biochar in the environment |
首先, 水流作用下生物质炭微粒的释放、迁移行为及其影响因素研究值得关注。土壤中普遍存在的矿物、黏土颗粒、有机质以及共存的一些活性物质如表面活性剂、低分子量有机酸等可能影响生物质炭微粒在土壤中的初期释放效率。地表水的溶液化学性质(如离子强度、pH等)和组成(如阳离子和可溶性有机质等)也将可能对生物质炭微粒的释放行为产生影响。土壤介质的普遍非均质性也可能影响生物质炭微粒在多孔介质中的迁移行为, 非均质介质中的优势流效应对生物质炭纵向物理迁移的作用不可忽视。
其次, 生物质炭自身的氧化还原活性与其在环境中的化学氧化作用之间的关系有待深入研究。生物质炭具备储存电子的作用, 其自身的氧化还原活性可能影响生物质炭与环境中氧化性物质的反应, 从而影响其在环境中的化学氧化稳定性。此外, 物理分解产生的生物质炭微粒在环境中的抗化学氧化性可能与大颗粒生物质炭存在差异, 生物质炭粒径的异质性也可能对其化学氧化分解作用产生影响。
最后, 植物根际圈内生物质炭的物理、化学和微生物分解作用及其相互关系值得系统研究。在真实的土壤-水环境条件下, 植物根际圈扮演着生物反应器的角色, 它将显著影响各种物质在环境中的转化、迁移和降解过程。植物的根系生长可能会穿透生物质炭从而影响生物质炭在土壤中的分布; 植物根系分泌物可能会进入生物质炭微孔破坏微孔结构, 或与生物质炭之间发生反应, 加速生物质炭的物理分解和化学氧化老化; 植物根系周边的微生物群落对生物质炭稳定性的影响可能较非根系区域更加明显。总之, 在未来的研究中, 生物质炭在环境中的稳定性方面值得进一步深入研究。这将有利于人们全面认识生物质炭的稳定性, 探寻有效调控生物质炭在环境中稳定性的技术和方法, 为生物质炭储碳和环境效益的可持续性提供必要的理论支持。
| [1] |
Ahmad M, Rjapaksha A, Lim J E, et al. Biochar as a sorbent for contaminant management in soil and water:A review . Chemosphere, 2014, 99: 19-33. DOI:10.1016/j.chemosphere.2013.10.071
(  0) 0) |
| [2] |
Poo K M, Son E B, Chang J S, et al. Biochars derived from wasted marine macro-algae(Saccharina japonica and Sargassum fusiforme)and their potential for heavy metal removal in aqueous solution . Journal of Environmental Management, 2018, 206: 364-372. DOI:10.1016/j.jenvman.2017.10.056
(  0) 0) |
| [3] |
Zheng H, Wang Z Y, Zhao J, et al. Sorption of antibiotic sulfamethoxazole varies with biochars produced at different temperatures . Environmental Pollution, 2013, 181: 60-67. DOI:10.1016/j.envpol.2013.05.056
(  0) 0) |
| [4] |
Kimetu J M, Lehmann J. Stability and stabilisation of biochar and green manure in soil with different organic carbon contents . Australian Journal of Soil Research, 2010, 48(7): 577-585. DOI:10.1071/SR10036
(  0) 0) |
| [5] |
Singh B P, Cowie A L, Smernik R J, et al. Biochar carbon stability in a clayey soil as a function of feedstock and pyrolysis temperature . Environmental Science & Technology, 2012, 46(21): 11770-11778.
(  0) 0) |
| [6] |
Jones D L, Murphy D V, Khalid M, et al. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated . Soil Biology and Biochemistry, 2011, 43(8): 1723-1731. DOI:10.1016/j.soilbio.2011.04.018
(  0) 0) |
| [7] |
Jaffé R, Ding Y, Niggemann J, et al. Global charcoal mobilization from soils via dissolution and riverine transport to the oceans . Science, 2013, 340(6130): 345-346. DOI:10.1126/science.1231476
(  0) 0) |
| [8] |
Lian F, Xing B S. Black carbon(biochar)in water/soil environments:molecular structure, sorption, stability, and potential risk . Environmental Science & Technology, 2017, 51(23): 13517-13532.
(  0) 0) |
| [9] |
Fu H Y, Liu H T, Mao J D, et al. Photochemistry of dissolved black carbon released from biochar:Reactive oxygen species generation and phototransformation . Environmental Science & Technology, 2016, 50(3): 1218-1226.
(  0) 0) |
| [10] |
韩旸, 多立安, 刘仲齐, 等. 生物炭颗粒的分级提取、表征及其对磺胺甲  唑的吸附性能研究. 环境科学学报, 2017, 37(6): 2181-2189. 唑的吸附性能研究. 环境科学学报, 2017, 37(6): 2181-2189.Han Y, Duo L A, Liu Z Q, et al. Fractionated extraction and characterization of biochar and its adsorption behavior for sulfamethoxazole (In Chinese). Acta Scientiae Circumstantiae, 2017, 37(6): 2181-2189. (  0) 0) |
| [11] |
Spokas K A. Review of the stability of biochar in soils:Predictability of O:C molar ratios . Carbon Management, 2010, 1(2): 289-303. DOI:10.4155/cmt.10.32
(  0) 0) |
| [12] |
Leng L J, Huang H J, Li H, et al. Biochar stability assessment methods:A review . Science of the Total Environment, 2019, 647: 210-222. DOI:10.1016/j.scitotenv.2018.07.402
(  0) 0) |
| [13] |
章明奎, 顾国平, 王阳. 生物质炭在土壤中的降解特征. 浙江大学学报(农业与生命科学版), 2012, 38(3): 329-335. Zhang M K, Gu G P, Wang Y. Degradation characteristic of different biochar materials in soil environments (In Chinese). Journal of Zhejiang University(Agriculture and Life Sciences), 2012, 38(3): 329-335. (  0) 0) |
| [14] |
周丹丹, 吴文卫, 吴敏. 生物炭的稳定性及其评价方法. 重庆大学学报, 2015, 38(3): 116-122. Zhou D D, Wu W W, Wu M. Stability of biochar and its evaluating methods (In Chinese). Journal of Chongqing University, 2015, 38(3): 116-122. (  0) 0) |
| [15] |
金梁, 魏丹, 李玉梅, 等. 生物炭制备及其稳定性估测方法研究进展. 农业资源与环境学报, 2015, 32(5): 423-428. Jin L, Wei D, Li Y M, et al. Progress on biochar preparation and its assessement methods of stability (In Chinese). Journal of Agricultural Resouces and Environment, 2015, 32(5): 423-428. (  0) 0) |
| [16] |
Harvey O R, Kuo L J, Zimmerman A R, et al. An index-based approach to assessing recalcitrance and soil carbon sequestration potential of engineered black carbons(biochars) . Environmental Science & Technology, 2012, 46(3): 1415-1421.
(  0) 0) |
| [17] |
Zimmerman A R. Abiotic and microbial oxidation of laboratory-produced black carbon(biochar) . Environmental Science & Technology, 2010, 44(4): 1295-1301.
(  0) 0) |
| [18] |
Ponomarenko E V, Anderson D W. Importance of charred organic matter in black chernozem soils of Saskatchewan . Canadian Journal of Soil Science, 2001, 81(3): 285-297. DOI:10.4141/S00-075
(  0) 0) |
| [19] |
Spokas K A, Novak J M, Masiello C A, et al. Physical disintegration of biochar:An overlooked process . Environmental Science & Technology Letters, 2014, 1(8): 326-332.
(  0) 0) |
| [20] |
Brodowski S, John B, Flessa H, et al. Aggregate-occluded black carbon in soil . European Journal of Soil Science, 2006, 57: 539-546. DOI:10.1111/j.1365-2389.2006.00807.x
(  0) 0) |
| [21] |
Glasser B, Balasho E, Haumaier L, et al. Black carbon in density fractions of anthropogenic soils of the Brazilian Amazon region . Org. Geochem, 2000, 31: 669-678. DOI:10.1016/S0146-6380(00)00044-9
(  0) 0) |
| [22] |
Rosa J M, Rosado M, Paneque M, et al. Effects of aging under field conditions on biochar structure and composition:Implications for biochar stability in soils . Science of the Total Environment, 2018, 613/614: 969-976. DOI:10.1016/j.scitotenv.2017.09.124
(  0) 0) |
| [23] |
孙红文, 张彦峰, 张闻. 生物炭与环境. 北京: 化学工业出版社, 2013: 120-124. Sun H W, Zhang Y F, Zhang W. Biochar and environment (In Chinese). Beijing: Chemical Industry Press, 2013: 120-124. (  0) 0) |
| [24] |
Braadbaart F, Poole I, van Brussel A A. Preservation potential of charcoal in alkaline environments:An experimental approach and implications for the archaeological record . Journal of Archaeological Science, 2009, 36(8): 1672-1679. DOI:10.1016/j.jas.2009.03.006
(  0) 0) |
| [25] |
Guggenberger G, Rodionov A, Shibistova O, et al. Storage and mobility of black carbon in permafrost soils of the forest tundra ecotone in Northern Siberia . Global Change Biology, 2008, 14: 1367-1381. DOI:10.1111/j.1365-2486.2008.01568.x
(  0) 0) |
| [26] |
Leifeld J, Fenner S, Muller M. Mobility of black carbon in drained peatland soils . Biogeo Sciences, 2007, 4: 425-432. DOI:10.5194/bg-4-425-2007
(  0) 0) |
| [27] |
Major J, Lehmann J, Rondon M, et al. Fate of soil-applied black carbon:Downward migration, leaching and soil respiration . Global Change Biology, 2010, 16: 1366-1379. DOI:10.1111/j.1365-2486.2009.02044.x
(  0) 0) |
| [28] |
Zhang W, Niu J Z, Morales V L, et al. Transport and retention of biochar particles in porous media:Effect of pH, ionic strength, and particle size . Ecohydrology, 2010, 3: 497-508. DOI:10.1002/eco.160
(  0) 0) |
| [29] |
Wang D J, Zhang W, Zhou D M. Antagonistic Effects of humic acid and iron oxyhydroxide grain coating on biochar nanoparticle transport in saturated sand . Environmental Science & Technology, 2013, 47(10): 5154-5161.
(  0) 0) |
| [30] |
Wang D J, Zhang W, Hao X Z, et al. Transport of biochar particles in saturated granular media:Effects of pyrolysis temperature and particle size . Environmental Science & Technology, 2012, 47: 821-828.
(  0) 0) |
| [31] |
Chen M, Wang D J, Yang F, et al. Transport and retention of biochar nanoparticles in a paddy soil under environmentally-relevant solution chemistry conditions . Environmental Pollution, 2017, 230: 540-549. DOI:10.1016/j.envpol.2017.06.101
(  0) 0) |
| [32] |
杨雯, 郝丹丹, 徐东昊, 等. 生物炭颗粒在饱和多孔介质中的迁移与滞留. 土壤通报, 2017, 48(2): 304-312. Yang W, Hao D D, Xu D H, et al. Transport and retention of biochar particles in saturated porous media (In Chinese). Chinese Journal of Soil Science, 2017, 48(2): 304-312. (  0) 0) |
| [33] |
Yang W, Wang Y, Shang J Y, et al. Antagonistic effect of humic acid and naphthalene on biochar colloid transport in saturated porous media . Chemosphere, 2017, 189: 556-564. DOI:10.1016/j.chemosphere.2017.09.060
(  0) 0) |
| [34] |
Mohanty S K, Boehm A B. Effect of weathering on mobilization of biochar particles and bacterial removal in a stormwater biofilter . Water Research, 2015, 85(15): 208-215.
(  0) 0) |
| [35] |
Li M, Zhang A F, Wu H M, et al. Predicting potential release of dissolved organic matter from biochars derived from agricultural residues using fluorescence and ultraviolet absorbance . Journal of Hazardous Materials, 2017, 334: 86-92. DOI:10.1016/j.jhazmat.2017.03.064
(  0) 0) |
| [36] |
Patryk O, Wiesława C B, Aleksandra B, et al. Characterization of nanoparticles of biochars from different biomass . Journal of Analytical and Applied Pyrolysis, 2016, 121: 165-172. DOI:10.1016/j.jaap.2016.07.017
(  0) 0) |
| [37] |
Qu X L, Fu H Y, Mao J D, et al. Chemical and structural properties of dissolved black carbon released from biochars . Carbon, 2016, 96: 759-767. DOI:10.1016/j.carbon.2015.09.106
(  0) 0) |
| [38] |
Wagner S, Jaffe R. Effect of photodegradation on molecular size distribution and quality of dissolved black carbon . Organic Geochemistry, 2015, 86: 1-4. DOI:10.1016/j.orggeochem.2015.05.005
(  0) 0) |
| [39] |
徐子博, 俞璐, 杨帆, 等. 土壤矿物质-可溶态生物炭的交互作用及其对碳稳定性的影响. 环境科学学报, 2017, 37(11): 4329-4335. Xv Z B, Yu L, Yang F, et al. Interactions between soil minerals and dissolvable biochar and its influence on carbon stability (In Chinese). Acta Scientiae Circumstantiae, 2017, 37(11): 4329-4335. (  0) 0) |
| [40] |
Uchimiya M, Ohno T, He Z Q. Pyrolysis temperature-dependent release of dissolved organic carbon from plant, manure, and biorefinery wastes . Journal of Analytical and Applied Pyrolysis, 2013, 104: 84-94. DOI:10.1016/j.jaap.2013.09.003
(  0) 0) |
| [41] |
Lin Y, Munroe P, Joseph S, et al. Water extractable organic carbon in untreated and chemical treated biochars . Chemosphere, 2012, 87(2): 151-157. DOI:10.1016/j.chemosphere.2011.12.007
(  0) 0) |
| [42] |
Buss W, Mašek O. Mobile organic compounds in biochar-A potential source of contamination-Phytotoxic effects on cress seed(Lepidium sativum)germination . Journal of Environmental Management, 2014, 137: 111-119.
(  0) 0) |
| [43] |
Cheng C H, Lehmann J, Thies J E, et al. Oxidation of black carbon by biotic and abiotic processes . Organic Geochemistry, 2006, 37(11): 1477-1488. DOI:10.1016/j.orggeochem.2006.06.022
(  0) 0) |
| [44] |
Nia Z K, Chen J Y, Tang B, et al. Optimizing the free radical content of graphene oxide by controlling its reduction . Carbon, 2017, 116: 703-712. DOI:10.1016/j.carbon.2017.02.060
(  0) 0) |
| [45] |
Liao S H, Pan B, Li H, et al. Detecting free radicals in biochars and determining their ability to inhibit the germination and growth of corn, wheat and rice seedlings . Environmental Science & Technology, 2014, 48(15): 8581-8587.
(  0) 0) |
| [46] |
Nguyen B T, Lehmann J. Black carbon decomposition under varying water regimes . Organic Geochemistry, 2009, 40(8): 846-853. DOI:10.1016/j.orggeochem.2009.05.004
(  0) 0) |
| [47] |
Hao R, Wang P C, Wu Y P, et al. Impacts of water level fluctuations on the physicochemical properties of black carbon and its phenanthrene adsorption-desorption behaviors . Ecological Engineering, 2017, 100: 130-137. DOI:10.1016/j.ecoleng.2016.11.014
(  0) 0) |
| [48] |
Fang Y Y, Singh B P, Singh B. Temperature sensitivity of biochar and native carbon mineralisation in biochar-amended soils . Agriculture, Ecosystems & Environment, 2014, 191: 158-167.
(  0) 0) |
| [49] |
Fang Y Y, Singh B, Singh B P. Effect of temperature on biochar priming effects and its stability in soils . Soil Biology & Biochemistry, 2015, 80: 136-145.
(  0) 0) |
| [50] |
Oihane F U, Nahia G B, Javier A, et al. Storage and stability of biochar-derived carbon and total organic carbon in relation to minerals in an acid forest soil of the Spanish Atlantic area . Science of the Total Environment, 2017, 587/588: 204-213. DOI:10.1016/j.scitotenv.2017.02.121
(  0) 0) |
| [51] |
Yang F, Zhao L, Gao B, et al. The interfacial behavior between biochar and soil minerals and its effect on biochar stability . Environmental Science & Technology, 2016, 50(5): 2264-2271.
(  0) 0) |
| [52] |
Lin Y, Munroe P, Joseph S, et al. Nanoscale organo-mineral reactions of biochars in ferrosol:An investigation using microscopy . Plant and Soil, 2012, 357(1/2): 369-380.
(  0) 0) |
| [53] |
Zhang Q Z, Du Z L, Lou Y L, et al. A one-year short-term biochar application improved carbon accumulation in large macroaggregate fractions . Catena, 2015, 127: 26-31. DOI:10.1016/j.catena.2014.12.009
(  0) 0) |
| [54] |
Bai M, Wilske B, Buegger F, et al. Biodegradation measurements confirm the predictive value of the O:C-ratio for biochar recalcitrance . Journal of Plant Nutrition and Soil Science, 2014, 177(4): 633-637. DOI:10.1002/jpln.201300412
(  0) 0) |
| [55] |
Chen D Y, Yu X Z, Song C, et al. Effect of pyrolysis temperature on the chemical oxidation stability of bamboo biochar . Bioresource Technology, 2016, 218: 1303-1306. DOI:10.1016/j.biortech.2016.07.112
(  0) 0) |
| [56] |
Han L F, Ro K S, Wang Y, et al. Oxidation resistance of biochars as a function of feedstock and pyrolysis condition . Science of the Total Environment, 2018, 616/617: 335-344. DOI:10.1016/j.scitotenv.2017.11.014
(  0) 0) |
| [57] |
Li F Y, Cao X D, Zhao L, et al. Effects of mineral additives on biochar formation:carbon retention, stability, and properties . Environmental Science & Technology, 2014, 48(19): 11211-11217.
(  0) 0) |
| [58] |
Zhao L, Cao X D, Zheng W, et al. Phosphorus-assisted biomass thermal conversion:reducing carbon loss and improving biochar stability . PLoS One, 2014, 9(12): e115373. DOI:10.1371/journal.pone.0115373
(  0) 0) |
| [59] |
Zhao L, Zheng W, Mašek O, et al. Roles of phosphoric acid in biochar formation:synchronously improving carbon retention and sorption capacity . Journal of Environmental Quality, 2017, 46(2): 393-401. DOI:10.2134/jeq2016.09.0344
(  0) 0) |
| [60] |
Guo J H, Chen B L. Insights on the molecular mechanism for the recalcitrance of biochars:Interactive effects of carbon and silicon components . Environmental Science & Technology, 2014, 48(16): 9103-9112.
(  0) 0) |
| [61] |
Rawal A, Stephen D J, Hook J M, et al. Mineral-biochar composites:Molecular structure and porosity . Environmental Science & Technology, 2016, 50(14): 7706-7714.
(  0) 0) |
| [62] |
顾博文, 曹心德, 赵玲, 等. 生物质内源矿物对热解过程及生物炭稳定性的影响. 农业环境科学学报, 2017, 36(3): 591-597. Gu B W, Cao X D, Zhao L, et al. Influence of inherent minerals on biomass pyrolysis and carbon stability in biochar (In Chinese). Journal of Agro-Environment Science, 2017, 36(3): 591-597. (  0) 0) |
| [63] |
Ren N N, Tang Y Y, Li M. Mineral additive enhanced carbon retention and stabilization in sewage sludge-derived biochar . Process Safety and Environmental Protection, 2017, 115: 70-78.
(  0) 0) |
| [64] |
Rechberger M V, Kloss S, Rennhofer H, et al. Changes in biochar physical and chemical properties:Accelerated biochar aging in an acidic soil . Carbon, 2017, 115: 209-219. DOI:10.1016/j.carbon.2016.12.096
(  0) 0) |
| [65] |
Mia S, Dijkstra F A, Singh B. Aging induced changes in biochar's functionality and adsorption behavior for phosphate and adsorption behavior for phosphate and ammonium . Environmental Science & Technology, 2017, 51(15): 8359-8367.
(  0) 0) |
| [66] |
Saquing J, Yu Y H, Chiu P. Wood-derived black carbon(biochar)as a microbial electron donor and acceptor . Environmental Science & Technology Letters, 2016, 3(2): 62-66.
(  0) 0) |
| [67] |
Klüpfel L, Keiluweit M, Kleber M, et al. Redox properties of plant biomass-derived black carbon(biochar) . Environmental Science & Technology, 2014, 48(10): 5601-5611.
(  0) 0) |
| [68] |
Kuzyakov Y, Subbotina I, Chen H, et al. Black carbon decomposition and incorporation into soil microbial biomass estimated by 14C labeling . Soil Biology & Biochemistry, 2009, 41(2): 210-219.
(  0) 0) |
| [69] |
Jiang X Y, Haddix M L, Cotrufo M F. Interactions between biochar and soil organic carbon decomposition:Effects of nitrogen and low molecular weight carbon compound addition . Soil Biology & Biochemistry, 2016, 100: 92-101.
(  0) 0) |
| [70] |
Ameloot N, Graber E R, Verheijen F G A, et al. Interactions between biochar stability and soil organisms:Review and research needs . European Journal of Soil Science, 2013, 64(4): 379-390. DOI:10.1111/ejss.12064
(  0) 0) |
| [71] |
Rafiq M, Bachmann R T, Rafiq M T, et al. Influence of pyrolysis temperature on physico-chemical properties of corn stover(Zea mays L.)biochar and feasibility for carbon capture and energy balance . PloS One, 2016, 11(6): e0156894. DOI:10.1371/journal.pone.0156894
(  0) 0) |
| [72] |
Azuara M, Baguer B, Villacampa J I, et al. Influence of pressure and temperature on key physicochemical properties of corn stover-derived biochar . Fuel, 2016, 186: 525-533. DOI:10.1016/j.fuel.2016.08.088
(  0) 0) |
| [73] |
Al-Wabel M I, Al-Omran A, El-Naggar A H, et al. Pyrolysis temperature induced changes in characteristics and chemical composition of biochar produced from conocarpus waste . Bioresource Technology, 2013, 131: 374-379. DOI:10.1016/j.biortech.2012.12.165
(  0) 0) |
| [74] |
Conti R, Rombolà A G, Modelli A, et al. Evaluation of the thermal and environmental stability of switchgrass biochars by Py-GC-MS . Journal of Analytical and Applied Pyrolysis, 2014, 110: 239-247. DOI:10.1016/j.jaap.2014.09.010
(  0) 0) |
| [75] |
Mitchell P J, Simpson A J, Soong R, et al. Shifts in microbial community and water-extractable organic matter composition with biochar amendment in a temperate forest soil . Soil Biology & Biochemistry, 2015, 81: 244-254.
(  0) 0) |
| [76] |
Grutzmacher P, Puga A P, Bibar M P S, et al. Carbon stability and mitigation of fertilizer induced N2O emissions in soil amended with biochar . Science of the Total Environment, 2018, 625: 1459-1466. DOI:10.1016/j.scitotenv.2017.12.196
(  0) 0) |
| [77] |
Bakshi S, Banik C, Laird D A. Quantification and characterization of chemically-and thermally-labile and recalcitrant biochar fractions . Chemosphere, 2018, 194: 247-255. DOI:10.1016/j.chemosphere.2017.11.151
(  0) 0) |
| [78] |
Mimmo T, Panzacchi P, Baratieri M, et al. Effect of pyrolysis temperature on miscanthus(Miscanthus giganteus)biochar physical, chemical and functional properties . Biomass and Bioenergy, 2014, 62: 149-157. DOI:10.1016/j.biombioe.2014.01.004
(  0) 0) |
| [79] |
Windeatt J H, Ross A B, Williams P T, et al. Characteristics of biochars from crop residues:Potential for carbon sequestration and soil amendment . Journal of Environmental Management, 2014, 146: 189-197.
(  0) 0) |
| [80] |
Ahmad M, Ahmad M, Usman A R A, et al. Date palm waste-derived biochar composites with silica and zeolite:Synthesis, characterization and implication for carbon stability and recalcitrant potential . Environmental Geochemistry and Health, 2017. DOI:10.1007/s10653-017-9947-0
(  0) 0) |
| [81] |
Maestrini B, Nannipieri P, Abiven S. A meta-analysis on pyrogenic organic matter induced priming effect . GCB Bioenergy, 2015, 7(4): 577-590. DOI:10.1111/gcbb.12194
(  0) 0) |
| [82] |
Wu M X, Han X G, Zhong T, et al. Soil organic carbon content affects the stability of biochar in paddy soil . Agriculture, Ecosystems and Environment, 2016, 223: 59-66. DOI:10.1016/j.agee.2016.02.033
(  0) 0) |
| [83] |
Ventura M, Alberti G, Viger M, et al. Biochar mineralization and priming effect on SOM decomposition in two European short rotation coppices . GCB Bioenergy, 2015, 7(5): 1150-1160. DOI:10.1111/gcbb.12219
(  0) 0) |
| [84] |
Wu M X, Feng Q B, Sun X, et al. Rice(Oryza sativa L.)plantation affects the stability of biochar in paddy soil . Scientific Reports, 2015. DOI:10.1038/srep10001
(  0) 0) |
| [85] |
Ameloot N, Sleutel S, Alberti G, et al. C mineralization and microbial activity in four biochar field experiments several years after incorporation . Soil Biology & Biochemistry, 2014, 78: 195-203.
(  0) 0) |
| [86] |
Ahmad M, Ok Y S, Kim Y M, et al. Impact of soybean stover- and pine needle-derived biochars on Pb and As mobility, microbial community, and carbon stability in a contaminated agricultural soil . Journal of Environmental Management, 2016, 166: 131-139.
(  0) 0) |
| [87] |
Bhaduri D, Saha A, Desai D, et al. Restoration of carbon and microbial activity in salt-induced soil by application of peanut shell biochar during short-term incubation study . Chemosphere, 2016, 148: 86-98. DOI:10.1016/j.chemosphere.2015.12.130
(  0) 0) |
| [88] |
Murray J, Keith A, Singh B. The stability of low- and high-ash biochars in acidic soils of contrasting mineralogy . Soil Biology & Biochemistry, 2015, 89: 217-225.
(  0) 0) |
| [89] |
Kappler A, Wuestner M L, Ruecker A, et al. Biochar as an electron shuttle between bacteria and Fe(Ⅲ)minerals . Environmental Science & Technology Letters, 2014, 1(8): 339-344.
(  0) 0) |
| [90] |
Xu S N, Adhikari D, Huang R, et al. Biochar-facilitated microbial reduction of hematite . Environmental Science & Technology, 2016, 50(5): 2389-2395.
(  0) 0) |
2. College of Environment and Resources, Zhejiang University, Hangzhou 310058, China
 2019, Vol. 56
2019, Vol. 56

