2. 天津大学表层地球系统科学研究院,天津 300072;
3. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;
4. 中国农业科学院农业资源与农业区划研究所,农业部作物营养与施肥重点开放实验室,北京 100081
全球红壤总面积约6 400万km2,占全球土地总面积的45.2%,主要分布在热带和亚热带地区的发展中国家,红壤地区人口总数约占全球总人数的一半以上[1]。据第二次土壤普查资料显示,我国红壤地区耕地占全国的30%,而68%的红壤农田属于中低产田,耕地有机质含量普遍偏低;同时,由于长期对土地的不合理利用,红壤退化现象极为严重,特别是由于化肥的长期和过量施用,导致旱地农业生态系统中红壤有机碳含量呈现下降的趋势[2]。土壤团聚体的物理保护作用[3]和矿物-有机复合体的形成[4-6]被认为是土壤有机碳稳定和累积的主要机制。据统计,在全球范围内的沉积物中,铁氧化物可以结合/固定约21%的有机碳[7]。因此,传统观点认为酸性红壤黏粒含量高及铁铝氧化物丰富的特点有利于有机碳的稳定[8-9];同时,富含的铁、铝矿物可以促进微团聚体的形成,保护有机碳免受生物降解[10]。然而,同黑土、棕壤等相比,具有很强物理化学作用保护潜力的红壤有机碳含量却相对较低,并且在农业耕作利用后表现出快速的退化趋势。迄今为止,尚无合适的概念模型可以解释亚热带红壤上存在的这种矛盾现象。
芬顿反应(Fenton reaction)是Fe(Ⅱ)对H2O2的催化,须在酸性条件下进行,H2O2利用效率低,反应发生具有局限性,但氧化效率高。类芬顿反应(Fenton-like reaction)是除Fe(Ⅱ)以外,Fe(Ⅲ)、含铁矿物以及其他一些过渡金属如钴(Co)、镉(Cd)、铜(Cu)、银(Ag)、锰(Mn)、镍(Ni)等可以加速或者替代Fe(Ⅱ)而对H2O2起催化作用的一类反应的总称,它具有适用pH范围广、催化剂种类多等优点而广泛发生于土壤中[11]。最近的研究表明,添加至土壤中的铁卟啉在光照条件下可通过自由基机制增加土壤有机质分子间共价键的形成,促进土壤有机质间的分子缩聚,进而增加其稳定性[12]。此外,研究发现,土壤微生物普遍具有产生胞外超氧化物(O2·‒)的能力,这些O2·‒在酶的作用下进一步转化为过氧化氢(H2O2)[13-14];虽然产生的O2·‒和H2O2是弱氧化剂,但在环境中可以发生矿物催化的类芬顿反应,进一步形成非选择性、氧化能力极强的羟基自由基(HO·)[15-16]。由于施用有机肥可激发土壤微生物活性、改变微生物群落结构[17-18],同时又提高了土壤中铁矿物的可利用性[19],因此,长期施肥处理可能通过改变红壤的微生物群落结构和铁的可利用性而影响红壤有机碳的固持。目前,国际上关于长期施肥处理影响红壤中H2O2、HO·的含量及土壤固碳效应等方面的研究尚未见报道。
鉴于此,本文依托中国农业科学院湖南祁阳红壤长期定位试验站,通过设计一系列原位微宇宙试验,研究1)长期施肥、微生物和作物根系分泌物对红壤中H2O2、HO·和二价铁[Fe(Ⅱ)]的调控作用;2)土壤中微生物群落结构和类芬顿反应的关联;3)H2O2对土壤释放CO2的贡献;4)土壤-根的界面特征。研究结果将有助于深入理解红壤易退化的机制,同时为提升红壤有机物固持、保障国家粮食安全提供参考。
1 材料与方法 1.1 试验设计湖南祁阳红壤长期定位试验站始建于1990年,具体地理位置为111°52′32″E,26°45′12″N,海拔约120 m,年平均温度18.0℃,最高温度36.6~40℃,年降水量1 250 mm,年蒸发量1 470 mm,无霜期约300 d,采用一年两熟的小麦-玉米轮作模式[18]。供试土壤为第四纪红土发育的红泥土。2016年土壤的基本理化性质如下:单施有机肥(M)处理,有机质25.3 g·kg-1,pH 5.9,全碳13.4 g·kg-1,全铁46.7 g·kg-1,可溶性有机碳(DOC)37.5 mg·kg-1;单施化肥(NPK)处理,有机质18.5 g·kg-1,pH 4.6,全碳10.1 g·kg-1,全铁55.4 g·kg-1,DOC 444.6 mg·kg-1。
微宇宙试验于2016年12月(小麦播种后一个月)原位布置于M和NPK处理小区(图 1)。图 1从左至右依次为祁阳试验田、试验中所用的埋于土壤中的柱子和试验完成后取出的柱子。

|
注:从左到右依次为祁阳试验田、试验田埋入的柱子和试验完成后取出来的柱子 Note: The figure from left to right is the Qiyang experimental field, the column embedded in the experimental field, and the columns taken out after the test, respectively 图 1 原位微宇宙试验 Fig. 1 In situ microcosmic experiment |
聚氯乙烯(PVC)柱子高15 cm、直径7.5 cm,在柱身开2个大小相同的平行窗口,两个窗口的表面积之和占总表面积1/2。在窗口上分别覆盖3种不同孔径的尼龙网来构建不同处理,分别为0.45 μm、20 μm和1 000 μm。其中,0.45 μm尼龙网仅允许无机分子随水分流动通过;20 μm尼龙网允许微生物、一部分小分子的有机物以及无机分子随水分流动通过;1 000 μm尼龙网则允许植物根系、微生物、土壤中的有机无机分子随水分的流动通过[19-20]。试验启动时,柱子内装1 kg试验田的原位土,然后埋于该土壤区域内。
1.2 土壤采集与基本理化性质测定土壤样品2017年5月(小麦收割前一周)将所有PVC柱子取回实验室,将样品预留为干湿两部分,一部分置于阴凉处风干,研磨过10目、20目和100目筛网;一部分鲜土保存于-80℃冰箱。
土壤基本理化性质采用常规方法[21]测定。有机质采用重铬酸钾容量法测定;有效磷采用0.5 mol·L-1碳酸氢钠浸提-钼锑抗比色法测定;pH用pH计(PHS-3D,雷磁,上海)测定(水土比为1:2.5);全铁经过三酸(HNO3、HClO4和HF)消解[25]后利用电感耦合等离子体发射光谱仪(ICP-AES)(安捷伦710/715,澳大利亚)检测;全碳采用元素分析仪(Vario EL,Elementar Gmbh,哈瑙,德国)测定。土壤中Fe(Ⅱ)采用邻菲罗啉比色法检测[22];提取可溶性有机质(DOM)后用电感耦合等离子体原子发射光谱(ICP-AES)(安捷伦710/715,澳大利亚)测定里面的可溶性铁和DOC。
1.3 土壤中过氧化氢(H2O2)与羟基自由基(HO·)分析采用文献[23]的方法,准确称取过10目筛的新鲜土壤样品1.0 g,置于15 mL离心管中,加4 mL 10 mmol·L-1磷酸轻轻倒转浸提2 min,5 000 g离心力下离心5 min,调节土壤提取液pH为6.5(用0.1 mol·L-1 NaOH和HCl调节)。土壤过氧化氢吸光度的测定原理是在去除背景(磷酸盐缓冲溶液(PBS))影响的前提下,将土壤提取液分别添加磷酸盐缓冲液和过氧化氢酶,二者之间相差的过氧化氢吸光度进行拟化所得到的过氧化氢浓度就是土壤中的过氧化氢浓度。
过氧化氢的吸光度(AH2O2)计算:
| $ {A_{{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}}} = {A_{{\rm{ST1}}}} - {A_{{\rm{ST2}}}} + ({A_{{\rm{RB2}}}} - {A_{{\rm{RB1}}}}) $ | (1) |
式中,AST1、AST2分别为土壤样品加相同体积的磷酸盐缓冲液和过氧化氢酶处理的吸光度;ARB1、ARB2分别为磷酸盐缓冲液加相同体积的磷酸盐缓冲液和过氧化氢酶处理的吸光度。
H2O2 (0~2 μmol·L-1)标准曲线:用30% H2O2配成5 mmol·L-1 H2O2溶液,用10 mmol·L-1 PBS将5 mmol·L-1 H2O2溶液稀释成4 mol·L-1 H2O2溶液作为母液,并按照0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、2.0 μmol·L-1的浓度梯度进行稀释。
利用对苯二甲酸(TPA)捕捉HO·生成荧光产物——羟基对苯二甲酸 (HTPA)[24],然后,采用高效液相色谱仪(HPLC)检测荧光物质HTPA,从而间接测定HO·的含量[23]。准确称取过10目筛的新鲜土壤样品1.0 g,置于15 mL离心管中,加4 mL 10 mmol·L-1 H3PO4,充分摇匀5 min,在25℃以离心力4 200 g离心3 min,取上清液2 mL,在上清液中加入20 μL 100 mmol·L-1 TPA,再在25℃黑暗避光条件下培养24 h。培养后,将上清液过0.45 μm滤膜,取0.5 mL滤液置于棕色液相瓶中,随后通过HPLC(安捷伦1260,澳大利亚)配Eclipse XDB-C18色谱柱(4.6 mm× 250 mm,5 μm)、荧光检测器(FLD)测定。流动相用30%的甲醇(色谱纯)配制50 mmol·L-1 KH2PO4,pH 3.2(1 mol·L-1 NaOH和1 mol·L-1 HCl调节),流速为0.7 mL·min-1,FLD检测器激发波长为311 nm,发射波长为425 nm,柱温25℃。HTPA与HO·反应比例为1:1,样品中测定的HTPA的值即为HO·的值。与此同时,应将HTPA的标准样品按照适宜的浓度梯度进行稀释,所得到的峰值与已知浓度进行拟化,以方便样品中HTPA的换算。
1.4 土壤排放二氧化碳潜力分析准确称取过10目筛的新鲜土壤样品1.0 g,置于25 mL的血清瓶中,加入10 mL40 nmol·L-1的H2O2,对照组加入10 mL水,过氧化氢现配现用。在血清瓶里充氮气5~10 min,排出瓶内空气,将橡胶塞置于瓶口旁,随着氮气针头的慢慢抽出及时盖住瓶口,然后用锡盖封住,用黑色塑料袋包裹,避光,置于25℃恒温摇床培养24 h,摇速为170 r·min-1。培养后,利用注射器和三通阀取气,高效气相色谱仪(GC,安捷伦7890A,澳大利亚)待测。
1.5 土壤中DNA提取和高通量测序分析称取0.5 g新鲜土壤,采用DNA提取试剂盒(MoBio Laboratories,加利福尼亚州,美国),参照其操作说明提取土壤样品中总DNA,所得DNA于-20℃保存。DNA样品通过Illumina MiSeq平台(派森诺生物科技有限公司,上海)进行16S rRNA测序。
1.6 根-土界面观察同步辐射红外显微成像(SR-FTIR):收集NPK处理的通过1 000 μm孔径的根际土壤,首先,采取喷雾方式喷洒蒸馏水,润湿24 h,并尽量保持土壤颗粒的完整性[25];然后,样品在全封闭式快速冷冻切片机(CM1 950,徕卡,德国)内的低温(-20℃)条件下用水包埋后进行超薄切片(厚度为2 μm);最后,超薄切片样品放置于低辐射镜片(Low-E, 美国科弗里有限公司)上,带至上海光源BL01B线站进行红外显微成像观察。面扫参数设置:光谱范围,650~4 000 cm-1;步长,10 μm×10 μm;分辨率,4 cm-1;扫描次数,64次[25];微区域精扫参数设置:光谱范围,650~4 000 cm-1;步长,1 μm×1 μm;分辨率,4 cm-1;扫描次数,128次[26]。
扫描电子显微镜(SEM)观察:同步辐射红外显微成像后的超薄切片样品于磁控溅射镀膜机(Ted Pella,加利福尼亚州,美国)喷金,并利用SEM(S-3400N Ⅱ,日本日立公司)进行形貌分析[27]。
X射线光电子能谱(XPS)分析:收集NPK处理的通过1 000 μm孔径的根际土和非根际土[28],利用玛瑙研钵研磨样品至粒径小于200 μm;然后,在配有Al Kα X射线辐射检测器的PHI 5000 Versa Probe X射线能谱仪(UIVAC-PHI,日本)上进行土壤颗粒表面的铁形态分析。铁的XPS谱以C 1s的结合能(284.6 eV)作为校正标准,利用XPSPEAK(Version 4.1)软件进行分峰处理[27]。
1.7 数据处理数据采用Origin 9.0和SPSS 20.0进行图形分析处理,使用最小显著差异法(Least significant difference,LSD)检验进行多重比较(P < 0.05)。高通量测序的多样性指数,包括香农指数(Shannon index)、辛普森指数(Simpson index)、丰富度指数(Chao 1 index、ACE index),以及微生物群落与环境因子的冗余分析(RDA)均采用R 3.1.0软件运行。
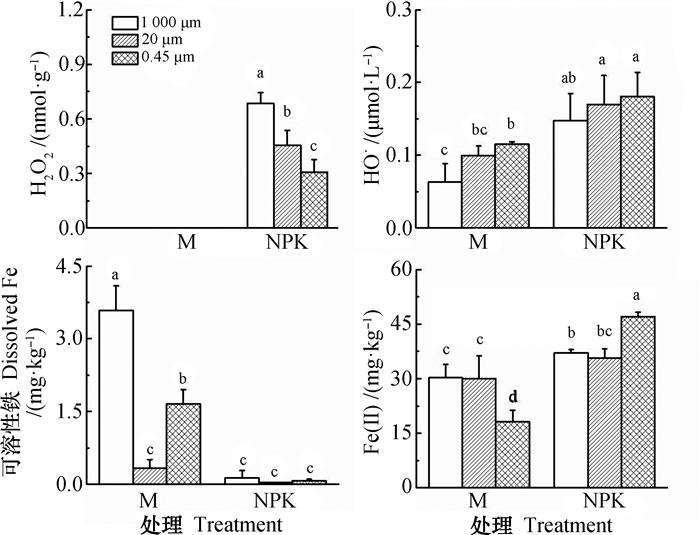
2 结果 2.1 长期施肥下红壤中芬顿/类芬顿反应发生的直接证据经过27 a的长期施肥,M处理的土壤未检测到H2O2,而NPK处理的土壤H2O2浓度范围约为0.4~0.8 nmol·g-1(图 2)。针对不同筛孔处理的NPK处理土壤而言,通过1 000 μm孔径的土壤H2O2浓度最高,其次是通过20 μm孔径的土壤,而通过0.45 μm孔径的土壤H2O2浓度最低。同样地,对于土壤中HO·而言,通过不同孔径的M处理土壤HO·含量均显著低于NPK处理的土壤。其中,M处理土壤和NPK处理土壤均是通过0.45 μm孔径的土壤HO·含量最高,其次是通过20 μm孔径的土壤,而通过1 000 μm孔径的土壤HO·含量最低。对于土壤中Fe(Ⅱ)而言,M处理的土壤Fe(Ⅱ)含量显著低于NPK处理土壤,其中,通过0.45 μm孔径的土壤中差异尤其显著,而在通过1 000 μm孔径和20 μm孔径的土壤之间差异相对较小。
|
注:M、NPK分别代表长期施用有机肥和化肥处理,图柱上不同字母表示不同施肥和孔径处理间差异显著(P < 0.05),误差线表示标准差,n=3。下同 Note: M and NPK represent long-term application of manure and inorganic fertilizer, respectively. The different letters above the columns indicate significant differences between fertilizations and mesh pore treatments at P < 0.05. Error bar represents standard deviation of n=3. The same below 图 2 长期施肥土壤中H2O2、HO·、可溶性Fe及Fe(Ⅱ)含量 Fig. 2 Concentrations of H2O2, HO·, dissolved Fe and Fe(Ⅱ) in long-term fertilized soils |
综上,长期施肥方式可以影响红壤中芬顿/类芬顿反应及其相关联的H2O2、HO·及Fe(Ⅱ)含量。同时,植物根系和微生物也对芬顿/类芬顿反应相关联的H2O2、HO·及Fe(Ⅱ)有一定程度的影响。
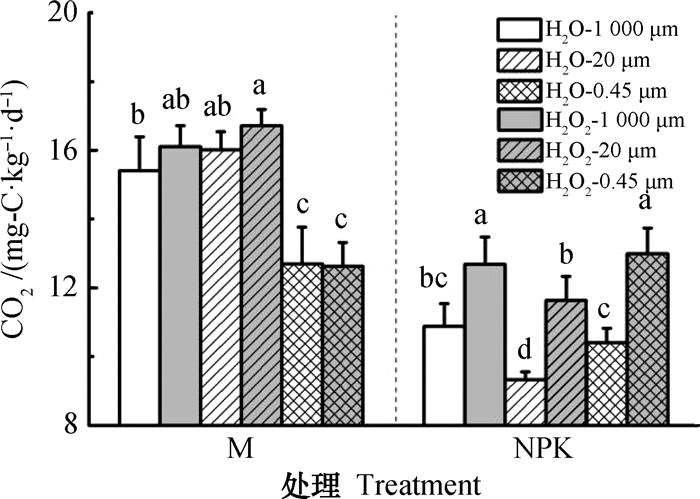
2.2 长期施肥下红壤的CO2释放潜力为了评估芬顿/类芬顿反应对长期施肥红壤中CO2释放潜力的影响,分别添加0.4 nmol·g-1当量的H2O2至土壤中,对照处理添加相当量的H2O;然后,在黑暗、避光环境中培养24 h,促进土壤发生芬顿反应。由图 3可知,在M处理的土壤中,添加H2O2和添加H2O培养的土壤释放的CO2量并无显著差异;而在NPK处理的土壤中,添加H2O2显著促进了CO2释放量,该结果表明长期M处理的土壤具有很好的H2O2缓冲性能,而长期NPK处理的土壤可能发生了退化(如土壤有机质含量低),易于发生芬顿/类芬顿反应,因而具有较差的H2O2缓冲性能。与NPK处理土壤相比,M处理土壤中通过1 000 μm孔径和20 μm孔径后释放的CO2量更高,但通过0.45 μm孔径的土壤释放的CO2量并无显著差别。
|
注:H2O2-1 000 μm、H2O2-20 μm和H2O2-0.45 μm表示在通过1 000 μm、20 μm和0.45 μm孔径处理的土壤中添加H2O2进行培养,H2O为对照处理。图柱上不同字母表示不同筛孔处理间差异显著(P < 0.05) Note: H2O2-1 000 μm, H2O2-20 μm and H2O2-0.45 μm mean that H2O2 was added to the soil treated with 1 000 μm, 20 μm and 0.45 μm mesh fabric panel, and H2O was used as the control treatment. Significant differences between mesh pore treatments were determined using one-way ANOVA's followed by Tukey's HSD post hoc tests at P < 0.05. 图 3 长期施肥红壤中二氧化碳的释放潜力 Fig. 3 Release potential of CO2 in long-term fertilized soils |
微生物具有产生O2·‒的能力,可能是土壤中H2O2的主要生物来源[13-14]。为了验证细菌群落在土壤芬顿/类芬顿反应中的关键作用,进一步研究了施肥措施和孔径处理条件下土壤中细菌丰度以及多样性指数(表 1)。由表 1可知,施肥措施和孔径处理显著(P < 0.05)影响了分类操作单元(OTUs)、ACE、Chao1、香农指数。通过不同孔径的M处理土壤中OTUs显著(P < 0.05)高于NPK处理土壤;其中,以通过1 000 μm孔径的M处理土壤中OTUs为最高。通过不同孔径的施肥处理土壤中群落丰富度指数ACE和Chao1的变化趋势一致,从高至底顺序为:M-1 000 > M-0.45 > M-20 > NPK-1 000,NPK-0.45 > NPK-20;通过不同孔径的施肥处理土壤中群落多样性香农指数的顺序为:M-1 000 > M-20,M-0.45 > NPK-1 000 > NPK-20,NPK-0.45。综上,长期施用有机肥红壤的微生物丰富度和多样性指数均显著高于施用化肥红壤。
|
|
表 1 长期施肥红壤的OTUs、群落丰度以及多样性 Table 1 Shift in OTUs, richness and diversity of long-term fertilized soils |
基于土壤细菌群落与环境因子之间的冗余分析(图 4)表明,RDA1及RDA2解释量分别为83.9%和5.5%。其中RDA1将M与NPK处理土壤明显分开。通过不同孔径的M处理土壤中细菌群落聚集在一起,说明植物根系和微生物的进入对土壤中细菌群落结构影响较小;而NPK处理的土壤中,通过0.45 μm孔径与通过1 000 μm和20 μm孔径的细菌群落差异较大,说明植物根系和微生物的进入对土壤中细菌群落结构影响较大。M处理的细菌群落与土壤pH、DOC、可溶性Fe和CO2释放呈正相关关系,说明M处理的土壤细菌群落结构影响了土壤pH、DOC、可溶性Fe和CO2释放;而NPK处理的土壤细菌群落与土壤H2O2、HO·和Fe(Ⅱ)呈正相关关系,说明NPK处理的土壤细菌群落结构可能通过产生H2O2、还原态Fe(Ⅱ)引发了土壤中的芬顿反应,此外,Fe(Ⅱ)也可能贡献了化学途径生成H2O2和HO·。

|
注:SI、DOC分别为土壤中可溶性铁和可溶性有机碳 Note: SI and DOC are soil soluble iron and dissolved organic carbon 图 4 土壤细菌群落与环境因子的冗余分析 Fig. 4 Redundancy analysis (RDA) of soil bacterial community and environmental factors |
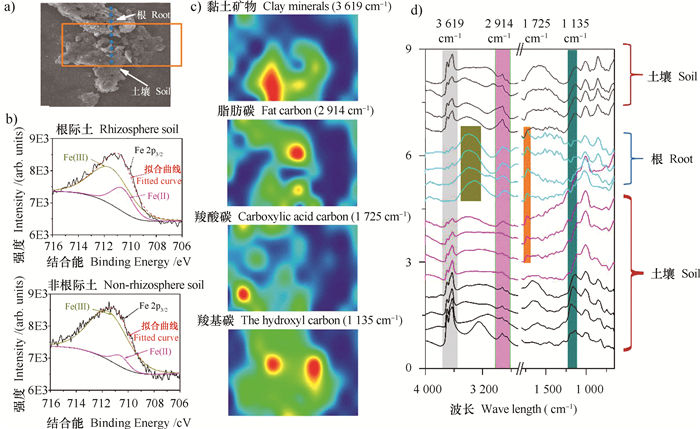
为研究植物根系的进入对土壤芬顿/类芬顿反应的影响,利用SEM结合SR-FTIR以及XPS技术研究了施用化肥处理通过1 000 μm孔径土壤中的界面特征(图 5)。SEM(图 5A)表明所观察的区域为土壤-根的接触面, 接触面上有一个明显的断区,上部较浅色区域为根系,且根系区域可以看出有明显的根系纹理,而下部较深色区域为土壤颗粒;Fe 2p3/2 XPS谱(图 5B)表明,根的出现增加了土壤-根界面上Fe(Ⅱ)比例,因此促进了土壤芬顿反应的发生;SR-FTIR(图 5C)表明,土壤-根界面上黏土矿物(3 619 cm-1)、脂肪碳(2 914 cm-1)、羧酸碳(1 725 cm-1)、羟基碳(1 135 cm-1)的分布模式有较大差异,其中,根的周围含有高浓度的脂肪碳、羟基碳,而羧酸碳似乎已经扩散至土壤颗粒中,因而根系的进入为土壤提供了酸性环境,利于芬顿反应的发生;土壤-根界面的微区FTIR图(图 5 d)进一步支持了SEM的观察结果,即该区域为土壤-根的界面区域,其中,黏土矿物主要分布在观察区域的边缘,羟基碳分布在界面,而脂肪碳、羧酸碳分布在观察区域的中心。
|
图 5 土壤-根界面观察a)扫描电子显微镜(SEM)图;b) Fe 2p3/2谱;c)同步辐射红外显微成像(SR-FTIR)面扫图;d)微区域红外显微成像(FTIR)谱 Fig. 5 Soil - root interface observation. a) Scanning electronic microscopy (SEM) image; b) Fe 2p3/2 spectrum; c) Synchrotron radiation (SR)-based Fourier transform infrared (FTIR) mapping; d) Micro-FTIR (µ-FTIR) |
最近研究表明,在特定条件下,土壤中芬顿或类芬顿化学反应导致的土壤有机碳分解量与生物分解量相当[23]。然而,红壤中芬顿或类芬顿化学反应方面的研究尚未见报道。本研究发现,红壤中H2O2含量最高为0.7 nmol·g-1(图 2),该结果较Georgiou等[23]报道的希腊南部地区土壤中H2O2含量(~0.2 nmol·g-1)略高,但较沙漠土中的H2O2含量(5~19 nmol g-1)明显偏低。同时,本研究发现与长期施用有机肥相比,长期施用化肥显著增加了红壤中H2O2和Fe(Ⅱ)含量,而降低了可溶性Fe含量(图 2)。该结果表明,长期施用有机肥的红壤由于增加了Fe的可溶性/可利用性,而类芬顿反应(式(1)~式(2))为矿物催化的界面反应,因此,可溶性Fe的增加促进了类芬顿反应的发生,进而导致了H2O2含量的降低。
| $ \equiv \mathrm{Fe}(\mathrm{III})-\mathrm{OH}+\mathrm{H}_{2} \mathrm{O}_{2} \rightarrow \equiv \mathrm{Fe}(\mathrm{II})+\mathrm{H}_{2} \mathrm{O}+\mathrm{HO}_{2} $ | (1) |
| $ \equiv \mathrm{Fe}(\mathrm{II})+\mathrm{H}_{2} \mathrm{O}_{2} \rightarrow \equiv \mathrm{Fe}(\mathrm{III})-\mathrm{OH}+\mathrm{HO} $ | (2) |
式中,$\equiv \mathrm{Fe}(\mathrm{III})-\mathrm{OH}$代表铁矿物表面。
与长期施用有机肥相比,长期施用化肥显著增加了红壤中Fe(Ⅱ)、H2O2和HO·含量(图 2),该结果印证了长期施用化肥红壤中芬顿反应的发生(式(2))。RDA结果表明,H2O2与HO·显著正相关(图 4),这与Lindsey和Tarr[29]在富里酸和胡敏酸体系中的研究结果一致。Page等[15]发现从干燥的高地到湿润的低地栖息地,土壤中HO·的产生速率随着Fe(Ⅱ)和DOM浓度的增加而增加。Tong等[16]也认为土壤中Fe(Ⅱ)和可溶性有机质(DOM)是生成HO·的主要因子。然而,上述研究均未涉及微生物的作用,本研究中RDA结果(图 4)同时表明H2O2与HO·的相关性是微生物介导的过程,且Fe(Ⅱ)调控着施用化肥土壤内芬顿反应的进行,是HO·产生的主要调控因子。
微生物通过影响土壤中铁的地球化学循环过程进而对土壤中H2O2产生影响。施肥改变了土壤的基本性质[19],对土壤微生物的丰度和多样性也有着强烈的影响(表 1)。采用稳定同位素原位标记土壤微生物核酸RNA的方法,Ding等[30]的研究结果表明,长期施用化肥处理的土壤可以显著提高铁还原能力,而Wen等[18]进一步研究发现,长期施用化肥显著改变了红壤中微生物群落结构,导致微生物和针铁矿的氧化还原过程中形成更高比例的Fe(Ⅱ)。因此,与长期施用化肥的红壤相比,长期施用有机肥的红壤中Fe(Ⅱ)含量较低,导致非生物形成H2O2的量较少[15]。
除了铁化学和微生物外,有机质含量也会影响土壤中H2O2。Petigara等[31]发现在有机质或锰含量高的土壤中,H2O2降解迅速,且形成的产物HO·较少(小于10%);而在有机质含量低的土壤中,H2O2降解缓慢,且HO·为主要产物。因此,长期施用有机肥的红壤中高的有机质含量是其H2O2迅速降解的原因之一。在今后的研究中,不同深度、不同季节、不同土壤性质(例如DOM)对过氧化氢、羟基含量的影响应该重点关注。
3.2 类芬顿化学反应对长期施肥红壤碳排放的影响土壤中产生的CO2是微生物代谢等一系列生物化学过程的综合产物,其主要来自土壤微生物和植物根系的呼吸作用。本研究发现无论添加水或者双氧水培养,长期施用有机肥的土壤排放的CO2显著较长期施化肥土壤的多,且植物根系和微生物能参与作用的土壤(1 000 µm)排放的CO2要远远大于仅能通过水分子和无机离子的土壤(0.45µm)(图 3),可能是由于长期施用有机肥的土壤较长期施化肥的土壤生物量大的缘故[17-18]。同时,研究结果表明在长期施用化肥的土壤中,添加0.4 nmol·g-1当量的H2O2会显著促进土壤CO2的排放;而在长期施用有机肥的红壤中,添加该当量的H2O2则不会显著促进土壤CO2的排放(图 3)。由于芬顿反应在酸性条件下效果显著高于中性或近中性条件,因此,长期施用化肥的土壤由于pH偏低,易于发生芬顿反应而形成强氧化性的产物HO·,HO·进一步氧化土壤有机碳,排放CO2,导致有机碳快速分解;而长期施用有机肥的土壤则利用它的中性土壤环境减缓芬顿反应而累积有机碳。此外,土壤排放的CO2量与HO·、H2O2及Fe(Ⅱ)含量成负相关关系。在芬顿反应机制中,H2O2催化Fe(Ⅱ)生成产物HO·和Fe(Ⅲ),羟基自由基是目前已知氧化性最强的活性氧自由基,其氧化还原电位达2.7 V,反应速率常数一般高于107 mol·L-1·s-1,它能氧化土壤有机质,排放出CO2、N2O等温室气体。
综上,长期施化肥的土壤内部环境利于芬顿反应的进行,所生存的微生物促进铁的还原过程;长期施有机肥的土壤内部微生物对Fe(Ⅱ)氧化过程有相对积极的作用,使得土壤具有显著抑制铁还原能力,能够有效抑制或减缓芬顿反应,进一步使土壤中的有机碳得到累积。
3.3 微生物介导的类芬顿反应:对红壤有机碳固持的启示传统观点认为,微生物通过胞外酶的作用分解有机物,原有的和分解的有机物与土壤中矿物作用,形成矿物-有机复合体,导致土壤有机碳稳定与累积[9]。但该观点难以有效解释黏粒含量高及铁铝氧化物丰富的亚热带红壤中有机碳含量低且退化严重的现象。基于长期定位试验站和原位微宇宙试验的研究结果,本文提出了有效增加亚热带红壤有机碳的概念模型(图 6)。具体而言,红壤通过施用有机物(如畜禽粪便、秸秆、有机肥),激发土壤中的微生物[17-18],增加红壤中铁矿物的可利用性[19]。由于土壤微生物普遍具有产生O2·‒的能力[13-14],导致铁氧化物含量丰富的红壤发生类芬顿反应,形成分子内共价键而促进了土壤有机碳的稳定性[11-12]。同时,可利用铁快速转化为比表面积大、活性高的非晶形水铁矿[19],促进了矿物-有机复合体的形成[4],增加了红壤有机碳稳定与累积。

|
图 6 微生物介导的类芬顿反应影响了红壤中碳储存 Fig. 6 Microbial - mediated Fenton-like reactions affect soil C storage |
基于长期定位试验站结合原位微宇宙试验,对亚热带红壤中H2O2、HO·、铁化学、微生物群落结构及其土壤-根界面过程进行了研究。研究发现,长期施用化肥的红壤中H2O2、HO·及Fe(Ⅱ)含量均显著高于长期施用有机肥,根系分泌物和微生物的参与也能够调控H2O2、HO·和Fe(Ⅱ)含量,且H2O2和HO·含量呈线性关系。长期施用有机肥的红壤具有很好的H2O2缓冲性能,其细菌群落影响了土壤pH、DOC、可溶性Fe和CO2释放;而长期施用化肥的红壤具有较差的H2O2缓冲性能,其细菌群落可能通过产生H2O2、还原态Fe(Ⅱ)引发了土壤中的芬顿反应。与长期施用化肥的红壤相比,长期施用有机肥的红壤中通过1 000 μm孔径和20 μm孔径后释放的CO2量更高,但通过0.45 μm孔径的土壤释放的CO2量并无显著差别。土壤-根界面上黏土矿物(3 619 cm-1)、脂肪碳(2 914 cm-1)、羧酸碳(1 725 cm-1)、羟基碳(1 135 cm-1)的分布模式有较大差异,其中,根的周围含有高浓度的脂肪碳、羟基碳。根的出现增加了土壤-根界面上Fe(Ⅱ)比例。提出了有效增加亚热带红壤有机碳的概念模型。具体而言,通过施用有机物(如畜禽粪便、秸秆、有机肥),激发红壤中的微生物和铁矿物的可利用性,促进芬顿或类芬顿反应的发生,进而形成分子内共价键和矿物-有机复合体而促进红壤有机碳稳定与累积。
| [1] |
何园球, 孙波. 红壤质量演变与调控. 北京: 科学出版社, 2000. He Y Q, Sun B. Red soil quality evolution and regulation (In Chinese). Beijing: Science Press, 2000. (  0) 0) |
| [2] |
赵其国, 黄国勤, 马艳芹. 中国南方红壤生态系统面临的问题及对策. 生态学报, 2013, 33(24): 7615-7622. Zhao Q G, Huang G Q, Ma Y Q. Problems and countermeasures for the ecosystem of red soil in southern China (In Chinese). Acta Ecologica Sinica, 2013, 33(24): 7615-7622. (  0) 0) |
| [3] |
Six J, Bossuyt H, Degryze S, et al. A history of research on the link between(micro)aggregates, soil biota, and soil organic matter dynamics . Soil & Tillage Research, 2004, 79(1): 7-31.
(  0) 0) |
| [4] |
Koegel-Knabner I, Guggenberger G, Kleber M, et al. Organo-mineral associations in temperate soils:Integrating biology, mineralogy, and organic matter chemistry . Journal of Plant Nutrition and Soil Science, 2008, 171(1): 61-82. DOI:10.1002/jpln.200700048
(  0) 0) |
| [5] |
Rasmussen C, Heckman K, Wieder W R, et al. Beyond clay:Towards an improved set of variables for predicting soil organic matter content . Biogeochemistry, 2018, 137(3): 297-306. DOI:10.1007/s10533-018-0424-3
(  0) 0) |
| [6] |
Schmidt M W, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property . Nature, 2011, 478(7367): 49-56. DOI:10.1038/nature10386
(  0) 0) |
| [7] |
Lalonde K, Mucci A, Ouellet A, et al. Preservation of organic matter in sediments promoted by iron . Nature, 2012, 483(7388): 198-200. DOI:10.1038/nature10855
(  0) 0) |
| [8] |
Wiseman C L S, Püttmann W. Interactions between mineral phases in the preservation of soil organic matter . Geoderma, 2016, 134(1/2): 109-118.
(  0) 0) |
| [9] |
Zhang J C, Zhang L, Wang P, et al. The role of non-crystalline Fe in the increase of SOC after long-term organic manure application to the red soil of southern China . European Journal of Soil Science, 2013, 64(6): 797-804. DOI:10.1111/ejss.12104
(  0) 0) |
| [10] |
Roscoe R, Buurman P. Tillage effects on soil organic matter in density fractions of a Cerrado Oxisol . Soil & Tillage Research, 2003, 70(2): 107-119.
(  0) 0) |
| [11] |
Hanna K, Kone T, Medjahdi G. Synthesis of the mixed oxides of iron and quartz and their catalytic activities for the Fenton-like oxidation . Catalysis Communications, 2008, 9(5): 955-959. DOI:10.1016/j.catcom.2007.09.035
(  0) 0) |
| [12] |
Piccolo A, Spaccini R, Cozzolino V, et al. Effective carbon sequestration in italian agricultural soils by in situ polymerization of soil organic matter under biomimetic photocatalysis . Land Degradation & Development, 2018, 29(3): 483-494.
(  0) 0) |
| [13] |
Diaz J M, Hansel C M, Voelker B M, et al. Widespread production of extracellular superoxide by heterotrophic bacteria . Science, 2013, 340(6137): 1223-1226. DOI:10.1126/science.1237331
(  0) 0) |
| [14] |
Tang Y, Zeiner C A, Santelli C M, et al. Fungal oxidative dissolution of the Mn(Ⅱ)-bearing mineral rhodochrosite and the role of metabolites in manganese oxide formation . Environmental Microbiology, 2013, 15(4): 1063-1077. DOI:10.1111/1462-2920.12029
(  0) 0) |
| [15] |
Page S E, Kling G W, Sander M, et al. Dark formation of hydroxyl radical in arctic soil and surface waters . Environmental Science & Technology, 2013, 47(22): 12860-12867.
(  0) 0) |
| [16] |
Tong M, Yuan S H, Ma S, et al. Production of abundant hydroxyl radicals from oxygenation of subsurface sediments . Environmental Science & Technology, 2016, 50(1): 214-221.
(  0) 0) |
| [17] |
Xun W, Zhao J, Xue C, et al. Significant alteration of soil bacterial communities and organic carbon decomposition by different long-term fertilization management conditions of extremely low-productivity arable soil in South China . Environmental Microbiology, 2016, 18(6): 1907-1917. DOI:10.1111/1462-2920.13098
(  0) 0) |
| [18] |
Wen Y, Xiao J, Liu F, et al. Contrasting effects of inorganic and organic fertilisation regimes on shifts in Fe redox bacterial communities in red soils . Soil Biology and Biochemistry, 2018, 117: 56-67. DOI:10.1016/j.soilbio.2017.11.003
(  0) 0) |
| [19] |
Yu G, Xiao J, Hu S, et al. Mineral availability as a key regulator of soil carbon storage . Environmental Science & Technology, 2017, 51(9): 4960-4969.
(  0) 0) |
| [20] |
Cheng L, Booker F L, Tu C, et al. Arbuscular mycorrhizal fungi increase organic carbon decomposition under elevated CO2 . Science, 2012, 337(6098): 1084-1087. DOI:10.1126/science.1224304
(  0) 0) |
| [21] |
鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000. Bao S D. Soil agrochemical analysis (In Chinese). 3rd ed. Beijing: China Agriculture Press, 2000. (  0) 0) |
| [22] |
Tamura H, Goto K, Yotsuyanagi T, et al. Spectrophotometric determination of iron(Ⅱ)with 1, 10-phenanthroline in the presence of large amounts of iron(Ⅲ) . Talanta, 1974, 21(4): 314-318. DOI:10.1016/0039-9140(74)80012-3
(  0) 0) |
| [23] |
Georgiou C D, Sun H J, Mckay C P, et al. Evidence for photochemical production of reactive oxygen species in desert soils. Nature Communications, 2015, 6(1): Artide number 7100
(  0) 0) |
| [24] |
Li L, Abe Y, Nagasawa Y, et al. An HPLC assay of hydroxyl radicals by the hydroxylation reaction of terephthalic acid . Biomedical Chromatography, 2004, 18(7): 470-474. DOI:10.1002/bmc.339
(  0) 0) |
| [25] |
Sun F S, Polizzotto M L, Guan D X, et al. Exploring the interactions and binding sites between Cd and functional groups in soil DOM using two-dimensional correlation spectroscopy and synchrotron radiation based spectromicroscopies . Journal of Hazardous Materials, 2017, 326: 18-25. DOI:10.1016/j.jhazmat.2016.12.019
(  0) 0) |
| [26] |
褚冰杰, 余光辉, 刘飞飞, 等. 土壤微团聚体中矿物-有机复合体特征. 土壤学报, 2017, 54(6): 1451-1458. Chu B J, Yu G H, Liu F F, et al. Characterization of mineral-organic complex in soil microaggregates with synchrotron radiation infrared micro-imaging method (In Chinese). Acta Pedologica Sinica, 2017, 54(6): 1451-1458. (  0) 0) |
| [27] |
Xiao J, He X H, Hao J L, et al. New strategies for submicron characterization the carbon binding of reactive minerals in long-term contrasting fertilized soils:Implications for soil carbon storage . Biogeosciences, 2016, 13(12): 3607-3618. DOI:10.5194/bg-13-3607-2016
(  0) 0) |
| [28] |
Weiss J V, Emerson D, Megonigal J P. Geochemical control of microbial Fe(Ⅲ)reduction potential in wetlands:Comparison of the rhizosphere to non-rhizosphere soil . FEMS Microbiology Ecology, 2004, 48(1): 89-100. DOI:10.1016/j.femsec.2003.12.014
(  0) 0) |
| [29] |
Lindsey M E, Tarr M A. Quantitation of hydroxyl radical during fenton oxidation following a single addition of iron and peroxide . Chemosphere, 2000, 41(3): 409-417. DOI:10.1016/S0045-6535(99)00296-9
(  0) 0) |
| [30] |
Ding L J, Su J Q, Xu H J, et al. Long-term nitrogen fertilization of paddy soil shifts iron-reducing microbial community revealed by RNA-13C-acetate probing coupled with pyrosequencing . ISME Journal, 2015, 9(3): 721-734. DOI:10.1038/ismej.2014.159
(  0) 0) |
| [31] |
Petigara B R, Blough N V, Mignerey A C. Mechanisms of hydrogen peroxide decomposition in soils . Environmental Science & Technology, 2002, 36(4): 639-645.
(  0) 0) |
2. Institute of Surface-Earth System Science, Tianjin University, Tianjing 300072, China;
3. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
4. Key Laboratory of Plant Nutrition and Nutrient Cycling, Ministry of Agriculture of China and Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
 2019, Vol. 56
2019, Vol. 56


