2. 江西省红壤研究所,南昌 331717
不合理的人为活动导致全球大气氮沉降量逐渐增加,氮沉降成为全世界关注的重要环境问题之一[1]。近年来我国氮沉降量急剧增加,总氮沉降量每年已超过1500万吨,成为继欧洲和北美之后的世界第三大氮沉降区[2]。过量的氮输入导致的土壤酸化、速效养分流失、生物多样性降低、微生物群落改变等问题已得到深入研究[2-4]。红壤作为我国重要的土壤资源,由于其自身发育以及气候等因素作用已经面临严重的酸化、生物退化等生态问题,同时严重的氮沉降势必会加剧红壤地区的生态退化,每年氮沉降输入红壤旱地的氮含量约为94.50~185.99 kg·hm-2,农田氮沉降普遍盈余,对红壤生态系统造成威胁[5-6],阻碍红壤地区的经济社会可持续发展。
为维护我国生态安全,有必要采取有效措施遏制氮沉降下土壤生态环境的继续恶化,促进土壤生态功能的恢复和可持续性发展。近年来,人们意识到依靠植被的自然恢复能力等调控措施恢复土壤生态健康的重要性,通过农田休耕,停止人为干扰后植被自行修复能够恢复生物多样性和生态系统功能[7-8]。休耕演替初期,占据生境的优势植物对土壤环境的改变起到了至关重要的作用,且植物根际性质是其利用土壤养分和适应脆弱环境的最直接表征之一[9]。同时,针对氮沉降下红壤恢复过程中存在的关键限制因子-土壤酸化,采取施用石灰可以有效克服这一限制因子。石灰作为土壤酸度改良剂,能够提高土壤肥力[10],加速红壤生态恢复进程。土壤生态恢复过程伴随着土壤生物群落和生物功能的改变。根际微生物存在于植物根系与土壤物质交换最为活跃的界面--根际中,是根际土壤的重要组成部分,对环境因子较为敏感,生境的改变(如:土壤酸度、养分含量等)会引起根际微生物群落结构和多样性发生改变[11],同时土壤微生物作为生态系统中物质循环和能量流动的重要参与者,在维持和反映生态系统健康方面起着重要作用,是评价自然或人为干扰引起土壤质量变化的重要指标[12]。
本研究通过氮添加模拟大气氮沉降,并通过石灰调控土壤酸度,选取休耕地演替初期先锋优势植物狗尾草(Setaria viridis(L.)Beauv)的根际土壤微生物群落为研究对象,结合全球变化因素和人为管理措施的综合影响因子,研究模拟氮沉降背景下施石灰对休耕红壤根际微生物群落的影响。基于已有的研究提出以下假说:模拟氮沉降能够增加土壤肥力而促进初级生产力,施石灰能够提高根际土壤pH改善根际微生物群落生境,因而氮沉降与石灰共同作用可增加土壤微生物生物量; 但是由于减少了环境限制因子的维度和生态位,氮沉降与石灰的共同作用会降低微生物多样性。预期结果有助于深入了解氮沉降下改良剂施用对休耕红壤微生物群落的影响,还将为热带和亚热带生态系统恢复措施完善提供指导。
1 材料与方法 1.1 研究区概况试验点位于江西省红壤研究所(116°20′24″E,28.3°15′30″N),属亚热带季风气候,年均气温17.7~18.5℃,年均降雨量1 537 mm,年蒸发量1 100~ 1 200 mm。土壤质地为粉砂质黏土,初始土壤pH 5.27,土壤有机碳10.37 g·kg-1,全氮0.99 g·kg-1,全磷0.62 g·kg-1,速效钾179.07 mg·kg-1。休耕前连续多年种植制度为花生-红薯轮作,休耕后对耕层土壤进行混匀处理以减少土壤异质性对试验结果的影响。休耕前两年禾本科植物狗尾草为优势物种,生物量约占每个小区总生物量的80%。
1.2 试验设计定位试验始于2015年1月,休耕后植被自然生长,试验采用3氮×2石灰的二因素完全交互设计。当地氮沉降量为每公顷每年40 kg N,在此基础上模拟低量(N0)、中量(N1)、高量(N2)三个氮(N)沉降水平,分别施N 0、45、90 kg·hm-2·a-1,以NH4NO3形式于每年3月份和7月份分两次施入。石灰需要量通过理论计算,以提升耕层土壤(20 cm)pH 1个单位确定石灰用量,石灰处理(L)设置L0、L1两个水平,施用量0、110 kg·hm-2·a-1,以Ca(OH)2形式直接施入土壤,每年3月份一次性施入。小区面积为6.3 m× 4 m,每个处理设置5个重复,随机区组排列。
1.3 样品采集于2016年10月5日,此时为狗尾草生物量最大期。每个小区内随机采集30 cm×30 cm面积大小的狗尾草生长区域,将植物样品地上部和根系分离后分开保存,烘干称重后粉碎用于养分含量分析。采用抖根法收集根际土壤样品并立即带回实验室,室内过2 mm筛混匀。部分土样保存于4℃条件下用于土壤速效养分分析并迅速测定; 部分土样冷冻干燥后用于微生物磷脂脂肪酸(PLFA)的测定; 部分土样风干后用于土壤pH、交换性钙(Ca2+)与交换性铝(Al3+)的测定。
1.4 土壤基础性质测定采用常规方法测定土壤pH用1︰2.5(土︰水,w︰v)浸提,pH计(METTLER-S220-K)测定; 交换性钙(Ca2+)含量用1 mol·L-1 NH4COOH交换,原子吸收分光光度法测定; 交换性铝(Al3+)含量采用1 mol·L-1 KCl交换,中和滴定法测定; 矿质氮(NH4+-N和NO3--N之和)采用2 mol·L-1 KCl浸提,流动分析仪(Auto Analyer AA3,德国)测定; 有效磷采用0.03 mol·L-1 NH4F-0.025 mol·L-1 HCl溶液浸提,钼蓝比色法测定; 可溶性有机碳(DOC)采用超纯水浸提TOC分析仪(Elementar,德国)测定。
1.5 磷脂脂肪酸(PLFA)的提取、分离、鉴定采用修正的Bligh-Dyer方法进行提取[13]:称取8 g冷冻干燥土样于特氟龙试管中,用柠檬酸缓冲溶液(pH 4.0)︰氯仿︰甲醇(体积比为0.8︰1︰2)振荡提取总脂类,经过SPE硅胶柱分离去除中性脂、糖脂,从而得到磷脂,碱性甲酯化后,用Agilent GC-6850气相色谱仪分析PLFA的成分,内标为正十九烷酸甲酯(19︰0),各成分脂肪酸通过MIDI Sherlock软件进行微生物的鉴定。根据磷脂脂肪酸的分子结构将其划分不同的微生物类群[14-16],细菌以i14:0,i15:0,a15:0,i16:0,i17:0,a17:0,16:1ω7c,cу17:0,18:1ω7c,cу19:0来表征; 真菌以16:1ω5c,18:1ω9c,18:2ω6, 9c来表征; 放线菌以10Me16:0,10Me17:0,10Me18:0来表征。其中i14:0,i15:0,a15:0,i16:0,i17:0,a17:0代表革兰氏阳性菌(G+),16:1ω7c,cу17:0,18:1ω7c,cу19:0代表革兰氏阴性菌(G-),16:1ω5c代表丛枝菌根真菌(AMF),18:1ω9c,18:2ω6, 9c代表腐生真菌。
1.6 数据处理采用Statistica 7软件进行数据相关性分析,用Origin 8.5软件作柱状图,R 3.3.1软件作结构方程模型(SEM)。采用多因素方差分析氮和石灰添加对土壤化学性质、植物生物量和微生物群落的影响,采用单因素方差分析评价处理间的差异显著性,平均值多重比较统计学检验采用最小显著极差法(LSD)。利用结构方程模型(SEM)探明模拟氮沉降和施石灰对微生物群落直接及通过根际土壤pH、速效养分、植物生物量间接产生的影响,其中速效养分用包含DOC、矿质氮、有效磷和交换性Ca2+的PCA一轴(PC1)数据表征,植物生物量由包含茎叶和根系生物量的PCA一轴(PC1)数据表征。
2 结果 2.1 根际土壤化学性质方差分析显示,模拟氮沉降对除交换性Ca2+以外其他土壤化学指标均有显著影响(P < 0.05),石灰对所有测定土壤化学指标的影响均达到显著水平,而二者交互作用仅对DOC、交换性Al3+含量有显著影响(表 1)。与对照相比,模拟氮沉降导致根际土壤pH、有效磷含量降低,矿质氮、交换性Al3+含量升高,DOC含量则随模拟氮沉降量增加呈先下降后上升的趋势(表 2)。模拟氮沉降下施石灰,pH和交换性Ca2+含量升高,DOC、有效磷、交换性Al3+含量降低,矿质氮含量则无显著变化(表 2)。
|
|
表 1 模拟氮沉降和施石灰对根际土壤化学性质和植物生物量的影响方差分析 Table 1 ANOVAs of effects of simulated nitrogen deposition and liming on rhizosphere soil chemical properties and plant biomass |
|
|
表 2 模拟氮沉降和施石灰对根际土壤化学性质的影响 Table 2 Effects of simulated nitrogen deposition and liming on rhizosphere soil chemical properties |
方差分析表明,模拟氮沉降对植物茎叶和根系生物量均有显著影响,而石灰仅对根系生物量有显著影响,而二者交互作用对茎叶和根系生物量均没有显著影响(表 1)。无论石灰施用与否,植物茎叶生物量、根系生物量均随模拟氮沉降量增加呈上升趋势,且石灰处理下上升更为明显(图 1)。

|
注:不同字母表示处理之间差异显著(P < 0.05)Note:Different letters represent significant difference among treatments at 0.05 level 图 1 模拟氮沉降和施石灰对植物茎叶和根系生物量的影响 Fig. 1 Effects of simulated nitrogen deposition and liming on plant aboveground and root biomass |
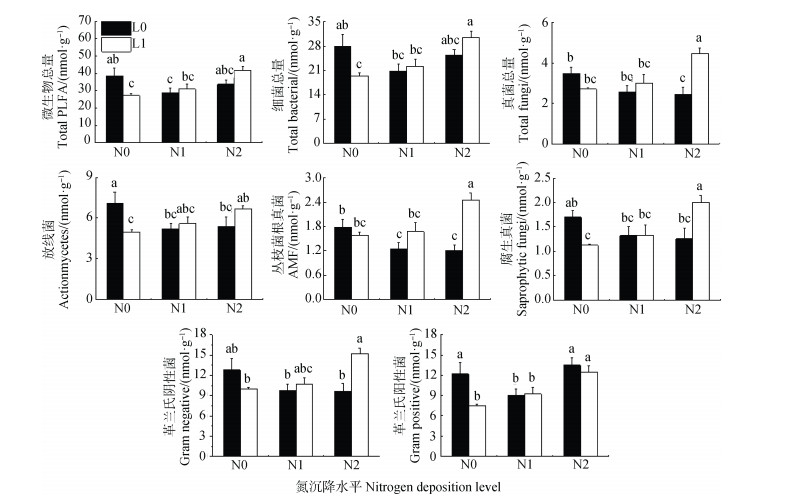
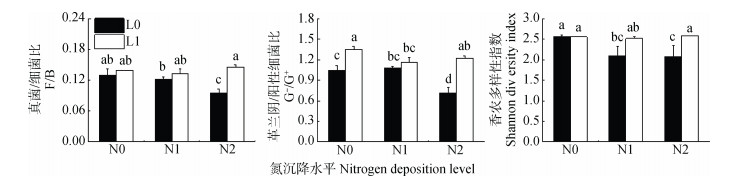
方差分析显示,模拟氮沉降对微生物总量、细菌总量、革兰氏阴性菌生物量(PLFA含量表征)以及革兰氏阴/阳性细菌比有显著影响,施石灰对真菌总量、丛枝菌根真菌生物量、革兰氏阴性菌生物量、革兰氏阴/阳性细菌比、真菌/细菌比及香农多样性指数均有显著影响,氮和石灰交互作用对几乎所有的微生物群落指标均有影响(表 3)。除革兰氏阳性菌外,模拟氮沉降导致各类群微生物生物量及真菌/细菌比、革兰氏阴/阳性细菌比、香农多样性指数降低(图 2,图 3);在没有额外施氮条件时施石灰也导致各微生物群落生物量下降,而革兰氏阴/阳性细菌比则显著升高; 模拟氮沉降下施石灰,所测各类群微生物生物量均随氮沉降量增加呈上升趋势; 而香农多样性指数并未受交互作用的影响。
|
|
表 3 模拟氮沉降和施石灰对根际土壤微生物群落影响的方差分析 Table 3 ANOVAs results of effects of simulated nitrogen deposition and liming on rhizosphere soil microbial community |
|
图 2 模拟氮沉降和施石灰对各类群微生物PLFA含量的影响 Fig. 2 Effects of simulated nitrogen deposition and liming on microbial PLFAs |
|
图 3 模拟氮沉降和施石灰对根际土壤真菌/细菌比、革兰氏阴/阳性细菌比、香农多样性指数的影响 Fig. 3 Effects of simulated nitrogen deposition and liming on the F/B ratio, G-/G+ ratio and Shannon diversity in rhizosphere soil |
结构方程模型阐明了模拟氮沉降和施石灰情况下根际土壤pH、土壤养分、植物生物量和微生物群落间的关系。最终模型拟合结果为:卡方值χ2 = 0.11,自由度df = 1.00,显著性概率值 P = 0.74,渐进残差均方和平方根RMSEA = 0.00,χ2 / df < 2,P > 0.05,RMSEA < 0.05,说明模型适配良好。石灰对微生物群落的影响最大(λ = 0.93),氮和石灰综合影响下,土壤pH对微生物群落的影响最大(λ = -0.78)(图 4)。
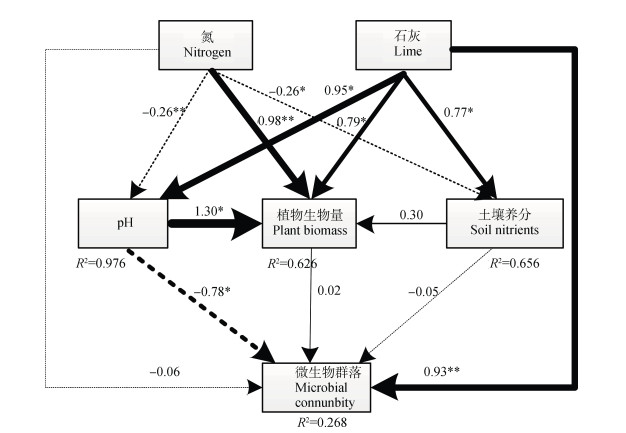
|
注:植物生物量:包括植物茎叶和根系生物量; 土壤养分:包括DOC、矿质氮、有效磷和交换性Ca2+含量; 微生物群落:包括各类群微生物PLFA含量、真菌/细菌比和香农多样性指数; 箭头:指标对指向指标的影响; 箭头粗细:所受影响程度(箭头越粗表示影响越大); 箭头上系数:λ值,通径系数; 实线:正相关; 虚线:负相关; *表示指标间P < 0.05,**表示指标间P < 0.01 Note:Plant biomass includes plant shoots and roots; Soil nutrients include DOC,mineral N,available P and exchangeable Ca2+; and Microbial community indices include PLFA content,fungi to bacterial ratio,and Shannon diversity index. Arrow means impact of starting point index on ending point index; width of the arrow,extent of the impact(the thicker the bigger); digit on the arrows,λ value(path coefficient); Solid line,positive correlation; and Dotted line,negative correlation,* P < 0.05 between the indexes,** P < 0.01 between the indicators 图 4 模拟氮沉降和施石灰作用下根际土壤pH、养分、植物生物量及微生物群落间关系概念模型 Fig. 4 A structural equation model(SEM)showing the causal relationships of plant biomass, rhizosphere soil pH and soil nutrients with soil microbial community as affected by nitrogen deposition and liming |
已有文献表明,休耕植物演替恢复过程中禾本科植物逐渐占据生态优势地位[17]。本研究中,禾本科狗尾草能够利用有限资源快速繁殖,符合r型生殖策略,成为休耕初期的优势种植物[18]。氮沉降下狗尾草根际土壤pH降低,且伴随着交换性Al3+含量的升高。大量研究证实,氮沉降增加导致土壤酸化[19-20]。对于本身pH较低且缓冲能力较弱的红壤而言,土壤酸化伴随着Ca2+等盐基离子的流失。同时,土壤化学反应导致土壤中磷被固定[21]。而植物生物量表现出对氮沉降的积极响应,说明氮素缺失是抑制生产力增加的主要因素。石灰作为常用碱性改良剂还能够显著增加土壤交换性Ca2+含量[22],这为植物生长创造了有利条件。
值得注意的是,施入石灰导致根际土壤可溶性有机碳含量降低,且同一氮沉降水平下,施石灰矿质氮含量低于不施石灰,这与土壤pH升高促进微生物对土壤活性有机质的降解能力有关[23]。施石灰也会降低土壤有效磷含量,有研究表明施石灰,酸性土壤pH上升,活性铝产生的沉淀聚合体和土壤中增加的Ca2+能够吸附土壤中的磷,从而降低土壤有效磷含量[24]。生物对磷的吸收也是有效磷含量降低的主要原因,尤其是在磷养分贫乏的红壤地区,在矿质氮含量增加条件下,植物和微生物之间对磷的争夺更为激烈。已有研究表明在养分受限的生态系统中,微生物与植物存在对土壤养分的争夺[25],因此土壤养分水平以及植物-微生物间养分竞争是影响微生物群落的重要因素。
3.2 模拟氮沉降和施石灰对优势植物根际土壤微生物的影响模拟氮沉降显著抑制根际土壤各微生物类群,结构方程模型进一步表明,对于酸性较强、缓冲性较弱的红壤,模拟氮沉降引起的根际土壤pH降低是造成该结果的主要原因。酸化导致土壤的交换性Al3+含量升高,对微生物产生抑制作用[26]。模拟氮沉降促进植物生长的同时导致土壤磷有效性降低,植物和微生物对磷素的竞争加剧,限制了微生物群落的发展。除此之外,本研究发现模拟氮沉降使真菌/细菌比以及革兰氏阴/阳性细菌比均显著降低,这可能是由于氮素增加降低了植物对菌根真菌的依赖,导致植物向根系分配的碳含量减少[27]。革兰氏阳性菌更偏好利用难降解有机物,而革兰氏阴性菌偏好利用易分解有机物[28],模拟氮沉降影响植物凋落物质量,增加了难降解有机碳比例,降低了革兰氏阴/阳性细菌比[29]。仅施石灰也会降低微生物生物量。施石灰促进了植物对土壤养分的吸收,加剧了微生物和植物的养分竞争。尽管很多研究认为微生物相较于植物具备较大的比表面积,繁殖速率快等属性使其在养分竞争上具有优势[30-31],但也有相反的观点,如植物可通过调节自身生理等来提高养分利用[32]。本研究中,植物在与微生物的养分竞争中占据了主导地位,尤其是受氮、磷水平变化较为敏感的丛枝菌根真菌[33]。仅施石灰显著增加革兰氏阴/阳性细菌比,说明偏中性环境下微生物群落向革兰氏阴性菌方向转变。
模拟氮沉降和仅施石灰均导致根际微生物生物量降低,而氮和石灰交互作用能够有效遏制氮沉降和单施石灰对微生物造成的不利影响。模拟氮沉降下施石灰,一方面中和土壤pH,缓解了Al3+对微生物毒害,另一方面植物地上和地下生物量的增加表明凋落物和根系输入资源的增加(图 1),促进微生物生长。DOC作为土壤微生物的能量来源之一[34],交互处理下DOC含量降低,从另一个角度表明微生物对DOC消耗增加。此外,氮和石灰交互作用对微生物生物量的影响受氮水平的调控。施石灰时,高氮处理下微生物生物量增长效果优于低氮处理,表明石灰影响下的土壤环境中微生物生长受土壤氮水平的限制。氮和石灰交互处理下真菌/细菌比、香农多样性指数与对照相比无显著变化,这一结果说明交互作用能够维持氮沉降下总体微生物群落结构和多样性稳定且石灰在其中起主导作用(表 3)。本结果部分支持之前假说,即模拟氮沉降能够增加土壤肥力而促进初级生产力,施石灰能够提高土壤pH改善根际土壤微生物群落生境,因而石灰与氮沉降共同作用可增加土壤微生物生物量,但微生物多样性并未受影响。
本研究也暗示,鉴于土壤环境和生物群落在支持生态系统结构和功能中的重要地位,今后应加强研究石灰对土壤有机碳积累、土壤团聚化、植物群落功能及养分循环等关键生态功能的影响,尤其是加强结合根系和根际动态揭示驱动生态系统多功能服务恢复的影响机制研究。
4 结论模拟氮沉降下施石灰有效提高根际土壤pH,降低交换性Al3+含量,提高植物生物量和各类群微生物生物量(以PLFA含量表征),同时,维持真菌/细菌比和香农多样性指数不变。氮和石灰交互作用能够改善休耕红壤根际土壤环境,缓解土壤酸化,提高土壤生产力,促进微生物生长同时维持微生物群落结构和多样性稳定。pH对根际土壤微生物群落影响最为强烈,且植物与微生物间对土壤资源的竞争也可能是影响微生物群落的关键因素。
| [1] |
Zhou L Y, Zhou X H, Zhang B C, et al. Different responses of soil respiration and its components to nitrogen addition among biomes:A meta-analysis . Global Change Biology, 2014, 20(7): 2332-2343. DOI:10.1111/gcb.12490
(  0) 0) |
| [2] |
黄幸然, 郭萍萍, 吴旺旺, 等. 模拟氮沉降增加对不同树种土壤微生物群落结构的影响. 生态学杂志, 2016, 35(6): 1420-1426. Huang X R, Guo P P, Wu WW, et al. Influence of simulated nitrogen deposition enhancement on soil microbial community of different tree species (In Chinese). Chinese Journal of Ecology, 2016, 35(6): 1420-1426. (  0) 0) |
| [3] |
Isbell F, Reich P B, Tilman D, et al. Nutrient enrichment, biodiversity loss, and consequent declines in ecosystem productivity . Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(29): 11911-11916. DOI:10.1073/pnas.1310880110
(  0) 0) |
| [4] |
Davis M P, David M B, Voigt T B, et al. Effect of nitrogen addition on miscanthus×giganteus yield, nitrogen losses, and soil organic matter across five sites . Global Change Biology Bioenergy, 2015, 7(6): 1222-1231. DOI:10.1111/gcbb.12217
(  0) 0) |
| [5] |
崔键, 周静, 马友华, 等. 我国红壤旱地氮素平衡特征. 土壤, 2008, 40(3): 372-376. Cui J, Zhou J, Ma Y H, et al. Characteristic of N-balance in red soil upland in China (In Chinese). Soils, 2008, 40(3): 372-376. DOI:10.3321/j.issn:0253-9829.2008.03.007 (  0) 0) |
| [6] |
崔键, 周静, 杨浩, 等. 我国红壤区大气氮沉降及其农田生态环境效应. 土壤, 2015, 47(2): 245-251. Cui J, Zhou J, Yang H, et al. Review on atmospheric nitrogen deposition and its influence in red soil agro-ecosystem, Southern China (In Chinese). Soils, 2015, 47(2): 245-251. (  0) 0) |
| [7] |
Zhang C, Liu G, Xue S, et al. Soil bacterial community dynamics reflect changes in plant community and soil properties during the secondary succession of abandoned farmland in the Loess Plateau . Soil Biology & Biochemistry, 2016, 97: 40-49.
(  0) 0) |
| [8] |
Li W J, Li J H, Liu S S, et al. Magnitude of species diversity effect on aboveground plant biomass increases through successional time of abandoned farmlands on the eastern Tibetan Plateau of China . Land Degradation & Development, 2017, 28(1): 370-378.
(  0) 0) |
| [9] |
宋同清, 彭晚霞, 曾馥平, 等. 喀斯特峰丛洼地退耕还林还草的土壤生态效应. 土壤学报, 2011, 48(6): 1219-1226. Song T Q, Peng W X, Zeng F P, et al. Soil ecological effects of converting cropland to forest and grassland in depressioms between Karst hills (In Chinese). Acta Pedologica Sinica, 2011, 48(6): 1219-1226. (  0) 0) |
| [10] |
程琳, 孙晓, 庄舜尧, 等. 模拟石灰添加对雷竹林土壤氮矿化的影响. 土壤, 2013, 45(6): 992-998. Cheng L, Sun X, Zhuang S Y, et al. Effect of liming on soil nitrogen mineralization of phyllostachys praecox using lab incubation experiment (In Chinese). Soils, 2013, 45(6): 992-998. (  0) 0) |
| [11] |
Ai C, Liang G, Sun J, et al. Reduced dependence of rhizosphere microbiome on plant-derived carbon in 32-year long-term inorganic and organic fertilized soils . Soil Biology & Biochemistry, 2015, 80: 70-78.
(  0) 0) |
| [12] |
Dinesh R, Chaudhuri S G. Soil biochemical/ microbial indices as ecological indicators of land use change in mangrove forests . Ecological Indicators, 2013, 32: 253-258. DOI:10.1016/j.ecolind.2013.03.035
(  0) 0) |
| [13] |
Bossio D A, Scow K M, Gunapala N, et al. Determinants of soil microbial communities:Effects of agricultural management, season, and soil type on phospholipid ftty acid profiles . Microbial Ecology, 1998, 36(1): 1-12.
(  0) 0) |
| [14] |
Frostegard A, Baath E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil . Biology & Fertility of Soils, 1996, 22(1/2): 59-65.
(  0) 0) |
| [15] |
Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities:Phospholipid fatty acid profiles and substrate utilization patterns . Microbial Ecology, 1998, 35(3): 265-278. DOI:10.1007/s002489900082
(  0) 0) |
| [16] |
Mikola J, Setälä H. No evidence of trophic cascades in an experimental microbial-based soil food web . Ecology, 1998, 79(1): 153-164. DOI:10.1890/0012-9658(1998)079[0153:NEOTCI]2.0.CO;2
(  0) 0) |
| [17] |
赵丽娅, 高丹丹, 熊炳桥, 等. 科尔沁沙地恢复演替进程中群落物种多样性与地上生物量的关系. 生态学报, 2017, 37(12): 4108-4117. Zhao L Y, Gao D D, Xiong B Q, et al. Relationship between the aboveground biomass and species diversity of sandy communities during the process of restoring succession in the Horqin Sandy Land (In Chinese). Acta Ecologica Sinica, 2017, 37(12): 4108-4117. (  0) 0) |
| [18] |
郑颖, 温仲明, 宋光, 等. 延河流域森林草原区不同植物功能型适应策略及功能型物种数量随退耕年限的变化. 生态学报, 2015, 35(17): 5834-5845. Zheng Y, Wen Z M, Song G, et al. Adaption strategies of different plant functional types and their composition along a vegetation restoration gradient in a fores-steppe zone in the Yanhe River catchment (In Chinese). Acta Ecologica Sinica, 2015, 35(17): 5834-5845. (  0) 0) |
| [19] |
刘贺永, 何鹏, 蔡江平, 等. 模拟氮沉降对内蒙古典型草地土壤pH和电导率的影响. 土壤通报, 2016, 47(1): 85-91. Liu H Y, He P, Cai J P, et al. Effects of simulated nitrogen deposition on soil pH and electric conductivity in a typical grassland of Inner Mongolia (In Chinese). Chinese Journal of Soil Science, 2016, 47(1): 85-91. (  0) 0) |
| [20] |
徐仁扣. 土壤酸化及其调控研究进展. 土壤, 2015, 47(2): 238-244. Xu R K. Research progresses in soil acidification and its control (In Chinese). Soils, 2015, 47(2): 238-244. (  0) 0) |
| [21] |
王方超, 邹丽群, 唐静, 等. 氮沉降对杉木和枫香土壤氮磷转化及碳矿化的影响. 生态学报, 2016, 36(11): 3226-3234. Wang F C, Zou L Q, Tang J, et al. Influence of nitrogen deposition on soil nutrient supply and organic carbon mineralization in Cunninghamia lanceolata and Liquidambar formosana plantations (In Chinese). Acta Ecologica Sinica, 2016, 36(11): 3226-3234. (  0) 0) |
| [22] |
韩天富, 王伯仁, 张会民, 等. 长期施肥及石灰后效对不同生育期玉米根际钾素的影响. 土壤学报, 2017, 54(6): 1497-1507. Han T F, Wang B R, Zhang H M, et al. Effect of long-term fertilization and residual effect of liming on potassium in rhizosphere of maize relative to growth stage of the crop (In Chinese). Acta Pedologica Sinica, 2017, 54(6): 1497-1507. (  0) 0) |
| [23] |
Tan B, Fan J, He Y, et al. Possible effect of soil organic carbon on its own turnover:A negative feedback . Soil Biology & Biochemistry, 2014, 69(1): 313-319.
(  0) 0) |
| [24] |
蔡东, 肖文芳, 李国怀. 施用石灰改良酸性土壤的研究进展. 中国农学通报, 2010, 26(9): 206-213. Cai D, Xiao W F, Li G H. Advance on study of liming on acid soils (In Chinese). Chinese Agricultural Science Bulletin, 2010, 26(9): 206-213. (  0) 0) |
| [25] |
Dijkstra F A, He M, Johansen M P, et al. Plant and microbial uptake of nitrogen and phosphorus affected by drought using 15N and 32P tracers . Soil Biology & Biochemistry, 2015, 82: 135-142.
(  0) 0) |
| [26] |
Kunito T, Isomura I, Sumi H, et al. Aluminum and acidity suppress microbial activity and biomass in acidic forest soils . Soil Biology & Biochemistry, 2016, 97: 23-30.
(  0) 0) |
| [27] |
Treseder K, Allen E B, Egerton‐Warburton L M, et al. Arbuscular mycorrhizal fungi as mediators of ecosystem responses to nitrogen deposition:A trait-based predictive framework . Journal of Ecology, 2018, 106(2): 480-489. DOI:10.1111/1365-2745.12919
(  0) 0) |
| [28] |
Treseder K, Kivlin S N, Hawkes C V. Evolutionary trade-offs among decomposers determine responses to nitrogen enrichment . Ecology Letters, 2011, 14(9): 933-938. DOI:10.1111/j.1461-0248.2011.01650.x
(  0) 0) |
| [29] |
Norris M D, Avis P G, Reich P B, et al. Positive feedbacks between decomposition and soil nitrogen availability along fertility gradients . Plant and Soil, 2013, 367(1/2): 347-361.
(  0) 0) |
| [30] |
蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用. 植物生态学报, 2010, 34(8): 979-988. Jiang J, Song M H. Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling (In Chinese). Chinese Journal of Plant Ecology, 2010, 34(8): 979-988. DOI:10.3773/j.issn.1005-264x.2010.08.011 (  0) 0) |
| [31] |
Hodge A, Fitter A H. Microbial mediation of plant competition and community structure . Functional Ecology, 2013, 27(4): 865-875. DOI:10.1111/1365-2435.12002
(  0) 0) |
| [32] |
Yin H, Wheeler E, Phillips R P. Root-induced changes in nutrient cycling in forests depend on exudation rates . Soil Biology & Biochemistry, 2014, 78: 213-221.
(  0) 0) |
| [33] |
Heijden M G A V D, Martin F M, Selosse M, et al. Mycorrhizal ecology and evolution:the past, the present, and the future . New Phytologist, 2015, 205: 1406-1423. DOI:10.1111/nph.13288
(  0) 0) |
| [34] |
苏丹, 张凯, 陈法霖, 等. 施氮对不同有机碳水平桉树林土壤微生物群落碳代谢的影响. 生态学报, 2015, 35(18): 5940-5947. Sun D, Zhang K, Chen F L, et al. Effects of nitrogen application on carbon metabolism of soil microbial communities in eucalyptus plantations with different levels of soil organic carbon (In Chinese). Acta Ecologica Sinica, 2015, 35(18): 5940-5947. (  0) 0) |
2. Jiangxi Institute of Red Soil, Nanchang 331717, China
 2019, Vol. 56
2019, Vol. 56


