2. 铜仁学院, 贵州铜仁 554300
土壤微生物是土壤的重要组成部分,在推动土壤养分转化、物质循环和能量流动中发挥极其重要的作用,并通过调控土壤养分来影响植物生长发育和群落结构演替[1]。由于森林土壤生态系统的复杂性,相关研究认为土壤pH[2]、有效氮[3]、地上植被[4]和土壤水分[5]等对土壤微生物群落结构影响较大。森林演变中植被凋落物和根系分泌物的差异,成为影响土壤微生物群落结构和代谢活性变化的重要因素。全球约4%的森林为人工林,人工林由于林分结构简单,植被群落演替对人工林土壤生态系统的影响尤为重要。鉴于土壤微生物群落结构和代谢功能多样性对人工林环境变化的灵敏性,土壤微生物群落结构特征可用作为人工林演变引起土壤质量变化的重要预警及敏感指标之一[6]。
马尾松(Pinus massoniana Lamb.)人工林适应性强、生长迅速、耐干旱与瘠薄,是我国亚热带地区种植面积最大的人工林,也是我国最重要的经济造林树种之一[7],如何维持人工林持续经营已经成为许多学者和造林者关注的焦点。目前,桉树[8]、湿地松[6]、落叶松[9]和樟子松[10]等人工林在生长过程中已出现土壤地力衰退现象。而关于马尾松人工林演变中是否出现地力衰退问题尚未达成共识。谭波等[11]研究认为,随着林龄的增加土壤地力逐渐衰退;葛晓改等[12]研究则认为,随着林龄的增加土壤肥力逐渐提高,未出现地力衰退。Mendes和Raaijmakers[13]研究表明,土壤地力衰退将不可避免地打破土壤微生物群落动态平衡,同时土壤微生物群落失衡将进一步加剧土壤退化;由此可知,通过研究土壤微生物群落结构和功能多样性,对了解人工林土壤质量状况、防止地力衰退和更好地经营人工林具有重要的意义。目前,马尾松人工林的研究主要集中在土壤养分[14]、酶活性[12]、凋落物[15]、植物多样性[16]和土壤动物功能群[17]等方面,并通过以上指标来反映人工林土壤质量状况。然而,目前关于土壤微生物群落结构特征在马尾松人工林生长过程中如何进行变化?该方面的研究尚少见报道。为此,本文利用PLFA和BIOLOG技术,对亚热带地区马尾松人工林生长过程中土壤微生物群落结构及功能多样性进行研究,以揭示土壤微生物群落结构和功能多样性随林龄的变化规律以及驱动土壤微生物群落结构变化的主要环境因子,从微生物角度来解析土壤地力衰退问题,最终为实现人工林可持续经营提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于贵州省林业科学院实验林场地(106°44′20″E,26°29′35″N),属于典型的中亚热季风气候,年均气温15.2℃,平均最高气温19.3 ℃,最低气温12℃,年均降雨量1 199 mm,年均相对湿度77%,年均日照时数1 412 h,无霜期278 d,土壤类型为铝质常湿淋溶土,成土母质为砂岩。
1.2 试验设计及样品采集采取空间代时间的方法,选择立地条件一致的不同林龄(13 a、25 a、38 a和58 a)马尾松人工林作为研究对象,分别造林于2004年、1992年、1979年和1959年(基本情况见表 1)。林下灌木以梨叶悬钩子(Rubus pirifolius)和野桐(Mallotus japonicus)等为主;草本以蕨(Pteridium aquilinum)、白茅(Imperata cylindrica)和芒萁(Dicranopteris dichotoma)等为主。于2017年8月在4个林龄内随机设置3个20 m×20 m的标准样地,样地内采用直径5 cm土钻均匀采取5个枯枝落叶层下0~10 cm土壤样品,混合成1个土样,使用低温冰盒保存并迅速带回实验室。土样在室内去除石块、植物根系并过2 mm筛后,最终分为三份,一份4℃冰箱保存,用于微生物生物量碳、氮测定和BIOLOG分析,一份-80℃冰箱保存用于PLFA分析,一份室内风干用于土壤理化指标测定。
|
|
表 1 不同林龄马尾松人工林基本概况 Table 1 General information of the studied Pinus massoniana plantations different in stand ages |
土壤理化性质:采用鲍士旦[18]的方法进行测定。土壤含水量(Moisture)采用烘干法测定;pH采用电位法测定;土壤有机碳(SOC)采用重铬酸钾氧化法测定;全氮(TN)采用凯氏定氮法测定;铵态氮采取靛酚蓝比色法测定;硝态氮采取酚二磺酸比色法测定。
土壤微生物生物量碳、氮:采用吴金水等[19]的方法进行测定。微生物生物量碳采用氯仿熏蒸-容量分析法,微生物生物量氮采取氯仿熏蒸-茚三酮比色法。
磷脂脂肪酸(PLFA):PLFA测定采用修正的Bligh和Dyer[20]方法。称取相当于8 g烘干土的新鲜土样,加入磷酸缓冲液30 mL,甲醇:氯仿(2:1)105 mL混合液振荡2 h后,分别加入氯仿36 mL和无菌水36 mL,避光浸提18~24 h。有机相过滤、浓缩,利用固相萃取技术,通过SPE固相萃取小柱(Bond Elute,500 mg/3 mL)进行脂肪酸分离,氮吹仪浓缩后,加氢氧化钾:甲醇(1:1)1 mL,37℃加热15 min进行甲基化。加内标液(十九碳酸甲酯)0.5 mL,用气相色谱-质谱(Gas Chromatography- Mass Spectrometry,GC-MS)分析。用MIDI系统操作GC-FID,后续脂肪酸甲酯扫描和数据分析均由MIDI Sherlock微生物鉴定系统完成。根据总结文献出现的磷脂脂肪酸标记物,对不同微生物的磷脂脂肪酸进行标记(见表 2)。
|
|
表 2 表征微生物类群的磷脂脂肪酸标记物 Table 2 PLFA biomarkers characteristic of soil microbial groups |
BIOLOG:称取相当于10 g干土的新鲜土样,加入无菌生理盐水,振荡30 min后于4℃下静止10 min,然后吸取1 mL原液于9 mL无菌生理盐水中,摇匀后用多通道移液器取150 μL提取液,加入到生态板的每一个孔中,每样1板,每板3次重复。然后在20℃下培养,每24 h在BIOLOG读数仪读取590 nm下的光密度值,连续培养192 h。
1.4 数据处理土壤微生物代谢活性用每孔颜色平均变化率(Average well color development,AWCD)描述,计算公式如下:
| $ {\rm{AWCD}} = \sum {\left( {{C_i} - R} \right)/n} $ |
式中,Ci为各反应孔在590 nm下的吸光值;R为ECO板对照孔的光密度值,n为Biolog-ECO微平板的碳源数目,计数为31;Ci-R < 0的孔,记为0。本试验采用Biolog-ECO微平板培养96 h的光密度值来计算微生物群落结构代谢功能多样性指数(香农多样性指数、辛普森优势度指数和McIntosh均匀度指数)。
| $ 香农指数\;\;H = - \sum {({P_i} \times \left( {\ln {P_i}} \right)} $ |
| $ 辛普森指数\;\;D = 1 - \sum {{{\left( {{P_i}} \right)}^2}} $ |
| $ {\rm{Mclntosh}}\;指数\;U = \sqrt {\sum {{{\left( {{{\rm{C}}_i} - R} \right)}^2}} } $ |
式中,
采用SPSS21.0统计软件,通过单因素方差分析(One-way ANOVA,n = 3,P < 0.05)和多重比较检验不同林龄间微生物生物量碳和氮、理化性质、微生物PLFA含量、Biolog碳源利用类型和多样性指数的差异显著性(P < 0.05);进行微生物群落层次聚类分析和制图。采用Canoco4.5软件进行主成分分析(Principal component analysis,PCA)和冗余分析(Redundancy analysis,RDA)。
2 结果 2.1 不同林龄人工林土壤特征林龄显著影响了土壤生物理化性质(P < 0.05)(表 3)。微生物生物量碳在13 a~38 a逐渐减少,13 a和25 a分别与38 a和58 a之间有显著差异(P < 0.001);微生物生物量氮在25 a时达到最大,38 a最小,并且25 a分别与13 a、38 a和58 a之间有显著差异(P < 0.001)。土壤pH随着林龄的增加先上升后下降,在25 a时达到最大。土壤含水量随着林龄的增加呈现递减趋势,并且13 a分别与25 a、38 a和58 a之间有显著差异(P < 0.01)。有机碳均在人工林演变中呈现先减少后增加,最高值均出现在13 a,分别与38 a和58 a差异显著(P < 0.01)。全氮、铵态氮和硝态氮由高到低依次为25 a、13 a、58 a、38 a。土壤C/N最高值出现在38 a,最小值为25 a,并且两者之间差异显著(P < 0.01)。
|
|
表 3 不同林龄马尾松人工林土壤生物理化性质 Table 3 Soil biological and physicochemical properties of the Pinus massoniana plantation relative to stand ages |
不同林龄土壤微生物群落组成及PLFAs含量具有明显差异(P < 0.05),共有21种PLFAs被标记到不同微生物类群(表 4)。土壤微生物总PLFAs含量、真菌PLFAs量、原生动物PLFAs量和真菌/细菌比随着人工林生长呈现“V”变化趋势,最大值均出现在13 a,最小值出现在38 a,且相互之间差异显著(P < 0.01);其中cy19:0在各林龄中含量均最高,分别为6.20±0.40 nmol·g-1、4.63±1.58 nmol·g-1、3.43±0.79 nmol·g-1和4.2±0.17 nmol·g-1;18:3ω6c、i18:0、20:1w9c、17:1ω8c和i14:0在所有林龄中含量相对较低。G+/G-比值在生长过程中均小于1,表明不同林龄土壤细菌均以G-细菌为主。G+细菌、G-细菌、AMF和放线菌数量均在25 a林龄中最高,与38 a、58 a差异显著(P < 0.01)。i14:0、a15:0、a17:0、16:1ω7c、cy17:0、18:1ω7c、16:1 w5c、10Me16:0、10Me18:0和20:1w9c最大值均为25 a,其中除10Me18:0外,其余均与38 a、58 a之间有显著差异(P < 0.05)。
|
|
表 4 不同林龄马尾松人工林土壤微生物PLFAs类群和含量 Table 4 Groups and contents of PLFAs in the Pinus massoniana plantation relative to stand ages |
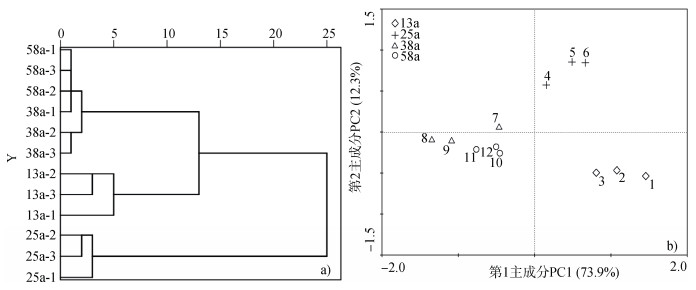
基于PLFAs层次聚类分析结果显示,不同林龄土壤微生物群落结构差异明显,除38 a-1外,其他林龄的3个重复均聚类在一起。其中,13 a和25 a、38 a和58 a距离较近(图 1a)。
|
图 1 不同林龄土壤磷脂脂肪酸结构层次聚类树(a)和主成分分析(b) Fig. 1 Hierarchical clustering tree (a) and principal components analysis (b) of composition of the phospholipid fatty acid in the soil of Pinus massoniana plantation relative to stand ages |
主成分分析进一步证实了不同林龄土壤微生物群落结构差异明显(图 1b),PC1和PC2共解释了土壤微生物群落结构总变异的86.2%,其中第一主成分解释了总变异的73.9%,第二主成分解释了总变异的12.3%,这两个主成分能够解释原始变量。13 a、25 a分别与38 a和58 a在PC1和PC2上逐渐分离,并且在PC1和PC2上分离都较大,说明林龄对土壤微生物群落结构影响较大;38 a和58 a相聚较近,说明群落结构相似度较大。
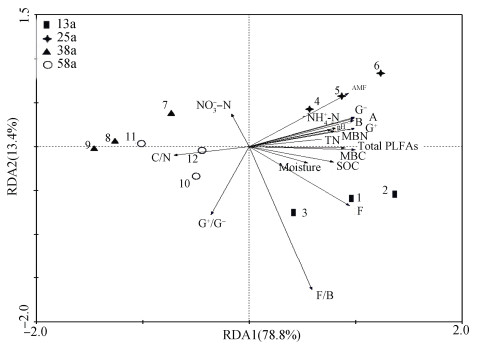
通过对土壤微生物类群PLFAs进行除趋势对应分析(Detrended correspondence analysis,DCA),得到轴梯度最大值为0.159,表明选择线性模型(RDA)进行分析比较适合。由图 2可知,G+细菌、细菌、放线菌和G-细菌最大值分布在25 a,真菌/细菌最大值分布在13 a,该结论与表 4结果相符。全氮、有机碳、微生物生物量碳、微生物生物量氮、pH和铵态氮与G+细菌、细菌、放线菌、G-细菌和微生物总PLFAs含量呈显著正相关关系;土壤含水量与真菌呈显著正相关关系;C/N与土壤微生物类群(G+/G-除外)呈负相关关系。
|
B:细菌Bacteria;G+:革兰氏阳性细菌Gram-positive bacteria;G-:革兰氏阴性细菌Gram-negative bacteria;G+/G-:革兰氏阳性细菌/革兰氏阴性细菌Ratio of gram-positive bacteria to gram-negative bacteria;F:真菌Fungi;A:放线菌Actinobacteria;F/B:真菌/细菌Ratio of fungi to bacteria;Total PLFA:总磷脂脂肪酸Total phospholipid fatty acids;SOC:土壤有机碳Soil organic carbon;Moisture:土壤含水量;TN:全氮Total nitrogen. 图 2 土壤微生物类群与土壤养分的冗余分析 Fig. 2 Redundancy analysis (RDA) of relationships among soil microorganism groups and soil nutrients |
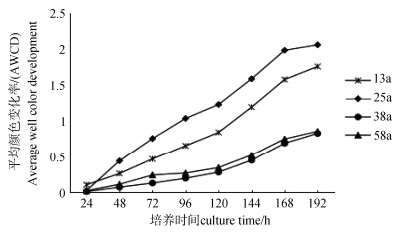
AWCD值(平均每孔颜色变化率)反映土壤微生物群落的总体活性,是土壤微生物对单一碳源利用能力的一个重要指标。由图 3可知,在192 h培养时间内,AWCD值随着时间增加而逐渐增大,表明微生物对底物碳源的利用能力总体增强。在培养24 h内微生物活性增加不明显,24 h以后微生物活性逐渐增强,120 h~168 h增加速率最大,168 h后AWCD值增加速率趋于平缓。不同林龄土壤微生物群落对碳源利用能力由强到弱依次为25 a、13 a、58 a、38 a,可知25 a林龄土壤微生物代谢活性强于其他林龄。
|
图 3 不同林龄土壤微生物群落AWCD在培养时间下动态变化 Fig. 3 Dynamics of AWCD of the soil microbial community in soil samples of the plantation with incubation time relative to stand ages |
本研究Biolog-ECO微平板中的31种碳源划分为碳水化合物类、羧酸类、氨基酸类、聚合物类、酚类和胺类。由表 5可知,不同林龄土壤微生物对6种碳源利用存在差异(P < 0.05),其中氨基酸、羧酸类和酚类是主要的碳源,其次为胺类和聚合物类,碳水化合物类利用率最低。25 a林龄土壤微生物对6类碳源的利用均最高,除氨基酸外,与其他林龄差异均显著(P < 0.05)。38 a林龄土壤微生物对碳水化合物、羧酸类、聚合物类和酚类利用率最低,对氨基酸的利用率仅次于25 a,高于13 a和58 a。
|
|
表 5 不同林龄土壤微生物对碳源的利用 Table 5 Carbon source utilization by soil microbes relative to stand ages |
香农指数、辛普森指数和McIntosh指数分别用来研究微生物群落种数及其个体数和分布均匀程度。由表 6可知,3种多样性指数的变化趋势一致,大小顺序均为25 a > 13 a > 58 a > 38 a。13 a~25 a人工林土壤微生物群落的物种丰富度指数、优势度指数和均匀度指数增加,25 a~38 a 3种土壤微生物多样性指数下降,随后逐渐升高。不同林龄土壤微生物群落的香农指数和McIntosh指数差异显著(P < 0.05),辛普森指数差异不显著(P > 0.05)。
|
|
表 6 不同林龄土壤微生物群落功能多样性指数 Table 6 Functional diversity indexes of the soil microbial community relative to stand ages |
土壤微生物数量、种类和功能多样性受环境因子影响较大,如植物群落、根系分泌物、凋落物和土壤养分等因素。本研究结果表明,人工林演变中土壤微生物总PLFAs量为21.00~37.99 nmol·g-1,低于四川省阿坝地区的云杉人工林[24],高于江西省九连山地区常绿阔叶林、马尾松纯林、马尾松阔叶混交林[25],造成土壤微生物PLFAs含量差异性的因素可能是植被类型和土壤养分的时空异质性。Merilä等[26]研究认为,森林土壤微生物群落结构与林下物种丰富度及多样性呈正相关关系,陈小红等[16]研究表明,马尾松人工林生长过程中林下物种丰富度及多样性呈下降趋势。由此可知,在人工林演变中土壤微生物PLFAs含量降低,与本研究结果一致。不同林龄土壤微生物群落AWCD值变化规律为25a > 13 a > 58 a > 38 a,香农指数、辛普森指数和McIntosh指数也证明了该结果。本研究由于立地条件一致,因此人工林演变中植物群落结构的差异,可能是土壤微生物群落结构和功能多样性发生显著变化的主要因素。
Maisto等[27]研究表明,森林土壤养分主要来源于凋落物。马尾松人工林的凋落物主要为针叶,真菌主要负责分解针叶中难分解的木质素、纤维素和丹宁酸等物质,最终使养分归还土壤。本研究土壤微生物总PLFAs和真菌数量随林龄的增加呈现“V”变化趋势(表 4),可能与凋落物和土壤养分含量有关。在人工生长过程中,13 a由于林木密度较大,光照不足,致使凋落物增多,同时养分归还速率快,导致土壤养分含量高。25 a处于杆材阶段,林木竞争力较大,天然整枝强度较大,导致凋落物较多。38 a处于成熟阶段,经过了稀疏竞争效应,林分密度低,凋落物减少,养分过多储存在生物体内,养分归还周期长,最终导致土壤养分含量低,微生物可利用养分减少,微生物PLFAs含量降低。58 a处于过熟期,林木对养分吸收逐渐减少,枯枝落叶归还量增多,导致土壤养分含量有所增加,有利于土壤微生物对养分的吸收利用,使土壤微生物PLFAs总量和各类群数量有所增加。同时,人工林在38 a和58 a时,凋落物中含有较多难降解的物质如纤维素和木质素等,这些物质中C/N相对较高,较高的C/N会导致土壤中氮的缺乏,从而抑制土壤微生物活性[28]。
Wu等[6]研究表明,土壤养分与土壤微生物功能多样性之间密切相关,土壤养分含量的下降将不可避免地降低微生物多样性。BIOLOG技术主要检测的为可培养的细菌类群,通过PLFA结果可知,不同林龄土壤细菌数量高低依次为25 a、13 a、58 a、38 a(表 4),由此可知,在一定程度上土壤微生物群落结构组成能够反映微生物群体代谢活性。造林25 a后,随着土壤养分和pH明显降低,对林下植物生长抑制程度较大,导致林下物种丰富度较小[16],林下植物及土壤养分交互作用使土壤微生物功能多样性和代谢活性明显降低。人工林演变中土壤微生物利用的主要碳源为氨基酸类、羧酸类和酚类,与胡婵娟等[29]研究结果不同,可能由于林分类型不同,导致植物群落结构和根系分泌物不同,影响土壤微生物对碳源的利用率。13 a人工林对胺类利用率最低,25 a、38 a和58 a人工林对碳水化合物类利用最低。由此可知,人工林演变中土壤微生物功能差异主要由底物造成。
3.2 土壤微生物类群PLFAs与土壤养分的相关性本研究中,不同林龄土壤微生物类群均以细菌为主,约占总PLFAs量的55%~63%,其次为真菌,占总PLFAs量的20%~30%,最后为放线菌和原生动物。Qiu等[30]研究认为,土壤微生物量碳氮比能够反映真菌/细菌比。王宁等[31]研究认为,土壤微生物量碳氮比在1~5时,土壤细菌占优势,并且微生物生物量碳氮比越小,细菌占比例越大;13 a和25 a林龄土壤生物量碳氮比低于38 a和58 a(表 3),可能由于13 a和25 a林龄根系活力强,分泌出较多适合细菌生长的物质,最终导致细菌数量多,土壤微生物生物量碳氮比低。Shen等[32]研究认为,土壤pH是影响土壤细菌的主要因素。冗余分析表明,土壤pH与多数微生物类群之间呈显著正相关关系(图 2);造林25 a后土壤细菌数量减少,可能由于针叶分解过程中产生的酸性物质富集,导致土壤pH降低,较低的pH抑制细菌生长。Chatterjee等[33]研究认为土壤pH在针叶林中随着林龄的增加而降低,与本结果不一致。本研究土壤pH在13 a~25 a有所增加,可能由于该时期人工林生长较快,对养分需求量较多,导致土壤中氮的转化加快,铵态氮和硝态氮含量增加,根系在吸收硝态氮时分泌出OH-来维持细胞膜内外电荷平衡,最终通过土壤中OH-来协调人工林土壤中的酸碱度[34]。Djukic等[35]研究表明,G-细菌在土壤养分充足的环境中生长较快,G+细菌较多的分解木质素等物质,对环境胁迫能力强于G-细菌。造林25 a后G-细菌数量总体减少,导致土壤G+/G-比例升高;由此可知,随着林龄的增加,土壤肥力下降可能是影响G-细菌生长的主要因素。罗达等[36]研究表明,土壤养分与丛枝菌根真菌PLFAs量的关系十分密切,土壤全氮和铵态氮与丛枝菌根真菌PLFAs量呈显著正相关关系。王卫霞等[37]研究表明,马尾松人工林土壤丛枝菌根真菌PLFAs量随着pH的增加而增加。在本研究中,随着林龄的增加,土壤丛枝菌根真菌PLFAs量呈现“N”变化趋势,在25 a林龄土壤丛枝菌根真菌PLFAs量最大(表 4),可能与该时期人工林土壤全氮、铵态氮和pH较高有关。Boyle等[38]研究认为F/B可以用来指示土壤生态系统的稳定性。在本研究中,随着人工林演变F/B比值逐渐减少,表示土壤生态系统稳定性变差,土壤质量逐渐退化。
本研究利用PLFA法和BIOLOG法分析不同林龄马尾松人工林土壤微生物群落结构特征的演变规律,取得了较好结果。但PLFA法和BIOLOG法仍然存在不足,PLFA法分类水平较低,不能检测到土壤微生物种的水平;BIOLOG法只能表征土壤中快速生长或富营养微生物活性,不能直接获取土壤微生物群落结构的详细信息。因此,在今后的研究中可以结合高通量测序技术,这样将有助于更深入地解析土壤微生物群落结构多样性在不同林龄间的演变规律。
4 结论造林13~25 a,土壤微生物总PLFAs含量变化不明显,其中细菌、丛枝菌根真菌、放线菌、G+细菌和G-细菌数量增加,微生物代谢活性增强,从微生态角度来看该生长阶段未出现地力衰退现象,可以维持马尾松人工林的正常生长。38 a人工林土壤养分含量、微生物群落结构和代谢活性均最低,说明造林25 a后土壤地力逐渐衰退。造林58 a土壤养分含量、微生物群落结构和代谢活性均高于38 a,但差异不显著,并且微生物群落结构相似,说明造林38 a后土壤地力衰退稍微缓和,但效果不明显。因此,在马尾松人工林经营管理中应注意造林25 a后的土壤养分状况,可以采取施用有机肥、微生物肥料和增加植物多样性等措施,通过调节土壤微生物群落结构和代谢活性来缓解土壤地力衰退,最终实现马尾松人工林的可持续经营。
| [1] |
戴雅婷, 闫志坚, 解继红, 等. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究. 土壤学报, 2017, 54(3): 735-748. Dai Y T, Yan Z J, Jie J H, et al. Soil bacteria diversity in rhizosphere under two types of vegetation restoration based on high throughput sequencing (In Chinese). Acta Pedologica Sinica, 2017, 54(3): 735-748. (  0) 0) |
| [2] |
Högberg M N, Högberg P, Myrold D D. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three? . Oecologia, 2007, 150(4): 590-601.
(  0) 0) |
| [3] |
Rasche F, Knapp D, Kaiser C, et al. Seasonality and resource availability control bacterial and archaeal communities in soils of a temperate beech forest . ISME Journal, 2011, 5(3): 389-402. DOI:10.1038/ismej.2010.138
(  0) 0) |
| [4] |
Hackl E, Zechmeisterboltenstern S, Bodrossy L, et al. Comparison of diversities and compositions of bacterial populations inhabiting natural forest soils . Applied and Environmental Microbiology, 2004, 70(9): 5057-5065. DOI:10.1128/AEM.70.9.5057-5065.2004
(  0) 0) |
| [5] |
Brockett B F T, Prescott C E, Grayston S J. Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in western Canada . Soil Biology & Biochemistry, 2012, 44(1): 9-20.
(  0) 0) |
| [6] |
Wu Z, Haack S E, Lin W, et al. Soil microbial community structure and metabolic activity of Pinus elliottii plantations across different stand ages in a subtropical area . PLoS One, 2015. DOI:10.1371/journal.pone.0135354
(  0) 0) |
| [7] |
洪伟, 吴承祯. 马尾松人工林经营模式及其应用. 北京: 中国林业出版社, 1999. Hong W, Wu C Z. Pinus massoniana plantation management model and its application (In Chinese). Beijing: China Forestry Publishing House, 1999. (  0) 0) |
| [8] |
张凯, 郑华, 陈法霖, 等. 桉树取代马尾松对土壤养分和酶活性的影响. 土壤学报, 2015, 52(3): 646-653. Zhang K, Zheng H, Chen F L, et al. Impacts of replacement of Pinus with Eucalyptus on soil nutrientsand enzyme activites (In Chinese). Acta Pedologica Sinica, 2015, 52(3): 646-653. (  0) 0) |
| [9] |
刘世荣, 李春阳. 落叶松人工林养分循环过程与潜在地力衰退趋势的研究. 东北林业大学学报, 1993, 21(2): 19-24. Liu S R, Li C Y. Nutrient cycling and stability of soil fertility in Larch plantation in the eastern part of Northern China (In Chinese). Journal of Northeast Forestry University, 1993, 21(2): 19-24. (  0) 0) |
| [10] |
杨涛, 徐慧, 李慧, 等. 樟子松人工林土壤养分、微生物及酶活性的研究. 水土保持学报, 2005, 19(3): 50-53. Yang T, Xu H, Li H, et al. Soil nutrient, microorganism and enzyme activity in Pinus sylvestris plantations (In Chinese). Journal of Soil and Water Conservation, 2005, 19(3): 50-53. DOI:10.3321/j.issn:1009-2242.2005.03.013 (  0) 0) |
| [11] |
谭波, 吴福忠, 杨万勤, 等. 不同林龄马尾松人工林土壤节肢动物群落结构. 应用生态学报, 2013, 24(4): 1118-1124. Tan B, Wu F Z, Yang W Q, et al. Population structure of soil arthropod in different age Pinus massoniana plantations (In Chinese). Chinese Journal of Applied Ecology, 2013, 24(4): 1118-1124. (  0) 0) |
| [12] |
葛晓改, 肖文发, 曾立雄, 等. 三峡库区不同林龄马尾松土壤养分与酶活性的关系. 应用生态学报, 2012, 23(2): 445-451. Ge X G, Xiao W F, Zeng L X, et al. Relationships between soil nutrient contents and soil enzyme activities in Pinus massoniana stands with different ages in three gorges reservoir area (In Chinese). Chinese Journal of Applied Ecology, 2012, 23(2): 445-451. (  0) 0) |
| [13] |
Mendes R, Raaijmakers J M. Deciphering the rhizosphere microbiome for disease-suppressive bacteria . Science, 2011, 332(6033): 1097-1103. DOI:10.1126/science.1203980
(  0) 0) |
| [14] |
项文化, 田大伦. 不同年龄阶段马尾松人工林养分循环的研究. 植物生态学报, 2002, 26(1): 89-95. Xiang W H, Tian D L. Nutrient cycling in Pinus massoniana stands of different age classes (In Chinese). Acta Phytoecologica Sinica, 2002, 26(1): 89-95. DOI:10.3321/j.issn:1005-264X.2002.01.015 (  0) 0) |
| [15] |
葛晓改, 肖文发, 曾立雄, 等. 不同林龄马尾松凋落物基质质量与土壤养分的关系. 生态学报, 2012, 32(3): 852-862. Ge X G, Xiao W F, Zeng L X, et al. Relationships between litter substrate quality and soil nutrients in different aged Pinus massoniana stands (In Chinese). Acta Ecologica Sinica, 2012, 32(3): 852-862. (  0) 0) |
| [16] |
陈小红, 赵安玖, 张健, 等. 不同林龄马尾松林下植物多样性与环境特征. 四川农业大学学报, 2017, 35(2): 186-192. Chen X H, Zhao A J, Zhang J, et al. Understory plant diversity and environmental characteristics of different age Pinus massoniana plantations (In Chinese). Journal of Sichuan Agricultural University, 2017, 35(2): 186-192. (  0) 0) |
| [17] |
周泓杨, 张丹桔, 张捷, 等. 马尾松人工林郁闭度对大型土壤动物功能群的影响. 应用生态学报, 2017, 28(6): 1860-1868. Zhou H Y, Zhang D J, Zhang J, et al. Effects of canopy density on the functional group of soil macro fauna in Pinus massoniana plantations (In Chinese). Chinese Journal of Applied Ecology, 2017, 28(6): 1860-1868. (  0) 0) |
| [18] |
鲍士旦. 土壤农化分析. 3版. 北京: 中国农业出版社, 2000. Bao S D. Analysis of soil agrochemica (In Chinese). 3rd ed. BeiJing: China Agriculture Press, 2000. (  0) 0) |
| [19] |
吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用. 北京: 气象出版社, 2006. Wu J S, Lin Q M, Huang Q Y, et al. Soil microbial biomass-Methods and application (In Chinese). Beijing: China Meteorological Press, 2006. (  0) 0) |
| [20] |
Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification . Canadian Journal of Biochemistry and Physiology, 1995, 37: 911-917.
(  0) 0) |
| [21] |
Frostegård A, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil . Biology and Fertility of Soils, 1996, 22(1-2): 59-65. DOI:10.1007/BF00384433
(  0) 0) |
| [22] |
Bååth E, Anderson T H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA-based techniques . Soil Biology & Biochemistry, 2003, 35(7): 955-963.
(  0) 0) |
| [23] |
Zelles L, Bai Q Y, Rackwitz R, et al. Determination of phospholipid and lipopolysaccharide-derived fatty acids as an estimate of microbial biomass and community structures in soils . Biology and Fertility of Soils, 1995, 19(2-3): 115-123. DOI:10.1007/BF00336146
(  0) 0) |
| [24] |
罗达, 刘顺, 史作民, 等. 川西亚高山不同林龄云杉人工林土壤微生物群落结构. 应用生态学报, 2017, 28(2): 519-527. Luo D, Liu S, Shi Z M, et al. Soil microbial community structure in Picea asperata plantations with different ages in subalpine of western Sichuan, Southwest China (In Chinese). Chinese Journal of Applied Ecology, 2017, 28(2): 519-527. (  0) 0) |
| [25] |
杨君珑, 付晓莉, 马泽清, 等. 中亚热带5种类型森林土壤微生物群落特征. 环境科学研究, 2015, 28(5): 720-727. Yang J L, Fu X L, Ma Z Q, et al. Characteristics of soil microbial community in five forest types in mid-subtropical China (In Chinese). Research of Environmental Sciences, 2015, 28(5): 720-727. (  0) 0) |
| [26] |
Merilä P, Malmivaaralämsä M, Spetz P, et al. Soil organic matter quality as a link between microbial community structure and vegetation composition along a successional gradient in a boreal forest . Applied Soil Ecology, 2010, 46(2): 259-267. DOI:10.1016/j.apsoil.2010.08.003
(  0) 0) |
| [27] |
Maisto G, de Marco A, Meola A, et al. Nutrient dynamics in litter mixtures of four Mediterranean maquis species decomposing in situ . Soil Biology & Biochemistry, 2011, 43(3): 520-530.
(  0) 0) |
| [28] |
Chen Y L, Kang L H, Malajczuk N, et al. Selecting ectomycorrhizal fungi for inoculating plantations in south China:Effect of Scleroderma on colonization and growth of exotic Eucalyptus globulus, E. urophylla, Pinus elliottii, and P. radiata . Mycorrhiza, 2006, 16(4): 251-259. DOI:10.1007/s00572-006-0039-8
(  0) 0) |
| [29] |
胡婵娟, 傅伯杰, 刘国华, 等. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性. 生态学报, 2009, 29(2): 727-733. Hu C J, Fu B J, Liu G H, et al. Soil microbial functional and diversity under typical artificial wood lands in the hillyarea of the Loess Plateau (In Chinese). Acta Ecologica Sinica, 2009, 29(2): 727-733. DOI:10.3321/j.issn:1000-0933.2009.02.022 (  0) 0) |
| [30] |
Qiu S J, Ju X T, Ingwersen J, et al. Changes in soil carbon and nitrogen pools after shifting from conventional cereal to greenhouse vegetable production . Soil & Tillage Research, 2010, 107(2): 80-87.
(  0) 0) |
| [31] |
王宁, 杨雪, 李世兰, 等. 不同海拔红松混交林土壤微生物量碳、氮的生长季动态. 林业科学, 2016, 52(1): 150-158. Wang N, Yang X, Li S L, et al. Seasonal dynamics of soil microbial biomass carbon-nitrogen in the Korean pine mixed forests along elevation gradient (In Chinese). Scientla Silvae Sinicae, 2016, 52(1): 150-158. (  0) 0) |
| [32] |
Shen C, Xiong J, Zhang H, et al. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain . Soil Biology & Biochemistry, 2013, 57: 204-211.
(  0) 0) |
| [33] |
Chatterjee A, Ingram L J, Vance G F, et al. Soil processes and microbial community structures in 45-and 135-year-old Lodgepole pine stands . Canadian Journal of Forest Research, 2009, 39(11): 2263-2271. DOI:10.1139/X09-132
(  0) 0) |
| [34] |
赵雪梅, 孙向阳, 王海燕, 等. 三倍体毛白杨速生林土壤养分因子及pH值动态变化. 生态学报, 2010, 30(13): 3414-3423. Zhao X M, Sun X Y, Wang H Y, et al. Dynamics of soil nutritional factors and pH value of triploid Populus tomentosa plantation (In Chinese). Acta Ecologica Sinica, 2010, 30(13): 3414-3423. (  0) 0) |
| [35] |
Djukic I, Zehetner F, Watzinger A, et al. In situ carbon turnover dynamics and the role of soil microorganisms therein:A climate warming study in an alpine ecosystem . FEMS Microbiology Ecology, 2013, 83(1): 112-124. DOI:10.1111/j.1574-6941.2012.01449.x
(  0) 0) |
| [36] |
罗达, 史作民, 唐敬超, 等. 南亚热带乡土树种人工纯林及混交林土壤微生物群落结构. 应用生态学报, 2014, 25(9): 2543-2550. Luo D, Shi Z M, Tang J C, et al. Soil microbial community structure of monoculture and mixed plantation stands of native tree species in south subtropical China (In Chinese). Chinese Journal of Applied Ecology, 2014, 25(9): 2543-2550. (  0) 0) |
| [37] |
王卫霞, 史作民, 罗达, 等. 南亚热带3种人工林土壤微生物生物量和微生物群落结构特征. 应用生态学报, 2013, 24(7): 1784-1792. Wang W X, Shi Z M, Luo D, et al. Characteristics of soil microbial biomass and community composition in three types of plantations in southern subtropical area of China (In Chinese). Chinese Journal of Applied Ecology, 2013, 24(7): 1784-1792. (  0) 0) |
| [38] |
Boyle S A, Yarwood R R, Bottomley P J, et al. Bacterial and fungal contributions to soil nitrogen cycling under Douglas fir and Red alder at two sites in Oregon . Soil Biology & Biochemistry, 2008, 40(2): 443-451.
(  0) 0) |
2. Tongren University, Tongren, Guizhou 554300, China
 2020, Vol. 57
2020, Vol. 57


