2. 生物资源保护与利用湖北省重点实验室(湖北民族大学), 湖北恩施 445000
硒是人类和动物必需的微量元素,适量的硒具有提高人体免疫机能、抗癌、抗衰老等功能[1-4]。硒的摄入量不足可引起克山病、大骨节病等疾病,而过量的硒会导致脱发、指甲变脆、肝增大等中毒症状[5]。表生环境中不同形态的硒具有不同的环境行为和生物有效性[1, 6-8]。可见,人畜体内硒的供应状况受制于环境中硒的总量和赋存形态。Se(Ⅳ)和Se(Ⅵ)是土壤中常见的硒形态,其生物有效性较高,是植物的主要硒营养源[6]。氧化铁是土壤的重要固相组分,可与不同形态的硒发生多种界面作用,从而改变环境硒的赋存形态和生物有效性[1, 9-10]。土壤中的铁和锰往往紧密伴生,并逐渐沉积形成掺锰的氧化铁。因此,研究纯氧化铁和锰掺杂产物的表面性质及其对硒的吸附特性,有助于理解土壤中铁锰氧化物与环境硒之间的界面作用过程,可深入认识土壤硒的地球化学行为,对土-水体系中硒的活性调控也有重要意义。
铁(羟基)氧化物在多种类型的土壤中均有分布[11-12]。棕壤和黄棕壤是亚热带湿润气候区主要土壤类型,其中针铁矿是各种铁(羟基)氧化物的主要存在物相[12-13];而针铁矿对环境中营养元素和污染物的迁移有重要的影响[14],因此针铁矿对土壤尤其是亚热带湿润气候区土壤有重要的环境意义。针铁矿通常呈针状、纺锤体、薄板状等,颗粒尺寸往往在几百纳米至数微米之间;自然环境中的针铁矿和人工合成针铁矿的比表面积一般在8~200 m2·g–1间变化[14-16]。针铁矿的表面功能团主要是两性铁羟基(≡≡Fe—OH)和边缘不饱和的铁原子。在悬浮液体系中,针铁矿Zeta的电位特性强烈依赖于介质溶液的pH和离子强度,表面电位零点一般在pH 7~9之间[14-15, 17]。针铁矿对Se(Ⅳ)的吸附数据适合用Langmuir方程拟合,而Freundlich方程适合描述铁/铝复合氧化物的吸附过程[18-19]。针铁矿对Se(Ⅳ)的吸附类型主要为单齿内圈配位化学吸附,而吸附Se(Ⅵ)以外圈物理吸附为主[19-22]。在悬浮液体系中,针铁矿对硒的吸附容量除了与矿物的基本性质有关外,也与硒的形态、溶液的pH、离子强度、温度等因素密切相关[10, 18]。
可见,针铁矿的表面性质和吸附硒的研究已有较多报道。然而,针铁矿的结晶形态和表面性质易随环境条件变化而改变[23]。土壤中氧化铁常与铝、硅、锰等多种元素共存,这些元素可掺杂于氧化铁结构中,对其形成、转化和表面性质产生明显影响。研究表明,铝、硅掺杂后针铁矿的结晶度变差、颗粒变小,比表面积和表面吸附能力均明显升高[24-26]。目前,有关锰掺杂对针铁矿的形成和表面性质影响的研究却少见,尤其在国内外还未见有关锰掺杂氧化铁与硒相互作用的研究。本研究制备了几种不同含量的锰掺杂针铁矿,用X-射线衍射(XRD)、透射电镜(TEM)、比表面及孔径分析、Zeta电位和酸碱滴定等手段分析针铁矿及锰掺杂产物的微观结构和表面性质,并研究样品对不同形态硒的吸附特性,有助于深入理解土壤/沉积物中锰掺杂氧化铁的表面性质及其与硒的相互作用特性,其结果可为土壤及水体中硒的形态分布和活性调控提供基础资料。
1 材料与方法 1.1 实验试剂所用试剂均为分析纯级,超纯水由超纯水机(HK-UP-11-20)制备,其电阻率<18.25 MΩ·cm–1。
1.2 样品的制备根据文献[27]中的方法合成针铁矿,其主要步骤为:取10.1 g Fe(NO3)3·9H2O于500 mL塑料烧杯中,加入50 mL超纯水,搅拌溶解后加入175 mL 2 mol·L–1的NaOH溶液,继续搅拌5 min再静置20 min,离心,洗涤,然后将沉淀转移至250 mL 0.3 mol·L–1的NaOH溶液中,调节pH至12.0~13.0之间,将搅拌均匀的悬浮液放入60℃的油浴锅中老化15 d,离心分离悬浮液,并用超纯水洗清,40℃烘箱烘干,碾磨过60目筛,产物记为Goe。为了制备锰掺杂产物,取4份10.1 g Fe(NO3)3·9H2O于500 mL的塑料烧杯中,加入50 mL超纯水,然后分别加入0.625、1.250、1.875和3.125 g Mn(NO3)2·4H2O,各体系中锰与铁的摩尔比(RMn/Fe)分别为0.1、0.2、0.3和0.5。参照制备针铁矿的方法制备不同掺杂量的锰掺杂产物,样品分别记为G-Mn0.1、G-Mn0.2、G-Mn0.3和G-Mn0.5。
1.3 样品的表征样品的X射线衍射(XRD)分析在X射线衍射仪(XRD-7 000,日本岛津)上进行。制样方式为粉末压片,测试条件为:Cu Kα(λ = 0.154 06 nm),管压40 kV,电流30 mA,室温,扫描速度8°·min–1,步长0.01°,扫描角度范围10°~80°。样品的透射电镜(TEM)分析在透射电子显微镜仪(Tecnai G2 F20,美国FEI)上进行。取1 mg左右样品分散于10 mL无水乙醇中,超声分散30 min,用胶头滴管将悬浮液滴至碳膜上,晾干后观察TEM图像,测试加速电压为200 kV。
样品的氮气等温吸附/脱附分析在全自动比表面和孔径分布分析仪(Autosorb-1,美国康塔)上进行。工作条件:取约30 mg样品在120℃下脱气处理20 h,除去水和其他的吸附气体。然后在77 K条件下进行氮气等温吸附/脱附测试。样品的比表面积根据多点Brunauer-Emmett-Teller(BET)方法计算,总孔体积根据相对压力接近饱和(p/p0 ≈ 0.998)时的氮气吸附量计算,平均孔径根据氮气等温吸附数据计算,表面分形度用Frenkel-Halsey-Hill(FHH)方法计算,孔径分布用Non-Local Density Functional Theory(NLDFT)方法计算。
样品的Zeta电位分析在Zetasizer Nano仪(Nano-ZS,英国马尔文)上进行。取若干份0.01 g样品,加入20 mL 0.01 mol·L–1的KCl溶液,超声分散30 min,用0.01 mol·L–1 KOH或HCl溶液调节其pH至预先设定值,然后取适量悬浮液于电极池中,测量其Zeta电位值。
1.4 样品对硒的吸附实验与数据处理样品悬浮液的制备:取0.90 g粉末样品于500 mL塑料烧杯中,加入150 mL 0.01 mol·L–1 KCl溶液,磁力搅拌均匀,超声分散30 min,用0.01 mol·L–1的HCl和KOH溶液将其pH调至5.0±0.02。硒储备溶液的制备:分别取1.73 g亚硒酸钠(Se(Ⅳ))和1.89 g硒酸钠(Se(Ⅵ))样品于两个100 mL烧杯中,加入80 mL超纯水使其溶解,用0.01 mol·L–1的HCl和NaOH溶液将pH调至5.0±0.02,转移至容量瓶中定容至100 mL。
等温吸附实验:分别取5 mL样品悬浮液于8支离心管中,依次加入不同体积的Se(Ⅳ)或Se(Ⅵ)储备溶液,使吸附体系中Se(Ⅳ)或Se(Ⅵ)的初始浓度分别为1、5、10、15、20、50、80、120 mg·L–1。然后加入pH=5.0±0.02、0.01 mol·L–1 KCl溶液至总体积为30 mL。将吸附体系在25℃、250 r·min–1条件下震荡24 h,然后在10 000 r·min–1转速下离心10 min。用原子荧光光度计(AFS-8330,北京吉天)测定上清液中Se(Ⅳ)和Se(Ⅵ)的浓度。根据吸附前后溶液中硒浓度之差计算样品对硒的吸附量(Qe)。实验重复3次取平均值。
选用Langmuir和Freundlich吸附模型[28-29]对等温吸附数据进行拟合。2种模型的表达式分别见式(1)和式(2):
| $ {Q_{\rm{e}}} = {Q_{\max }} \cdot {\rm{b}} \cdot {C_{\rm{e}}}/(1 + {\rm{b}} \cdot {C_{\rm{e}}}) $ | (1) |
| $ {Q_e} = {\rm{k}} \cdot {C_{\rm{e}}}^{1/{\rm{n}}} $ | (2) |
式中,Qe表示单位质量样品对吸附质的吸附量(mg·g–1),Ce为吸附体系中吸附质的平衡浓度(mg·L–1);Langmuir模型中Qmax表示最大吸附容量(mg·g–1),b为与吸附结合能及亲和力相关的常数(L·mg–1);Freundlich模型中k为与吸附容量有关的常数(mg1−(1/n)·L1/n·g–1),1/n为吸附量随吸附质的平衡浓度增加而升高的强度系数。
2 结果与讨论 2.1 针铁矿及其锰掺杂产物的结构与形貌Goe及其锰掺杂产物的XRD图谱见图 1。Goe样品分别在2θ为18.06°、21.45°、33.48°、34.94°、36.88°、40.26°、41.46°、53.42°、59.29°和61.53°处出现了衍射峰,这与标准针铁矿卡片(PDF-810462)的衍射数据一致,表明Goe样品为纯的针铁矿。与Goe相比,G-Mn0.1的衍射峰角度没有明显变化,且未见其他衍射峰,但其强度有所增强。G-Mn0.2中出现了更强的针铁矿衍射峰,且在29.84°、35.13°、42.67°和56.37°处还出现了微弱的其他衍射峰。根据文献[30],G-Mn0.2中新出现的这些衍射峰可归属于掺锰磁铁矿。G-Mn0.3和G-Mn0.5中,针铁矿的衍射峰不断减弱,而掺锰磁铁矿的衍射峰不断增强。根据文献[14],当锰掺杂比例(RMn/Fe)由0升高至0.2,样品中针铁矿的(101)晶面的衍射强度相对于其他晶面明显增强,而(301)、(401)和(601)晶面的衍射强度却不随RMn/Fe的增大而持续增强,同时(200)晶面的衍射强度逐渐减弱。这表明在低的锰掺杂条件下,提高RMn/Fe显著地促进了针铁矿晶体沿b轴方向生长的同时沿a轴方向略有扩展,而c轴方向的生长受到抑制;这种变化将导致针铁矿晶体的形貌随着RMn/Fe(0~0.2)的增大而向长径比增大的扁平状变化。当RMn/Fe由0.2升高至0.5时,样品中的掺锰磁铁矿衍射峰增强的同时,针铁矿的(101)晶面的衍射强度依次大幅度减弱,(020)晶面的衍射强度显著增强而(200)晶面衍射强度略有增强。这表明在高比例锰的掺杂下,针铁矿向掺锰磁铁矿转变的同时,针铁矿晶体沿b轴方向的生长受到严重的抑制,a轴有一定程度的促进;这可导致样品随着RMn/Fe的增大出现大量的掺锰磁铁矿,针铁矿的针状颗粒变短且向片状或纤细的晶须状变化。可见,锰掺杂对针铁矿晶体结构的影响与锰的掺杂量密切相关。低比例的锰掺杂(RMn/Fe=0.1~0.2)促进了针铁矿晶体沿b轴方向生长,而高比例的锰掺杂(RMn/Fe=0.3~0.5)在抑制了针铁矿晶体沿b轴方向生长的同时导致掺锰磁铁矿大量形成。
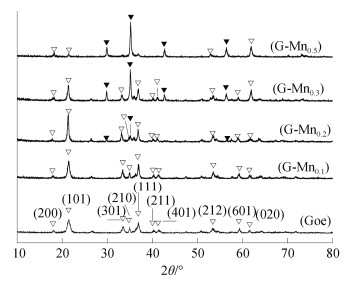
|
注:▽和▼分别表示针铁矿和锰掺杂针铁矿的XRD衍射峰。Goe为针铁矿,G-Mn0.1为RMn/Fe=0.1的样品,G-Mn0.2为RMn/Fe=0.2的样品,G-Mn0.3为RMn/Fe=0.3的样品,G-Mn0.5为RMn/Fe=0.5的样品。下同。 Note:▽ and ▼ stands for XRD peak of goethite and Mn-doped goethite, respectively. Goe stands for goethite sample; G-Mn0.1 for the sample of RMn/Fe=0.1;G-Mn0.2 for the sample of RMn/Fe=0.2;G-Mn0.3 for the sample of RMn/Fe=0.3;and G-Mn0.5 for the sample of RMn/Fe=0.5. 图 1 Goe及其锰掺杂产物的XRD图谱 Fig. 1 XRD patterns of Goe and Mn-doped products |
图 2为Goe及其锰掺杂产物的TEM图像。Goe为典型的纺锤体形貌,其长度在0.5 μm左右;G-Mn0.1为长度1 μm左右的扁平针状形貌;G-Mn0.2为典型的针状形貌,部分颗粒的长度达2.0 μm以上;G-Mn0.3中大部分颗粒为长度1.5 μm左右的针状颗粒,还有少量的近似纳米球状物;G-Mn0.5中出现了大量的纳米球状物,同时可见少量的长度约0.5 μm纤细的针状或须状颗粒。结合XRD分析的结果,G-Mn0.3和G-Mn0.5中纳米球状物应该是掺锰磁铁矿。而5种样品中的针铁矿晶体形貌的变化与XRD分析结果基本一致。可见,当RMn/Fe=0.1~0.2时促进了针铁矿晶体沿b轴方向生长;当RMn/Fe=0.3~0.5时,随着掺杂比例的增加,掺锰磁铁矿含量越来越高,而针铁矿晶体颗粒变得越来越纤细。

|
图 2 Goe及其锰掺杂产物的TEM图像 Fig. 2 TEM images of Goe and Mn-doped products |
图 3为Goe、G-Mn0.2和G-Mn0.5的氮气等温吸附/脱附曲线及孔径分布曲线(插图)。可见,在接近饱和相对气压(p/p0 =0.998)时,3种样品对氮气吸附量的由大到小依次为G-Mn0.5、G-Mn0.2、Goe。随着p/p0的增加,3种样品对氮气等温吸附/脱附曲线的变化趋势类似。当p/p0从近真空上升至0.01时,样品对氮气的吸附量随压力的上升而明显增加;当p/p0从0.01上升至0.90时,吸附量随压力的上升而缓慢增加;随着p/p0的进一步增加,氮气吸附量也明显增加;当接近饱和大气压(p/p0 >0.95)时,氮气吸附量呈急剧增加趋势。可见,样品中存在一定量的微孔和大孔,同时具有少量的介孔。根据文献[14],氧化铁样品结构内部没有空隙存在,因此样品中的空隙可归属于颗粒间的孔隙。

|
图 3 Goe、G-Mn0.2和G-Mn0.5的氮气等温吸附/脱附曲线及孔径分布曲线(插图) Fig. 3 Nitrogen isothermal adsorption / desorption curves and pore size distribution curves(the inset)of Goe, G-Mn0.2 and G-Mn0.5 |
图 3显示,Goe的孔径主要集中分布在9.70 nm左右,G-Mn0.2的孔径主要分布在6.36 nm和14.77 nm附近,G-Mn0.5的孔径主要集中分布在5.54 nm左右。与Goe相比,G-Mn0.2中的孔径分布峰向更大和更小的两端分布,这主要是由于G-Mn0.2颗粒的长径比显著增大导致颗粒间的堆积多样化,因此颗粒间的空隙尺寸也随之变小或变大;G-Mn0.5的孔径尺寸明显减小,这是由于G-Mn0.5中掺锰磁铁矿和针铁矿的颗粒尺寸均小于Goe中的颗粒。
Goe、G-Mn0.2和G-Mn0.5的孔性结构参数和表面分形度见表 1。3种样品的比表面积大小顺序为G-Mn0.5 > G-Mn0.2 > Goe。由于针铁矿等氧化铁属于非孔材料,因此样品的孔结构主要为颗粒间的聚集而产生的假孔,相应的比表面积主要为颗粒外比表面积。G-Mn0.2的比表面积高于Goe,这可能是由于G-Mn0.2颗粒的长径比增大,导致颗粒间的空隙增多致使外表面积变大。G-Mn0.5的比表面积明显增加,这主要是G-Mn0.5样品中的球形掺锰磁铁矿颗粒以及纤细的针铁矿颗粒的尺寸更小,导致样品聚集产生的假孔孔径变小而增大了样品的外比表面积。固体样品的表面分形度(SFD)可反映样品表面的异质性。矿物样品的SFD值通常在2~3间,当SFD接近2时表明样品表面光滑、均匀,SFD值升高则表明样品表面均匀性变差、粗糙度增加。Goe和G-Mn0.2的SFD值分别为2.31和2.53,可见其表面粗糙度和表面异质性的差异性较小,但有逐渐升高的趋势;而G-Mn0.5的SFD值相对增大明显,这主要是G-Mn0.5样品中出现大量掺锰磁铁矿的同时还存在少量纤细的针铁矿,导致样品的异质性增大。
|
|
表 1 Goe、G-Mn0.2和G-Mn0.5的孔性结构参数 Table 1 Pore structural parameters of Goe, G-Mn0.2 and G-Mn0.5 |
不同pH条件下样品的Zeta电位见图 4。Goe、G-Mn0.2和G-Mn0.5的Zeta电位零点分别为7.36、6.58和5.31。Goe的电位零点与文献报道的结果相符[14-15, 17]。对G-Mn0.2和G-Mn0.5而言,随着锰掺杂量的增加其Zeta电位零点不断降低。根据文献[31],这可归因于锰氧化物的Zeta电位零点较低,通常在2.25~5.00范围间。此外,G-Mn0.2样品的Zeta电位降低,还可能与G-Mn0.2样品中针铁矿的比表面积和(101)晶面比例增大导致针铁矿表面≡Fe—OH和边缘不饱和铁原子的数量增多有关。pH=5.0时,Goe、G-Mn0.2和G-Mn0.5的表面Zeta电位分别为40.5、35.3和4.92 mV。可见,pH=5.0时3种样品的Zeta电位均为正值,但其电位量随着锰掺杂量的增加而逐渐减小。

|
图 4 Goe及其锰掺杂产物的Zeta电位 Fig. 4 Zeta potential of Goe and Mn-doped products |
图 5为样品悬浮液的pH与H+消耗量之间的关系曲线。当初始pH平衡至8.0时,随着H+的不断加入悬浮液的pH逐渐降低。当悬浮液的pH从8.0降低至4.0时,Goe、G-Mn0.2和G-Mn0.5消耗的H+量分别为1.19、1.39和1.52 mmol·g–1。样品表面的活性羟基具有酸碱两性特征,在不同pH条件下可发生质子化或去质子化反应,从而表现出酸碱缓冲性[32-34]。因此,样品悬浮液从pH 8.0降至pH 4.0消耗的H+量与其表面活性羟基的密度呈正相关性。可见,随着锰掺杂量的升高,样品表面的活性羟基密度也逐渐升高。

|
图 5 样品的H+消耗量-pH关系曲线 Fig. 5 Proton titration isotherms of the samples as a function of pH |
图 6为Goe、G-Mn0.2和G-Mn0.5对Se(Ⅳ)的等温吸附曲线。图 6a显示,样品对Se(Ⅳ)的吸附量(Qe)随着Se(Ⅳ)平衡浓度(Ce)的增大而逐渐增加。当悬浮液中Se(Ⅳ)的平衡浓度小于10 mg·L –1时,吸附量随Se(Ⅳ)平衡浓度升高而急剧增加;当悬浮液中Se(Ⅳ)的平衡浓度在10~40 mg·L–1之间时,Goe和G-Mn0.2对Se(Ⅳ)的吸附量增幅减小,而G-Mn0.5对Se(Ⅳ)的吸附量依然明显增加。当悬浮液中Se(Ⅳ)的平衡浓度达40 mg·L–1以上时,3种样品对Se(Ⅳ)的吸附接近饱和,吸附量趋于稳定。图 6b中,当悬浮液中Se(Ⅵ)的平衡浓度小于15 mg·L–1时,Goe、G-Mn0.2和G-Mn0.5对Se(Ⅵ)的吸附量随Se(Ⅵ)平衡浓度升高而明显增加;当悬浮液中Se(Ⅵ)的平衡浓度在15~25 mg·L–1之间时,Goe和G-Mn0.2的吸附量略有增加,而G-Mn0.5的吸附量依然呈现为较明显的增加趋势。当Se(Ⅵ)的平衡浓度接近25 mg·L–1时,3种样品对Se(Ⅵ)的吸附均趋于平衡。当Se(Ⅵ)的平衡浓度达25 mg·L–1以上时,3种样品对Se(Ⅵ)的吸附接近饱和,吸附量趋于稳定。

|
图 6 Goe、G-Mn0.2和G-Mn0.5对Se(Ⅳ)a)和Se(Ⅵ)b)的等温吸附 Fig. 6 Se(Ⅳ)a)and Se(Ⅵ)b)adsorption isotherms of the samples |
Langmuir和Freundlich等温吸附模型对样品等温吸附Se(Ⅳ)和Se(Ⅵ)的拟合结果见表 2。2种等温吸附模型对样品吸附Se(Ⅳ)和Se(Ⅵ)的拟合度表明,Goe、G-Mn0.2和G-Mn0.5样品对Se(Ⅳ)和Se(Ⅵ)的吸附均更适合用Langmuir等温吸附模型描述。Langmuir模型拟合结果显示,3种样品对Se(Ⅳ)的最大吸附量Qmax在11.6~20.4 mg·g–1间,随样品锰掺杂量的增加而增加;吸附亲和力常数b在0.60~0.53 L·mg–1间,其中G-Mn0.2对Se(Ⅳ)吸附亲和力略有升高,而G-Mn0.5对Se(Ⅳ)吸附亲和力有所降低。样品吸附Se(Ⅳ)的Langmuir模型拟合结果表明,增大锰掺杂比例可有效提高样品对Se(Ⅳ)的吸附容量,然而样品对Se(Ⅳ)的吸附亲和力却受锰掺杂量的影响较小。尽管3种样品对Se(Ⅵ)最大吸附量Qmax的影响程度相对较小(Qmax为7.6~9.2 mg·g–1),但3种样品对Se(Ⅵ)吸附亲和力常数b却变化显著(b为0.25~0.93 L·mg–1),且Qmax和b均随样品锰掺杂量的增加而不断增加;这说明锰掺杂可一定程度提高样品对Se(Ⅵ)的吸附容量,同时极大地增强样品对Se(Ⅵ)的吸附亲和力。
|
|
表 2 样品吸附Se(Ⅳ)和Se(Ⅵ)的等温模型拟合参数 Table 2 Fitting parameters of the isotherm models of Se(Ⅳ)and Se(Ⅵ)adsorption of the samples |
Freundlich模型拟合结果显示,3种样品对Se(Ⅳ)的吸附容量常数k在5.2~8.5 mg1−(1/n)·L1/n·g–1间,不同样品的吸附容量常数k的相对大小与Langmuir模型拟合的最大吸附容量Qmax一致。3种样品的Freundlich吸附强度系数随锰掺杂量的升高而略微增加(1/n为0.19~0.21),说明3种样品对Se(Ⅳ)的吸附容量随平衡浓度增加而升高的强度无明显差异。在吸附Se(Ⅵ)的实验中,Freundlich模型拟合结果k随样品锰掺杂量的增加而增加,但吸附强度系数1/n略有减小,说明提高锰掺杂比例可增大样品对Se(Ⅵ)的吸附量和吸附亲和力,这与Langmuir模型拟合结果一致。
Goe和G-Mn0.2样品的XRD和TEM均显示针铁矿仍为主要成分,而掺锰磁铁矿含量非常低,因此G-Mn0.2样品中的掺锰磁铁矿对样品吸附Se(Ⅳ)的吸附影响可忽略。与Goe相比,G-Mn0.2的晶体结构沿b轴明显伸展,形貌由短纺锤体形发展为大长径比的扁平针状,导致样品的比表面积和(101)晶面比例显著扩大。针铁矿等氧化铁对Se(Ⅳ)的吸附机制主要为化学吸附作用,并且针铁矿晶体的(101)晶面最有利于对阴离子酸根的化学吸附[35-36]。G-Mn0.2样品的比表面积和(101)晶面比例扩大导致样品的活性吸附位点增多,因此G-Mn0.2对Se(Ⅳ)的吸附量显著增大。此外,G-Mn0.2样品的(101)晶面扩大使吸附位点的密度增大以至于吸附量明显增大,但由于吸附位点种类不变,因此G-Mn0.2对Se(Ⅳ)的吸附亲和力没有明显的变化,这与Langmuir和Frenudlich模型拟合得到的结果一致。对于G-Mn0.5样品,其主要成分已经不再是针铁矿,因此G-Mn0.5样品对Se(Ⅳ)吸附量的增大可能与掺锰磁铁矿具有最大的比表面积和羟基表表面密度有关。
研究显示,包括各种氧化铁在内的金属(羟基)氧化物对Se(Ⅵ)的吸附机制主要为物理吸附,相应的吸附作用力主要为氢键以及包括静电引力在内的分子间作用力[35, 37]。当吸附体系的pH为5.0时,与Goe样品相比,尽管G-Mn0.2和G-Mn0.5样品的Zeta电位降低可导致样品对Se(Ⅵ)因静电作用产生的吸附减少;但是G-Mn0.2和G-Mn0.5样品的比表面积和表面羟基密度明显依次增大,这可使G-Mn0.2和G-Mn0.5样品与Se(Ⅵ)形成更多的氢键和更大的接触面积并导致样品对Se(Ⅵ)的吸附量增大;并且G-Mn0.2和G-Mn0.5样品的异质性增强,导致样品颗粒局部表面能升高[38],也有利于增强样品对Se(Ⅵ)的吸附。因此,在多种吸附作用下,锰掺杂产物对Se(Ⅵ)的吸附量随着锰掺杂量的增大而增大。此外,由于Goe、G-Mn0.2和G-Mn0.5样品对Se(Ⅵ)的吸附为吸附作用力较弱物理吸附,因此受条件影响更为明显,导致3种样品对Se(Ⅵ)的吸附亲和力变化较大且随着锰掺杂量的增加而增大。
3 结论低比例的锰掺杂(RMn/Fe=0.1~0.2)促进了针铁矿晶体沿b轴方向生长,其形貌随着掺杂量的升高而变得更加细长。当RMn/Fe=0.3~0.5时,针铁矿晶体的形成受到了抑制而变得更加纤细,且产物中出现了掺锰磁铁矿。Goe、G-Mn0.2和G-Mn0.5的比表面积、表面分形度和表面活性羟基密度均表现为依次升高的趋势,且样品的Zeta电位零点随锰掺杂量的增加逐渐降低。初始pH=5.0时,Goe、G-Mn0.2和G-Mn0.5对Se(Ⅳ)的吸附量均高于对Se(Ⅵ)的吸附量,且等温吸附数据均适合用Langmuir模型拟合。低比例的锰掺杂导致针铁矿的比表面积和(101)晶面扩大,增大了对Se(Ⅳ)的活性吸附位点密度,而高比例的锰掺杂则形成了掺锰磁铁矿,因此G-Mn0.2和G-Mn0.5样品对Se(Ⅳ)的吸附均有明显的增加。随着掺杂锰比例的增大,样品的比表面积和羟基密度以及样品的异质性均依次增大,导致对Se(Ⅵ)的吸附量和吸附亲和力依次增加。可见,锰掺杂对针铁矿的结构和表面性质均产生了明显影响,可增强样品对Se(Ⅳ)和Se(Ⅵ)的吸附作用而降低硒在环境中的迁移性。
| [1] |
周军, 白兆帅, 徐辉碧, 等. 硒蛋白与糖尿病——硒的两面性. 化学进展, 2013, 25(4): 488-494. Zhou J, Bai Z S, Xu H B, et al. Selenoproteins and diabetes-Dual effect of selenium (In Chinese). Progress in Chemistry, 2013, 25(4): 488-494. (  0) 0) |
| [2] |
Zheng X Q, Xu W, Sun R X, et al. Synergism between thioredoxin reductase inhibitor ethaselen and sodium selenite in inhibiting proliferation and inducing death of human non-small cell lung cancer cells . Chemico-Biological Interactions, 2017, 275: 74-85. DOI:10.1016/j.cbi.2017.07.020
(  0) 0) |
| [3] |
Ju W, Li W, Li Z, et al. The effect of selenium supplementation on coronary heart disease:A systematic review and meta-analysis of randomized controlled trials . Journal of Trace Elements in Medicine and Biology, 2017, 44: 8-16. DOI:10.1016/j.jtemb.2017.04.009
(  0) 0) |
| [4] |
Ding Y Z, Wang Y J, Zheng X Q, et al. Effects of foliar dressing of selenite and silicate alone or combined with different soil ameliorants on the accumulation of As and Cd and antioxidant system in Brassica campestris . Ecotoxicology and Environmental Safety, 2017, 142: 207-215. DOI:10.1016/j.ecoenv.2017.04.001
(  0) 0) |
| [5] |
Lanctôt C M, Cresswell T, Callaghan P D, et al. Bioaccumulation and biodistribution of selenium in metamorphosing tadpoles . Environmental Science & Technology, 2017, 51(10): 5764-5773.
(  0) 0) |
| [6] |
Wang S S, Liang D L, Wang D, et al. Selenium fractionation and speciation in agriculture soils and accumulation in corn (Zea mays L.) under field conditions in Shanxi Province, China . Science of the Total Environment, 2012, 427-428: 159-164. DOI:10.1016/j.scitotenv.2012.03.091
(  0) 0) |
| [7] |
周鑫斌, 赖凡, 张城铭, 等. 不同形态硒向水稻籽粒转运途径及品种差异. 土壤学报, 2017, 54(5): 1251-1258. Zhou X B, Lai F, Zhang C M, et al. Pathways of selenium to grain relative to form of selenium and variety of rice (Oryza sativa L.) (In Chinese). Acta Pedologica Sinica, 2017, 54(5): 1251-1258. (  0) 0) |
| [8] |
Weng L, Vega F A, Supriatin S, et al. Speciation of Se and DOC in soil solution and their relation to Se bioavailability . Environmental Science & Technology, 2010, 45(1): 262-267.
(  0) 0) |
| [9] |
Elizabeth H, Amineh A B, David S, et al. Influence of iron redox cycling on organo-mineral associations in Arctic tundra soil . Geochimica et Cosmochimica Acta, 2017, 207: 210-231. DOI:10.1016/j.gca.2017.02.034
(  0) 0) |
| [10] |
Das S, Jim Hendry M, Essilfie-Dughan J. Adsorption of selenate onto ferrihydrite, goethite, and lepidocrocite under neutral pH conditions . Applied Geochemistry, 2013, 28: 185-193. DOI:10.1016/j.apgeochem.2012.10.026
(  0) 0) |
| [11] |
张志毅. 几种水平地带性土壤颗粒中粘土矿物的组成与演化特征. 武汉: 华中农业大学, 2016. Zhang Z Y. Composition and evolution characteristics of clay minerals in several horizontal zonality soil particles (In Chinese). Wuhan: Huazhong Agricultural University, 2016. (  0) 0) |
| [12] |
刘凡, 徐凤琳, 李学垣, 等. 几种可变电荷土壤中氧化铁类型与磷吸附特性. 华中农业大学学报, 1993, 12(5): 450-454. Liu F, Xu F L, Li X Y, et al. Types of Fe oxides and their phosphate sorption character in soils with variable charge (In Chinese). Journal of Huazhong Agricultural University, 1993, 12(5): 450-454. (  0) 0) |
| [13] |
季峻峰, 陈骏, Balsam W, 等. 黄土剖面中赤铁矿和针铁矿的定量分析与气候干湿变化研究. 第四纪研究, 2007, 27(2): 221-229. Ji J F, Chen J, Balsam W, et al. Quabtitative analysis of hematite and goethite in the Chinese loess-paleosol sequences and its mplication for dry and humid variability (In Chinese). Quaternary Sciences, 2007, 27(2): 221-229. DOI:10.3321/j.issn:1001-7410.2007.02.007 (  0) 0) |
| [14] |
Cornell, R M, Schwertmann U. The iron oxides, structure, properties, reactions occurences, uses . Weinheim, Germany: Wiley-VCH, 2003.
(  0) 0) |
| [15] |
魏世勇, 刘凡, 冯雄汉, 等. 针铁矿-高岭石二元体的微观结构与形成机制. 土壤学报, 2011, 48(2): 320-330. Wei S Y, Liu F, Feng X H, et al. Microstructure of goethite-kaolinite dyad and mechanism of its formation (In Chinese). Acta Pedologica Sinica, 2011, 48(2): 320-330. (  0) 0) |
| [16] |
Montes-Hernandez G, Renard F, Chiriac R, et al. Sequential precipitation of a new goethite-calcite nanocomposite and its possible application in the removal of toxic ions from polluted water . Chemical Engineering Journal, 2013, 214: 139-148. DOI:10.1016/j.cej.2012.10.050
(  0) 0) |
| [17] |
Silvina P, Maria L F, Elsa H R. Adsorption of alizarin, eriochrome blue black R, and fluorescein using different iron oxides as adsorbents . Industrial & Engineering Chemistry Research, 2007, 46(24): 8255-8263.
(  0) 0) |
| [18] |
Goh K H, Lim T T. Geochemistry of inorganic arsenic and selenium in a tropical soil:Effect of reaction time, pH, and competitive anions on arsenic and selenium adsorption . Chemosphere, 2004, 55(6): 849-859. DOI:10.1016/j.chemosphere.2003.11.041
(  0) 0) |
| [19] |
Nie Z, Finck N, Heberling F, et al. Adsorption of selenium and strontium on goethite:EXAFS study and surface complexation modeling of the ternary systems . Environmental Science & Technology, 2017, 51(7): 3751-3758.
(  0) 0) |
| [20] |
Sheha R R, El-Shazly E A. Kinetics and equilibrium modeling of Se (Ⅳ) removal from aqueous solutions using metal oxides . Chemical Engineering Journal, 2010, 160(1): 63-71. DOI:10.1016/j.cej.2010.03.004
(  0) 0) |
| [21] |
Leonel V C, Juliana N Q, Alessandra M M, et al. Sorption-desorption of selenite and selenate on Mg-Al layered double hydroxide in competition with nitrate, sulfate and phosphat . Chemosphere, 2017, 187: 627-634.
(  0) 0) |
| [22] |
Rovira M, Giménez J, Martínez m, et al. Sorption of selenium (Ⅳ) and selenium (Ⅵ) onto natural iron oxides:Goethite and hematite . Journal of Hazardous Materials, 2008, 150(2): 279-284. DOI:10.1016/j.jhazmat.2007.04.098
(  0) 0) |
| [23] |
Patricia G B, Silvia A F, Norberto J C, et al. Phosphate adsorption on goethite and Al-rich goethite . Computational Materials Science, 2014, 85: 59-66. DOI:10.1016/j.commatsci.2013.12.030
(  0) 0) |
| [24] |
Li M X, Liu H B, Chen T H, et al. Adsorption of europium on Al-substituted goethite . Journal of Molecular Liquids, 2017, 236: 445-451. DOI:10.1016/j.molliq.2017.04.046
(  0) 0) |
| [25] |
Li W, Wang L J, Liu F, et al. Effects of Al3+ doping on the structure and properties of goethite and its adsorption behavior towards phosphate . Journal of Environmental Sciences, 2016, 45: 18-27. DOI:10.1016/j.jes.2015.12.013
(  0) 0) |
| [26] |
Yuan B L, Xu J G, Li X T, et al. Preparation of Si-Al/α-FeOOH catalyst from an iron-containing waste and surface-catalytic oxidation of methylene blue at neutral pH value in the presence of H2O2 . Chemical Engineering Journal, 2013, 226: 181-188. DOI:10.1016/j.cej.2013.04.058
(  0) 0) |
| [27] |
Schwertmann U, Cornell R M. Iron oxides in the laboratory:Preparation and characterization . John Wiley & Sons, 2008.
(  0) 0) |
| [28] |
Langmuir I. The adsorption of gases on plane surfaces of glass, mica and platinum . Journal of the American Chemical Society, 1918, 40: 1361-1403. DOI:10.1021/ja02242a004
(  0) 0) |
| [29] |
Freundlich H M F. Uber die adsorption in lasungen . Journal of Physical Chemistry, 1906, 57: 385-470.
(  0) 0) |
| [30] |
Hudson W P C, Peter H, Sandra H P, et al. Improvement of the photocatalytic activity of magnetite by Mn-incorporation . Materials Science and Engineering:B, 2014, 181: 64-69. DOI:10.1016/j.mseb.2013.11.008
(  0) 0) |
| [31] |
Mustafa S, Khan S, Zaman M I. Effect of Ni2+ ion doping on the physical characteristics and chromate adsorption behavior of goethite . Water Research, 2010, 14(3): 918-926.
(  0) 0) |
| [32] |
Wei S Y, Niu P J, Wang R, et al. Binary systems of kaolinite and hematite:Preparation, characterization and adsorption characteristics for fluoride . Materials Transactions, 2016, 57(7): 1171-1176. DOI:10.2320/matertrans.M2015448
(  0) 0) |
| [33] |
Schwertmann U, Cornell R M. Iron oxides in the laboratory-preparation and characterization . Weinheim, German:Wiley-VCH, 1991, 61-80.
(  0) 0) |
| [34] |
魏世勇, 王锐, 牛鹏举, 等. 氧化铁改性蛭石的制备、表征及吸附氟的特性. 无机化学学报, 2016, 32(9): 1619-1628. Wei S Y, Wang R, Niu P J, et al. Preparation, characterization and fluoride adsorption characteristics of iron oxides-modified vermiculite (In Chinese). Chinese Journal of Inorganic Chemistry, 2016, 32(9): 1619-1628. (  0) 0) |
| [35] |
Lounsbury A W, Yamani J S, Johnston C P, et al. The role of counter ions in nano-hematite synthesis:Implications for surface area and selenium adsorption capacity . Journal of Hazardous Materials, 2016, 310: 117-124. DOI:10.1016/j.jhazmat.2016.01.078
(  0) 0) |
| [36] |
Davantès A, Lefèvre G. Molecular orientation of molybdate ions adsorbed on goethite nanoparticles revealed by polarized in situ ATR-IR spectroscopy . Surface Science, 2016, 653: 88-91. DOI:10.1016/j.susc.2016.06.007
(  0) 0) |
| [37] |
Sun W L, Pan W Y, Wang F, et al. Removal of Se (Ⅳ) and Se (Ⅵ) by MFe2O4 nanoparticles from aqueous solution . Chemical Engineering Journal, 2015, 273: 353-362. DOI:10.1016/j.cej.2015.03.061
(  0) 0) |
| [38] |
刘洪国, 孙德军, 郝京诚. 新编胶体界面与化学. 北京: 化学工业出版社, 2016. Liu H G, Sun D J, Hao J C. Colloid and interface chemistry (In Chinese). Beijing: Chemical Industry Press, 2016. (  0) 0) |
2. Hubei Key Laboratory of Biologic Resources Protection and Utilization, Hubei Minzu University, Enshi, Hubei 445000, China
 2020, Vol. 57
2020, Vol. 57


