2. 安徽省农业科学院土壤肥料研究所, 合肥 230001
磷素(P)是植物生长必需的营养元素,缺乏时影响植物的生产力;同时磷素也是导致水污染的重要元素,过量时导致严重的环境问题。土壤及沉积物中磷素的流动性和生物有效性深受磷-矿物界面反应的影响。宏观热力学和动力学研究可以获得矿物对磷酸根的吸附容量和速率,而光谱、模型、量子化学计算等技术方法则能提供吸附构型和配位距离等分子尺度的吸附机制。在过去的50年间,诸多研究在分子或微观层面阐述了磷酸根的吸附机理,显著提高了对无机磷吸附机制的认识[1-3]。早期基于磷酸根的吸附量与羟基释放量统计、异位红外光谱等方法判定磷酸根在矿物表面形成内圈络合物[4-7];后期核磁共振技术、原位红外光谱、络合模型等技术对磷酸根吸附形态、结构有了更为清晰的认识[8-12];现代化的双共振核磁共振波谱、原子力显微镜(AFM)、X-射线吸收光谱(XAS)、量子化学计算等进一步丰富了对磷酸根吸附机制的研究,对其吸附形态与质子化状态有了更清楚的认识[13-16]。国内学者对磷酸根在矿物表面吸附机制的研究相对较晚,近十年来关注逐步增加,取得了较好的进展[14-15, 17-21]。目前,一般认为磷酸根的吸附机制是磷酸根与金属氧化物表面的羟基官能团发生配位交换而形成内圈络合物[2],内圈络合物包括双齿双核和单齿单核表面络合物。当磷酸根与矿物表面的2个羟基发生交换时,形成双齿双核络合物;当磷酸根通过与矿物表面的1个金属原子(Me)结合形成P-O-Me连接时,形成单齿络合物。但是,关于无机磷在铁铝氧化物表面吸附形成内圈络合物的结构还存在很多争议,如在一定条件下,对双齿配位还是单齿配位起主导作用仍没有一致的认识。此外,在一定条件下,吸附在铁铝氧化物等矿物表面的磷酸络合物还可以转化成磷酸铁或磷酸铝表面沉淀。磷在铁铝氧化物表面由络合态到沉淀态的转化,进一步促进了磷的固定,降低了磷的移动性和生物有效性。同时,上述研究结果,对于有机磷界面反应的研究具有很好的借鉴意义和重要的推动作用。
对磷酸根在矿物表面吸附机制的认识高度依赖于各种分析技术和方法,如基于OH-释放的化学计量分析、Zeta电位(电泳迁移率)测试、等温滴定量热法、AFM、核磁共振波谱(NMR)、光谱技术[X射线光电子能谱(XPS)、傅里叶变换红外光谱(FTIR)和XAS]、表面络合模型(SCM)和量子化学计算。各技术均有其独特之性,也存在一定的局限性,对于不同的吸附反应体系,选择不同的技术或联合应用不同的技术方法,发挥各自的优势,可以获取更清楚的配位信息,有利于解释磷酸根在矿物表面的界面反应机制。比如31P NMR可以揭示磷酸根在铝氧化物表面的吸附机制,但是由于铁元素的顺磁效应,对于铁氧化物体系,一般31P NMR的应用会受到限制;由于(氢)氧化铝矿物在晶体表面的粘性较铁氧化物弱,且(氢)氧化铝的红外吸收峰干扰P-O的吸收峰,原位ATR-FTIR技术多用于铁氧化物-磷体系的吸附机制研究。本文深入分析了各种现代技术手段及方法在揭示无机磷(正磷酸)在矿物表面微观吸附机制中的应用,对磷酸根在矿物-水界面的吸附反应机制进行了系统的总结。
1 OH-释放量分析磷酸根的吸附量与OH-释放量(Amount of OH- released)之间的化学计量关系可用来揭示吸附过程,可为解释其吸附机制提供依据[22],这种分析方法在早期磷界面反应的研究中经常涉及,如今也常常作为辅助的研究手段之一[4-5, 19-20, 23]。铁氧化物与P的配位交换(内圈配位反应)涉及到P与一个或多个表面OH官能团(Fe-OH1/2-和Fe-OH21/2+)交换,释放表面OH2和/或OH-进入溶液[4-5, 23-25]。由于Fe-OH21/2+有更高的亲合力,优先与P交换,释放H2O;Fe-OH1/2-随后与P交换,释放OH-[12, 26-27]。电位滴定实验、羟基/质子释放定量分析表明磷酸根在针铁矿表面形成双齿双核络合物[7]。OH-释放化学计量随着磷酸盐在针铁矿表面吸附密度增加而增加,表明在不同的磷酸盐浓度下,不同的机制占主导地位。随着表面磷酸盐吸附密度的增加,表面配位模式从单齿络合物变为双齿络合物[22]。最近的研究表明,相对于针铁矿和赤铁矿,水铁矿表现出更高的P吸附量和OH-释放量,其慢速反应阶段也更快[20]。OH-释放定量分析结合原位红外光谱和差分配对分布函数(d-PDF)进一步研究磷酸根在不同尺寸水铁矿表面吸附历程和机制,表明最初磷酸根优先与两Fe-OH21/2+官能团交换,形成双齿双核表面配位,不释放OH-,水铁矿结晶尺寸越小,单位质量交换的Fe-OH21/2+越多;随后,磷酸根与Fe-OH21/2+和Fe-OH1/2-交换,每吸附一个P,释放一定量OH-;磷酸根在水铁矿表面形成双齿双核配位,P-Fe原子间距为~3.25Å[19]。
对于铝氧化物体系,反应过程类似。由于表面水基较氢氧基更活泼,吸附量低时,优先与P交换,随着反应进行越来越多的羟基与P交换。这使得表面电荷变化越来越小,OH-释放越来越大。通过表面净电荷变化和OH-释放定量分析进一步明确了这一结论[5]。在低磷浓度的反应体系中,主要通过置换氢氧化铝(三羟铝石和假勃姆石)表面的水合基(Al-H2O)发生吸附;随着磷浓度的增加,羟基(Al-OH)成为吸附的主要部位;在更高的浓度下,水合基和羟基几乎全部被磷酸吸附取代,连接铝原子(Al-OH-Al)的羟基桥断开并产生新的吸附位点,从而进一步增加磷酸根的吸附[28]。根据不同磷酸盐浓度下水合氧化铝吸附磷酸根与释放羟基离子之间的定量关系,提出磷酸根与氧化铝表面结合形成单齿和双齿络合物[4]。氢氧化铝表面上的水合基较羟基反应活性更强,并主导磷酸根初始的快速吸附反应。pH升高会降低水合基的数量,因此pH对反应速率的影响在开始比吸附后期有更大的影响[23]。此外,通过分析OH-释放量,也可以解释有机磷在矿物表面的吸附-沉淀转化过程[29]。
2 等温滴定量热法等温滴定量热法(Isothermal Titration Calorimetry,ITC)是近年来发展起来的一种研究生物热力学与生物动力学的重要方法,它通过高灵敏度、高自动化的微量量热仪连续、准确地监测和记录一个变化过程的量热曲线,原位、在线和无损伤地同时提供热力学和动力学信息。等温滴定量热法也可用于研究磷酸根在矿物表面的吸附机制[30-31]。pH 4.3条件下向高岭石悬液中滴加磷酸盐溶液的热谱分析表明磷酸根的吸附经历了初始快速放热反应,然后是较慢的吸热反应;继续滴加磷酸盐溶液,两种反应的热量变化均下降。随着滴定进一步进行,净反应从放热变为吸热,表明吸热反应占主导地位;相反,pH 6.3时,高岭石在磷酸盐滴定过程中仅表现出放热反应。强烈的吸热反应表明生成磷酸铝、磷酸铁沉淀,而放热主导的热模式表明磷酸钙的沉淀以及磷酸根在铁铝氧化物及高岭石表面的配体交换吸附[30-31]。
3 Zeta电位(电泳迁移率)分析电泳迁移率(Electrophoretic Mobility,EM)测量是一种有用的微观方法,不仅用于确定纯矿物组分的等电点(IEP),而且可用于间接区分胶体-水界面处的表面络合物的信息。剪切面外部电解质的非特异性吸附(即通过范德华力形成外圈络合物)通常不会影响IEP,但如果存在高浓度电解质时,则可能导致EM值的变化。然而,由于剪切面内的专性离子吸附,一般内圈络合物导致EM和IEP的变化,即含氧阴离子的内圈吸附增加了表面上的净负电荷。使用EM测量可间接区分胶体上的主要表面络合物[2]。EM数据表明磷在金属氧化物上主要以内圈络合物存在。电泳迁移率测量分析磷在水铁矿、针铁矿和勃姆石(γ-AlOOH,boehmite)上的吸附,表明由于形成内圈络合物可使矿物表面电荷反转,并且随着P吸附密度的增加IEP变得更低[8, 11, 32-33]。
此外,通过检测吸附磷酸根矿物的Zeta电位,可以间接解释磷酸根吸附与沉淀过程。例如,针铁矿吸附的磷酸根对Zeta电位的影响随表面吸附密度而变化,在低表面吸附密度下,每个磷酸根对Zeta电位的影响远大于高表面吸附密度下的影响;高表面吸附密度时磷酸根对Zeta电位的影响小是因为磷酸根形成了沉淀而不是表面络合物[34]。长时间反应后,吸附磷酸根的针铁矿其Zeta电位缓慢增加,表明这最可能是由于针铁矿溶解释放铁离子,随后铁离子与表面结合的磷酸根发生沉淀反应[35]。
4 原子力显微镜原子力显微镜(Atomic Force Microscope,AFM)可直接“观察”磷酸根在针铁矿、碳酸钙等矿物表面形成铁磷、钙磷沉淀的过程,原位揭示可溶性磷在矿物表面固定、磷酸钙与铁磷沉淀形成及其溶解等动力学过程和微观机制,有助于理解土壤中溶解性磷酸盐的转化和迁移[14]。
AFM研究表明,在不同pH和离子强度下,方解石诱导的Ca-P相形成始于Ca-P团簇的聚集,继而在方解石表面成核生长形成结晶态Ca-P;在高磷酸盐浓度时,在方解石表面Ca-P相的成核加快,导致溶解性磷酸盐浓度显著降低,并且在高盐浓度时更显著[14]。类似地,在酸性pH条件下,通过磷酸的耦合溶解和沉淀反应机制,针铁矿表面溶解释放铁离子使得矿物-水界面层对磷酸铁过饱和,继而诱导磷酸铁纳米粒子的成核和后续的团聚及生长(形成二次颗粒和层状沉淀)[21]。在最早的结晶阶段,赤铁矿和针铁矿溶解期间,观察到磷酸铁纳米颗粒(高度为1.0~4.0 nm)的成核,这可能是初始阶段的非晶相;随后是聚集阶段,在不同的pH、离子强度和有机添加剂下,形成较大的颗粒和层状沉淀[36]。在高浓度NaCl或AlCl3存在下,针铁矿的溶解增强,导致Fe-P成核速率快速增加[21, 36],而低浓度MgCl2抑制针铁矿溶解,抑制Fe-P成核[21]。在pH 4.5的NH4H2PO4溶液(50 mmol·L-1)中,Fe-P相的表面成核动力学分析显示针铁矿上的成核速率较赤铁矿更大[36]。动力学数据分析显示低浓度的柠檬酸盐导致Ca-P相、Fe-P相的成核速率增加;然而,在较高柠檬酸盐浓度时,需要更长诱导时间形成Ca-P核以及Fe-P核[14, 21, 36]。此外,AFM图像显示吸附磷酸根、氢离子的针铁矿(010)表面很类似,由此判定在低pH和高吸附密度条件下,磷酸根与针铁矿(010)表面形成单齿配位[37]。
5 X射线光电子能谱法X射线光电子能谱(X-ray Photoelectron Spectroscopy,XPS)的原理是用X射线去辐射样品,使原子或分子的内层电子或价电子受激发射出来,被光子激发出来的电子称为光电子,利用能量分析器对光电子进行分析得到样品的光电子能谱。XPS不但为化学研究提供分子结构和原子价态等信息,还能为材料研究提供各种化合物的元素组成和含量、化学状态、分子结构、化学键等信息。例如,XPS研究表明磷酸根吸附在三水铝石矿物外表面[38]。早期XPS分析表明,磷酸根在针铁矿表面主要形成双齿双核络合物[39];低pH有利于形成磷的单齿配位,高pH有利于形成磷的双齿配位,体系pH升高,磷酸根在针铁矿表面由单齿配位向双齿配位转化,pH可能是通过影响磷酸根在溶液中的形态分布,以及矿物表面吸附态磷酸根质子化程度等来改变针铁矿表面磷的配位形式[17-18]。磷酸根与水铁矿结合形成表面络合物,还可进一步转化为更稳定的FePO4沉淀[40]。也有报道,在一定条件下(10-3 mol·L-1,60℃,反应90 d),磷酸根在天然针铁矿表面形成了Fe3Mn2(PO4)2.5(OH)2沉淀[41]。
6 红外光谱法 6.1 红外光谱基本原理红外光谱(Infrared Spectroscopy,IR)是一种基于分子振动的光谱技术。处于不同化学环境的分子(离子)基团其振动频率存在差别,通过观察磷酸根的红外吸收峰可以分辨其化学环境,揭示其在环境界面的吸附构型和机制[3]。红外光谱对磷酸盐配位环境和分子对称性非常敏感,可以揭示磷酸根的吸附机制,区分内圈和外圈络合物,其原理是基于不同络合物的分子对称性不同,红外吸附峰存在差异。例如,在pH 12的溶液中,PO43-阴离子是正四面体对称结构(Td),并在1 007 cm-1处产生一个单独的吸收峰;溶液pH降至9,PO43-逐渐质子化形成HPO42-(C3v),其对称性较低,吸收峰分裂成两个主峰(1 078和990 cm-1),并在850 cm-1处分裂成另一个小峰;在较低的pH(pH 5)下,生成H2PO4-,对称性进一步降低(C2v),吸收峰出现在1 159、1 077、940和875 cm-1[11, 32, 42]。
当磷酸根在铁、铝氧化物等矿物表面生成内圈络合物时,其配位结构会导致其对称性进一步降低,同时吸收峰的位置也会产生较大偏移,由此可以推断磷酸根吸附是单齿配位还是双齿配位,从而确定磷酸根吸附的机制[3]。对于磷酸根在矿物表面吸附机制的解释有许多争议,通常认为磷酸根在矿物(如针铁矿)表面形成双齿双核表面络合物,pH影响磷酸根在矿物表面的形态及质子化程度。
6.2 异位红外光谱红外光谱技术的发展经历了一个从异位到原位研究的过程。早期红外光谱是应用透射模式采集数据,需要对样品进行一定处理,因此也被称为异位红外[3]。异位红外谱表明针铁矿吸附磷酸根后,其表面的两个单齿羟基被取代,说明磷酸根在矿物表面形成双齿双核络合物[43],对配体交换机理提供了分子水平证据。同一时期,Parfitt和Atkinson等[6-7]用异位红外谱也表明磷酸根在针铁矿表面形成双齿双核络合物。此外,磷酸根取代氧化铁表面的两个羟基离子(或水分子),磷酸根离子的两个氧原子与不同的铁离子配位,形成Fe-O-P(O2)-O-Fe型双核表面络合物;同时也表明磷酸根在针铁矿、赤铁矿、纤铁矿、β-氢氧化铁和无定形氢氧化铁表面形成相似的配位结构[44]。Parfitt等[45]用红外吸收光谱研究了磷酸根在氘代针铁矿(α-FeOOD)和普通针铁矿(α-FeOOH)上吸附,表明均形成双核(FeO)2PO2表面络合物[45]。
6.3 漫反射红外光谱漫反射红外(Diffuse Reflectance FTIR,DRIFTIR)光谱法研究发现,在pH 3.3~11.9范围内,在相同pH下针铁矿表面的磷酸根络合物形态不随吸附密度(0~197 mol·g-1)的增加而变化,并且在所有pH下均存在双齿双核络合物[46]。然而,后来有学者用漫反射红外光谱研究磷酸根在针铁矿表面的吸附,并指出单齿表面络合物主要在pH 3和12.8之间形成,但在中等pH下,不能排除形成双齿络合物[47]。此外,漫反射红外光谱表明磷酸根在氧化铝表面可形成磷酸铝沉淀[48-49]。
6.4 内反射红外光谱随着反射附件如柱形内反射(Cylinder Internal Reflectance,CIR)[11, 50]以及衰减全反射(Attenuated Total Reflectance,ATR)的出现[32, 42, 51-52],红外光谱实现了原位分析吸附样品。诸多研究报道磷酸根在矿物表面主要形成多种形态表面络合物,pH是一个决定性因素。例如,Tejedor-Tejedor和Anderson[11]首次用原位柱形内反射红外光谱(CIR-FTIR)研究了磷酸根在针铁矿表面的吸附,提出磷酸根在针铁矿表面形成三种不同的络合物,即质子化双齿桥接络合物、去质子化双齿桥接络合物和去质子化单齿络合物,其相对比例随pH和磷酸根吸附密度的变化而变化。在低pH(3.5~6.5)和高表面吸附密度下双齿双核表面络合物占优势,在高pH(6.5~8.0)和低表面吸附密度下主要形成单齿单核络合物[11]。原位内反射红外光谱表明磷酸根在二氧化钛表面表现出快速吸附和慢速的解吸,形成双齿配位[50]。
6.5 衰减全反射红外光谱近二十年来,ATR-FTIR的发展很快,并对磷酸根在矿物(尤其是针铁矿、赤铁矿和水铁矿)表面的吸附构型及质子化状态有了更清楚的认识[13, 19, 32, 42, 51]。ATR-FTIR研究表明,在pH ≥7.5时,磷酸根在水铁矿表面形成非质子化的双齿双核内圈络合物(≡Fe2PO4)。在pH 4~6,吸附密度为0.38和2.69 μmol·m-2时,形成质子化的内圈络合物[32]。Luengo等[51]使用ATR-FTIR研究针铁矿表面磷形态随时间(5~400 min)的变化,发现在pH 4.5时非质子化和质子化双齿形态共存;在pH 7.5和9,主要形成非质子化双齿形态,并且在低浓度下还形成一种未知的吸附形态。磷酸根在赤铁矿表面形成单齿双核(桥接)络合物,质子化和非质子化单齿单核络合物,其相对比重随pH和吸附密度的变化而变化[42]。
7 核磁共振波谱法 7.1 31P核磁共振波谱基本原理核磁共振波谱(Nuclear Magnetic Resonance,NMR)是研究核自旋行为以及核自旋与晶体结构关系的一种分析技术。核磁共振谱学的重要参数化学位移对化学环境非常敏感,其物理意义是核外电子对核自旋的屏蔽效应。化学位移可以提供结构信息,因为处在不同化学环境下的原子核所经受的化学屏蔽(核外电子对核自旋行为的影响)不同,从而表现出不同的化学位移值[3]。如今,各种核磁共振方法广泛用于磷酸根在矿物表面的吸附研究。
7.2 单脉冲31P核磁共振技术固态NMR非常适合测定吸附在矿物表面上的磷酸盐的化学环境。由于其化学位移(δP-31)与化学结构尤其是配位结构具有一定对应性,传统的单脉冲核磁共振技术可以基于它们的化学位移来区分内圈络合物、外圈络合物和表面沉淀物[8-10, 53-55]。外圈磷酸盐络合物可具有与碱性磷酸盐相似的化学环境,因此产生具有各向同性化学位移的31P NMR信号(δP=0~10);表面沉淀物的化学位移可能与磷酸铝矿物的化学位移相似,磷酸铝矿物由于铝的化学屏蔽而通常更负(δP= -11~-30);出现在δP=0~-11之间的信号则可归因于内圈络合物。Bleam等[8]结合31P NMR与表面络合模型研究了磷酸根在勃姆石上的吸附,在pH 4~11范围形成内圈络合物,并且在pH > 9时形成完全去质子化的磷表面络合物,随着pH降低表面磷络合物的质子化程度增加。磷酸根在经70 ℃干燥的无定形氢氧化铝表面形成内圈络合物,并很快(10 d)就转化为磷酸铝;而无定形氢氧化铝在200 ℃下处理后,磷酸根吸附在矿物内外表面,反应120 d不会形成磷酸铝沉淀[9]。固态31P NMR研究表明磷酸根在γ-Al2O3表面可形成外圈和内圈络合物及表面沉淀,随正磷酸盐浓度和平衡时间增加,表面沉淀比例增加[53]。磷酸根在勃姆石和γ-Al2O3表面形成内圈表面络合物和磷酸铝沉淀,其相对含量随着pH和磷酸盐浓度的变化而变化[54]。可见,铝氧化物的结晶度、体系pH、磷酸根浓度以及反应时间是影响磷酸根在其表面吸附机制的重要因素。
此外,高岭石吸附磷酸根样品的核磁峰位同三水铝石吸附磷酸根样品的核磁峰位几乎一致,推断磷酸根主要与高岭石的铝羟基结合[55]。固体31P NMR和139La NMR研究表明,磷酸根吸附到La交换的黏土矿物表面后形成了磷稀土矿(LaPO4·nH2O,n≤3)[56]。碳酸钙低磷吸附样品(P 3.33~36.72 μmol·g-1)的固态31P NMR谱表明形成碳酸化的类磷灰石相;而高磷吸附样品的31P NMR分析表明形成类磷灰石和透钙磷石[57]。Lookman等[10, 58]通过31P和27Al NMR进一步研究了土壤样品中磷的存在形态,指出大部分磷元素在土壤中与铝结合,部分以磷酸八钙或磷灰石存在[58]。土壤中存在钙磷和铝磷,至少存在3种不同的磷形态[10]。
7.3 核磁双共振技术仅仅基于各向同性的化学位移很难明确区分双齿和单齿表面络合物,而利用核磁双共振技术能够对磷酸根在矿物表面的分子构型、质子化状态做出更深入的分析[59-60]。Li等[59]利用核磁双共振技术和二维杂核相关核磁谱等技术,研究了磷酸根在勃姆石表面的吸附,通过减少吸附样品反应时间,观察到吸附在勃姆石表面磷酸根的核磁谱有δP=0和δP=-6两条共振峰,并应用核磁双共振技术成功地证实了两个共振峰均属于双齿双核表面配合物,结合量子化学计算(详见后文)进一步将δP=0和δP=-6两个共振峰分别归属为去质子化吸附磷和质子化吸附磷[3, 59]。NMR分析进一步表明,在不同pH、磷酸根浓度、离子强度条件下,磷酸根在勃姆石表面主要形成双齿双核内圈络合物;表面湿度对磷的形态的影响较小,双共振技术表明除双齿双核内圈络合物外,还形成少量单齿单核内圈络合物(图 1);pH影响磷酸根在勃姆石表面的质子化状态,高pH时利于形成去质子化的双齿络合物,而低pH时利于形成质子化的双齿络合物;此外,NMR分析表明,为了平衡矿物表面电荷的需要,低磷酸根表面负荷时利于形成去质子化的双齿络合物,而高磷酸根表面负荷时利于形成质子化的双齿络合物[60]。
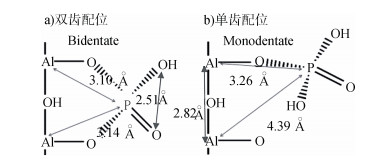
|
图 1 双齿和单齿的磷表面络合物结构模型[60] Fig. 1 Structural models for bidentate and monodentate phosphate surface complexes[60] |
此外,固态31P NMR一般很难用于铁氧化物吸附态磷的分析,而Kim等[61]在超低温下通过31P静态自旋回波成像核磁共振技术,研究了磷酸根在针铁矿、四方纤铁矿和纤铁矿表面的吸附,提出磷酸根在矿物表面主要形成双齿双核表面络合物。
8 X射线吸收精细结构光谱法 8.1 X射线吸收精细结构光谱基本原理X射线吸收精细结构光谱(X-Ray Absorption Fine Structure,XAFS)是一种基于同步辐射X射线光源的结构分析方法。通常XAFS谱图可以分为两个能量区域:X射线吸收近边结构(XANES)和延展边X射线吸收精细结构(EXAFS)。XANES的形状取决于电子相关性和电子态密度,主要提供吸收原子的电子结构信息,特别是对化合价态、配位体类型以及配位环境十分敏感[3]。例如,与土壤相关的不同磷酸盐显示出有区别的XAFS光谱特征:Fe-磷酸盐的磷K边XANES光谱的特征在相对能量-3 eV附近的独特边前特征,随着矿物结晶度的增加其强度增加,但是吸附在针铁矿上的磷酸盐吸收峰非常弱;Ca-磷酸盐的光谱在吸收边的高能侧显示出明显的肩峰;磷酸铝的光谱在相对能量-1 eV时具有弱的边前特征[62]。
8.2 磷在不同矿物组分上的吸附分配研究由于不同的磷酸盐样品,其磷K边XANES光谱差异较大,利用磷K边XANES可定量分析磷在矿物组分上的吸附分配。Khare等[63]根据XANES谱的边前峰特征,判定磷酸根在水铁矿表面形成内圈络合物;线性叠加拟合(LCF)分析表明在水铁矿-勃姆石混合体系中59%~97%的磷酸根吸附在水铁矿表面,随着磷酸根吸附量的增加,吸附在水铁矿组分上的量呈线性增加;在较低磷酸根吸附量(0.1 mol·kg-1)时,磷优先吸附于水铁矿表面;吸附量(0.2~0.6 mol·kg-1)适中条件下,磷酸根在矿物表面的吸附没有偏好;在较高磷酸根吸附量(1.3 mol·kg-1)时,可能形成磷酸铝表面沉淀[63]。XANES分析表明,在相同条件下分别培养的针铁矿-勃姆石、水铁矿-无定形氢氧化铝混合体系中,磷吸附达到饱和之后,磷更倾向于与铝结合[64]。在勃姆石和无定形氢氧化铝单一矿物体系中,存在表面吸附与表面沉淀两种固磷机制;但在针铁矿或水铁矿单一体系中,磷酸根在矿物表面形成内圈络合物,不形成表面沉淀。吸附等温线和XANES分析见证在勃姆石和针铁矿混合体系中,同样形成磷酸铝表面沉淀,说明勃姆石和针铁矿间的相互作用对磷酸根吸附的影响很小;但是,在水铁矿-无定形氢氧化铝体系中没有发现磷酸盐沉淀,说明该体系中矿物间的相互作用抑制磷酸盐的沉淀[64]。此外,磷K边XANES光谱可区分磷在不同Al/Fe比例氢氧化物共沉物表面的分布:对于Al/Fe比例较低(Al/Fe= 0.2,0.5)的样品,磷酸根优先与Al结合。但对于Al/Fe比例较高(Al/Fe= 0.75)的样品,磷酸根的吸附没有偏向[65]。XANES分析表明,在水铁矿-方解石混合体系中(pH 8~9.5),磷优先吸附在水铁矿表面,可能是由于水铁矿OH表面位点浓度高于方解石。在水铁矿单一体系和水铁矿-方解石混合体系中,磷酸根在水铁矿表面均形成双齿双核内圈表面络合物[66]。XANES研究表明磷在水铁矿改性硅藻土上吸附过程中,化学吸附与物理吸附同时发生。磷酸根的化学吸附发生在水铁矿改性硅藻土体相中(在距表层50 nm和5 μm之间),而物理吸附发生在表层50 nm的区域[67]。XANES分析还表明pH为4、6和8条件下,磷酸盐在水铁矿-勃姆石单一矿物质和混合物表面主要形成双齿双核络合物;当柠檬酸添加到吸附磷的水铁矿-勃姆石混合物中(pH 4和6),磷酸盐优先从勃姆石表面释放出来,再次吸附到水铁矿上,并沉淀形成非晶态FePO4矿物;在碱性pH下的趋势相反[68]。可见,磷酸根的吸附分配受混合矿物的组成、不同矿物的比例、吸附量和pH等因素的影响。
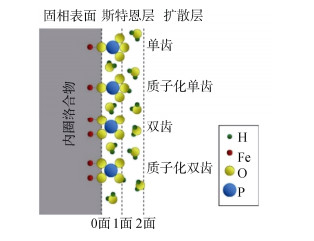
8.3 磷在矿物表面吸附的分子机制研究磷K边XANES/EXAFS可定性分析磷在矿物表面的配位机制、磷酸根的吸附-沉淀转化。磷K边EXAFS分析表明,pH 4.5条件下,磷酸根在针铁矿-水界面处形成双齿单核、双齿双核和单齿单核表面络合物,不同表面络合物的比例受磷酸根表面负荷影响(图 2)。观察到P-O间距是1.51~1.53 Å,双齿双核的P-Fe间距是3.2~3.3 Å,单核表面络合物的P-Fe间距是3.6 Å。最短的P-Fe间距是2.83~2.87 Å,表明是双齿单核键合构型[16]。此外,磷K边EXAFS光谱表明,在实验条件下(pH在3.0、4.5和6.0,反应时间5 d和18 d),形成单齿表面络合物是磷酸根吸附在针铁矿表面的主要机制,此外也可能形成磷酸盐的表面沉淀。反应时间对P-Fe距离的影响较pH变化的影响更显著。磷酸根和针铁矿之间的反应时间越长,表面络合物的P-Fe距离越短[69]。XANES以及分子轨道计算表明,磷酸根主要以双齿双核络合物形式吸附在水铁矿表面(pH 6;吸附量为0.75 mol·kg-1)[70]。最近,磷和铁K边XANES结合d-PDF、ATR-FTIR及同步辐射X射线衍射(XRD)等技术综合表明随着磷酸根和植酸吸附量的增加,吸附机制由双齿双核表面配位物向三元配位、以及无定形磷酸铁和无定形植酸铁沉淀过渡[71]。在一定的磷吸附量下,磷酸根较植酸更容易形成表面沉淀。磷酸根和植酸均能强烈地促进水铁矿的溶解,且植酸的促进效应更显著。此外,无定形磷酸铁和无定形植酸铁具有相似的PO4局部配位环境[71]。
|
图 2 基于P-EXAFS数据提出的磷酸根在针铁矿表面吸附模型[16] Fig. 2 Conceptual model depicting adsorption of phosphate on surface of goethite based on P-EXAFS data[16] |
表面络合模型(Surface Complexation Model,SCM)是一类使用平衡吸附数据在分子水平描述双电层的化学模型[2]。具体而言,SCM是建立在热力学和表面配位理论基础上的,其基本原理是将矿物,如金属(氢)氧化物的表面作为一种带有许多羟基的吸附剂,表面羟基可发生质子迁移和键合离子(如磷酸根)而生成表面络合物,采用表面活性位点与吸附质之间发生的络合反应来描述吸附过程。表面络合模型已广泛用于实验和现场条件下预测磷酸根的吸附行为。常见的SCM有恒电容模型(Constant Capacitance Model,CCM)、三层模型(Triple Layer Model,TLM)、扩散层模型(Diffusion Layer Model,DLM)和电荷分布-多点络合模型(Charge Distribution and Multisite Surface Complexation,CD-MUSIC)等等。CD-MUSIC模型从氧化物晶体形貌学角度考虑表面吸附位点的异质性和多样性,吸附离子在表面双电层中空间分布、中心原子对相邻电层氧原子电荷中和的贡献[72]。
9.2 表面络合模型定量描述磷的吸附Goldberg和Sposito[73]使用CCM模型描述磷在氧化铝和氧化铁表面上的吸附;假设在矿物表面上形成内圈表面络合物,磷在氧化铝和氧化铁上的吸附边和吸附等温线能够很好地模拟,两种矿物具有相近的质子化-解离常数和表面络合常数。借助计算机软件FITEQL、CCM模型可模拟针铁矿表面磷的吸附行为,阐明pH相关的内圈吸附机制[74]。三层模型可描述水钠锰矿表面磷酸根的吸附,仅考虑内圈表面络合物,显著高估了pH < 7时的总磷吸附。当假设外圈表面络合物存在时,模型能够很好地模拟离子强度0.7 mol·L-1NaCl条件下的吸附行为[75]。
CD-MUSIC模型可描述针铁矿的表面电荷特性,以及对浓度、pH和盐的依赖性,ζ电位和IEP以及OH/P交换率等特性,并可很好地描述表面所吸附磷的形态[12]。假定存在三种内圈表面络合物,即单齿非质子化、双齿非质子化和双齿质子化络合物,CD-MUSIC模型能够很好模拟针铁矿对磷酸根的吸附[76]。
CD-MUSIC模型研究表明单配位羟基在水铁矿表面占优势,并存在两种构型,它们分别通过共边和共双角形成双齿络合物,可对酸根等离子的吸附作出不同的响应[77]。结合已有的光谱数据和分子信息,用CD-MUSIC模型分析并描述在系列pH和离子强度范围内,磷酸根在水铁矿表面的吸附过程及机制,发现质子化和非质子化双齿表面配合物是主要的配位形态(图 3)[27]。
|
图 3 磷酸根在水铁矿表面形成内圈络合物[27] Fig. 3 Inner-sphere phosphate complexes formed on the surface of ferrihydrite[27] |
在模型中设置强吸附位点和弱吸附位点,使用 > CaPO4CaO0和 > CaHPO4Ca+或 > CaHPO4-作为表面吸附形态,恒定电容模型可以很好地模拟磷酸根在方解石上的吸附[78]。进一步的研究表明,CD-MUSIC模型能够模拟磷酸根和砷酸根在方解石表面的吸附,磷酸根在方解石表面主要形成单齿单核、单齿双核和双齿双核三种配位方式;结合单体系的模型,CD-MUSIC可以预测磷酸根和砷酸根在方解石上的竞争吸附[79]。
模型研究表明共存的阳离子或天然有机质等影响磷酸根在矿物表面的吸附[80-82]。Rietra等[80]运用了CD-MUSIC模型研究了针铁矿上Ca2+和磷酸根吸附的相互作用,研究表明,从单一体系中获得的静电参数来预测Ca2+和磷酸根吸附的相互作用依然是可行的。HA和FA在与针铁矿表面的磷酸根相互作用方面存在非常明显的差异,HA与针铁矿强烈结合,但不会强烈地影响磷酸根的吸附;而FA与矿物表面的结合不太强烈,但对磷酸根的吸附具有非常大的影响[81]。HA或FA与针铁矿表面上的磷酸盐之间的相互作用主要是静电效应。FA空间位置更接近氧化物表面,对磷酸根吸附的影响更大,因此吸附的FA与磷酸根之间的静电相互作用较HA颗粒强得多[81]。
近年来,配位电荷分布模型(LCD)也用于土壤中可溶性磷的模拟。模型计算表明吸附是控制溶解性磷酸根浓度的主要机制,吸附受NOM和多价阳离子的影响;NOM通过竞争吸附作用增加了溶解性磷酸根的浓度,而多价阳离子(Al3+/Ca2+)通过协同效应增加了磷酸根的吸附[83]。随着土壤中铝(氢)氧化物占铝和铁(氢)氧化物总量的比例增加,磷酸盐吸附的差异变得更大;当氧化铝占土壤氧化物的40%以上时,土壤的吸附行为与纯氧化铝相似[84]。
总之,表面络合模型促进了对磷酸根表面形态的定量认识,但是也需要结合光谱技术揭示的表面存在形态,这样模拟得到的形态定量数据以及亲和力等参数才有意义,并反映真实情况。
10 量子化学计算近年来,量子化学计算,比如密度泛函理论(Density Function Theory,DFT)常常作为光谱手段的补充甚至作为主要方法来研究磷酸根在矿物表面的配位机制。通过量子化学计算可以建立一些与表面配合物相似的分子团簇,计算出这些分子团簇的理论谱图,通过与实验谱图对比,获取结构信息[3, 85]。
使用DFT簇计算研究Cu(Ⅱ)和磷酸根在γ-Al2O3表面的吸附。在pH 5.5时,形成B型Cu(Ⅱ)-磷酸-γ-Al2O3三元表面络合物[86]。量子化学计算用于估计不同模拟pH条件下磷酸盐在铁氧化物表面吸附的相对吉布斯自由能。酸性pH条件下,双齿双核表面络合物代表热力学最有利的吸附模式,吸附能为-94.4 kJ·mol-1[87]。用基于密度泛函理论的量子化学计算不同pH下三水铝石表面的磷酸盐络合物形态,理论结果表明磷酸表面络合物在酸性pH下热力学反应更有利,与实验结果一致[88]。
应用DFT计算发现在pH 4~6,磷酸根在氧化铁表面的吸附模式以双质子化双齿双核为主;在中性条件(pH 7.5),吸附磷酸根的构型可能是质子化单齿单核也可能是脱质子化双齿双核;在碱性条件(pH 12.3),脱质子化的单齿单核结构占主导地位[89]。然而,也有研究发现在低吸附密度(≤1.5 μmol·m-2)条件下,在很宽的pH范围内非质子化双齿络合物占主导地位;在低pH和高吸附密度时,主要形成单质子化单齿络合物;双质子化双齿和单齿表面络合物和非质子化单齿络合物不是重要的吸附形态[90]。另有研究表明,磷酸根在针铁矿的不同晶面形成单齿和双齿构型的相对稳定性随着针铁矿表面的变化而变化,磷酸根在针铁矿表面形成各种表面络合物,取决于矿物性质(所暴露的晶面)和溶液pH[13]。
光谱/波谱等方法联合量子化学计算,有助于从不同视角揭示磷酸根在矿物表面的吸附机制。31P NMR研究表明磷酸根在刚玉表面形成内圈络合物,还形成少量磷酸铝表面沉淀。31P{27Al}双共振技术分析结合基于DFT的量子化学计算确定磷酸根在矿物表面形成双齿双核表面络合物,ATR-FTIR光谱进一步表明在pH 5,形成非质子化双齿和单质子化双齿表面络合物;在pH 9,形成双齿表面络合物[15]。此外,EXAFS、ATR-FTIR、DFT和化学平衡模型研究表明,表面络合是磷酸根在镧基材料上吸附的主要机制,配位形式受pH影响[91]。
11 总结及展望不同分析技术或方法可从不同视角分析磷酸根在矿物表面的吸附机制。由于研究技术的差异或局限性,不同反应体系的吸附机制有些差异或不一致。在磷酸根吸附机制方面,国内学者整体水平在逐步提高,在某些研究方面达到国际水平。为了进一步深入认识磷酸根的吸附机制,还需从以下几个方面加强研究。
1) 进一步加强吸附历程(不同吸附阶段)的速率及机制研究。进一步深入定量分析磷酸根在矿物表面的结合形态。譬如分析磷酸根在矿物表面由单齿向双齿配位以及表面沉淀形态的过渡及转化规律。
2) 深入探讨磷酸根在弱晶质与晶质矿物体系的吸附差异,单一矿物、多相与真实环境体系的吸附差异。明确随着介质条件的变化,磷酸根吸附形态的改变,以及反应条件与产物的对应关系。
3) 加强对吸附与沉淀反应的界定与区分,明确两者在不同体系的差异。利用显微技术及光谱技术区分吸附与沉淀,并区分沉淀物的类型。同时,还需要开发新的表面吸附模型,以分析包括表面沉淀形态在内的各种形态磷酸根的相对比例。
4) 结合不同技术的优势,进一步加强量子化学计算、模型等理论手段与光谱技术的结合,并探讨复杂环境条件下的吸附机制,以更真实地模拟吸附行为、反映真实环境。
| [1] |
Goldberg S, Sposito G. On the mechanism of specific phosphate adsorption by hydroxylated mineral surfaces:A review . Communications in Soil Science and Plant Analysis, 1985, 16(8): 801-821. DOI:10.1080/00103628509367646
(  0) 0) |
| [2] |
Arai Y, Sparks D L. Phosphate reaction dynamics in soils and soil components:A multiscale approach . Advances in Agronomy, 2007, 94: 135-179. DOI:10.1016/S0065-2113(06)94003-6
(  0) 0) |
| [3] |
李伟, 罗磊, 张淑贞. 应用先进光谱技术研究无机离子的环境界面化学. 化学进展, 2011, 23(12): 2576-2587. Li W, Luo L, Zhang S Z. Towards a molecular scale understanding of the chemistry of inorganic ions at environmental interfaces:Application of spectroscopic techniques (In Chinese). Progress in Chemistry, 2011, 23(12): 2576-2587. (  0) 0) |
| [4] |
Rajan S S S. Adsorption of divalent phosphate on hydrous aluminum oxide . Nature, 1975, 253(5491): 434-436. DOI:10.1038/253434a0
(  0) 0) |
| [5] |
Rajan S S S. Changes in net surface-charge of hydrous alumina with phosphate adsorption . Nature, 1976, 262(5563): 45-46. DOI:10.1038/262045a0
(  0) 0) |
| [6] |
Atkinson R J, Parfitt R L, Smart R S C. Infrared study of phosphate adsorption on goethite . Journal of the Chemical Society, Faraday Transactions 1:Physical Chemistry in Condensed Phases, 1974, 70: 1472-1479.
(  0) 0) |
| [7] |
Parfitt R L, Atkinson R J. Phosphate adsorption on goethite (α-FeOOH) . Nature, 1976, 264(5588): 740-742. DOI:10.1038/264740a0
(  0) 0) |
| [8] |
Bleam W F, Pfeffer P E, Goldberg S, et al. A 31P solid-state nuclear magnetic resonance study of phosphate adsorption at the boehmite/aqueous solution . Langmuir, 1991, 7(8): 1702-1712. DOI:10.1021/la00056a023
(  0) 0) |
| [9] |
Lookman R, Grobet P, Merckx R, et al. Phosphate sorption by synthetic amorphous aluminum hydroxides:A 27Al and 31P solid-state MAS NMR spectroscopy study . European Journal of Soil Science, 1994, 45(1): 37-44. DOI:10.1111/j.1365-2389.1994.tb00484.x
(  0) 0) |
| [10] |
Lookman R, Grobet P, Merckx R, et al. Application of 31P and 27Al MAS NMR for phosphate speciation studies in soil and aluminium hydroxides:Promises and constraints . Geoderma, 1997, 80(3/4): 369-388.
(  0) 0) |
| [11] |
Tejedor-Tejedor M I, Anderson M A. Protonation of phosphate on the surface of goethite as studied by CIR-FTIR and electrophoretic mobility . Langmuir, 1990, 6(3): 602-611.
(  0) 0) |
| [12] |
Hiemstra T, van Riemsdijk W H. A surface structural approach to ion adsorption:The charge distribution (CD) model . Journal of Colloid and Interface Science, 1996, 179(2): 488-508. DOI:10.1006/jcis.1996.0242
(  0) 0) |
| [13] |
Kubicki J D, Paul K W, Kabalan L, et al. ATR-FTIR and density functional theory study of the structures, energetics, and vibrational spectra of phosphate adsorbed onto goethite . Langmuir, 2012, 28(41): 14573-14587. DOI:10.1021/la303111a
(  0) 0) |
| [14] |
Wang L, Ruiz-Agudo E, Putnis C V, et al. Kinetics of calcium phosphate nucleation and growth on calcite:Implications for predicting the fate of dissolved phosphate species in alkaline soils . Environmental Science & Technology, 2012, 46(2): 834-842.
(  0) 0) |
| [15] |
Li W, Pierre-Louis A, Kwon K D, et al. Molecular level investigations of phosphate sorption on corundum (α-Al2O3) by 31P solid state NMR, ATR-FTIR and quantum chemical calculation . Geochimica et Cosmochimica Acta, 2013, 107: 252-266. DOI:10.1016/j.gca.2013.01.007
(  0) 0) |
| [16] |
Abdala D B, Northrup P A, Arai Y, et al. Surface loading effects on orthophosphate surface complexation at the goethite/water interface as examined by extended X-ray Absorption Fine Structure (EXAFS) spectroscopy . Journal of Colloid and Interface Science, 2015, 437: 297-303. DOI:10.1016/j.jcis.2014.09.057
(  0) 0) |
| [17] |
Liu F, Jie X L, Zhou D H, et al. Influence of pH on chemical forms of phosphate adsorbed on goethite surfaces . Pedosphere, 1995, 5(2): 157-162.
(  0) 0) |
| [18] |
刘凡, 介晓磊, 贺纪正, 等. 不同pH条件下针铁矿表面磷的配位形式及转化特点. 土壤学报, 1997, 34(4): 367-374. Liu F, Jie X L, He J Z, et al. Coordination forms and transformations of phosphate adsorbed by goethite surface on different pH (In Chinese). Acta Pedologica Sinica, 1997, 34(4): 367-374. DOI:10.3321/j.issn:0564-3929.1997.04.003 (  0) 0) |
| [19] |
Wang X, Li W, Harrington R, et al. Effect of ferrihydrite crystallite size on phosphate adsorption reactivity . Environmental Science & Technology, 2013, 47(18): 10322-10331.
(  0) 0) |
| [20] |
Wang X, Liu F, Tan W, et al. Characteristics of phosphate sorption-desorption onto ferrihydrite:Comparison with well-crystalline Fe (hydr) oxides . Soil Science, 2013, 178(1): 1-11.
(  0) 0) |
| [21] |
Wang L, Putnis C V, Ruiz-Agudo E, et al. In situ Imaging of Interfacial Precipitation of Phosphate on Goethite . Environmental Science & Technology, 2015, 49(7): 4184-4192.
(  0) 0) |
| [22] |
Zhong B, Stanforth R, Wu S N, et al. Proton interaction in phosphate adsorption onto goethite . Journal of Colloid and Interface Science, 2007, 308(1): 40-48. DOI:10.1016/j.jcis.2006.12.055
(  0) 0) |
| [23] |
Shang C, Stewart J W B, Huang P M. pH effects on kinetics of adsorption of organic and inorganic phosphates by short-range ordered aluminum and iron precipitates . Geoderma, 1992, 53(1/2): 1-14.
(  0) 0) |
| [24] |
Ryden J C, Syers J K. Charge relationships of phosphate sorption . Nature, 1975, 255(5503): 51-53. DOI:10.1038/255051a0
(  0) 0) |
| [25] |
Rietra R P J J, Hiemstra T, van Riemsdijk W H. The relationship between molecular structure and ion adsorption on variable charge minerals . Geochimica et Cosmochimica Acta, 1999, 63(19/20): 3009-3015.
(  0) 0) |
| [26] |
Ryden J C, Mclaughlin J R, Syers J K. Mechanisms of phosphate sorption by soils and hydrous ferric-oxide gel . Journal of Soil Science, 1977, 28(1): 72-92.
(  0) 0) |
| [27] |
Antelo J, Fiol S, Pérez C, et al. Analysis of phosphate adsorption onto ferrihydrite using the CD-MUSIC model . Journal of Colloid and Interface Science, 2010, 347(1): 112-119. DOI:10.1016/j.jcis.2010.03.020
(  0) 0) |
| [28] |
Rajan S S S, Perrott K W, Saunders W M H. Identification of phosphate-reactive sites of hydrous alumina from proton consumption during phosphate adsorption at constant pH values . Journal of Soil Science, 1974, 25(4): 438-447. DOI:10.1111/j.1365-2389.1974.tb01139.x
(  0) 0) |
| [29] |
Yan Y, Li W, Yang J, et al. Mechanism of myo-inositol hexakisphosphate sorption on amorphous aluminum hydroxide:Spectroscopic evidence for rapid surface precipitation . Environmental Science & Technology, 2014, 48(12): 6735-6742.
(  0) 0) |
| [30] |
Penn C J, Warren J G. Investigating phosphorus sorption onto kaolinite using isothermal titration calorimetry . Soil Science Society of America Journal, 2009, 73(2): 560-568. DOI:10.2136/sssaj2008.0198
(  0) 0) |
| [31] |
Penn C J, Zhang H. Isothermal titration calorimetry as an indicator of phosphorus sorption behavior . Soil Science Society of America Journal, 2010, 74(2): 502-511. DOI:10.2136/sssaj2009.0199
(  0) 0) |
| [32] |
Arai Y, Sparks D L. ATR-FTIR spectroscopic investigation on phosphate adsorption mechanisms at the ferrihydrite-water interface . Journal of Colloid and Interface Science, 2001, 241(2): 317-326. DOI:10.1006/jcis.2001.7773
(  0) 0) |
| [33] |
Hansmann D D, Anderson M A. Using electrophoresis in modeling sulfate, selenite, and phosphate adsorption onto goethite . Environmental Science & Technology, 1985, 19(6): 544-551.
(  0) 0) |
| [34] |
Li L, Stanforth R. Distinguishing adsorption and surface precipitation of phosphate on goethite (α-FeOOH) . Journal of Colloid and Interface Science, 2000, 230(1): 12-21. DOI:10.1006/jcis.2000.7072
(  0) 0) |
| [35] |
Ler A, Stanforth R. Evidence for surface precipitation of phosphate on goethite . Environmental Science & Technology, 2003, 37(12): 2694-2700.
(  0) 0) |
| [36] |
Wang L, Putnis C V, Hövelmann J, et al. Interfacial precipitation of phosphate on hematite and goethite . Minerals, 2018, 8(5): 207. DOI:10.3390/min8050207
(  0) 0) |
| [37] |
Dideriksen K, Stipp S L S. The adsorption of glyphosate and phosphate to goethite:A molecular-scale atomic force microscopy study . Geochimica et Cosmochimica Acta, 2003, 67(18): 3313-3327. DOI:10.1016/S0016-7037(02)01369-8
(  0) 0) |
| [38] |
Alvarez R, Fadley C S, Silva J A. Silicate and phosphate adsorption on gibbsite studied by X-ray photoelectron spectroscopy angular distributions . Soil Science Society of America Journal, 1980, 44(2): 422-425. DOI:10.2136/sssaj1980.03615995004400020043x
(  0) 0) |
| [39] |
Martine R R, Smart R S C. X-ray photoelectron studies of anion adsorption on goethite . Soil Science Society of America Journal, 1987, 51(1): 54-56. DOI:10.2136/sssaj1987.03615995005100010010x
(  0) 0) |
| [40] |
Mallet M, Barthélémy K, Ruby C, et al. Investigation of phosphate adsorption onto ferrihydrite by X-ray photoelectron spectroscopy . Journal of Colloid and Interface Science, 2013, 407: 95-101. DOI:10.1016/j.jcis.2013.06.049
(  0) 0) |
| [41] |
Martin R R, Smart R S C, Tazaki K. Direct observation of phosphate precipitation in the goethite/phosphate system . Soil Science Society of America Journal, 1988, 52(5): 1492-1500. DOI:10.2136/sssaj1988.03615995005200050054x
(  0) 0) |
| [42] |
Elzinga E J, Sparks D L. Phosphate adsorption onto hematite:An in-situ ATR-FTIR investigation of the effects of pH and loading level on the mode of phosphate surface complexation . Journal of Colloid and Interface Science, 2007, 308(1): 53-70. DOI:10.1016/j.jcis.2006.12.061
(  0) 0) |
| [43] |
Russell J D, Parfitt R L, Fraser A R, et al. Surface structures of gibbsite, goethite and phosphate goethite . Nature, 1974, 248: 220-221. DOI:10.1038/248220a0
(  0) 0) |
| [44] |
Parfitt R L, Atkinson R J, Smart R S C. The Mechanism of phosphate fixation by iron oxides . Soil Science Society of America Journal, 1975, 39(5): 837-841. DOI:10.2136/sssaj1975.03615995003900050017x
(  0) 0) |
| [45] |
Parfitt R L, Russell J D, Farmer V C. Confirmation of the surface structures of goethite (α-FeOOH) and phosphate goethite by infrared spectroscopy . Journal of the Chemical Society, Faraday Transactions 1:Physical Chemistry in Condensed Phases, 1976, 72: 1082-1087.
(  0) 0) |
| [46] |
Nanzyo M, Watanabe Y. Diffuse reflectance infrared spectra and ion-adsorption properties of the phosphate surface complex on goethite . Soil Science and Plant Nutrition, 1982, 28(3): 359-368. DOI:10.1080/00380768.1982.10433651
(  0) 0) |
| [47] |
Persson P, Nilsson N, Sjoberg S. Structure and bonding of orthophosphate ions at the iron oxide-aqueous interface . Journal of Colloid and Interface Science, 1996, 177(1): 263-275. DOI:10.1006/jcis.1996.0030
(  0) 0) |
| [48] |
Nanzyo M. Diffuse reflectance infrared spectra of phosphate sorbed on alumina gel . Journal of Soil Science, 1984, 35(1): 63-69.
(  0) 0) |
| [49] |
Laiti E, Persson P, Ohman L O. Surface complexation and precipitation at the H+-orthophosphate-aged γ-Al2O3/water interface . Langmuir, 1996, 12(12): 2969-2975. DOI:10.1021/la9515074
(  0) 0) |
| [50] |
Connor P A, McQuillan A J. Phosphate adsorption onto TiO2 from aqueous solutions: An in situ internal reflection infrared spectroscopic study . Langmuir, 1999, 15(8): 2916-2921. DOI:10.1021/la980894p
(  0) 0) |
| [51] |
Luengo C, Brigante M, Antelo J, et al. Kinetics of phosphate adsorption on goethite:Comparing batch adsorption and ATR-IR measurements . Journal of Colloid and Interface Science, 2006, 300(2): 511-518. DOI:10.1016/j.jcis.2006.04.015
(  0) 0) |
| [52] |
del Nero M, Galindo C, Barillon R, et al. Surface reactivity of α-Al2O3 and mechanisms of phosphate sorption:In situ ATR-FTIR spectroscopy and ζ potential studies . Journal of Colloid and Interface Science, 2010, 342(2): 437-444. DOI:10.1016/j.jcis.2009.10.057
(  0) 0) |
| [53] |
Johnson B B, Ivanov A V, Antzutkin O N, et al. 31P nuclear magnetic resonance study of the adsorption of phosphate and phenyl phosphates on γ-Al2O3 . Langmuir, 2002, 18(4): 1104-1111. DOI:10.1021/la001537t
(  0) 0) |
| [54] |
Kim Y, Kirkpatrick R. An investigation of phosphate adsorbed on aluminium oxyhydroxide and oxide phases by nuclear magnetic resonance . European Journal of Soil Science, 2004, 55(2): 243-251. DOI:10.1046/j.1365-2389.2004.00595.x
(  0) 0) |
| [55] |
van Emmerik T J, Sandstrom D E, Antzutkin O N, et al. 31P solid-state nuclear magnetic resonance study of the sorption of phosphate onto gibbsite and kaolinite . Langmuir, 2007, 23(6): 3205-3213. DOI:10.1021/la062765b
(  0) 0) |
| [56] |
Dithmer L, Lipton A S, Reitzel K, et al. Characterization of phosphate sequestration by a lanthanum modified bentonite clay:A solid-state NMR, EXAFS, and PXRD study . Environmental Science & Technology, 2015, 49(7): 4559-4566.
(  0) 0) |
| [57] |
Hinedi Z R, Goldberg S, Chang A C, et al. A 31P and 1H MAS NMR study of phosphate sorption onto calcium carbonate . Journal of Colloid and Interface Science, 1992, 152(1): 141-160. DOI:10.1016/0021-9797(92)90015-E
(  0) 0) |
| [58] |
Lookman R, Geerts H, Grobet P, et al. Phosphate speciation in excessively fertilized soil:A 31P and 27Al MAS NMR spectroscopy study . European Journal of Soil Science, 1996, 47(1): 125-130. DOI:10.1111/j.1365-2389.1996.tb01379.x
(  0) 0) |
| [59] |
Li W, Feng J, Kwon K D, et al. Surface speciation of phosphate on boehmite (γ-AlOOH) determined from NMR spectroscopy . Langmuir, 2010, 26(7): 4753-4761. DOI:10.1021/la903484m
(  0) 0) |
| [60] |
Li W, Feng X, Yan Y, et al. Solid-state NMR spectroscopic study of phosphate sorption mechanisms on aluminum (hydr) oxides . Environmental Science & Technology, 2013, 47(15): 8308-8315.
(  0) 0) |
| [61] |
Kim J, Li W, Phillips B L, et al. Phosphate adsorption on the iron oxyhydroxides goethite (α-FeOOH), akaganeite (β-FeOOH), and lepidocrocite (γ-FeOOH):A 31P NMR Study . Energy & Environmental Science, 2011, 4(10): 4298-4305.
(  0) 0) |
| [62] |
Hesterberg D L, Zhou W, Hutchison K J, et al. XAFS study of adsorbed and mineral forms of phosphate . Journal of Synchrotron Radiation, 1999, 6(3): 636-638. DOI:10.1107/S0909049599000370
(  0) 0) |
| [63] |
Khare N, Hesterberg D, Beauchemin S, et al. XANES determination of adsorbed phosphate distribution between ferrihydrite and boehmite in mixtures . Soil Science Society of America Journa, 2004, 68(2): 460-469. DOI:10.2136/sssaj2004.4600
(  0) 0) |
| [64] |
Khare N, Hesterberg D, Martin J D. XANES investigation of phosphate sorption in single and binary systems of iron and aluminum oxide minerals . Environmental Science & Technology, 2005, 39(7): 2152-2160.
(  0) 0) |
| [65] |
Liu Y, Hesterberg D. Phosphate bonding on noncrystalline Al/Fe-hydroxide coprecipitates . Environmental Science & Technology, 2011, 45(15): 6283-6289.
(  0) 0) |
| [66] |
Adam N. A wet-chemical and phosphorus K-edge X-ray absorption near edge structure investigation of phosphate adsorption on binary mixtures of ferrihydrite and calcite:Implications for phosphorus bioavailability . Soil Science Society of America Journal, 2017, 81(5): 1079-1087. DOI:10.2136/sssaj2016.10.0342
(  0) 0) |
| [67] |
Xiong W, Peng J, Hu Y. Use of X-ray absorption near edge structure (XANES) to identify physisorption and chemisorption of phosphate onto ferrihydrite-modified diatomite . Journal of Colloid and Interface Science, 2012, 368(1): 528-532. DOI:10.1016/j.jcis.2011.11.041
(  0) 0) |
| [68] |
Adam N. Phosphate Speciation under organic-acid-promoted dissolution of phosphorus-sorbed ferrihydrite- boehmite mixtures:Implications for soil phosphorus . Soil Science Society of America Journal, 2016, 80(4): 900-910. DOI:10.2136/sssaj2016.02.0024
(  0) 0) |
| [69] |
Abdala D B, Northrup P A, Vicentin F C, et al. Residence time and pH effects on the bonding configuration of orthophosphate surface complexes at the goethite/water interface as examined by Extended X-ray Absorption Fine Structure (EXAFS) spectroscopy . Journal of Colloid and Interface Science, 2015, 442: 15-21. DOI:10.1016/j.jcis.2014.11.048
(  0) 0) |
| [70] |
Khare N, Martin J D, Hesterberg D. Phosphate bonding configuration on ferrihydrite based on molecular orbital calculations and XANES fingerprinting . Geochimica et Cosmochimica Acta, 2007, 71(18): 4405-4415. DOI:10.1016/j.gca.2007.07.008
(  0) 0) |
| [71] |
Wang X, Hu Y, Tang Y, et al. Phosphate and phytate adsorption and precipitation on ferrihydrite surfaces . Environmental Science:Nano, 2017(11): 4:2193-2204.
(  0) 0) |
| [72] |
张佩.铝同晶替代对针铁矿吸附Pb (Ⅱ)的影响及其CD-MUSIC模拟.武汉: 华中农业大学, 2015. Zhang P. Effect of aluminum substitution on the Pb (Ⅱ) adsorption on goethite and CD-MUSIC modeling. Wuhan: Huazhong Agriculture University, 2015. (  0) 0) |
| [73] |
Goldberg S, Sposito G. A chemical model of phosphate adsorption by soils:1. Reference oxide minerals . Soil Science Society of America Journal, 1984, 48(4): 772-778. DOI:10.2136/sssaj1984.03615995004800040015x
(  0) 0) |
| [74] |
Nilsson N, Lövgren L, Sjöberg S. Phosphate complexation at the surface of goethite . Chemical Speciation & Bioavailability, 1992, 4(4): 121-130.
(  0) 0) |
| [75] |
Yao W, Millero F J. Adsorption of phosphate on manganese dioxide in sea water . Environmental Science & Technology, 1996, 30(2): 536-541.
(  0) 0) |
| [76] |
Antelo J, Avena M, Fiol S, et al. Effects of pH and ionic strength on the adsorption of phosphate and arsenate at the goethite-water interface . Journal of Colloid and Interface Science, 2005, 285(2): 476-486. DOI:10.1016/j.jcis.2004.12.032
(  0) 0) |
| [77] |
Hiemstra T, van Riemsdijk W H. A surface structural model for ferrihydrite Ⅰ:Sites related to primary charge, molar mass, and mass density . Geochimica et Cosmochimica Acta, 2009, 73(15): 4423-4436. DOI:10.1016/j.gca.2009.04.032
(  0) 0) |
| [78] |
Sø H U, Postma D, Jakobsen R, et al. Sorption of phosphate onto calcite; results from batch experiments and surface complexation modelling . Geochimica et Cosmochimica Acta, 2011, 75(10): 2911-2923. DOI:10.1016/j.gca.2011.02.031
(  0) 0) |
| [79] |
Sø H U, Postma D, Jakobsen R, et al. Competitive adsorption of arsenate and phosphate onto calcite; experimental results and modeling with CCM and CD-MUSIC . Geochimica et Cosmochimica Acta, 2012, 93: 1-13. DOI:10.1016/j.gca.2012.06.021
(  0) 0) |
| [80] |
Rietra R P J J, Hiemstra T, van Riemsdijk W H. Interaction between calcium and phosphate adsorption on goethite . Environmental Science & Technology, 2001, 35(16): 3369-3374.
(  0) 0) |
| [81] |
Weng L, van Riemsdijk W H, Hiemstra T. Humic nanoparticles at the oxide water interface:Interactions with phosphate ion adsorption . Environmental Science & Technology, 2008, 42(23): 8747-8752.
(  0) 0) |
| [82] |
Weng L, van Riemsdijk W H, Hiemstra T. Factors controlling phosphate interaction with iron oxides . Journal of Environmental Quality, 2012, 41(3): 628-635. DOI:10.2134/jeq2011.0250
(  0) 0) |
| [83] |
Weng L, Vega F A, van Riemsdijk W H. Competitive and synergistic effects in pH dependent phosphate adsorption in soils:LCD modeling . Environmental Science & Technology, 2011, 45(19): 8420-8428.
(  0) 0) |
| [84] |
Cui Y, Weng L. Arsenate and phosphate adsorption in relation to oxides composition in soils:LCD modeling . Environmental Science & Technology, 2013, 47(13): 7269-7276.
(  0) 0) |
| [85] |
Kubicki J D, Kwon K D, Paul K P, et al. Surface complex structures modelled with quantum chemical calculations:Carbonate, phosphate, sulphate, arsenate and arsenite . European Journal of Soil Science, 2007, 58(4): 932-944. DOI:10.1111/j.1365-2389.2007.00931.x
(  0) 0) |
| [86] |
Ren X, Yang S, Tan X, et al. Mutual effects of copper and phosphate on their interaction with γ-Al2O3:Combined batch macroscopic experiments with DFT calculations . Journal of Hazardous Materials, 2012, 237/238: 199-208. DOI:10.1016/j.jhazmat.2012.08.032
(  0) 0) |
| [87] |
Acelas N Y, Mejia S M, Mondragón F, et al. Density functional theory characterization of phosphate and sulfate adsorption on Fe-(hydr) oxide:Reactivity, pH effect, estimation of Gibbs free energies, and topological analysis of hydrogen bonds . Computational and Theoretical Chemistry, 2013, 1005: 16-24. DOI:10.1016/j.comptc.2012.11.002
(  0) 0) |
| [88] |
Luengo C V, Castellani N J, Ferullo R M. Quantum chemical study on surface complex structures of phosphate on gibbsite . Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2015, 147: 193-199. DOI:10.1016/j.saa.2015.03.013
(  0) 0) |
| [89] |
Kwon K D, Kubicki J D. Molecular orbital theory study on surface complex structures of phosphates to iron hydroxides:Calculation of vibrational frequencies and adsorption energies . Langmuir, 2004, 20(21): 9249-9254. DOI:10.1021/la0487444
(  0) 0) |
| [90] |
Rahnemaie R, Hiemstra T, van Riemsdijk W H. Geometry, charge distribution, and surface speciation of phosphate on goethite . Langmuir, 2007, 23(7): 3680-3689. DOI:10.1021/la062965n
(  0) 0) |
| [91] |
Fang F, Shi Q, Nguyen J, et al. Removal mechanisms of phosphate by lanthanum hydroxide nanorods:Investigations using EXAFS, ATR-FTIR, DFT, and surface complexation modeling approaches . Environmental Science & Technology, 2017, 51(21): 12377-12384.
(  0) 0) |
2. Soil and Fertilizer Institute, Anhui Academy of Agricultural Sciences, Hefei 230001, China
 2020, Vol. 57
2020, Vol. 57


