2. 浙江农林大学环境与资源学院,浙江临安 311300
反硝化作用是土壤氮素循环过程中的重要一环,是指反硝化微生物在厌氧的条件下,通过一系列的酶催化还原反应,先将转化为,然后再进一步转化为气态氮(NO,N2O,N2)的过程[1]。反硝化作用不仅会导致氮肥损失,造成严重的经济危害。同时反硝化作用过程释放的N2O是三大温室气体之一,其产生的温室效应约是CO2的300倍[2]。此外,N2O还会对臭氧层造成极大的破坏,增加皮肤癌的患病概率[3]。虽然硝化和反硝化过程均能产生N2O。但与硝化过程不同的是,N2O是反硝化过程中的必要产物,甚至是终产物[4],而且有大量研究表明亚热带酸性森林土壤中由反硝化作用产生的N2O大于硝化作用[5]。虽然反硝化微生物主要分布在水体、沉积物和土壤等环境[6],但由于土壤的环境更适合微生物生存,微生物多样性更为丰富,而且土壤中氮含量普遍较水体、沉积物高,因此,研究土壤微生物反硝化作用对于减少氮肥损失,降低N2O排放均有着重要的意义。
反硝化作用是一个由四步反应所构成的生物地球化学过程,包括还原、还原、NO还原和N2O还原。其每个步骤均由相应细菌的代谢合成酶催化完成。
| $ {\text{NO}}_3^ - \xrightarrow[{napA}]{{narG}}{\text{NO}}_2^ - \xrightarrow[{nirS}]{{nirK}}{\text{NO}}\xrightarrow{{norB}}{{\text{N}}_{\text{2}}}{\text{O}}\xrightarrow{{nosZ}}{{\text{N}}_{\text{2}}} $ |
其中,亚硝酸盐(NO2-)还原为NO的过程是反硝化过程中产生气体的关键步骤,这一步骤由两种不同类型的亚硝酸还原酶(Nir)催化,分别由nirK和nirS两种功能基因编码,两种基因功能相似,但分别属于不同的细菌菌株[7]。反硝化过程的最后一步则是nosZ基因编码的N2O还原酶将有害的N2O气体还原成无害的N2,在反硝化过程中具有重要意义。因此,许多研究者选择nirK、nirS以及nosZ编码基因作为研究反硝化过程的目标基因。
毛竹林土壤属于旱地土壤,虽然总体为好氧环境,但土壤中存在大小不等的孔隙,微小孔隙的局部环境也可能是厌氧的。故在此种土壤环境中也会有相应的反硝化过程存在。然而已有的大多数研究均围绕着不同树种森林[8]、沙漠[9]、草原[10]等其他生态系统展开。有关毛竹林反硝化过程微生物的变化情况少见报道。
毛竹是我国重要的经济和生态竹种,具有生长周期短、产量高、经济价值高等特点。为追求更高的经济效益,人们对原来以粗放经营为主的毛竹林进行了集约化经营。集约经营的主要措施有施肥、去除林下植被、翻耕等。这种集约经营模式虽然提高了毛竹的产量,但人为耕作导致水土流失加剧,使土壤出现不同程度的退化[11]。与此同时,长期集约经营降低了土壤微生物的活性[12],这也促使人们加大了对集约经营过程中土壤微生物相关生态变化的关注[13-15]。然而,与碳氮循环密切相关的反硝化微生物的研究少见报道。许多研究证明氮肥施用后因硝化作用产生大量N2O[16],集约经营毛竹林土壤是否存在反硝化微生物?是否也会导致排放N2O等问题值得探索。本文以nirK、nirS和nosZ 3个基因为研究对象,运用定量PCR的方法初步探究集约经营过程中毛竹林土壤3种功能基因丰度的变化,研究结果对毛竹林经营管理具有重要指导意义。
1 材料与方法 1.1 研究区概况研究区遂昌县位于浙江省西南部(28°13′—18°49′N,118°41′—119°30′E)。属中亚热带季风类型,全年平均气温16.8 ℃,年降水量1 510 mm,降水天数172 d,年无霜期251 d。土壤母岩为由花岗岩变质而成的片麻岩石,土层厚度大于1 m,坡度为20°~25°。毛竹密度约为1 800株·hm-2,1989年之前为竹林开发阶段,仅开垦、劈山,不施肥。该阶段毛竹林下主要有9种植被,其中狗脊蕨(Woodwardia japonica)和兔儿伞(Syneilesis aconitifolia)盖度为90%。1989—2000年施肥方法为:大年(留养新竹年)6月在每株毛竹的上方开环形沟,施用尿素(或碳铵)450 kg·hm-2; 2000—2010年施用配方肥,每年用量为尿素450 kg·hm-2、过磷酸钙380 kg·hm-2、氯化钾75 kg·hm-2; 2010年之后每年施用毛竹专用肥(福建中化生产)750 kg·hm-2和尿素450 kg·hm-2。集约经营过程毛竹林下基本无灌木杂草,毛竹平均密度约3 250株·hm-2。
1.2 样品采集与处理于2013年9月按照生态控制原则,选择生长历史一致但集约经营时间不同的毛竹林,采用随机取样法采集不同经营年限毛竹林表层(0~20 cm)和亚表层(20~40 cm)的土壤样品。该毛竹林地均位于同一山头,并由同一农户经营,采取的施肥管理措施也均一致。集约经营的时间分别为:0 a(对照组)、10 a、15 a、20 a和25 a。每个年份分别选择3个样地,即3个重复,每个样地采用S型取样法选取5个样品点就地混合为一个样品,分别采集表层(0~20 cm)、亚表层(20~40 cm)的土样,过筛(2 mm)后装入密封袋,将样品放入冰盒带回实验室。样品共分为2份,1份放入-70℃冰箱,经冷冻干燥后,提取土壤细菌总DNA,用于分子生物学分析; 另一份于室内自然风干,充分研磨过筛后用于土壤基本理化性质的测定。
1.3 分析方法土壤理化性质分析:土壤理化性质分析方法参考《土壤农化分析》[17]。土壤pH采用酸度计测定,土水比为2.5︰1;有机碳含量采用重铬酸钾-浓硫酸油浴外加热法测定; 土壤全氮含量采用半微量凯式滴定法测定; 碱解氮含量采用碱解扩散法测定; 有效磷含量采用盐酸-氟化铵溶液浸提,钼锑抗比色法测定; 速效钾含量采用醋酸铵提取,火焰光度计测定; 硝态氮含量采用氯化钾浸提,紫外分光光度计测定; 铵态氮含量采用氯化钾浸提,靛酚蓝比色法测定。
土壤总DNA提取:采用Power Soil DNA Isolation Kit试剂盒提取土壤总DNA。称取0.50 g保存于-70 ℃冰箱,经冷冻干燥后,按试剂盒说明书进行提取。DNA提取成功后经1%(m/v)的琼脂糖凝胶电泳检测DNA片段大小,并用微量分光光度计检测其浓度和纯度。提取后的DNA样品保存于-40℃。
土壤反硝化细菌质粒制备:以土壤样品DNA为模板分别对nirK、nirS、nosZ三种功能基因进行PCR扩增,扩增条件如表 1所示。PCR产物用纯化试剂盒(Takara)纯化后与PEASY-T3 Vector(全式金生物技术公司,北京)连接,然后将连接产物转化到Trans1-T1感受态细胞中,并涂在含有X-gal、IPTG和Amp的LB琼脂平板上进行蓝白斑筛选,用菌落PCR方法检测阳性克隆子。对阳性克隆子用LB液体培养基继续培养,最后用质粒抽提试剂盒提取质粒。
|
|
表 1 聚合酶链式反应中的引物及反应条件 Table 1 Primers and PCR condition used for the PCR amplification |
土壤反硝化细菌相关功能基因荧光定量PCR:采用引物FlaCu:R3Cu、Cd3aF:R3cd、Lb:Rb分别对nirK、nirS、nosZ三种功能基因进行基因片段扩增,定量PCR在荧光实时定量PCR仪(Bio-Red, USA)上进行。反应体系为20 μL,反应体系如下:2×Premix Ex Taq 10 μL,50 μmoL·L-1上游和下游引物各0.2 μL,模板DNA1.0 μL,无菌双蒸水8.6 μL。三种功能基因荧光定量PCR条件相同,均为:95℃预变性3 min,95℃变性10 s,56 ℃退火30 s,72℃延伸20 s,35个循环,溶解曲线过程(65℃至95℃,0.5℃·5 s-1)。标准曲线制作:三种功能基因质粒DNA经Nanodrop®ND-1000测定,nirK、nirS和nosZ基因重组质粒浓度分别为105.6、102.5、135.2 ng·μL-1,计算其拷贝数分别为2.74×1010、2.70×1010、3.74×1010 copies·μL-1,以10倍梯度对重组质粒进行梯度稀释(10-3~10-8),每个梯度3次重复,nirK、nirS和nosZ决定系数(R2)分别为0.995、0.998和0.999。
1.4 数据处理采用Microsoft Excel 2016软件对数据进行处理,采用Origin 7.5软件作图,采用SPSS 21.0软件对数据进行分析,采用单因素方差分析(One-way ANOVA)和最小显著差数(LSD)法进行显著性和多重比较(α=0.05),采用皮尔逊(Pearson)法进行相关性分析。通过Canoco 4.5结合环境因子分析微生物功能基因丰度的变化。
2 结果 2.1 集约经营毛竹林土壤理化性质有关毛竹集约经营土壤理化性质变化已有报道[15]。简要概括:毛竹集约经营过程中土壤理化性质变化,表层土壤pH呈下降趋势; 有机碳、全氮含量于经营10 a达到最大(P < 0.05),其余年份无显著差异; 碱解氮呈现先上升再下降后又上升的波动变化规律; 碳氮比经营初期缓慢上升,15 a时达到最大,20 a显著下降(P < 0.05); 有效磷和速效钾总体呈上升趋势; 硝态氮出现先减少后增加的变化规律,而铵态氮在整个经营过程中变化不大。
与表层土壤不同的是,集约经营前期亚表层毛竹土壤pH没有发生明显变化,而在第25年时显著下降0.42个pH单位(P < 0.05); 全氮和碱解氮均在经营25 a之后显著增加(P < 0.05); 有机碳含量在经营10 a和25 a显著增加(P < 0.05),而在经营20 a显著下降(P < 0.05)。其余理化因子变化与表层相同。
2.2 集约经营对毛竹林土壤反硝化细菌功能基因丰度的影响采用荧光实时定量PCR分析集约经营毛竹林土壤反硝化细菌丰度结果表明,nirK基因数量在2.62×107~1.28×108 copies·g-1干土之间,随着集约经营时间的持续,表层土壤nirK基因数量呈现周期性波动态势(图 1A),上升过程发生在集约经营10 a和20 a的2个时间,其基因丰度显著大于其他年份(P < 0.05),集约经营15年时丰度达到最低值,显著小于其他年份(P < 0.05),第25年时的基因丰度与对照组无显著性差异。而亚表层土壤的nirK丰度变化呈V字型,集约经营15 a时才开始下降、20 a时达到低谷,土壤nirK基因数量在15 a和20 a分别较对照下降43%和63%(P < 0.05),25 a时又恢复至对照水平,集约经营10 a和25 a与对照无显著性差异。nirS基因数量在1.45×106~4.96×107 copies·g-1干土之间,总体低于nirK基因。表层土壤基因数量在集约经营10 a显著上升41%(P < 0.05),之后一直保持较高的水平(图 1B),说明集约经营促进表层土壤中携带nirS基因微生物的繁殖。土壤亚表层nirS基因数量则在前20 a的集约经营过程中呈下降趋势,第20年最大下降幅度为63%,而第25年则恢复到对照水平。nosZ基因数量在3.81×107~3.03×108 copies·g-1干土之间。表层土壤基因丰度在集约经营10 a明显增加,第15年时开始下降,集约经营20 a较对照低70%,之后则变化不大(P > 0.05)。亚表层土壤nosZ基因丰度前10年变化不大(图 1C),第15年和20年分别降低34%和48%,显著低于对照和10 a土壤(P < 0.05),第25年时nosZ基因丰度恢复、且数量显著高于对照(增加35%,P < 0.05)。集约经营过程中表层土壤的(nirK+nirS)/nosZ比率为0.34~1.08,在亚表层为1.63~2.27。表层(nirK+nirS)/nosZ的比率在集约经营20 a显著增加,而亚表层中显著降低。
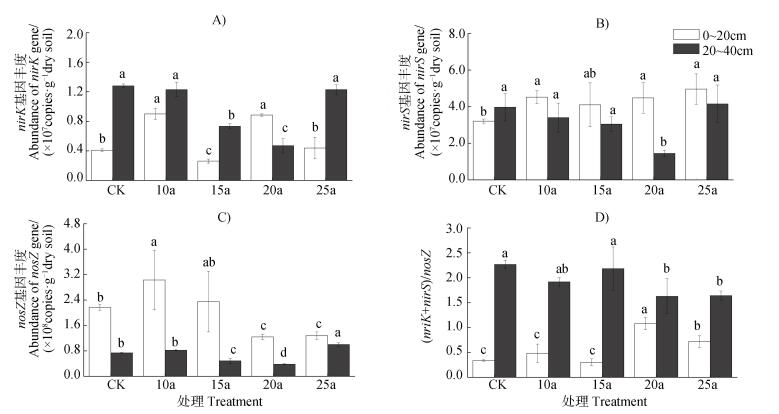
|
注:不同字母表示同一土层不同处理间差异显著。 Note:Surface soil and subsurface soils are marked separately for significance level. 图 1 长期集约经营毛竹林土壤反硝化细菌nirK、nirS、nosZ功能基因丰度 Fig. 1 Abundance of nirK, nirS, nosZ genes in the soils of the moso bamboo plantations under long-term intensive management |
集约经营主要通过土壤性质的改变来影响土壤微生物。为揭示土壤性质对反硝化细菌丰度的影响,将表层与亚表层土壤的三个功能基因的丰度分别与对应的土壤理化性质进行相关性分析,结果如表 2所示。在表层土壤中,nirK基因数量与全氮呈显著正相关(P < 0.05),nirS基因与有效磷呈显著正相关(P < 0.05),而nosZ基因则与有机碳和碳氮比呈显著正相关(P < 0.05)、与速效钾和硝态氮含量呈显著负相关(P < 0.05),说明影响表层土壤三个功能基因丰度的主要因素并不一致。作为N2O排放量指标[21]的(nirK+nirS)/nosZ比值与碳氮比呈显著负相关(P < 0.05)、与速效钾和硝态氮呈显著正相关(P < 0.05)。在亚表层土壤中,三种功能基因均与有机碳呈显著正相关(P < 0.05),nosZ基因还与全氮和碱解氮含量呈显著正相关(P < 0.05)。(nirK+nirS)/ nosZ的比值与硝态氮呈显著负相关(P < 0.05)。
|
|
表 2 毛竹林土壤反硝化功能基因与环境参数之间的皮尔逊相关系数 Table 2 Pearson's correlations(r)between denitrifying functional gene abundance and environmental parameters in the moso bamboo plantation |
为了进一步揭示集约经营过程中土壤性质对反硝化功能基因丰度变化的影响,将表层以及亚表层土壤的反硝化功能基因丰度分别与对应土层的理化性质作为两组变量进行冗余分析(RDA,Redundancy analysis)。根据蒙特卡洛检验,选取影响较大的4个环境因子分析结果表明,表层土壤中第一排序轴和第二排序轴分别解释了25.8%和23.6%的变异(图 2A),第一排序轴将CK和10年样品与20年和25年样品很好地区分开来,而15年样品则在第二坐标轴附近,说明集约经营过程中土壤反硝化功能基因丰度变化分为三个阶段。第一排序轴与碳氮比呈正相关、与硝态氮和速效钾呈负相关,第二排序轴与全氮呈负相关。土壤硝态氮(F=3.855,P= 0.024)、碳氮比(F=3.832,P=0.022)、速效钾(F=2.844,P=0.050)对土壤反硝化细菌功能基因丰度的影响均达显著水平,而全氮(F=2.646,P=0.054)则接近显著水平。进一步分析可得,硝态氮和速效钾对20年和25年样地反硝化细菌影响最大。nirK与全氮呈显著正相关,nosZ与硝态氮和速效钾呈显著负相关,这与相关性分析结果相同。
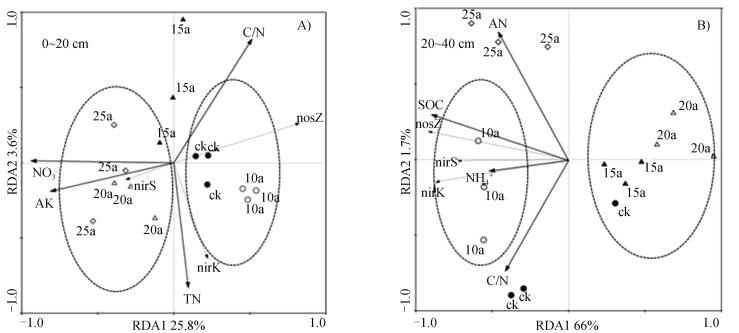
|
注:AK:速效钾; TN:全氮; AN:碱解氮; SOC:土壤有机碳。 Note: AK: Available K: TN: Total N: AN: Alkalytic N: SOC:Soil organic carbon. 图 2 集约经营毛竹林土壤反硝化功能基因丰度与环境参数的冗余分析 Fig. 2 Redundancy analysis of abundance of denitrifying functional genes and environmental parameters in soils of the moso bamboo plantation under intensive management |
根据蒙特卡洛检验,选取亚表层土壤中影响较大的4个环境因子分析结果表明,第一排序轴和第二排序轴分别解释了66%和1.7%的变异,第一排序轴上三个功能基因与有机碳相关性很强(图 2B)。不同集约经营时间的土壤均聚焦在一起(一个对照重复外),但分组情况与表层土壤不同,15年和20年聚在一组、位于第一排序轴正值区,其他3个年份组位于第一排序轴的负值区,且25年又与CK和10年在第二排序轴分开。说明集约经营时间对3个反硝化功能基因影响显著,其中影响最大是有机碳和铵态氮,与第一排序轴呈负相关,有机碳(F=14.717,P=0.002)达到显著水平,而铵态氮(F=2.795,P=0.092)则没有; 其次为碱解氮和碳氮比,分别与第二排序轴呈正相关和负相关,但均未达到显著水平(碱解氮F=2.315,P=0.114、碳氮比F=1.811,P=0.181)。进一步分析发现,碱解氮对集约经营25年样地有积极影响,有机质与3种功能基因均呈显著正相关,全氮和碱解氮与nosZ功能基因呈正相关。
3 讨论前人的研究结果证明,影响土壤反硝化作用的因素比较多,而且各因素之间互为影响,主要影响因子包括速效氮、有机碳、土壤水分、温度、pH以及土壤质地等[22]。理论推测以及研究证明,单因素的速效氮[23]、有机碳[24]、土壤水分[23]、温度[25]、pH[26]与反硝化作用均有正相关关系,而自然或人为耕作土壤的土壤性质变化不一致(不同步),因此,实际测量得到的反硝化基因丰度变化是多个因素综合作用的结果。由于不同因素的作用强度不同,正反作用可能会抵消、或者作用强的因子将弱的因子掩盖掉。
3.1 集约经营对毛竹林表层和亚表层反硝化基因的总体影响毛竹林土壤的反硝化基因nirK、nirS和nosZ丰度总体较报道的结果高(图 1),除旱地农田nirS外,水稻田、杉木林和旱地农田中的三种功能基因丰度均显著低于毛竹林或与毛竹林持平[27-29]。这表明毛竹林土壤含有更高的反硝化基因丰度,因此相比其他土地利用方式可能N2O排放量较高。集约经营措施主要措施有施肥、去除林下植被、翻耕等。由此,集约经营过程中土壤速效养分水平提高,土壤通气性增加,pH下降,有机碳含量不断波动。其中pH下降的原因在于集约经营过程中大量氮肥的施用,而有机碳含量不断变化的原因在于一方面集约经营初期施肥结合翻耕促进土壤中地下根鞭的分解,另一方面施肥促进毛竹生长,增加毛竹根系分泌物量,从而提高了土壤的有机质含量。而10年后不断翻耕施肥导致有机碳含量下降。25年有机质又有小幅回升,这可能与毛竹生产量提高后,枯落物和根系分泌物的增加有关。随着集约经营时间的增加,三种反硝化基因的变化表现出一定的规律性,无论是表层还是亚表层土壤,三种功能基因丰度在集约经营10年时增加或保持不变,说明在前10年期间毛竹林集约经营措施对反硝化细菌没有产生不良影响,有的还有促进作用。尽管有研究表明酸性范围内土壤pH越低,反硝化细菌丰度也会随之降低[26]。而在本研究中有机碳、全氮和碱解氮明显增加对反硝化作用的正作用抵消了pH下降的负面影响,从而掩盖了pH下降带来的不利影响。土壤硝态氮下降是反硝化作用增强导致底物减少的结果(表 1)。这与斐自伟等[30]的研究结果相似。除表层土壤nirS基因外,三种功能基因在集约经营过程的某一阶段出现不同程度的下降,但集约经营持续25年时,除了nosZ表层功能基因外,其他反硝化功能基因丰度均恢复到对照甚至超过对照的水平(图 1)。10年之后土壤有机碳及pH明显低于对照和10年土壤,这可能是导致反硝化基因丰度下降的主要原因。而在25年反硝化基因丰度回升可能是由于有机碳含量的上升。由于土壤因子变化较复杂,将土壤性质与基因丰度进行相关性和冗余分析以揭示内在规律,相关分析表明,nirK和nirS基因丰度与不同土层土壤性质的相关性没有一致的规律,而nosZ基因丰度在表层和亚表层均与有机碳显著相关。表层和亚表层土壤pH和铵态氮与所有基因均没有显著相关性(表 2),其他指标则分别或同时与某一土层的某个基因表现出显著相关性,其中单因子有机碳、全氮以及它们的比值(C/N)与反硝化基因相关的频率最高。冗余分析表明,表层土壤的硝态氮、C/N、速效钾以及全氮含量等4个因子对3个反硝化基因影响的显著水平依次递减,而对亚表层影响较大的4个因子依次为:有机碳、铵态氮、碱解氮以及C/N,不同土层驱动基因丰度变化的主要土壤性质不同,而C/N同时影响两个土层,且两个土层分别同时出现2个含氮指标,说明集约经营措施主要通过土壤氮和有机碳综合影响反硝化微生物的活动和功能。由于所有土壤的质地相同,集约经营措施是每年去除林下植被、翻耕,故不同集约经营时间的土壤疏松度差别不大,因此,土壤化学性质变化是影响基因丰度的主要因素。
3.2 集约经营过程中表层和亚表层反硝化基因的差异为弄清土层深度对不同反硝化基因的影响,我们对不同土层之间各种基因丰度差异情况展开讨论。表层nirS和nosZ土壤基因丰度显著高于亚表层土壤,但nirK基因丰度出现相反现象。大部分研究报道表层土壤反硝化基因丰度高于亚表层土壤,nirK、nirS和nosZ丰度在不同类型土壤如耕地[31]、草地[32]和森林[33]中均随着深度的增加而降低。虽然亚表层土壤的氧化还原电位通常较表层低,有利于反硝化作用,但表层土壤有机碳高于亚表层,可能对反硝化作用的影响更大。为什么亚表层土壤的nirK基因丰度反而高于表层的异常现象?从前面分析得知,毛竹林集约经营土壤反硝化细菌丰度变化受到氮素水平和有机碳的影响最大,而亚表层土壤的氮素水平和有机碳均低于正常表层,从土壤性质解释不通。推测可能是分布在30 cm亚表层的毛竹竹鞭分泌大量可溶性有机碳,对携带nirK基因的微生物促进效果较nirS和nosZ基因微生物更加显著。李振高等[34]也发现在小麦生长过程中随着根系分泌物的增加反硝化细菌数量不仅显著增加,同时根系分泌物还刺激了反硝化细菌的代谢活动。此外,研究证明pH与nirK反硝化基因丰度呈显著正相关[26],而在本研究中表层pH显著低于亚表层,因此pH也可能是导致nirK表层和亚表层丰度出现异常的原因之一。
3.3 集约经营过程中不同反硝化基因之间的差异本研究中,反硝化基因nirK、nirS和nosZ等随着集约经营时间的变化规律不同。尽管表层土壤中nirK和nirS两种功能基因共同编码亚硝酸还原酶,且丰度上有着相同的数量级,但毛竹集约经营过程中两种nir基因变化趋势不同,且分别受不同的土壤理化因子的控制。关于这两种基因的同步[35]和反向[36]变化规律的结果均有报道。由于土壤中携带反硝化nirK和nirS的微生物属于不同的种[7],在环境中有各自的生态位[27],对同一环境因子的响应可能不同。有时可能存在竞争关系[36]、有时候存在正相关关系[35],有时则互不影响[26],三种关系均有可能发生。毛竹林表层土壤中nirK和nirS无显著相关性,属于互不影响的关系,这可能是因为nirK丰度在整个集约过程中的波动远大于nirS。研究表明nirK对环境的敏感程度要远大于nirS[37]。而集约经营过程中由于施肥、毛竹凋落物、翻耕等抗干扰活动导致微生物的生境不断变化,可以很好地解释nirK基因丰度波动大于nirS的结果。与nirK和nirS变化规律不同,集约经营过程中表层和亚表层土壤的nosZ基因丰度均表现为先增加后减少的一致规律,且与有机碳含量呈显著正相关; 表层土壤nosZ丰度与速效钾和硝态氮含量呈显著负相关、而亚表层土壤nosZ丰度则与碳氮比呈显著正相关,说明有机碳是影响nosZ丰度的共性因子,研究表明[38]随着氮肥施用量增加,土壤碳氮比降低,土壤中反硝化微生物nosZ的丰度显著降低。毛竹林在集约经营初期由于施肥促进有机质分解以及促进毛竹生长使毛竹分泌根系分泌物增加,因而,土壤有机质含量明显增加,虽然施肥增加土壤氮水平,但增幅小于有机碳,因此,土壤碳氮比总体升高有利于携带nosZ基因的微生物活动。而长期集约经营碳氮比显著低于对照,nosZ基因丰度同碳氮比一样呈现同步变化的趋势。
3.4 集约经营过程中(nirK+nirS)/nosZ比值变化研究发现(nirK+nirS)/nosZ比值可预测N2O排放的变化,相同基因丰度水平情况下比值越高产生的N2O越多[21]。表层土壤(nirK+nirS)/nosZ比值在集约经营初期变幅不大,而在集约经营后期显著上升(图 1D),说明随着集约经营时间可能会增加N2O排放。表层后期nosZ基因降幅较大(图 1C)而nirS基因则没有下降(图 1B),因此造成(nirK+nirS)/nosZ比值明显增加。集约经营后期硝态氮明显积累,为反硝化作用提供丰富的底物,反硝过程可以保持在较高水平,而nosZ基因数量显著减少使硝化过程不能彻底还原为N2,导致N2O排放量增加。nosZ基因数量减少主要受到与硝态氮积累有关,研究表明[23]高浓度的硝态氮会抑制N2O还原酶(nosZ)的活性,使N2O转化为N2速率减慢。亚表层土壤由于nirK明显高于表层、而nosZ则明显低于表层,导致(nirK+nirS)/nosZ比值显著高于表层(图 1D),但随着集约经营时间呈缓慢下降趋势。从3个基因丰度变化情况看,亚表层土壤对nosZ基因的影响大于(nirK+nirS),说明亚表层土壤反硝化步骤主要为NO2-还原形成NO,因而产生较多的N2O。然而,亚表层土壤(nirK+nirS)/nosZ的比值在集约经营后期显著降低,这正好与表层的变化规律相反、呈显著负相关。亚表层土壤(nirK+nirS)/nosZ与硝态氮浓度呈显著负相关,这可能是由于土壤亚表层相比表层硝态氮浓度更低,故在集约经营后期并未抑制N2O还原酶活性。以上结果推测,整个集约经营过程亚表层土壤反硝化产生的N2O均高于表层,表层土壤集约经营后期N2O排放量增加。
4 结论反硝化作用是竹林土壤氮循环的重要一环。随着集约经营时间的增加,两层土壤的三种功能基因丰度在集约经营10年时表现增加或不变的一致规律。除表层土壤nirS基因外,三种功能基因在集约经营过程的某一阶段(15或20年)出现不同程度的下降,集约经营持续25年时,除nosZ表层土壤基因丰度仍低于对照,其他不同土层土壤基因丰度均恢复甚至超过对照水平,说明土壤反硝化细菌表现出对集约经营干扰的抵抗和恢复反应。集约经营措施主要通过土壤氮和有机碳变化综合影响反硝化细菌的活动和功能。毛竹林集约经营土壤的反硝化细菌积极参与氮循环过程,加剧N2O温室气体的排放。建议在集约经营过程中,通过施用缓释肥料以减少反硝化细菌的底物硝酸根。
| [1] |
Maeda K, Hanajima D, Toyoda S, et al. Microbiology of nitrogen cycle in animal manure compost . Microbial Biotechnology, 2011, 4(6): 700-709. DOI:10.1111/j.1751-7915.2010.00236.x
(  0) 0) |
| [2] |
Conrad R. Soil microorganisms as controllers of atmospheric trace gases(H2, CO, CH4, OCS, N2O, and NO) . Microbiological Reviews, 1996, 60(4): 609-640. DOI:10.1128/MMBR.60.4.609-640.1996
(  0) 0) |
| [3] |
Kim S W, Miyahara M, Fushinobu S, et al. Nitrous oxide emission from nitrifying activated sludge dependent on denitrification by ammonia-oxidizing bacteria . Bioresource Technology, 2010, 101(11): 3958-3963. DOI:10.1016/j.biortech.2010.01.030
(  0) 0) |
| [4] |
Anderson I C, Levine J S. Relative rates of nitric oxide and nitrous oxide production by nitrifiers, denitrifiers, and nitrate respirers . Applied and Environmental Microbiology, 1986, 51(5): 938-945. DOI:10.1128/AEM.51.5.938-945.1986
(  0) 0) |
| [5] |
Zhang J B, Cai Z C, Cheng Y, et al. Denitrification and total nitrogen gas production from forest soils of Eastern China . Soil Biology & Biochemistry, 2009, 41(12): 2551-2557.
(  0) 0) |
| [6] |
张瑞娟, 李华, 林勤保, 等. 土壤微生物群落表征中磷脂脂肪酸(PLFA)方法研究进展. 山西农业科学, 2011, 39(9): 1020-1024. Zhang R J, Li H, Lin Q B, et al. Research progress of PLFA method in the soil microbial community (In Chinese). Journal of Shanxi Agricultural Sciences, 2011, 39(9): 1020-1024. DOI:10.3969/j.issn.1002-2481.2011.09.28 (  0) 0) |
| [7] |
Zumft W G, K rner H. Enzyme diversity and mosaic gene organization in denitrification . Antonie Van Leeuwenhoek, 1997, 71(1/2): 43-58. DOI:10.1023/A:1000112008026
(  0) 0) |
| [8] |
Jung J, Yeom J, Han J, et al. Seasonal changes in nitrogen-cycle gene abundances and in bacterial communities in acidic forest soils . Journal of Microbiology, 2012, 50(3): 365-373. DOI:10.1007/s12275-012-1465-2
(  0) 0) |
| [9] |
李刚, 修伟明, 王杰, 等. 不同植被恢复模式下呼伦贝尔沙地土壤反硝化细菌nirK基因组成结构和多样性研究. 草业学报, 2015, 24(1): 115-123. Li G, Xiu W M, Wang J, et al. Community structure and diversity of soil denitrifying bacteria of the nirK gene type under different vegetation restoration patterns in the Hulunbeier Sandy Land, Inner Mongolia (In Chinese). Acta Prataculturae Sinica, 2015, 24(1): 115-123. (  0) 0) |
| [10] |
孙翼飞, 沈菊培, 张翠景, 等. 不同放牧强度下土壤氨氧化和反硝化微生物的变化特征. 生态学报, 2018, 38(8): 2874-2883. Sun Y F, Shen J P, Zhang C J, et al. Responses of soil ammonia oxidizers and denitrifiers to different grazing intensities (In Chinese). Acta Ecologica Sinica, 2018, 38(8): 2874-2883. (  0) 0) |
| [11] |
Liang B C, MacKenzie A F, Schnitzer M, et al. Management-induced change in labile soil organic matter under continuous corn in eastern Canadian soils . Biology and Fertility of Soils, 1997, 26(2): 88-94. DOI:10.1007/s003740050348
(  0) 0) |
| [12] |
秦华, 徐秋芳, 曹志洪. 长期集约经营条件下雷竹林土壤微生物量的变化. 浙江林学院学报, 2010, 27(1): 1-7. Qin H, Xu Q F, Cao Z H. Soil microbial biomass in long-term and intensively managedPhyllostachys praecox stands (In Chinese). Journal of Zhejiang A & F University, 2010, 27(1): 1-7. (  0) 0) |
| [13] |
何冬华, 陈俊辉, 徐秋芳, 等. 集约经营对毛竹林土壤固氮细菌群落结构和丰度的影响. 应用生态学报, 2015, 26(10): 2961-2968. He D H, Chen J H, Xu Q F, et al. Effects of intensive management on abundance and composition of soil N2-fixing bacteria in Phyllostachys heterocycla stands (In Chinese). Chinese Journal of Applied Ecology, 2015, 26(10): 2961-2968. (  0) 0) |
| [14] |
赵天心.经营模式对毛竹林土壤细菌、真菌群落结构和丰度的影响[D].杭州: 浙江农林大学, 2017. Zhao T X. Effects of management models on abundanceand structure of soil bacterial and fungal community in Mao bamboo(Phyllostachys edulis)forest[D]. Hangzhou: Zhejiang A & F University, 2017. (  0) 0) |
| [15] |
刘彩霞, 周燕, 徐秋芳, 等. 毛竹林集约经营对土壤固碳细菌群落结构和多样性的影响. 生态学报, 2018, 38(21): 7819-7829. Liu C X, Zhou Y, Xu Q F, et al. Effects of intensive management on the community structure and diversity of CO2-assimilating bacteria in a Phyllostachys pubescens stand (In Chinese). Acta Ecologica Sinica, 2018, 38(21): 7819-7829. (  0) 0) |
| [16] |
陈浩, 李博, 熊正琴. 减氮及硝化抑制剂对菜地氧化亚氮排放的影响. 土壤学报, 2017, 54(4): 938-947. Chen H, Li B, Xiong Z Q. Effects of N reduction and nitrification inhibitor on N2O emissions in intensive vegetable field (In Chinese). Acta Pedologica Sinica, 2017, 54(4): 938-947. (  0) 0) |
| [17] |
鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000. Bao S D. Soil and agricultural chemistry analysis (In Chinese). Beijing: China Agriculture Press, 2000. (  0) 0) |
| [18] |
Hallin S, Lindgren P E. PCR detection of genes encoding nitrite reductase in denitrifying bacteria . Applied and Environmental Microbiology, 1999, 65(4): 1652-1657. DOI:10.1128/AEM.65.4.1652-1657.1999
(  0) 0) |
| [19] |
Throb ¤ck I N, Enwall K, Jarvis , et al. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE . FEMS Microbiology Ecology, 2004, 49(3): 401-417. DOI:10.1016/j.femsec.2004.04.011
(  0) 0) |
| [20] |
Chèneby D, Hartmann A, Hénault C, et al. Diversity of denitrifying microflora and ability to reduce N2O in two soils . Biology and Fertility of Soils, 1998, 28(1): 19-26. DOI:10.1007/s003740050458
(  0) 0) |
| [21] |
Szukics U, Hackl E, Zechmeister-Boltenstern S, et al. Contrasting response of two forest soils to nitrogen input:Rapidly altered NO and N2O emissions and nirK abundance . Biology and Fertility of Soils, 2009, 45(8): 855-863. DOI:10.1007/s00374-009-0396-5
(  0) 0) |
| [22] |
Bolan N S, Saggar S, Luo J F, et al. Gaseous emissions of nitrogen from grazed pastures:Processes, measurements and modelling, environmental implications, and mitigation . Advances in Agronomy, 2004, 84: 37-120. DOI:10.1016/S0065-2113(04)84002-1
(  0) 0) |
| [23] |
Weier K L, Doran J W, Power J F, et al. Denitrification and the dinitrogen/nitrous oxide ratio as affected by soil water, available carbon, and nitrate . Soil Science Society of America Journal, 1993, 57(1): 66-72. DOI:10.2136/sssaj1993.03615995005700010013x
(  0) 0) |
| [24] |
陈晨, 许欣, 毕智超, 等. 生物炭和有机肥对菜地土壤N2O排放及硝化、反硝化微生物功能基因丰度的影响. 环境科学学报, 2017, 37(5): 1912-1920. Chen C, Xu X, Bi Z C, et al. Effects of biochar and organic manure on N2O emissions and the functional gene abundance of nitrification and denitrification microbes under intensive vegetable production (In Chinese). Acta Scientiae Circumstantiae, 2017, 37(5): 1912-1920. (  0) 0) |
| [25] |
Schaufler G, Kitzler B, Schindlbacher A, et al. Greenhouse gas emissions from European soils under different land use:Effects of soil moisture and temperature . European Journal of Soil Science, 2010, 61(5): 683-696. DOI:10.1111/j.1365-2389.2010.01277.x
(  0) 0) |
| [26] |
王晓辉, 郭光霞, 郑瑞伦, 等. 生物炭对设施退化土壤氮相关功能微生物群落丰度的影响. 土壤学报, 2013, 50(3): 624-631. Wang X H, Guo G X, Zheng R L, et al. Effect of biochar on abundance of n-related functional microbial communities in degraded greenhouse soil (In Chinese). Acta Pedologica Sinica, 2013, 50(3): 624-631. (  0) 0) |
| [27] |
Tang Y Q, Zhang X Y, Li D D, et al. Impacts of nitrogen and phosphorus additions on the abundance and community structure of ammonia oxidizers and denitrifying bacteria in Chinese fir plantations . Soil Biology & Biochemistry, 2016, 103: 284-293.
(  0) 0) |
| [28] |
尹昌.农田土壤N2O产生和还原及相关功能微生物对温度及施肥的响应[D].北京: 中国农业科学院, 2017. Yin C. Responses of N2O emission and reduction as well as associated microbes to temperature and different fertilization regimes in arable soils[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. (  0) 0) |
| [29] |
Hallin S, Jones C M, Schloter M, et al. Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment . The ISME Journal, 2009, 3(5): 597-605. DOI:10.1038/ismej.2008.128
(  0) 0) |
| [30] |
裴自伟, 陈意超, 李伏生, 等. 不同灌水模式和施氮处理下稻田N2O排放通量及其与硝化-反硝化细菌数量的关系. 农业环境科学学报, 2017, 36(12): 2561-2568. Pei Z W, Chen Y C, Li F S, et al. The relationship between N2O emission flux from paddy fields and nitrifying-denitrifying bacteria under different irrigation methods and nitrogen treatments (In Chinese). Journal of Agro-Environment Science, 2017, 36(12): 2561-2568. DOI:10.11654/jaes.2017-0749 (  0) 0) |
| [31] |
Fierer N, Schimel J P, Holden P A. Variations in microbial community composition through two soil depth profiles . Soil Biology & Biochemistry, 2003, 35(1): 167-176.
(  0) 0) |
| [32] |
Regan K, Kammann C, Hartung K, et al. Can differences in microbial abundances help explain enhanced N2O emissions in a permanent grassland under elevated atmospheric CO2? . Global Change Biology, 2011, 17(10): 3176-3186. DOI:10.1111/j.1365-2486.2011.02470.x
(  0) 0) |
| [33] |
Mergel A, Schmitz O, Mallmann T, et al. Relative abundance of denitrifying and dinitrogen-fixing bacteria in layers of a forest soil . FEMS Microbiology Ecology, 2001, 36(1): 33-42. DOI:10.1111/j.1574-6941.2001.tb00823.x
(  0) 0) |
| [34] |
李振高, 潘映华, 李良谟. 不同基因型小麦根际细菌及酶活性的动态研究. 土壤学报, 1993, 30(1): 1-8. Li Z G, Pan Y H, Li L M. Dynamics of bacteria and their enzyme activity]in rhizosphere of wheat of different genotypes (In Chinese). Acta Pedologica Sinica, 1993, 30(1): 1-8. (  0) 0) |
| [35] |
Wang C, Lu H H, Dong D, et al. Insight into the effects of biochar on manure composting:Evidence supporting the relationship between N2O emission and denitrifying community . Environmental Science & Technology, 2013, 47(13): 7341-7349.
(  0) 0) |
| [36] |
呼和, 陈先江, 程云湘. 撂荒地亚硝酸还原酶基因nirK和nirS丰度动态. 草业科学, 2016, 33(7): 1253-1259. Hu he, Chen X J, Cheng Y X. The dynamics for abundance of nitrite reductase genes nirKand nirS in abandoned land (In Chinese). Pratacultural Science, 2016, 33(7): 1253-1259. (  0) 0) |
| [37] |
Yin C, Fan F L, Song A L, et al. Different denitrification potential of aquic brown soil in Northeast China under inorganic and organic fertilization accompanied by distinct changes of nirS- and nirK-denitrifying bacterial community . European Journal of Soil Biology, 2014, 65: 47-56. DOI:10.1016/j.ejsobi.2014.09.003
(  0) 0) |
| [38] |
Yang C, Hamel C, Gan Y T. Incongruous variation of denitrifying bacterial communities as soil N level rises in Canadian canola fields . Applied Soil Ecology, 2015, 89: 93-101. DOI:10.1016/j.apsoil.2015.01.002
(  0) 0) |
2. School of Environmental and Resources, Zhejiang Agriculture and Forestry University, Lin'an, Zhejiang 311300, China
 2020, Vol. 57
2020, Vol. 57

