2. 萨斯卡切温大学加拿大光源,萨斯卡通,萨斯卡切温省,S7N 2V3
土壤作为地球上最基本的生产资料,是农业可持续发展的基础,同时土壤也是污染物的重要消纳体。2014年环保部和国土资源部公布的全国土壤污染状况调查结果表明,全国土壤污染点位超标率达16.1%,其中耕地污染点位超标率高达19.4%,并以重金属污染为主[1]。由于重金属在土壤中通常以固相结合态形式赋存(质量百分比含量超过99%)[2],因此土壤重金属移动性差、滞留时间长,且不能被微生物降解,是污染区生态环境巨大的“潜在威胁”。此外,镉、砷等重金属会通过作物进入食物链或通过地下水直接进入人体,引发骨痛病、癌症等一系列疾病,对居民健康构成严重影响[3-4]。因此,土壤重金属污染是我国将长期面临的生态环境问题,有效防治土壤重金属污染对于我国绿色发展意义重大。
1 微尺度重金属化学的提出 1.1 重金属环境土壤化学发展及瓶颈1975年瑞典科学家Tyler[5]首次在Nature上发表森林土壤重金属污染抑制土壤氮循环的研究成果,从此土壤重金属污染问题日益受到重视,揭开了以重金属为研究对象的环境土壤化学研究的序幕。我国著名科学家、中国农业科学院刘更另院士[6]在1985年以第一作者身份在《中国农业科学》发表了《土壤中砷对植物生长的影响-南方“砷毒田”的研究》,开启了我国的重金属环境土壤化学研究。针对污染土壤系统,土壤重金属的形态解析及其有效性评估一直是研究的重点和难点[7],其中以传统的化学连续提取法[8-9]和分子水平表征技术为主[10];同时针对模拟系统,研究重金属在土壤及其典型固相组分的界面化学行为长期备受青睐[7],其中吸附反应机理为研究焦点[11],主要通过传统的吸附模型预测及现代分子水平表征技术进行微观反应机制解析[7],最为经典的研究是斯坦福大学Brown及其合作者[12]在国际顶尖期刊Science杂志上发表利用同步辐射X射线吸收精细结构(XAFS)谱技术直接揭示了硒酸根在铁氧化物表面吸附的分子机制。上述两类研究中使用的分子水平表征技术包括傅里叶红外光谱(FTIR)、核磁共振(NMR)、电子显微镜、同步辐射技术等[7]。由于土壤固相组分复杂,分布不均,富含铁氧化物等顺磁离子,加之土壤重金属浓度通常处于痕量水平,因此,依托高亮度的同步辐射光,具有高灵敏度、空间/时间分辨、元素选择及微结构解析特性的同步辐射技术最受青睐[10-13](表 1)。
|
|
表 1 传统表征方法的优点及其局限性 Table 1 Advantages and limitations of the traditional characterization techniques |
随着同步装置和光束线的建设及其相关光谱技术在环境土壤化学中的推广应用,20世纪80年代,研究者逐步认识到土壤重金属生物有效性及环境风险主要取决于其分子形态,并诞生了环境土壤化学的重要分支学科-分子环境科学(Molecular Environmental Science),即在分子水平上研究污染物在土壤、底泥、废弃物、自然水体和大气中的物理、化学形态及分布[7]。同步辐射技术包括X射线吸收近边结构(XANES)谱、扩展X射线吸收精细结构(EXAFS)谱、X射线荧光光谱分析(XRF)、X射线晶体衍射(XRD)、X射线扫描透射显微术(STXM)等多种技术,被广泛关注,而在分子环境科学诞生初期主要以X射线吸收精细结构(XAFS)谱应用最为广泛。1994年,美国特拉华大学Sparks课题组首次提出利用XAFS研究土壤元素的微观结构,有望推进对土壤和土壤化学过程机理的认识[14]。1995年Schulze等[15]率先利用XANES谱指纹技术对土壤中重金属锰的价态进行了研究;随后,Manceau等[16]通过EXAFS谱线性拟合研究了不同污染类型土壤中铅的形态,揭示了土壤铅形态因污染来源不同而以有机结合态铅、黏土矿物结合态铅、硫化铅或铅的氢氧化物形态赋存。1999年Brown等[13]指出了重金属生物地球化学过程的复杂性,有必要从分子水平阐明土壤重金属的生物有效性;并利用EXAFS技术在分子水平上揭示了尾矿和污染土壤中铅、砷和硒等重金属元素主要以矿物结合态形态赋存,生物有效性和环境风险较溶解态重金属低。2000年美国特拉华大学Sparks课题组利用XAFS技术揭示了铅在不同有机碳含量土壤中吸附和解吸的分子机制[17],开启了重金属在土-水界面反应动力学分子机制的新阶段。
由于土壤组成复杂,活性组分多样且分布不均,导致土壤重金属通常以多种形态赋存。虽然EXAFS技术可在分子水平上揭示目标重金属元素赋存的分子形态,但是EXAFS反映的是土体土壤中目标重金属的平均信息,因此仅适用于重金属单一形态占主体或者形态均一的样品,例如高污染的尾矿渣[13]以及土壤样品[18]。为推进同步辐射技术向环境低浓度样品应用以及有效揭示重金属与非均相土壤固相组分结合的分子机制,同时鉴于土壤团聚体粒径范围大小多变,从毫米级至纳米级均有分布,因此,以同步辐射微探针、扫描透射显微术等具有不同空间分辨率的技术逐渐得到发展并应用。例如,Morin等[19]利用同步辐射微探针(µ-XRF/µ-XAFS)揭示了冶炼厂污染土壤中铅在微米尺度上的空间分布,其分子形态主要以有机结合态、铁锰氧化物结合态赋存。Roberts等[20]利用该技术有效揭示了冶炼厂污染土壤中锌赋存形态主要以外配层吸附为主,有效解释了该地区土壤锌的高移动性和流失风险。随后,利用同步辐射微探针技术研究土壤重金属微区分布及其分子形态在典型重金属铜、镉、锌、镍等中得到广泛应用[18, 21-22]。
1.2 微尺度重金属土壤化学提出及发展随着高空间分辨率的同步辐射技术发展及其应用,2011年美国北卡罗莱纳州立大学Hesterberg等[2]首次提出了土壤“微化学反应器”的科学设想,指出污染物在土壤中的形态转化与生物有效性主要由污染物所富集的土壤微域中特定的活性组分组成决定,犹如一个独特的“微化学反应器”控制着该富集微域中重金属的环境化学行为。该设想充分考虑了土壤组分多样、结构复杂、分布不均以及土壤团聚体颗粒粒径大小多变的特性,同时强调在具有环境意义的尺度上从土壤微域固相微观结构及其结合态重金属分子形态两方面表征,这是准确认识土壤重金属形态转化与生物有效性的前提。当前适用于土壤微尺度化学研究的微域分析技术主要包括同步辐射微探针技术、X射线扫描透射显微术(STXM)以及纳米二次离子质谱技术(NanoSIMS)等技术。
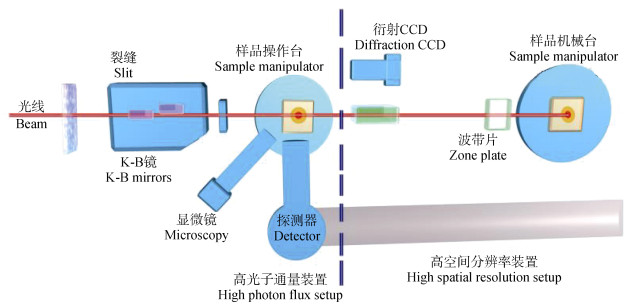
2 微尺度的重金属土壤化学分析方法 2.1 同步辐射X射线微探针技术(Microprobe)同步辐射X射线微探针技术(Microprobe)主要利用中高能同步辐射光表征目标样品中元素的分布、形态及矿物组成,主要包括微束X射线荧光分析(μ-XRF)、微束X射线吸收光谱(μ-XAS)、微束X射线衍射(μ-XRD)等。Microprobe技术主要依托Kirkpatrick-Baez显微镜(K-B镜)聚焦,最初在高能光束线被广泛采用,随后逐步扩展至中能光束线[23],具有微米级的空间分辨率。常规条件下,该技术主要根据光束线的能量范围表征元素周期表中磷、硫和钙以上的金属元素,可有效识别样品化学成分的空间分布以及典型微区中元素的价态、微观局域(μ-XAS表征)或长程有序(μ-XRD表征)的微观结构[10]。此外,该技术还具有样品用量少、多种元素同时表征以及可构建土壤中典型元素二维分布图等优点。图 1为微探针装置示意图,装置主要由K-B镜、样品台、波带片纳米探针装置、显微镜和探测器组成,其中K-B镜可通过平移、倾斜特定角度对光束进行反射,并通过调节反射镜曲率进行对焦;波带片纳米探针可通过其中的聚焦光学模块将硬X射线光束聚焦至纳米级[24]。
2.2 同步辐射X射线扫描透射显微术(STXM)X射线扫描透射显微术(Scanning transmission X-ray microscopy,STXM)是一种利用波带片(Zone plate)将软X射线进行聚焦,然后针对目标元素在吸收边附近的吸收差异来获取图像和图谱信息的光谱显微分析技术。通常情况下,软X射线的能量范围小于2 500 eV,可检测土壤中组成元素碳、氮、钙、铁、铝、硅以及铜、锌等重金属元素[25]。当前该技术主要采用透射模式进行样品检测,但为提高重金属元素的检测能力,可配置荧光检测器降低其检测限[26]。STXM技术的主要优势包括:(1)样品用量少;(2)纳米级的空间分辨率;(3)可得到样品二维和三维图像以及目标元素的微观化学形态及结构信息。图 2为STXM的原理示意图,入射的单色软X光通过波带片聚焦成极小的斑点,形成微探针,进而在样品平面进行逐点扫描后由探测器接受信号。

|
图 2 X射线扫描透射显微术(STXM)的原理示意图 Fig. 2 Schematic illustration of the scanning transmission X-ray microscopy(STXM) |
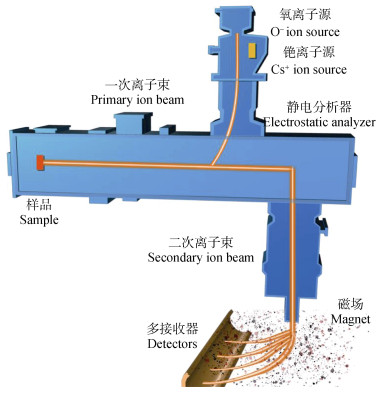
纳米二次离子质谱技术(NanoSIMS)是结合了同位素示踪技术和超高分辨率显微镜成像技术的新型分析技术,是在二次离子质谱技术(SIMS)基础上发展起来的一种新型表面分析技术。该技术的主要原理是结合超高分辨率显微镜成像技术,以一种一次离子(如Cs+或O-初级离子束)轰击样品靶,从中溅射出的正、负二次离子引入磁场进行质谱分析,得出被分析样品表面或化合物的元素组分、同位素比等信息[27],从而实现在非均相样品中目标微区面进行元素和同位素组成分布表征。NanoSIMS技术具有纳米级空间分辨率(~50 nm)、样品用量少、多元素分析等特点[28-30]。目前,较为先进的纳米二次离子质谱仪以法国CAMECA公司生产的NanoSIMS 50L型为代表,较传统的质谱仪具有更高的横向分辨率及灵敏度,能够同时对5种离子进行成像分析和精确定量,在高分辨率的条件下依然能够有较好的透射率[31]。图 3为CAMECA NanoSIMS 50L型纳米二次离子质谱仪工作原理示意图[32]。
|
图 3 CAMECA NanoSIMS 50L型纳米二次离子质谱仪原理示意图[32] Fig. 3 Schematic illustration of the CAMECA NanoSIMS(50L)[32] |
重金属在土壤中主要与其固相活性组分交互作用,土壤固相活性组分包括有机质、金属氧化物(铁/锰/铝氧化物等)、黏土矿物(1:1型和1:2型黏土矿物)、碳酸盐矿物以及金属硫化物等,其中主要以有机质、金属氧化物和黏土矿物为主[33]。土壤固相活性组分在实际土壤系统中分布不均,粒径大小不一(毫米至纳米级),结合方式多样(铁氧化物黏土矿物复合、有机铁氧化物复合体、有机黏土矿物复合体等),导致活性组分分布的微域中颗粒物化学组成、局域结构和表面性质各异,类似不同的“微反应器”控制着土壤重金属的分布、形态转化及最终归趋。鉴于此,有必要利用高空间分辨率的表征技术在具有环境意义的微纳米空间尺度上对上述特殊微域中重金属分布、形态进行探究,以深入认识非均相土壤系统中重金属的形态转化及生物有效性机制。
3.1 基于Microprobe技术的微米尺度研究进展同步辐射Microprobe技术是最早应用于表征土壤重金属在微米尺度上赋存形态及化学作用机制的分析技术之一。实际应用中,通常首先通过μ-XRF在微米尺度上表征土壤重金属(铜、锌、砷等)以及样品中铁、锰、钙、钾、硫、磷等典型的矿质元素的分布特征,再利用相关性分析探究目标重金属可能结合的土壤矿物;随后利用μ-XANES技术表征目标重金属的分子形态,或结合μ-XRD技术表征重金属及其结合态矿物的晶体结构,从土壤微域的矿物组成和重金属分子形态两方面阐明土壤重金属典型赋存微域中的分子形态。Manceau等[10]系统综述了同步辐射微探针等多种技术联用(µ-XRF/ µ-XAFS/µ-XRD)在土壤重金属形态表征中的应用及相应数据处理过程,显著推进了该技术在分子环境科学的应用。根据具体研究目标,常用的技术组合包括:μ-XRF单用或者与大光斑X射线吸收光谱(bulk-XAS)联用、μ-XRF/μ-XAS联用、μ-XRF/ μ-XRD联用以及μ-XRF/μ-XRD/μ-XAS联用。
Jacobson等[34]利用μ-XRF技术对葡萄产地土壤铜及相关矿质元素铷(指示黏土矿物)、铁的微区分布表征,发现土壤黏土矿物和铁氧化物并非铜的吸附载体,而结合电镜分析发现颗粒态有机质是铜的主要吸附载体,控制着高铜微区中铜的形态转化。Khaokaew等[21]运用同步辐射μ-XRF和bulk-EXAFS技术联用对镉污染水稻土在淹水-落干过程的分子形态进行了表征,结果表明淹水过程中土壤镉主要以碳酸镉形式赋存,与μ-XRF技术发现土壤镉与钙微区分布的高度相关的结论一致。Yang等[35]利用μ-XRF与bulk-XANES联合表征了不同硫肥影响下污染水稻土中胶体铜及相关矿质元素铁、锰、钙、钾等的分布特征以及铜的分子形态,发现硫肥可促进淹水稻田土壤中胶体态铜铁硫化物共沉淀生成,控制着土壤胶体铜的形态、分布和转化。Strawn等[18, 36]利用μ-XRF与μ-XAFS揭示了不同理化性质土壤铜主要与有机质而非铁氧化物或黏土矿物结合,控制着土壤铜的形态、分布及生物有效性。Landrot等[37]应用μ-XRF、μ-XANES与bulk-EXAFS技术揭示了皮革生产导致的污染土壤铬、铁的微区分布特征一致,主要以Cr(Ⅲ)形态被铁氧化物固定,而砷首要与铝氧化物结合,其次为铁氧化物。对于中能的Microprobe,当前主要针对土壤微域中磷、硫和钙进行表征[23, 38],为研究这些元素在土壤微域中与重金属的微尺度作用机制奠定了重要基础。
同步辐射Microprobe技术虽然在微尺度的重金属土壤化学机制中广泛应用,但是由于该技术所用X射线能量范围限制,无法表征碳、氮和铝、硅等轻质元素的分布特征,因此无法直接研究供试土壤样品中有机质、黏土矿物的微区分布特征及其与重金属在微尺度的土壤化学作用机制。
3.2 基于STXM技术的亚微米尺度研究进展同步辐射STXM技术可在纳米尺度上表征土壤重金属(铜、锌、铬、砷等)以及样品中碳、氮、钙、铁、锰、铝、硅等典型矿质元素的分布特征,覆盖土壤固相中有机质、碳酸盐、铁/铝/锰氧化物、黏土矿物等主要活性组分[25],同时具有纳米级空间分辨率,可有效表征土壤中纳米级及其以上粒径尺度的团聚体微观结构及其结合态重金属的分子形态,从而为土壤重金属微尺度作用机制提供了独特的研究平台。STXM技术在表征土壤固相组成及微观结构方面已取得了长足发展,为进一步研究微尺度的重金属土壤化学作用机制奠定了良好基础,但是当前利用该技术对于微尺度重金属土壤化学作用机制的研究尚处于起步阶段。
土壤活性组分主要以有机质、铁氧化物和黏土矿物为主,其中有机质微观结构解析一直是土壤学研究的瓶颈问题,常规的核磁共振、傅里叶红外光谱等技术可提供土壤有机碳结构的整体信息,但是有机质在土壤中微区分布及其微结构解析直到STXM技术的应用才逐步得到认识。美国康奈尔大学Lehmann团队在国际上率先利用STXM技术揭示了土壤黑碳以及非黑炭的有机碳中羧基碳、脂肪碳、多糖碳和芳香碳在纳米尺度上的分布特征[39],并通过对比分析发现世界典型地区土壤中有机碳在纳米尺度上的结构差异性[40]。随着STXM技术覆盖能量的扩大,Wan等[41]首次全面探究土壤典型元素碳及相关矿质元素硅、铝、钙、铁、钾和钛在纳米至微米尺度上的分布特征及相关性,率先揭示了不同土壤中有机碳形态(羧基碳、脂肪碳和芳香碳等)与土壤矿物(铁氧化物、黏土矿物等)的交互作用机制,发现土壤有机碳主要以颗粒态有机碳赋存或者与铁氧化物和黏土矿物结合形成有机矿物复合体。随后,美国康奈尔大学Lehmann团队、特拉华大学Sparks团队等先后利用STXM技术揭示不同土壤中有机碳结构差异和在微尺度上的分布特征及其与土壤典型矿物间的交互作用机制[42-44]。上述研究成果有力地揭示了土壤不同微域物质组成及微观结构的差异性特征,从而有理由推测在污染土壤中重金属在不同土壤微域中赋存形态及作用机制很可能受上述结构差异的影响,进而导致不同微域中重金属生物有效性各异。
鉴于土壤有机碳结构在纳米尺度上的空间异质性,Yang和Wang[45]在国际上率先利用STXM技术探究了铜污染土壤中有机质的羧基碳、芳香碳和脂肪碳以及铜在亚微米尺度上的分布特征,结果发现土壤中高铜微区与土壤芳香碳和羧基碳的高含量区重合,而在脂肪碳高含量区则未探测到铜信号,从而说明供试土壤中芳香碳和羧基碳是吸附铜的主要载体。此外,Yang等[46]还利用STXM技术揭示了矿区污染土壤中铜、铁、铝和硅在亚微米尺度上的分布特征,并发现铜的高含量点与三价铁高含量点重合,而与铝、硅高含量点无关,说明土壤铜主要与三价铁氧化物而非黏土矿物(云母)结合,土壤铁氧化物是铜的主要吸附载体,控制着微尺度的土壤铜化学形态及其生物有效性。
3.3 基于NanoSIMS技术的亚微米/纳米尺度研究进展NanoSIMS技术是在纳米尺度上研究土壤微域元素组成及微尺度重金属土壤化学的又一重要技术;相比于STXM技术,虽然NanoSIMS不能表征目标元素的分子形态,但是可根据目标元素的稳定同位素比(例如13C/12C、15N/14N,64Cu/63Cu等)来研究元素的动态转化和同位素分馏机制。一般而言,NanoSIMS的检测限较同步辐射技术低,因此对于污染土壤中痕量重金属的分布特征及同位素比变化研究具有重要作用。当前NanoSIMS主要用于表征土壤有机碳与矿物的交互作用机制,主要由德国Ingrid Koegel-Knabner课题组[27-28, 47-49]引领,而对于微尺度的土壤重金属化学作用机制刚有所涉足。
Heister等[47]首次利用已知结构的模拟土壤证实了NanoSIMS可在亚微米尺度上揭示不同土壤微域中矿物与有机质分布特征及可能的结合机制。随后,Mueller等[28]利用NanoSIMS研究了13C和15N标记的氨基酸与土壤粉粒、黏粒和团聚体的相互作用机制,发现粉粒和黏粒中13C和15N富集量随标记时间的延长而降低,而在土壤团聚体中则呈非均相微区分布特征,标记的氨基酸向土壤团聚体内部扩散而被固定,从而有效展示了NanoSIMS研究土壤微域有机碳氮周转及与土壤组分作用的独特优势。Vogel等[49]利用NanoSIMS研究了标记的植物残留物与土壤黏粒组分的作用机制,结果发现添加的新有机碳优先与土壤有机矿物复合体中粗糙表面相结合,说明土壤黏粒组成结构差异性影响新输入有机碳的固定机制。近年来,Koegel-Knabner课题组在针对NanoSIMS测试过程中的样品制备方法以及利用元素微尺度数据分布解析土壤功能微域中取得了长足进步,显著推进NanoSIMS在微尺度的土壤元素化学研究[30, 48]。新近,Rennert等[50]利用NanoSIMS技术率先对微尺度的土壤重金属分布特征进行了探究,在基于多同位素示踪(12C、18O、32S、63Cu、56Fe和16O)研究不同地区的土壤样品后发现:土壤中铜主要以金属硫化物和铁氧化物吸附态铜形态赋存,而含铜矿物则与有机质相邻或被有机质包围。
3.4 多技术综合表征土壤重金属及相关元素微尺度作用机制上述单一技术均是在微尺度上研究重金属在土壤中作用机制、转化及归趋的有力工具,但是由于单一技术的局限性,需要将上述技术联合使用,以全面认识非均相土壤中不同微域中微尺度的重金属化学作用机制。例如,Yang等[46]在国际上率先将同步辐射Microprobe和STXM技术相结合研究了低有机碳土壤中铜与土壤活性组分铁氧化物、黏土矿物的微尺度作用机制,上述两种技术均表明铁氧化物是重金属铜的重要固定相,但是STXM进一步发现黏土矿物(云母)颗粒物表面无铁氧化物和铜分布,说明供试土壤中黏土矿物不是铜的吸附载体,从而综合表明土壤铁氧化物是该土壤铜的主要吸附固定相(图 4)。Remusat等[29]首次联合NanoSIMS和STXM技术研究了低15N标记的森林土壤微团聚体颗粒,发现NanoSIMS表征的参与氮循环作用的土壤功能微域可同时利用STXM技术分析该微域中碳、氮元素微观结构,充分体现了两种技术在研究土壤氮素微尺度循环机制方面的优势互补。
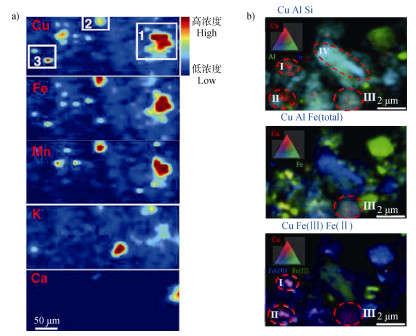
|
注:图a)中热点区域用白框标记为1到3,表示Cu/Fe重合微域;图b)中由上至下分别表示感兴趣区域中Cu/Al/Si、Cu/Al/Fe(总)和Cu/Fe(Ⅲ)/Fe(Ⅱ)的分布,感兴趣的点用红色虚线圆圈表示,标记为Ⅰ-Ⅵ,其中Ⅰ/Ⅱ表示铜与三价铁重合的微域,Ⅲ表示低铜与铁和铝硅重合的区域,Ⅵ表示铝硅(云母)重合的区域。 Note:In Fig.a), hot spot regions are marked by white boxes and labeled from 1 to 3, representing the microsites with the co-distribution of Cu and Fe with high concentration, and in Fig. b), the three circled patches from top to bottom denote distribution of Cu/Al/Si、Cu/Al/Fe and Cu/Fe(Ⅲ)/Fe(Ⅱ), respectively and spots of interest are marked with red dashed circles and are labelled Ⅰ-Ⅵ, andⅠandⅡdenote microsites with the overlapping of high Cu and Fe(Ⅲ), Ⅲ represented the microsites with the overlapping of low Cu, Fe, Al and Si, Ⅵ represented the microsites with the overlapping of Al and Si(muscovite). 图 4 利用Microprobe(a))和STXM(b))分别在微米和亚微米尺度上表征矿区土样Cu/Fe/Mn/K/Ca和Cu/Fe/Al/Si元素的微区分布特征[46] Fig. 4 Distribution of Cu/Fe/Mn/K/Ca and Cu/Fe/Al/Si in a mining soil by microprobe(a))and STXM(b))at the micron and submicron scales, respectively[46] |
土壤重金属污染是当前世界性生态环境问题,在发展中国家尤为突出。有效管控和修复重金属污染土壤需要全面认识土壤重金属的分布、形态转化、归趋及其生物有效性,进而有必要在微尺度上深入研究重金属在非均相土壤中的化学作用机制。土壤活性组分的多样性、异质性分布以及结合方式和粒径大小多变等因素导致当前环境土壤学研究面临重要瓶颈。现代仪器分析技术的不断发展和推广为有效突破这些瓶颈问题提供了便利条件,同步辐射微探针、STXM及NanoSIMS等具有高空间分辨率等特点的新技术的发展,为从分子水平上揭示重金属在非均相土壤中不同微域的赋存形态和结合机制提供了有力工具。随着科技的不断发展,多种分子尺度技术的综合应用,结合计算建模等对微尺度的反应过程进行有机整合,有望深化认识重金属的宏观化学行为,从根本上实现对污染土壤重金属环境行为的有效预测、管控以及污染土壤修复。
| [1] |
Zhao F J, Ma Y B, Zhu Y G, et al. Soil contamination in China:Current status and mitigation strategies . Environmental Science & Technology, 2015, 49(2): 750-759.
(  0) 0) |
| [2] |
Hesterberg D, Duff M C, Dixon J B, et al. X-ray microspectroscopy and chemical reactions in soil microsites . Journal of Environmental Quality, 2011, 40(3): 667-678. DOI:10.2134/jeq2010.0140
(  0) 0) |
| [3] |
赵方杰, 谢婉滢, 汪鹏. 土壤与人体健康. 土壤学报, 2020, 57(1): 1-11. Zhao F J, Xie W Y, Wang P. Soil and human health (In Chinese). Acta Pedologica Sinica, 2020, 57(1): 1-11. (  0) 0) |
| [4] |
Hussain S, Habib-Ur-rehman M, Khanam T, et al. Health risk assessment of different heavy metals dissolved in drinking water . International Journal of Environmental Research and Public Health, 2019, 16(10): 1737. DOI:10.3390/ijerph16101737
(  0) 0) |
| [5] |
Tyler G. Heavy-metal pollution and mineralization of nitrogen in forest soils . Nature, 1975, 255(5511): 701-702. DOI:10.1038/255701a0
(  0) 0) |
| [6] |
刘更另, 陈福兴, 高素端, 等. 土壤中砷对植物生长的影响-南方"砷毒田"的研究. 中国农业科学, 1985, 18(4): 9-16. Liu G L, Chen F X, Gao S D, et al. Effect of arsenic in soil on plants:Research on"arsenic field"in South China (In Chinese). Scientia Agricultura Sinica, 1985, 18(4): 9-16. (  0) 0) |
| [7] |
Sparks D L. Elucidating the fundamental chemistry of soils:Past and recent achievements and future frontiers . Geoderma, 2001, 100(3/4): 303-319.
(  0) 0) |
| [8] |
Bacon J R, Davidson C M. Is there a future for sequential chemical extraction? . The Analyst, 2008, 133(1): 25-46. DOI:10.1039/B711896A
(  0) 0) |
| [9] |
Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals . Analytical Chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017
(  0) 0) |
| [10] |
Manceau A, Marcus M A, Tamura N. Quantitative speciation of heavy metals in soils and sediments by synchrotron X-ray techniques . Reviews in Mineralogy and Geochemistry, 2002, 49(1): 341-428. DOI:10.2138/gsrmg.49.1.341
(  0) 0) |
| [11] |
Scheidegger A M, Sparks D L. A critical assessment of sorption-desorption mechanisms at the soil mineral/water interface . Soil Science, 1996, 161(12): 813-831. DOI:10.1097/00010694-199612000-00002
(  0) 0) |
| [12] |
Hayes K F, Roe A L, Brown G E, et al. In situ X-ray absorption study of surface complexes:Selenium oxyanions on α-FeOOH . Science, 1987, 238(4828): 783-786. DOI:10.1126/science.238.4828.783
(  0) 0) |
| [13] |
Brown G E, Foster A L, Ostergren J D. Mineral surfaces and bioavailability of heavy metals:A molecular-scale perspective . Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3388-3395. DOI:10.1073/pnas.96.7.3388
(  0) 0) |
| [14] |
Fendorf S E, Sparks D L, Lamble G M, et al. Applications of X-ray absorption fine structure spectroscopy to soils . Soil Science Society of America Journal, 1994, 58(6): 1583-1595. DOI:10.2136/sssaj1994.03615995005800060001x
(  0) 0) |
| [15] |
Schulze D G, Sutton S R, Bajt S. Determining manganese oxidation state in soils using X-ray absorption near-edge structure(XANES)spectroscopy . Soil Science Society of America Journal, 1995, 59(6): 1540-1548. DOI:10.2136/sssaj1995.03615995005900060005x
(  0) 0) |
| [16] |
Manceau A, Boisset M C, Sarret G, et al. Direct determination of lead speciation in contaminated soils by EXAFS spectroscopy . Environmental Science & Technology, 1996, 30(5): 1540-1552.
(  0) 0) |
| [17] |
Strawn D G, Sparks D L. Effects of soil organic matter on the kinetics and mechanisms of Pb(Ⅱ)sorption and desorption in soil . Soil Science Society of America Journal, 2000, 64(1): 144-156. DOI:10.2136/sssaj2000.641144x
(  0) 0) |
| [18] |
Strawn D G, Baker L L. Speciation of Cu in a contaminated agricultural soil measured by XAFS, μ-XAFS, and μ-XRF . Environmental Science & Technology, 2008, 42(1): 37-42. DOI:10.1021/es071605z
(  0) 0) |
| [19] |
Morin G, Ostergren J D, Juillot F, et al. XAFS determination of the chemical form of lead in smelter-contaminated soils and mine tailings:Importance of adsorption processes . American Mineralogist, 1999, 84(3): 420-434. DOI:10.2138/am-1999-0327
(  0) 0) |
| [20] |
Roberts D R, Scheinost A C, Sparks D L. Zinc speciation in a smelter-contaminated soil profile using bulk and microspectroscopic techniques . Environmental Science & Technology, 2002, 36(8): 1742-1750.
(  0) 0) |
| [21] |
Khaokaew S, Chaney R L, Landrot G, et al. Speciation and release kinetics of cadmium in an alkaline paddy soil under various flooding periods and draining conditions . Environmental Science & Technology, 2011, 45(10): 4249-4255.
(  0) 0) |
| [22] |
Manceau A, Tamura N, Celestre R S, et al. Molecular-scale speciation of Zn and Ni in soil ferromanganese nodules from loess soils of the mississippi basin . Environmental Science & Technology, 2003, 37(1): 75-80.
(  0) 0) |
| [23] |
Xiao Q F, MacLennan A, Hu Y F, et al. Medium-energy microprobe station at the SXRMB of the CLS . Journal of Synchrotron Radiation, 2017, 24(1): 333-337.
(  0) 0) |
| [24] |
张丽丽, 闫帅, 蒋升, 等. Hard X-ray micro-focusing beamline at SSRF. 核技术:英文版, 2015, 26(6): 1-8. Zhang L L, Yan S, Jiang S, et al. Hard X-ray micro-focusing beamline at SSRF (In Chinese). Nuclear Science and Techniques, 2015, 26(6): 1-8. (  0) 0) |
| [25] |
Stuckey J W, Yang J J, Wang J, et al. Advances in scanning transmission X-ray microscopy for elucidating soil biogeochemical processes at the submicron scale . Journal of Environmental Quality, 2017, 46(6): 1166-1174. DOI:10.2134/jeq2016.10.0399
(  0) 0) |
| [26] |
Hitchcock A P, Obst M, Wang J, et al. Advances in the detection of as in environmental samples using low energy X-ray fluorescence in a scanning transmission X-ray microscope:Arsenic immobilization by an Fe(Ⅱ)-oxidizing freshwater bacteria . Environmental Science & Technology, 2012, 46(5): 2821-2829. DOI:10.1021/es202238k
(  0) 0) |
| [27] |
Kogel-Knabner I, Heister K, Mueller C W, et al. Elucidating soil structural associations of organic material with nano-scale secondary ion mass spectrometry(NanoSIMS)[C]. Proceedings of the 19th World Congress of Soil Science: Soil solutions for a changing world, Brisbane, Australia, 1-6 August 2010. Working Group 1.2 Architecture of soil structural diversity2010: 37-40.
(  0) 0) |
| [28] |
Mueller C W, Kölbl A, Hoeschen C, et al. Submicron scale imaging of soil organic matter dynamics using NanoSIMS-From single particles to intact aggregates . Organic Geochemistry, 2012, 42(12): 1476-1488. DOI:10.1016/j.orggeochem.2011.06.003
(  0) 0) |
| [29] |
Remusat L, Hatton P J, Nico P S, et al. NanoSIMS study of organic matter associated with soil aggregates:Advantages, limitations, and combination with STXM . Environmental Science & Technology, 2012, 46(7): 3943-3949.
(  0) 0) |
| [30] |
Steffens M, Rogge D M, Mueller C W, et al. Identification of distinct functional microstructural domains controlling C storage in soil . Environmental Science & Technology, 2017, 51(21): 12182-12189.
(  0) 0) |
| [31] |
Guerquin-Kern J L, Wu T D, Quintana C, et al. Progress in analytical imaging of the cell by dynamic secondary ion mass spectrometry(SIMS microscopy) . Biochimica et Biophysica Acta(BBA)- General Subjects, 2005, 1724(3): 228-238. DOI:10.1016/j.bbagen.2005.05.013
(  0) 0) |
| [32] |
Kanbach G, Nittler L. Instruments for observations of radioactivities[M]// Diehl R, Hartmann D H. Astronomy with Radioactivities. Berlin, Heidelberg: Springer, 2010: 491-515.
(  0) 0) |
| [33] |
Bertsch P M, Seaman J C. Characterization of complex mineral assemblages:Implications for contaminant transport and environmental remediation . Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3350-3357. DOI:10.1073/pnas.96.7.3350
(  0) 0) |
| [34] |
Jacobson A R, Dousset S, Andreux F, et al. Electron microprobe and synchrotron X-ray fluorescence mapping of the heterogeneous distribution of copper in high-copper vineyard soils . Environmental Science & Technology, 2007, 41(18): 6343-6349.
(  0) 0) |
| [35] |
Yang J J, Zhu S H, Zheng C Q, et al. Impact of S fertilizers on pore-water Cu dynamics and transformation in a contaminated paddy soil with various flooding periods . Journal of Hazardous Materials, 2015, 286: 432-439. DOI:10.1016/j.jhazmat.2015.01.035
(  0) 0) |
| [36] |
Strawn D G, Baker L L. Molecular characterization of copper in soils using X-ray absorption spectroscopy . Environmental Pollution, 2009, 157(10): 2813-2821. DOI:10.1016/j.envpol.2009.04.018
(  0) 0) |
| [37] |
Landrot G, Tappero R, Webb S M, et al. Arsenic and chromium speciation in an urban contaminated soil . Chemosphere, 2012, 88(10): 1196-1201. DOI:10.1016/j.chemosphere.2012.03.069
(  0) 0) |
| [38] |
Liu J, Yang J J, Cade-Menun B J, et al. Molecular speciation and transformation of soil legacy phosphorus with and without long-term phosphorus fertilization:Insights from bulk and microprobe spectroscopy . Scientific Reports, 2017, 7(1): 15354. DOI:10.1038/s41598-017-13498-7
(  0) 0) |
| [39] |
Lehmann J, Liang B Q, Solomon D, et al. Near-edge X-ray absorption fine structure(NEXAFS)spectroscopy for mapping nano-scale distribution of organic carbon forms in soil:Application to black carbon particles . Global Biogeochemical Cycles, 2005, 19(1): GB1013. DOI:10.1029/2004gb002435
(  0) 0) |
| [40] |
Lehmann J, Solomon D, Kinyangi J, et al. Spatial complexity of soil organic matter forms at nanometre scales . Nature Geoscience, 2008, 1(4): 238-242. DOI:10.1038/ngeo155
(  0) 0) |
| [41] |
Wan J M, Tyliszczak T, Tokunaga T K. Organic carbon distribution, speciation, and elemental correlations within soil microaggregates:Applications of STXM and NEXAFS spectroscopy . Geochimica et Cosmochimica Acta, 2007, 71(22): 5439-5449. DOI:10.1016/j.gca.2007.07.030
(  0) 0) |
| [42] |
Chen C M, Dynes J J, Wang J, et al. Soft X-ray spectromicroscopy study of mineral-organic matter associations in pasture soil clay fractions . Environmental Science & Technology, 2014, 48(12): 6678-6686.
(  0) 0) |
| [43] |
Solomon D, Lehmann J, Harden J, et al. Micro- and nano-environments of carbon sequestration:Multi-element STXM-NEXAFS spectromicroscopy assessment of microbial carbon and mineral associations . Chemical Geology, 2012, 329: 53-73. DOI:10.1016/j.chemgeo.2012.02.002
(  0) 0) |
| [44] |
Solomon D, Lehmann J, Wang J, et al. Micro- and nano-environments of C sequestration in soil:A multi-elemental STXM-NEXAFS assessment of black C and organomineral associations . Science of the Total Environment, 2012, 438: 372-388. DOI:10.1016/j.scitotenv.2012.08.071
(  0) 0) |
| [45] |
Yang J J, Wang J. Submicron distribution and association of copper and organic carbon in a contaminated soil using scanning transmission X-ray microspectroscopy . Microscopy and Microanalysis, 2018, 24(S2): 512-513. DOI:10.1017/S1431927618014782
(  0) 0) |
| [46] |
Yang J J, Liu J, Dynes J J, et al. Speciation and distribution of copper in a mining soil using multiple synchrotron-based bulk and microscopic techniques . Environmental Science and Pollution Research, 2014, 21(4): 2943-2954. DOI:10.1007/s11356-013-2214-8
(  0) 0) |
| [47] |
Heister K, Höschen C, Pronk G J, et al. NanoSIMS as a tool for characterizing soil model compounds and organomineral associations in artificial soils . Journal of Soils and Sediments, 2012, 12(1): 35-47. DOI:10.1007/s11368-011-0386-8
(  0) 0) |
| [48] |
Höschen C, Höschen T, Mueller C W, et al. Novel sample preparation technique to improve spectromicroscopic analyses of micrometer-sized particles . Environmental Science & Technology, 2015, 49(16): 9874-9880.
(  0) 0) |
| [49] |
Vogel C, Mueller C W, Höschen C, et al. Submicron structures provide preferential spots for carbon and nitrogen sequestration in soils . Nature Communications, 2014, 5: 2947. DOI:10.1038/ncomms3947
(  0) 0) |
| [50] |
Rennert T, Höschen C, Rogge D, et al. Small-scale distribution of copper in a technosol horizon studied by nano-scale secondary ion mass spectrometry . Rapid Communications in Mass Spectrometry, 2018, 32(11): 851-861. DOI:10.1002/rcm.8111
(  0) 0) |
2. Canadian Light Source Inc, University of Saskatchewan, Saskatoon, SK, S7N 2V3, Canada
 2020, Vol. 57
2020, Vol. 57