2. 中国科学院大学,北京 100049
稻田生态系统具有保持土壤肥力、提供粮食保障和生态调节等多种功能。目前全球水稻种植面积达1.45亿hm2,是世界约1/2人口的主要粮食;我国水稻土面积约3 000万hm2,约占全国耕地面积的1/4,是我国60%人口的主要粮食。在不施氮肥条件下,种植水稻提供的蛋白质是种植玉米的1.5倍[1-2],其主要原因是稻田生态系统能进行生物固氮而不断为水稻生长提供氮素[3]。稻田还具有蓄水防洪、涵养地下水源、气温调节、水质净化、生物多样性维持和景观文化价值等功能[4]。
没有氮素就没有生命。氮是生物生长发育的关键生命元素,又是陆地生态系统最不能满足生物生长需要的元素。在合成氨技术发明以前,生物固定的氮是陆地生态系统氮的主要来源。生物固氮是固氮微生物在固氮酶催化下将空气中的氮气转化成氨的过程。自1913年Haber-Bosch合成氨技术发明以来,人工合成氨不断增加,到2010年达到1.2亿吨N [5],但陆地生态系统每年固氮量估计约为1.6亿~4亿吨,其中自然生态系统固氮1亿~2.9亿吨[6],农田每年固氮6 000万吨~1亿吨(豆类作物每年固氮2 150万吨,草地、稻田等其他农田固氮约3 870万~7 100万吨)[7]。可见,无论过去、现在或将来生物固定的氮均为陆地生态系统的重要氮源。
考古资料表明大约7 000年前亚洲开始种植水稻,3 100年前中国开始种植大豆。大约2 100年前,我国劳动人民就初步总结了生物固氮的基本现象,古农籍《汜胜之书》记载了“瓜与小豆间作”为宜的耕作方式,反映了古代劳动人民对生物固氮的朴素认识;1838年Boussingault发现豆科作物能将活性氮(相对于惰性N2而言)富集在土壤中,并认为豆科作物能生产活性氮,但仍然不知道为什么水稻和大豆能增加氮素供给。直至1888年,Herman Hellriegel和Hermann Wilfarth才发现土壤中微生物参与了生物固氮过程,而且与豆科作物存在共生关系[3]。稻田的淹水环境为光合固氮菌和异养固氮菌的生物固氮提供了合适的pH、氧化还原状况等条件[8]。本文拟对稻田生物固氮研究方法、固氮量、固氮微生物、影响因素、调控及其研究方向进行综述,以期为稻田生物固氮研究提供帮助。
1 稻田生物固氮类型生物固氮一般分为共生固氮(symbiotic biological N2 fixation)、联合固氮(plant-associated biological N2 fixation)和自生固氮(free-living biological N2 fixation)[7]。共生固氮是固氮微生物与能进行光合作用的生物生活在一起,利用光合生物提供的碳水化合物为能源,并利用其驱动固氮酶将大气中的氮气转化为氨,并反过来为光合生物提高氮素的过程,典型的有豆科植物-根瘤菌共生、满江红-鱼腥蓝细菌共生。联合固氮是固氮微生物与植物生活在一起,不形成根瘤,以植物提供的碳水化合物为能源,并反过来为植物提高氮素和(或)激素类物质而进行的固氮过程,如甘蔗-固氮螺菌(Azospirillum)联合固氮。自生固氮是自由生长的固氮微生物独立进行的固氮过程,如蓝细菌(Cyanobacteria)、褐球固氮菌(Azotobacter chroococcum)和梭菌(Clostridium prazmowski)。
在本文中,我们将生物固氮主要分为豆科生物固氮和非豆科生物固氮,详见图 1。
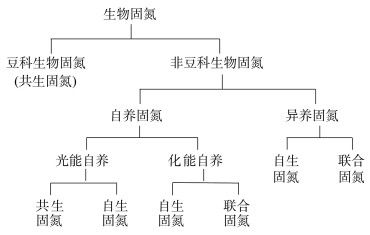
|
图 1 生物固氮类型 Fig. 1 Types of biological N2 fixation |
生物固氮的定量方法分为直接定量法和间接定量法。直接定量法为15N2气体饲喂法。间接定量法有总氮差异法、15N自然丰度法、15N同位素稀释法和乙炔还原法。
15N2气体饲喂法是测定生物固氮的最直接方法。该方法向固氮系统中充入15N标记的氮气,通过测定系统中氮总量和15N丰度,来计算固氮量。该方法直接、准确、技术要求高、试验成本大。卑其成、谢祖彬等发明了田间原位智能气密植物生长控制技术(授权专利号ZL200910232184.3),并成功用于生物固氮研究[9]。该系统能自动控制系统内温度和CO2浓度,并且有很好密封性(图 2)。

|
图 2 田间原位气密植物生长控制系统 Fig. 2 In-situ field air-proof plant growth system |
总氮差异法是计算一个系统试验前后总氮的差异来定量该系统在一定时间内生物固定的氮量。该=方法原理简单,只要测出试验期间输入、输出该系统的各氮分量,多出的部分就是生物固氮的氮量。可实施起来非常困难。输入有土壤氮、干湿沉降、通过灌溉水输入量、通过地下水输入量;输出有氨挥发、硝化-反硝化、径流、淋溶、土壤氮和植物带走的氮。要准确测出这些输入、输出氮分量非常困难。短时间内利用该法定量生物固氮量几乎不能实现。如果通过长时间试验,忽视干湿沉降,通过灌溉水输入量、地下水输入量、氨挥发、硝化-反硝化、径流和淋溶的氮,可以粗略地估算出生物固定的氮。
15N同位素自然丰度法:土壤氮素自然转化过程中14N优先离开土壤系统而使得15N在土壤中富集,造成土壤中的15N丰度高于生物利用大气氮固定氮的丰度[10]。也就是土壤中的15N丰度与生物固定氮的15N丰度不一样。这个方法比较适用于没有人为扰动的自然生态系统中,如不施肥草地和林地。如果自然生态土壤系统中的15N丰度高于大气,那么就可以用来定量研究生物固氮。但在农田生态系统中,由于大量施用与大气15N丰度相似的氮肥,而使得农田土壤15N与大气15N丰度相似,使得该方法难以用于农田生态系统。
15N同位素稀释法:15N稳定性同位素稀释法是研究共生固氮主要方法。该方法利用15N同位素标记肥料对一个固氮植物和非固氮植物(参照植物)进行标记,通过测定植物、土壤15N丰度和含量,来计算生物固定的氮量。该方法一般不考虑其他输入和其他输出。该方法需要参照植物与固氮植物有相似的根系分布、生长特性、吸氮能力和吸氮喜好。而且由于该方法需要有不固氮的参照系,在不能找到不固氮参照系时无法使用。
乙炔还原法是通过测定乙炔还原酶活性的变化来表征稻田生物固氮能力的变化,主要用于生物固氮的定性和半定量研究。固氮酶能将N2还原成NH3,也能将乙炔还原成乙烯。该方法一般是将样品采回来放在实验室条件下,往样品中注入乙炔,混匀。通过测定两个时间点培养瓶中乙烯浓度的变化来计算乙炔还原量。然后通过乙炔还原量与固氮量的理论转化系数来换算成生物固氮量。乙炔还原量与固氮量间的理论转换系数为3:1,即3 mol乙炔还原量=1 mol固氮量。但固氮菌中的固氮酶在还原乙炔过程中受环境条件影响,有很大的不确定性[11]。Spiff和Odu[12]发现在砖红壤(latosols)上只有0.56,而Rice和Paul[13]发现在滞水条件下达15。Nohrstedt[14]发现水分含量对转化系数影响巨大:当土壤水分饱和时达15.7,而当土壤水分低于饱和水分的75%时只有2.6。Hardy等[15]给出了4.3作为平均转化系数。目前用乙炔还原法研究生物固氮量时通常采用3作为转化系数。相对于15N2气体标记法,乙炔还原法简单、便宜和灵敏。虽然乙炔还原量和固氮量间的转化系数存在不确定性,但仍是研究生物固氮的常用方法。
3 稻田生物固氮量影响因素研究表明稻田的淹水环境为光合固氮菌和异养固氮菌的生物固氮提供了合适的pH和氧化还原状况等条件[8]。土壤水分状况、水稻品种、施肥和碳源均影响稻田的生物固氮[8, 16-18]。土壤有机质高的土壤有利于稻田固氮菌生长,有机物的施用促进土壤生物固氮[16-18]。稻草秋季还田的土壤乙炔还原酶活性仅为春季还田的30%;光照条件下纤维素还田土壤的固氮效率是黑暗条件下的3倍[8]。大量NH4+抑制固氮酶(nitrogenase)活性,而少量施氮对固氮酶活性没有影响[19-20];Charyulu等[18]报道少量氮肥促进土壤固氮,而大量施用抑制固氮;而且与施肥方式和氮肥种类有关[21]。Wang等[22]研究了东北黑土、江苏下位砂姜土、江西红壤和四川紫色土发育水稻土的土壤属性与生物固氮量的关系。他们利用Spearman相关技术分析表明生物固氮量与土壤pH,交换性Na、Mg,总Ca、总Mg成正相关,与交换性Al3+、活性和无定形Al氧化物成负相关。他们进一步分析表明土壤pH又与交换性Na、Mg,总Ca、总Mg成显著正相关,与交换性Al3+、活性和无定形Al氧化物成显著负相关。但生物固氮量与固氮菌数量(nifH基因拷贝数)没有关系。进一步在固氮菌OTU水平(操作分类单元水平)分析表明生物固氮量与念珠藻量成显著正相关。他们用随机森林模型中的均方差增加百分法评估了土壤各属性对生物固氮影响的相对重要性,结果表明Al氧化物最重要,其他依次为活性Fe、活性Al、总Mg、交换性Mg、C/N、有效Cu、土壤有机质、黏粒含量和阳离子交换量。
4 稻田固氮微生物及活跃固氮微生物我国从20世纪70年代末开始从水稻根系分离固氮微生物。丘元盛等[23]分离到2种固氮菌为粪产碱菌和阴沟肠杆菌。谭志远等[24]从广东和海南普通野生稻中分离到37株内生固氮菌,采用固氮酶nifH基因PCR扩增测序检测技术,鉴定可能属于克雷伯氏菌属、泛菌属、克雷伯氏肺炎杆菌、阿氏肠杆菌、阴沟肠杆菌、丙二酸柠檬酸杆菌、成团泛菌。孙建光等[25]采用16S rDNA序列分析技术,分析了北京、内蒙古、河北、辽宁、山东、陕西、宁夏、广东、新疆、福建、贵州、四川和黑龙江等13个省市自治区67个旱地土壤和3个稻田土壤样品中的固氮微生物资源,得到非共生固氮微生物资源181份,其中有36%属于类芽孢杆菌属,29%属于芽孢杆菌属,11%属于节杆菌属。Islam Rashedul等[26]采用无氮培养分离技术对韩国7种不同施肥管理措施下的稻田固氮微生物进行了分离,分离到165份细菌,其中32份具有固氮基因,分别为布克氏菌、鞘氨醇单胞菌、甲基杆菌、假单胞菌、新鞘氨醇杆菌、杆菌、类芽孢杆菌、肠杆菌、克雷白氏杆菌、分枝杆菌、玫瑰单胞菌、环丝菌、寡养单胞菌、叶杆菌、格里蒙菌。da Costa等在巴西3种不同施肥管理土壤上分离到190份疑似固氮微生物,除了Islam Rsshedul等[26]在韩国土壤中发现的布克氏菌、鞘氨醇单胞菌、假单胞菌、杆菌、类芽孢杆菌、肠杆菌、克雷白氏杆菌、寡养单胞菌等固氮菌外,还有噬氢菌、固氮根瘤菌、苍白杆菌、产碱杆菌、根瘤菌、不动杆菌、葡萄球菌、泛菌、埃希氏菌、柠檬酸细菌、无色杆菌、土壤杆菌[27]。
活跃固氮微生物指的是发挥固氮作用的固氮微生物。稻田中均有固氮微生物,但稻田中的固氮微生物种类和固氮能力各不相同,它们受水稻土类型、性质和管理措施影响。目前有一些关于稻田固氮微生物数量和种类的报道,但很少有关于活跃固氮微生物研究的报道。这与研究活跃固氮微生物难度较大有关,虽然稳定性同位素核酸探针(DNA or RNA stable isotope probing)技术为研究活跃固氮微生物提供了途径。由于DNA或RNA中C的含量是N的两倍多,13C-SIP技术从2000年建立[28]以来已取得一些进展[29-32],但15N-DNA(RNA)-SIP技术进展缓慢。Ma等[33]用99 atom% 15N2研究了Mo施用对稻田土壤活跃固氮微生物的影响,发现非异形蓝细菌(non-heterocystous cyanobateria)细鞘丝藻属(leptolyngbya)和微鞘藻属(Microcoleus)是主要的活跃固氮微生物。Buckley等[34]用99.8 atom% 15N2室内培养土壤的方法研究长期休闲土壤的固氮微生物,但遗憾的是结果中没有提供证据证明15N-DNA在密度梯度离心的那一层,也没有提供DNA15N丰度来证明哪些微生物确实发生了固氮作用。大量发表的13C-DNA(RNA)-SIP文章也没有提供DNA(RNA)13C丰度[29-32]。原因是用稳定性同位素比值质谱仪和液相色谱-质谱联用仪测定13C丰度需要0.8~1.0 µg的核酸,而一般土壤提取的DNA(RNA)只有10~200 ng,无法满足测定需要[35-36]。而DNA(RNA)中N较C要少,这就需要更多的DNA(RNA)。纳米二次离子质谱(Nanoscale secondary ion mass spectrometry-NanoSIMS)实现了成像与单细胞稳定性同位素测定的有机结合[37-38]。Woebken等[39]用NanoSIMS技术和15N2标记技术,测定了15N2标记和非标记单细胞蓝细菌体内15N丰度,证明了美国Monterey海湾Elkhorn Slough河口微生物簇群中的蓝细菌具有固氮能力。这些工作说明NanoSIMS技术可以满足DNA密度梯度离心后各层中极微量DNA 15N的测定,但能在多大程度上解决稻田活跃固氮微生物问题还缺乏研究。
5 稻田生物固氮调控增加稻田生物固氮量可以减少化学氮肥使用、减少环境污染、降低能源消耗和提高农民收入,是长期想实现而又没有取得大的进展。有研究表明施用有机物能促进稻田生物固氮[16-18]。Ma等[33]发现在低有效钼土壤上(下位砂姜土)施用钼酸钠(1 kg hm-2)74天能使稻田生物固氮量由22.3 kg hm-2提高至53.1 kg hm-2。Ma等[40]的研究还表明种植杂交水稻较常规粳稻能提高生物固氮。Andreozzi等[41]接种Herbaspirillum huttiense RCA24,Enterobacter asburiae RCA23和Staphylococcus sp. 377发现Herbaspirillum huttiense RCA24的表现最好,能提高生物固氮、增加叶绿素含量、提高氮含量和水稻幼苗干重。但稻田生物固氮的研究还很不够,非常缺乏大田应用研究。
6 稻田生物固氮未来研究方向稻田生物固氮的现象早被发现,但由于研究的难度非常大,进展一直不大。为实现粮食产量和生态协调发展,有必要加大稻田生物固氮研究。
(1)DNA基因测序是目前研究稻田固氮微生物的常用方法,可以提供较多的信息,但DNA测序基因序列在与现有微生物数据库比对时,往往出现很多无法匹配的情况。主要原因是目前固氮微生物基因数据库中固氮微生物种类较少。而固氮微生物基因数据库中的基因数据来源于纯菌的分离和全基因测序。因此在测序大量采用的时候,纯菌的分离、培养和全基因测序需要进一步加强。
(2)关于稻田生物固氮量和固氮微生物,目前只对少数几种水稻土开展了研究。我国稻田类型众多,成土母质和环境条件各异,需要进一步加强研究。
(3)研究发现秸秆还田、接种固氮微生物菌剂和在低有效钼土壤上施钼可以大幅度提高稻田生物固氮量,但均还处在研究初期阶段,还需要继续研究,尤其要加强田间实际应用效果研究。
(4)稻田固氮微生物不仅具有固氮功能,为植物提供氮素,还能分泌激素等促生物质促进植物生长,但目前高效固氮微生物菌剂的开发力度不大,需要加强,同时需要加强固氮微生物与植物的互作研究。
(5)固氮微生物存在氮抑制,即在有氮条件下,固氮微生物不固氮或减少固氮。如何通过基因工程的办法解除氮抑制是需要加强研究的课题。
| [1] |
李少昆, 王崇桃. 我国玉米产量变化及增产因素分析. 玉米科学, 2008(4): 32-36. Li S K, Wang C T. Analysis on change of production and factors promoting yield increase of corn in China (In Chinese). Journal of Maize Sciences, 2008(4): 32-36. (  0) 0) |
| [2] |
虞国平, 朱鸿英. 我国水稻生产现状及发展对策研究. 现代农业科技, 2009(6): 123-127, 131. Yu G P, Zhu H Y. Studies on production situation and development countermeasures of rice in China (In Chinese). Modern Agricultural Science and Technology, 2009(6): 123-127, 131. (  0) 0) |
| [3] |
Galloway J N, Dentener F, Capone D G, et al. Nitrogen cycles:Past, present, and future . Biogeochemistry, 2004, 70(2): 153-226. DOI:10.1007/s10533-004-0370-0
(  0) 0) |
| [4] |
Natuhara Y. Ecosystem services by paddy fields as substitutes of natural wetlands in Japan . Ecological Engineering, 2013, 56: 97-106. DOI:10.1016/j.ecoleng.2012.04.026
(  0) 0) |
| [5] |
Fowler D, Coyle M, Skiba U, et al. The global nitrogen cycle in the twenty-first century . Philosophical Transactions of the Royal Society B, 2013, 368(1621): 20130164. DOI:10.1098/rstb.2013.0164
(  0) 0) |
| [6] |
Cleveland C C, Townsend A R, Schimel D S, et al. Global patterns of terrestrial biological nitrogen(N2)fixation in natural ecosystems . Global Biogeochemical Cycles, 1999, 13(2): 623-645. DOI:10.1029/1999GB900014
(  0) 0) |
| [7] |
Herridge D F, Peoples M B, Boddey R M, et al. Global inputs of biological nitrogen fixation in agricultural systems . Plant and Soil, 2008, 311: 1-18. DOI:10.1007/s11104-008-9668-3
(  0) 0) |
| [8] |
Kondo M, Yasuda M. Seasonal changes in N2 fixation activity and N enrichment in paddy soils as affected by soil management in the northern area of Japan . Jarq-Japan Agricultural Research Quarterly, 2003, 37(2): 105-111. DOI:10.6090/jarq.37.105
(  0) 0) |
| [9] |
Bei Q C, Liu G, Tang H Y, et al. Heterotrophic and phototrophic 15N2 fixation and distribution of fixed 15N in a flooded rice-soil system . Soil Biology and Biochemistry, 2013, 59: 25-31. DOI:10.1016/j.soilbio.2013.01.008
(  0) 0) |
| [10] |
Shearer G, Kohl D H, Chien S H. The nitrogen-15 abundance in a wide variety of soils . Soil Science Society of America Journal, 1978, 42(6): 899-902. DOI:10.2136/sssaj1978.03615995004200060013x
(  0) 0) |
| [11] |
An S M, Gardner W S, Kana T, et al. Simultaneous measurement of denitrification and nitrogen fixation using isotope pairing with membrane inlet mass spectrometry analysis . Applied and Environmental Microbiology, 2001, 67(3): 1171-1178. DOI:10.1128/AEM.67.3.1171-1178.2001
(  0) 0) |
| [12] |
Spiff E D, Odu C T I. An assessment of non-symbiotic nitrogen fixation in some nigerian soils by the acetylene reduction technique . Soil Biology and Biochemistry, 1972, 4(1): 71-77. DOI:10.1016/0038-0717(72)90044-2
(  0) 0) |
| [13] |
Rice W A, Paul E A. The acetylene reduction assay for measuring nitrogen fixation in waterlogged soil . Canadian Journal of Microbiology, 1971, 17(8): 1049-1056. DOI:10.1139/m71-166
(  0) 0) |
| [14] |
Nohrstedt H Ö. Conversion factor between acetylene reduction and nitrogen fixation in soil:Effect of water content and nitrogenase activity . Soil Biology and Biochemistry, 1983, 15(3): 275-279. DOI:10.1016/0038-0717(83)90071-8
(  0) 0) |
| [15] |
Hardy R W F, Burns R C, Holsten R D, et al. Applications of the acetylene-ethylene assay for measurement of nitrogen fixation . Soil Biology and Biochemistry, 1973, 5(1): 47-81. DOI:10.1016/0038-0717(73)90093-X
(  0) 0) |
| [16] |
Charyulu P B B N, Rajaramamohan-Rao V. Influence of carbon substrates and moisture regime on nitrogen fixation in paddy soils . Soil Biology and Biochemistry, 1981, 13(1): 39-42. DOI:10.1016/0038-0717(81)90100-0
(  0) 0) |
| [17] |
Rajaramamohan-Rao V. Nitrogen fixation as influenced by moisture content, ammonium sulphate and organic sources in a paddy soil . Soil Biology and Biochemistry, 1976, 8(5): 445-448. DOI:10.1016/0038-0717(76)90048-1
(  0) 0) |
| [18] |
Charyulu P B B N, Nayak D N, Rajaramamohan-Rao V, et al. 15N2 incorporation by rhizosphere soil influence of rice variety, organic matter and combined nitrogen . Plant and Soil, 1981, 59(3): 399-405. DOI:10.1007/BF02184544
(  0) 0) |
| [19] |
Valiente E F, Quesada A, Prosperi C, et al. Short- and long-term effects of ammonium on photodependent nitrogen fixation in wetland rice fields of Spain . Biology and Fertility of Soils, 1997, 24(4): 353-357. DOI:10.1007/s003740050257
(  0) 0) |
| [20] |
Watanabe I, De Guzman M R, Cabrera D A, et al. The effect of nitrogen fertilizer on N2 fixation in the paddy field measured by in situ acetylene reduction assay . Plant and Soil, 1981, 59(1): 135-139. DOI:10.1007/BF02183599
(  0) 0) |
| [21] |
Roger P A, Ladha J K. Biological N2 fixation in wetland rice fields:Estimation and contribution to nitrogen balance . Plant and Soil, 1992, 141: 41-55. DOI:10.1007/BF00011309
(  0) 0) |
| [22] |
Wang X J, Liu B J, Ma J, et al. Soil aluminum oxides determine biological nitrogen fixation and diazotrophic communities across major types of paddy soils in China . Soil Biology and Biochemistry, 2019, 131: 81-89. DOI:10.1016/j.soilbio.2018.12.028
(  0) 0) |
| [23] |
丘元盛, 周淑萍, 莫小真, 等. 稻根联合固氮细菌的研究-Ⅰ.菌种的分离和鉴定. 微生物学报, 1981, 21(4): 468-472. Qiu Y S, Zhou S P, Mo X Z, et al. Studies on associative diazotrophs in the rhizosphere of rice-Ⅰ. Isolation and identification of bacteria (In Chinese). Acta Microbiologica Sinica, 1981, 21(4): 468-472. (  0) 0) |
| [24] |
谭志远, 彭桂香, 徐培智, 等. 普通野生稻(Oryza rufipogon)内生固氮菌多样性及高固氮酶活性. 科学通报, 2009, 54(13): 1885-1893. Tan Z Y, Peng G X, Xu P Z, et al. Diversity and high nitrogenase activity of endophytic diazotrophs in common wild rice (In Chinese). Chinese Science Bulletin, 2009, 54(13): 1885-1893. (  0) 0) |
| [25] |
孙建光, 徐晶, 胡海燕, 等. 中国十三省市土壤中非共生固氮微生物菌种资源研究. 植物营养与肥料学报, 2009, 15(6): 1450-1465. Sun J G, Xu J, Hu H Y, et al. Collection and investigation on asymbiotic nitrogen-fixing microbial resources from 13 provinces over China (In Chinese). Plant Nutrition and Fertilizer Science, 2009, 15(6): 1450-1465. DOI:10.3321/j.issn:1008-505X.2009.06.030 (  0) 0) |
| [26] |
Islam M R, Sultana T, Cho J C, et al. Diversity of free-living nitrogen-fixing bacteria associated with Korean paddy fields . Annals of Microbiology, 2012, 62(4): 1643-1650. DOI:10.1007/s13213-012-0421-z
(  0) 0) |
| [27] |
da Costa P B, Beneduzi A, De Souza R, et al. The effects of different fertilization conditions on bacterial plant growth promoting traits:Guidelines for directed bacterial prospection and testing . Plant and Soil, 2013, 368: 267-280. DOI:10.1007/s11104-012-1513-z
(  0) 0) |
| [28] |
Radajewski S, Ineson P, Parekh N R, et al. Stable-isotope probing as a tool in microbial ecology . Nature, 2000, 403(6770): 646-649. DOI:10.1038/35001054
(  0) 0) |
| [29] |
Daebeler A, Bodelier P L E, Yan Z, et al. Interactions between thaumarchaea, nitrospira and methanotrophs modulate autotrophic nitrification in volcanic grassland soil . The ISME Journal, 2014, 8(12): 2397-2410. DOI:10.1038/ismej.2014.81
(  0) 0) |
| [30] |
Wang B Z, Zhao J, Guo Z Y, et al. Differential contributions of ammonia oxidizers and nitrite oxidizers to nitrification in four paddy soils . The ISME Journal, 2015, 9(5): 1062-1075. DOI:10.1038/ismej.2014.194
(  0) 0) |
| [31] |
Xia W W, Zhang C X, Zeng X W, et al. Autotrophic growth of nitrifying community in an agricultural soil . The ISME Journal, 2011, 5(7): 1226-1236. DOI:10.1038/ismej.2011.5
(  0) 0) |
| [32] |
Wilhelm R, Szeitz A, Klassen T L, et al. Sensitive, efficient quantitation of 13C-enriched nucleic acids via ultra high-performance liquid chromatography-tandem mass spectrometry for applications in stable isotope probing . Applied and Environmental Microbiology, 2014, 80(23): 7206-7211. DOI:10.1128/AEM.02223-14
(  0) 0) |
| [33] |
Ma J, Bei Q C, Wang X J, et al. Impacts of Mo application on biological nitrogen fixation and diazotrophic communities in a flooded rice-soil system . Science of the Total Environment, 2019, 649: 686-694. DOI:10.1016/j.scitotenv.2018.08.318
(  0) 0) |
| [34] |
Buckley D H, Huangyutitham V, Hsu S F, et al. Stable isotope probing with 15N achieved by disentangling the effects of genome G+C content and isotope enrichment on DNA density . Applied and Environmental Microbiology, 2007, 73(10): 3189-3195. DOI:10.1128/AEM.02609-06
(  0) 0) |
| [35] |
Auclair J, Lepine F, Villemur R. A liquid chromatography mass spectrometry method to measure 13C-isotope enrichment for DNA stable-isotope probing . Canadian Journal of Microbiology, 2012, 58(3): 287-292. DOI:10.1139/w11-133
(  0) 0) |
| [36] |
Rangel-Castro J I, Killham K, Ostle N, et al. Stable isotope probing analysis of the influence of liming on root exudate utilization by soil microorganisms . Environmental Microbiology, 2005, 7(6): 828-838. DOI:10.1111/j.1462-2920.2005.00756.x
(  0) 0) |
| [37] |
Clode P L, Kilburn M R, Jones D L, et al. In situ mapping of nutrient uptake in the rhizosphere using nanoscale secondary ion mass spectrometry . Plant Physiology, 2009, 151(4): 1751-1757. DOI:10.1104/pp.109.141499
(  0) 0) |
| [38] |
Nunez J, Renslow R, Cliff Ⅲ J B, et al. NanoSIMS for biological applications:Current practices and analyses . Biointerphases, 2018, 13(3): 03B301. DOI:10.1116/1.4993628
(  0) 0) |
| [39] |
Woebken D, Burow L C, Behnam F, et al. Revisiting N2 fixation in Guerrero Negro intertidal microbial mats with a functional single-cell approach . The ISME Journal, 2015, 9(2): 485-496. DOI:10.1038/ismej.2014.144
(  0) 0) |
| [40] |
Ma J, Bei Q C, Wang X J, et al. Paddy system with a hybrid rice enhances cyanobacteria Nostoc and increases N2 fixation . Pedosphere, 2019, 29(3): 374-387. DOI:10.1016/S1002-0160(19)60809-X
(  0) 0) |
| [41] |
Andreozzi A, Prieto P, Mercadoblanco J, et al. Efficient colonization of the endophytes Herbaspirillum huttiense RCA24 and Enterobacter cloacae RCA25 influences the physiological parameters of Oryza sativa L. cv. Baldo rice . Environmental Microbiology, 2019, 21(9): 3489-3504. DOI:10.1111/1462-2920.14688
(  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2020, Vol. 57
2020, Vol. 57


