2. 湿润亚热带山地生态国家重点实验室培育基地,福州 350007;
3. 福建三明森林生态系统与全球变化研究站,福建三明 365000
森林生态系统是陆地生态系统的主体部分, 其生物量以及生产量占到陆地生态系统的90%和70%[1], 储存着陆地生态系统45%左右的碳, 在维持全球碳氮平衡、减缓大气的温室效应等方面发挥着重要的作用。凋落物作为森林生态系统的重要组成部分, 是土壤有机质的重要物质源也是土壤碳氮的主要来源, 凋落物每年通过分解归还到土壤里的有机碳约为50 Gt、归还到土壤中的总氮大约是植物所需氮量的70%~80%[2]。凋落物的输入深刻影响着森林生态系统的碳氮循环过程。
全球气候变暖已成为不争的事实。随着气温的升高和大气CO2浓度增加可能会导致我国热带亚热带地区森林生产力增加, 新陈代谢增强, 凋落物增多[3-5]。凋落物的增加会改变对土壤中碳氮的输入, 影响土壤中的碳氮过程。一方面有观点认为, 凋落物输入量的增加促进了土壤中有机碳的积累[6-7], 另一方面有观点认为凋落物量的增加导致向土壤中输入更多的新鲜可溶性有机质, 加速土壤中有机碳氮的分解, 促使土壤有机碳氮产生激发效应[8-9], 并最终导致土壤有机碳氮含量的下降。凋落物对土壤有机质的影响取决于凋落物自身的特性和土壤条件。传统的观点认为土壤有机质长期积累主要由难分解(高C/N)植物凋落物形成的, 因为高质量(低C/N)的凋落物降解速度更快, 不易在土壤中积累, 而难分解的凋落物通过抵抗降解在土壤中积累[10]。然而越来越多的研究提出了相反的观点, 有研究通过室内培养实验发现, 低质量的凋落物输入增多可能会导致土壤更加缺氮, 加剧了微生物对N素的需求, 促进微生物对土壤有机质的分解从而获取N素, 可能不利于土壤有机质的积累[11]; 高质量(低C/N)凋落物有利于土壤微生物的转化和吸收, 并最终以微生物残体的形式进入土壤, 有利于土壤有机质的积累[12]。
我国亚热带地区属于海洋性季风气候, 分布着世界上面积最大的常绿阔叶林。然而, 过去几十年来由于对木材和其他林产品的需求, 大面积天然常绿阔叶林被人工林、特别杉木人工林取代[13]。现有杉木林面积约900万hm2, 占全国人工林面积的30%[14]。那么未来气候变化背景下, 杉木人工林土壤碳氮固持能力对亚热带地区具有重要的影响。假定未来气候变化(如气温升高, CO2浓度增加)能够促进亚热带杉木人工林生产力的提高, 从而增加地上凋落物输入, 那么杉木凋落物输入量增加, 对杉木林中土壤碳氮过程产生怎样的影响, 土壤中碳氮固持是增多还是减少?针对这个科学问题, 本研究以亚热带杉木人工林为研究对象, 通过对林中土壤设置去除与添加(一倍)凋落物处理为期四年的控制试验, 研究杉木林凋落物输入量的变化对土壤碳氮循环过程产生的影响, 为进一步认识全球变化背景下亚热带杉木人工林土壤碳氮过程的响应机制提供依据。
1 材料与方法 1.1 研究区概况研究样地位于福建三明全球变化森林生态研究站(26° 09′24″N, 117° 28′03″E), 地处武夷山东南、戴云山西北, 以低山丘陵为主, 平均海拔300 m, 属于中亚热带季风气候。实验3年期间(2013—2015年)年均降水量1 749 mm, 主要集中在3—8月份。年均气温18.7℃, 蒸发量1 585 mm, 相对湿度81%, 无霜期达300 d。植被以常绿阔叶林为主, 森林覆盖率可达67.8%[15], 土壤以花岗岩发育的红壤为主。1976年将米槠天然林皆伐、炼山后营造成杉木人工林。样地林分密度2 858株·hm-2, 平均树高18.2 m、胸径15.6 cm, 林下植物以毛冬青(Ilex pubescens)、芒萁(Dicranopteris dichotoma)、狗骨柴(Diplospora dubia)为主。
1.2 试验设计与样品采集2012年6月, 在杉木人工林设置3个20 m×20 m的标准样地, 在每个样地内设3个1 m×1 m的小区作不同处理:(1)CK, 保留凋落物, 即不做任何处理; (2)LE, 去除凋落物, 去除小区地表全部凋落物, 并在小区上方0.5 m高处放置1.5 m×1.5 m大小的正方形尼龙网, 阻止凋落物掉入; (3)LA, 添加凋落物, 每月将LE处理中尼龙网上截留的凋落物移至添加凋落物处理的小区内。每种处理设3个重复, 共9个小区。
2016年5月, 在每个小区中随机多点采样, 去除凋落物, 取0~10 cm的土层样品并混合。随后将土壤样品放置于保温箱中保存, 然后带回室内处理分析。在去除土壤中的根系以及石块后, 取部分新鲜土样于-20℃保存待测土壤酶活性, 其余土壤过2 mm筛, 取少量鲜土自然风干后过0.154 mm钢筛, 测定土壤理化性质。
1.3 测定方法土壤中全碳、全氮含量采用土壤碳氮元素分析仪(Elementar Vario MAX, Germany)进行测定, 可溶性有机碳、氮(DOC、DON)含量采用硫酸钾提取[16]、TOC-VCPN分析仪测定, 微生物生物量碳、氮(MBC、MBN)采用氯仿熏蒸—硫酸钾提取[17]、TOC-VCPN、流动(QC8000)分析仪测定, 土壤中δ13C、δ15N采用稳定同位素质谱仪(IsoPrime100, Isoprime, Manchester, UK)测定。
土壤酶活性测定:参照Saiya-Cork等[18]的方法测定土壤中6种参与碳、氮、磷循环相关的酶活性。用伞形酮(MUB)作为标示底物来测定4类水解酶活性:包括β-葡萄糖苷酶(βG)(EC3.2.1.21)、纤维素水解酶(CBH)(EC3.2.1.91)、β-N-乙酰氨基葡萄糖苷酶(NAG)(EC3.1.1.14)和酸性磷酸酶(AP)(EC 3.1.3.2)。氧化酶中酚氧化酶(PHO)(EC1.14.18.1)和过氧化物酶(PEO)(EC 1.11.1.7)测定采用L-二羟苯丙氨酸(DOPA)为底物, 用多功能酶标仪(Synergy H4, 美国)测定荧光度(水解酶)或吸光度(氧化酶), 各种酶的缩写、反应类型及所用底物见表 1。
|
|
表 1 研究选取的胞外酶相应的底物及功能 Table 1 Related substrates and functions of extracellular enzymes in this study |
悬浮样品制备:取1g鲜土置于125 mL、50 mmol·L-1、pH 5.0的醋酸盐缓冲液中, 用磁力搅拌器搅拌使其均质化, 后用移液器取200 μL移入96孔微孔板, 用酶标仪进行测定。
1.4 数据分析所有数据运用SPSS20.0软件进行分析, 采用单因素方差分析(One-way ANOVA)进行差异性分析, 运用Origin9软件进行作图。
2 结果 2.1 凋落物添加与去除对土壤碳氮的影响经过四年的控制试验, 添加凋落物处理土壤NH4+-N、NO3--N相较于对照均显著下降(P < 0.05), 而SOC、DOC则未发生显著变化。全氮、DON差异不显著, 但相较于去除凋落物处理则显著降低(P<0.05)。去除凋落物后, NH4+-N较对照显著升高而NO3--N显著下降(P < 0.05), SOC、DOC则无显著变化(表 2)。与对照相比, 凋落物添加未对土壤微生物生物量碳、氮产生显著影响, 而凋落物去除导致土壤MBC极显著上升、土壤MBN极显著下降(P < 0.01)。凋落物添加与去除对土壤C/N无显著影响。土壤DOC/DON在凋落物添加后显著上升, 去除处理则较对照显著下降(P < 0.05), 说明土壤DOC/DON呈现出随凋落物增加而升高的趋势。土壤MBC/MBN在凋落物添加处理后未出现显著变化, 而在凋落物去除处理中相较于对照与添加处理表现出极显著的变化(P < 0.01)。
|
|
表 2 凋落物处理下土壤碳氮含量变化 Table 2 Changes in soil carbon and nitrogen relative to litter treatment |
通过对土壤C、N同位素自然丰度的分析发现, 添加凋落物较去除凋落物相比, δ13C丰度则显著上升(P < 0.05, 图 1), 与对照相比, 添加与去除凋落物后土壤中δ13C丰度均无显著变化(P>0.05), 但δ13C丰度呈现出随着凋落物下降而减少的趋势。凋落物添加显著提高土壤δ15N值, 而凋落物去除降低了土壤δ15N值, 说明随着凋落物输入增加土壤δ15N值也逐渐升高。
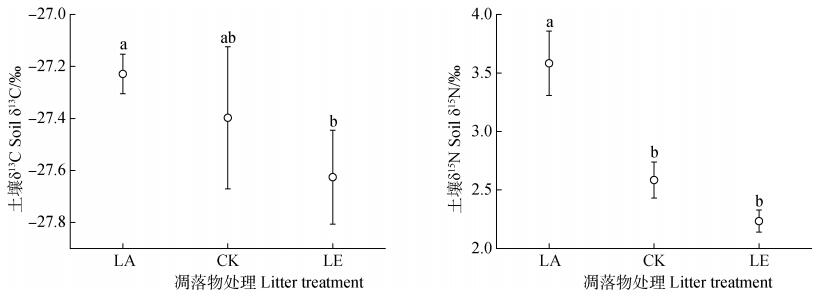
|
图 1 凋落物处理下土壤碳氮同位素的变化 Fig. 1 Change in soil C and N isotopes relative to litter treatment |
凋落物添加后, 土壤β葡萄糖苷酶、酸性磷酸酶活性显著下降(P < 0.05), 而β-N-乙酰氨基葡萄糖苷酶、酚氧化酶、过氧化物酶活性显著升高(P < 0.05), 纤维素水解酶呈现下降现象但未达到显著水平(P>0.05)。去除凋落物处理后, β葡萄糖苷酶、纤维素水解酶、酸性磷酸酶、过氧化物酶均显著下降(P < 0.05), 而β-N-乙酰氨基葡萄糖苷酶与酚氧化酶变化不显著(P>0.05)。
3 讨论 3.1 土壤碳氮对凋落物处理的响应凋落物可以通过两种途径来影响着土壤养分, 一方面是通过淋溶、分解作用直接为土壤提供可溶性养分, N的含量是凋落物分解过程中主要的影响因素; 另一方面通过影响土壤微生物来改变土壤的养分[19-20]。本研究中, 杉木林凋落物处理四年后, 添加凋落物处理土壤DON、铵态氮、硝态氮均发生显著下降现象, 而且凋落物添加处理后, DOC/DON明显升高, 表明杉木凋落物增多时土壤氮含量下降, 而土壤微生物生物量碳氮未发生显著变化, 表明微生物量未发生变化, 这与Wisconsin的橡树林中添加凋落物导致土壤氮增加的结论相反[21], 可能是因为本实验中未对杉木根系做出处理。凋落物添加后可能对土壤中杉木细根产生了影响, 凋落物作为土壤养分源, 添加后会对细根的觅养行为产生影响, 部分根系延伸至凋落物层及凋落物层与表层土壤连接处, 导致细根生物量[22]和菌根侵染率[23]增加, 更好地吸收凋落物层中淋溶出的及土壤中的养分, 因此, 添加凋落物可能会影响植物与微生物之间的养分利用关系。杉木作为内生菌根树种, 其菌根无法分解有机质, 只能通过向腐生微生物提供光合产物, 刺激腐生微生物分解土壤有机质, 为其提供氮素, 从而导致土壤中氮素消耗增加、土壤氮含量下降。数据显示凋落物添加后土壤中氮获得酶显著升高, 这进一步印证了由于土壤中氮素的损失导致微生物为满足自身需求不得不增强β-N-乙酰氨基葡萄糖苷酶的分泌来获取氮素(图 2)。此外, 凋落物添加后导致土壤含水率增加[24], 可能增强了土壤中氮的硝化-反硝化作用, 提高了土壤氮气态损失的风险。而无论是凋落物添加还是去除处理, 对土壤有机碳的影响均不明显, 可能是因为凋落物分解对于土壤中总有机碳的改变需要较长的时间[25]; 孙丽娟等[26]在2010年鼎湖山地区针阔叶混交林中通过添加凋落物后发现, 添加凋落物对土壤碳的影响不明显。相比土壤氮而言, 土壤有机碳本身的背景值较大, 短期的控制实验很难对土壤有机碳产生显著的影响。
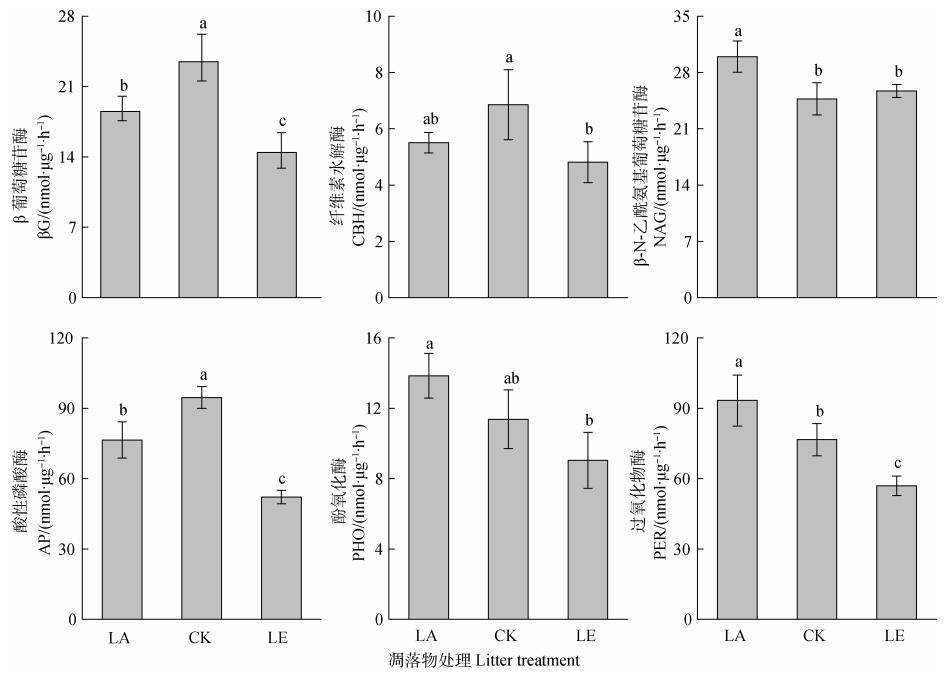
|
图 2 凋落物处理下土壤酶活性的变化 Fig. 2 Change in soil enzyme activity relative to litter treatment |
目前多数研究利用土壤C、N同位素自然丰度值的变化从微观的角度来揭示土壤碳氮的变化[27-28]。因为同位素具有分馏效应, 所以不同物质之间C、N同位素丰度有差异[29]。土壤中δ13C、δ15N组成能较好的阐明土壤中有机碳与全氮的迁移、转化并能够对土壤中有机质的分解程度进行评估, 是研究土壤碳氮循环的重要工具[30]。有关研究发现, 影响土壤有机碳中δ13C值的主要因素是土壤微生物的分解作用和植物凋落物及其根系的δ13C值[31]。本研究中土壤δ13C丰度与凋落物量并没有呈现出相关规律性:凋落物添加与去除处理后δ13C相对于对照来说均未产生显著变化。因此, 从土壤δ13C的角度进一步说明了凋落物量的变化对土壤有机碳的影响较小。而且, 凋落物添加处理后, 土壤β葡萄糖苷酶显著降低, 一定程度上反应了土壤中活性碳组分的分解减少, 因为凋落物添加处理后微生物具有丰富碳源, 微生物不需要分泌多余的胞外酶来获取碳源。土壤δ15N丰度在凋落物添加后显著升高, 凋落物去除后显著降低, 说明土壤中氮对凋落物的处理更为敏感, 而土壤碳受其影响较小。有研究显示[32], 表层土壤氮同位素与植物体氮同位素具有显著相关性, 地上植被对土壤氮同位素具有重要影响, 本研究中, 凋落物添加后显著提高了土壤δ15N丰度值, 一般而言, 土壤δ15N丰度值越高, 说明这个系统越开放, 土壤中N较容易损失[33], 所以, 凋落物添加后δ15N丰度的升高一定程度上反映了土壤中可能发生了氮素的转移或损失, 如土壤中DON、铵态氮和硝态氮显著降低。杉木凋落物输入增加导致β-N-乙酰氨基葡萄糖苷酶上升, 主要与土壤中氮素的减少有关, 凋落物添加后可能导致的植物细根生物量的增加会使得植物进一步吸收土壤氮素, 微生物需要同植物共同竞争土壤氮素, 从而使微生物分泌更多的氮获得酶来满足自身需求。微生物具有自身相对稳定的碳氮比, 当土壤中氮素减少时, 微生物就会通过调节自身对不同胞外酶的分泌, 即分泌更多的氮获得酶来获取自身稳定的碳氮比。此外, 凋落物添加处理后, 土壤微生物C/N无显著变化; 但去除凋落物处理显著降低了微生物C/N, 这可能是因为凋落物去除一方面减少了有机碳的输入, 同时也会去除凋落物层中的微生物, 导致了微生物群落结构发生了变化, 造成微生物C/N下降[34]。
3.3 土壤酶活性对凋落物处理的响应从土壤中酚氧化酶和过氧化氢酶的变化也可以证实上述推理, 凋落物添加处理, 酚氧化酶和过氧化氢酶活性均增加, 而凋落物去除后两种酶活性降低。相比C/N比较高的杉木凋落物, 微生物会偏向选择利用土壤中的有机质, 而凋落物添加处理后, 微生物碳源充足, 氮素不足, 微生物会利用新鲜凋落物作为碳源来获取能量, 去分解土壤有机质获取氮素; 由于杉木凋落物C/N比较高, 木质素/N较高, 那么微生物利用杉木凋落物时则需要分泌更多的酚氧化酶或者过氧化氢酶。因此, 凋落物添加后酚氧化酶和过氧化氢酶活性增加是因为微生物需要分解杉木凋落物获取碳源而满足自身能量需求, 并非反应微生物分解土壤难分解有机质。同理, 凋落物去除后酚氧化酶和过氧化氢酶活性降低, 则说明微生物对难分解有机物的分解减少, 即相比对照而言, 凋落物去除等于去除了供给微生物较高C/N比的底物, 微生物失去了分解对象, 没有新鲜碳源作为能量来源, 那么微生物的分解作用也降低, 导致酚氧化酶和过氧化氢酶活性降低。而且, 在凋落物去除处理后, 土壤δ15N值显著降低, 说明土壤氮循环变得更加封闭和缓慢[25, 27]; 同时土壤β葡萄糖苷酶、纤维素水解酶均出现不同程度下降现象; 由于β葡萄糖苷酶、纤维素水解酶都参与土壤中碳的分解与循环[34], 所以凋落物去除可能会减缓土壤碳氮循环速率。
4 结论土壤氮对杉木人工林中添加、减少凋落物的影响较为敏感, 土壤碳受其影响不显著。凋落物添加增强了植物对土壤中氮素的吸收, 导致土壤中氮素的减少, 而土壤微生物为了维持自身碳氮比, 会分泌更多的氮获得酶去分解土壤中的有机质来获取氮素, 使得微生物与植物之间竞争土壤氮, 导致土壤中氮素的循环加快, 最终可能导致土壤碳氮失衡。
| [1] |
Post W M, Emanuel W R, Zinke P J, et al. Soil carbon pools and world life zones . Nature, 1982, 298(5870): 156-159. DOI:10.1038/298156a0
(  0) 0) |
| [2] |
Gholz H L, Fisher R F, Prichett W L. Nutrient dynamics in slash pine plantation ecosystems . Ecology, 1985, 66(3): 647-659.
(  0) 0) |
| [3] |
Sombroek W, Nachtergaele F O, Hebel A. Amounts, dynamics and sequestering of carbon in tropical and subtropical soils . Ambio, 1993, 22(7): 417-426.
(  0) 0) |
| [4] |
Finzi A C, Allen A S, DeLucia E H, et al. Forest litter production, chemistry, and decomposition following two years of free-air CO2 enrichment . Ecology, 2001, 82(2): 470-484.
(  0) 0) |
| [5] |
Ellsworth D S, Thomas R, Crous K Y, et al. Elevated CO2 affects photosynthetic responses in canopy pine and subcanopy deciduous trees over 10 years:A synthesis from Duke FACE . Global Change Biology, 2012, 18(1): 223-242.
(  0) 0) |
| [6] |
Fang X, Zhao L, Zhou G Y, et al. Increased litter input increases litter decomposition and soil respiration but has minor effects on soil organic carbon in subtropical forests . Plant and Soil, 2015, 392(1/2): 139-153.
(  0) 0) |
| [7] |
Leff J W, Wieder W R, Taylor P G, et al. Experimental litterfall manipulation drives large and rapid changes in soil carbon cycling in a wet tropical forest . Global Change Biology, 2012, 18(9): 2969-2979. DOI:10.1111/j.1365-2486.2012.02749.x
(  0) 0) |
| [8] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply . Nature, 2007, 450(7167): 277-280. DOI:10.1038/nature06275
(  0) 0) |
| [9] |
Kuzyakov Y. Priming effects:Interactions between living and dead organic matter . Soil Biology & Biochemistry, 2010, 42(9): 1363-1371.
(  0) 0) |
| [10] |
Zhang D Q, Hui D F, Luo Y Q, et al. Rates of litter decomposition in terrestrial ecosystems:Global patterns and controlling factors . Journal of Plant Ecology, 2008, 1(2): 85-93.
(  0) 0) |
| [11] |
Wang Q K, Wang S L, He T X, et al. Response of organic carbon mineralization and microbial community to leaf litter and nutrient additions in subtropical forest soils . Soil Biology & Biochemistry, 2014, 71: 13-20.
(  0) 0) |
| [12] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization:Do labile plant inputs form stable soil organic matter? . Global Change Biology, 2013, 19(4): 988-995.
(  0) 0) |
| [13] |
Yang Y S, Xie J S, Sheng H, et al. The impact of land use/cover change on storage and quality of soil organic carbon in midsubtropical mountainous area of Southern China . Journal of Geographical Sciences, 2009, 19(1): 49-57. DOI:10.1007/s11442-009-0049-5
(  0) 0) |
| [14] |
李明学.第二代杉木人工林水文功能恢复研究[D].长沙: 中南林业科技大学, 2007. Li M X.A study on the restoration of the hydrological functions in the second generation Chinese fir plantation[D].Changsha: Central South University of Forestry & Technology, 2007. (  0) 0) |
| [15] |
Liu X F, Lin T C, Yang Z J, et al. Increased litter in subtropical forests boosts soil respiration in natural forests but not plantations of Castanopsis carlesii . Plant and Soil, 2017, 418(1/2): 141-151.
(  0) 0) |
| [16] |
Jones D, Willett V. Experimental evaluation of methods to quantify Dissolved organic nitrogen (DON) and Dissolved organic carbon (DOC) in soil . Soil Biology & Biochemistry, 2006, 38(5): 991-999.
(  0) 0) |
| [17] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C . Soil Biology & Biochemistry, 1987, 19(6): 703-707.
(  0) 0) |
| [18] |
Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil . Soil Biology & Biochemistry, 2002, 34(9): 1309-1315.
(  0) 0) |
| [19] |
廖利平, Lindley D.K., 杨永辉. 森林叶凋落物混合分解的研究I.缩微(Microcosm)实验. 应用生态学报, 1997, 8(5): 459-464. Liao L P, Lindley D K, Yang Y H. Decomposition of mixed foliar litter I.A microcosm study (In Chinese). Chinese Journal of Applied Ecology, 1997, 8(5): 459-464. DOI:10.3321/j.issn:1001-9332.1997.05.003 (  0) 0) |
| [20] |
涂玉, 尤业明, 孙建新. 油松-辽东栎混交林地表凋落物与氮添加对土壤微生物生物量碳、氮及其活性的影响. 应用生态学报, 2012, 23(9): 2325-2331. Tu Y, You Y M, Sun J X. Effects of forest floor litter and nitrogen addition on soil microbial biomass C and N and microbial activity in a mixed Pinus tabulaeformis and Quercus liaotungensis forest stand in Shanxi Province of China (In Chinese). Chinese Journal of Applied Ecology, 2012, 23(9): 2325-2331. (  0) 0) |
| [21] |
Nielsen G E, Hole F D. A study of the natural processes of incorporation of organic matter into soil in the University of Wisconsin Arboretum . Arts and Letters, 1963, 52: 213-227.
(  0) 0) |
| [22] |
王微, 伍小刚, 胡凯, 等. 凋落物输入对中亚热带不同森林细根生物量及分布的影响. 生态学报, 2016, 36(11): 3391-3401. Wang W, Wu X G, Hu K, et al. Increased litterfall regulates fine root biomass and distribution in three typical forests in subtropical China (In Chinese). Acta Ecologica Sinica, 2016, 36(11): 3391-3401. (  0) 0) |
| [23] |
Brzostek E R, Dragoni D, Brown Z A, et al. Mycorrhizal type determines the magnitude and direction of root-induced changes in decomposition in a temperate forest . New Phytologist, 2015, 206(4): 1274-1282. DOI:10.1111/nph.13303
(  0) 0) |
| [24] |
李晓杰, 刘小飞, 熊德成, 等. 中亚热带杉木人工林和米槠次生林凋落物添加与去除对土壤呼吸的影响. 植物生态学报, 2016, 40(5): 447-457. Li X J, Liu X F, Xiong D C, et al. Impact of litterfall addition and exclusion on soil respiration in Cunninghamia lanceolata plantation and secondary Castanopsis carlesii forest in mid-subtropical China (In Chinese). Chinese Journal of Plant Ecology, 2016, 40(5): 447-457. (  0) 0) |
| [25] |
Berg B. Litter decomposition and organic matter turnover in northern forest soils . Forest Ecology & Management, 2000, 133(1/2): 13-22.
(  0) 0) |
| [26] |
孙丽娟, 曾辉, 郭大立. 鼎湖山亚热带常绿针阔叶混交林凋落物及矿质氮输入对土壤有机碳分解的影响. 应用生态学报, 2011, 22(12): 3087-3093. Sun L J, Zeng H, Guo D L. Effects of litter and mineral nitrogen input on soil organic carbon decomposition in subtropical mixed forest in Dinghu Mountain, South China (In Chinese). Chinese Journal of Applied Ecology, 2011, 22(12): 3087-3093. (  0) 0) |
| [27] |
段中华, 乔有明, 全小龙, 等. 黄河源区湿地、草地土壤理化性质和碳氮组成及其稳定同位素特征分析. 水土保持学报, 2015, 29(4): 247-252, 315. Duan Z H, Qiao Y M, Quan X L, et al. Analysis of nitrogen and carbon composition and stable isotope characteristics and physicochemical properties of wetland and grassland soil in source region of the Yellow River (In Chinese). Journal of Soil and Water Conservation, 2015, 29(4): 247-252, 315. (  0) 0) |
| [28] |
王毛兰, 赖建平, 胡珂图, 等. 鄱阳湖湿地土壤有机碳氮同位素特征及其环境意义. 中国环境科学, 2016, 36(2): 500-505. Wang M L, Lai J P, Hu K T, et al. Compositions of stable organic carbon and nitrogen isotopes in wetland soil of Poyang Lake and its environmental implications (In Chinese). China Environmental Science, 2016, 36(2): 500-505. DOI:10.3969/j.issn.1000-6923.2016.02.029 (  0) 0) |
| [29] |
Natelhoffer K J, Fry B. Controls on natural nitrogen-15 and carbon-13 abundances in forest soil organic matter . Soil Science Society of America Journal, 1988, 52(6): 1633-1640. DOI:10.2136/sssaj1988.03615995005200060024x
(  0) 0) |
| [30] |
曾伟斌.丹江口库区不同土地利用下土壤碳氮含量及其同位素值的变化[D].北京: 中国科学院研究生院, 2012. Zeng W B.Changes of soil carbon and nitrogen content and isotope values under different land use conditions in Danjangkou Reservior[D].Beijing: Graduate University of the Chinese Academy of Sciences, 2012. (  0) 0) |
| [31] |
Billings S A, Richter D D. Changes in stable isotopic signatures of soil nitrogen and carbon during 40 years of forest development . Oecologia, 2006, 148(2): 325-333. DOI:10.1007/s00442-006-0366-7
(  0) 0) |
| [32] |
汪智军, 梁轩, 贺秋芳, 等. 岩溶区不同植被类型下的土壤氮同位素分异特征. 生态学报, 2011, 31(17): 4970-4976. Wang Z J, Liang X, He Q F, et al. Differential characteristics of soil δ15N under varying vegetation in Karst areas (In Chinese). Acta Ecologica Sinica, 2011, 31(17): 4970-4976. (  0) 0) |
| [33] |
Hobbie E A, Ouimette A P. Controls of nitrogen isotope patterns in soil profiles . Biogeochemistry, 2009, 95(2/3): 355-371.
(  0) 0) |
| [34] |
边雪廉, 赵文磊, 岳中辉, 等. 土壤酶在农业生态系统碳、氮循环中的作用研究进展. 中国农学通报, 2016, 32(4): 171-178. Bian X L, Zhao W L, Yue Z H, et al. Research process of soil enzymes effect on carbon and nitrogen cycle in agricultural ecosystem (In Chinese). Chinese Agricultural Science Bulletin, 2016, 32(4): 171-178. (  0) 0) |
2. Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology, Fuzhou 350007, China;
3. Sanming Research Station of Forest Ecosystem and Global Change, Sanming, Fujian 365000, China
 2020, Vol. 57
2020, Vol. 57


