土壤有机碳(SOC)矿化是陆地生态系统碳循环过程中的重要环节, 也是温室气体的主要来源之一[1]。因此, 研究SOC矿化过程, 对于了解生态系统碳循环及全球变化具有重要意义[2]。诸多研究表明, 影响SOC矿化的因素主要包括土壤性质(有机质含量、pH、质地、温度、湿度等)、土地利用方式、外源碳的质量和数量以及微生物活性等[3-4]。在森林生态系统中, 凋落物是SOC的重要来源, 其分解及相关过程均会影响大气中CO2浓度和土壤碳库稳定[5]。凋落物通过微生物的分解作用产生CO2, 同时亦对土壤原有有机碳(原SOC)的矿化产生重要影响[6]。如史学军等[5]利用室内91 d培养实验发现, 4种凋落物(青冈栎Cyclobalanopsis glauca oerst.、麻栎Quercus acutissima carr.、马尾松Pinus massoniana lamb.、狗牙根Cynodon dactylon pers.)添加均显著促进了黄棕壤有机碳的矿化。而王晓峰等[7]利用81 d的培养实验发现, 杉木凋落物显著改变了土壤有机碳的分解速率, 从而产生激发效应, 并且深层(40~45 cm)土壤有机碳分解对杉木凋落物的响应高于表层(0~5 cm)土壤。研究表明, 大气CO2浓度升高, 氮沉降等全球变化将会提高植物净初级生产力[8], 相应地进入土壤中的凋落物亦会增加。
生物质炭(Biochar, BC)是生物质在厌氧或者部分厌氧条件下经高温裂解产生的多孔芳香类物质, 具有惰性, 可在土壤中存在成百上千年[9]。BC输入可改善土壤肥力, 减少温室气体排放和增加土壤碳固持[10], 国际上已将施用BC作为土壤改良的有效措施及碳封存的重要技术[11]。王富华等[12]研究表明BC(油菜秸秆, 500℃热解)与秸秆配施显著提高紫色土团聚体有机碳含量, 且随着施用量增加, 有机碳含量呈升高趋势。在我国亚热带地区, 杉木是一种重要的速生造林树种, 但由于杉木特有的生态学特性和连栽等措施导致人工林土壤肥力下降[13]。如在人工林经营初期, 若将采伐剩余物和凋落物部分制成BC, 并将其返还土壤, 可避免直接火烧造成的环境污染和水肥流失等问题, 亦有可能改善人工林土壤肥力, 提高人工林土壤的固碳潜力[14]。凋落物为易分解碳源, 而BC为较难分解碳源, 杉木人工林原SOC矿化对2种类型外源碳输入的响应有何异同?而原SOC矿化与添加量之间是否存在一定的数量关系?基于上述问题, 本研究以杉木人工林土壤为研究对象, 利用13C标记的杉木凋落物及其制备的BC作为2种不同类型外源碳, 采用室内培养实验结合稳定性同位素技术, 研究凋落物和BC不同添加量对其自身分解及土壤原SOC矿化的影响, 为人工林土壤固碳管理与生物质资源有效利用提供科学依据。
1 材料与方法 1.1 供试材料土壤样品取自福建省建瓯市万木林自然保护区内杉木人工林, 树龄约36 a, 海拔350 m, 西北坡向, 坡度27°。该区属中亚热带季风气候, 年均气温19.4℃, 年均降水量1 731 mm, 土壤为花岗岩发育的普通山地红壤。根据“S”型多点取样, 去除表层凋落物后取0~20 cm土壤, 剔除石块和可见植物残体与根系, 新鲜土壤样品过2 mm筛置于冰箱4℃冷藏备用。
利用13C脉冲标记的杉木凋落物作为供试材料, 标记方法参照尹云锋等[15]。去离子水冲洗干净后60℃烘干, 粉碎机粉碎过2 mm筛后用于培养和BC制备。BC生产设备采用管式炉(O-KTF1200, 江苏前锦炉业), 将凋落物适量置于锡箔纸中放置炉中封闭, 制备温度为350℃, 通入氮气厌氧热解2 h, 冷却的BC样品过2 mm筛后充分混匀备用。供试土壤、杉木凋落物及BC基本性质参见表 1。
|
|
表 1 供试土壤、凋落物、生物质炭的基本性质 Table 1 Basic properties of the soil, litter and biochar used in this study |
采用双因素实验设计, 外源碳类型(凋落物、BC)和添加量(0、10、20、30、40、50 g·kg-1)。实验处理:土壤(S)、土壤+10 g·kg-1凋落物(SL1)、土壤+20 g·kg-1凋落物(SL2)、土壤+30 g·kg-1凋落物(SL3)、土壤+40 g·kg-1凋落物(SL4)、土壤+50 g·kg-1凋落物(SL5)、土壤+10 g·kg-1BC(SB1)、土壤+20 g·kg-1BC(SB2)、土壤+30 g·kg-1BC(SB3)、土壤+40 g·kg-1BC(SB4)、土壤+50 g·kg-1BC(SB5), 每个处理4个重复。
为避免不同处理间13CO2相互污染问题, 本实验对培养过程中产生的CO2收集方法做了改进, 采用碱吸收结合采气法, 在不同培养时段更换碱液可以保证所有样品均在密闭好氧条件下进行, 而在特定时间采集气体可以方便CO2浓度及其13C丰度的测定。具体步骤为:称取过2 mm筛的新鲜土壤(相当于40.00 g烘干土)和相应添加量的凋落物或BC, 分别混合均匀置于60 mL塑料杯中, 另取2个60 mL塑料杯分别内置20 mL去离子水和20 mL 1 mol·L-1 NaOH溶液, 将3个塑料杯置于1 L带有橡胶塞培养瓶中, 培养温度为25℃。由于BC分解缓慢且其显著变化主要体现在培养前期(2周或4周内), 故培养时间选择28 d。在培养第0、1、3、5、7、14、21、28 d采集气体。气体采集时, 将装有土壤样品的塑料杯转移至1 L采气瓶中, 同时设置4个空白采气瓶测定CO2背景值, 采气瓶瓶口带有橡皮塞、玻璃管、胶塞等装置便于采集气体, 连接处均涂抹704硅胶密封。2 h后用注射器抽取20 mL气体注入已抽真空的20 mL采气瓶中密封保存。采气结束后通过称重法调节水分维持60%土壤持水量(WHC), 然后将装有土壤样品的塑料杯转移至原来的培养瓶中, 更换新的碱液后继续密闭培养。
1.3 分析方法pH利用便携式pH计(STARTER 300, 美国)测定, 土壤pH测定的水土比例为2.5:1, 凋落物和BC的pH测定选择水与凋落物或BC的比例为15:1;土壤、凋落物和BC的碳、氮含量采用元素分析仪(Elementar Vario EL III, Elementar, 德国)测定, 溶解性有机碳(DOC)含量采用总碳分析仪(TOC-V CPH, 日本)测定; BC的碳酸盐测定采用容量滴定法; CO2浓度使用气相色谱仪(GC-2010, Shimadzu, 日本)测定; 样品13C丰度利用稳定同位素质谱仪(MAT 253, Thermo Fisher, 德国)测定; 土壤微生物含量采用磷脂脂肪酸(Phospholipid fatty acid, PLFA)法, 用气相色谱仪(Agilent 6890 N, 美国)结合微生物识别系统(MIDI Inc., Newark, DE, 美国)测定提取的甲基酯化脂肪酸(Fatty acid methyl eaters, FAME)含量[16]。
1.4 计算方法CO2排放速率计算方法参照Lang等[17], 具体如下:
| $ F = {\rm{V}} \times ({C_{\rm{s}}} - {C_{\rm{b}}}) \times {\rm{M}} \times {\rm{(273/(273 + T)}} \times {\rm{22}}{\rm{.4)/}}m/t $ | (1) |
式中, F代表CO2排放速率, mg·kg-1·h-1; V为采气瓶中气体体积, L; Cs和Cb分别代表土样和空白采气瓶中CO2浓度, mg·kg-1; T为培养温度, ℃; M代表CO2分子量, g·mol-1; m代表土样质量(干物质量), g; t代表采气瓶密封时间, h。
区分CO2中2种碳源方法参照Keith等[18], 具体如下:
| $ {F_{\rm{a}}} = {F_{\rm{t}}} \times ({\delta _{\rm{t}}} - {\delta _{\rm{s}}})/({\delta _{\rm{a}}} - {\delta _{\rm{s}}}) $ | (2) |
| $ {F_{\rm{s}}} = {F_{\rm{t}}} - {F_{\rm{a}}} $ | (3) |
式中, Fa代表来源于凋落物或BC的CO2排放速率, mg·kg-1·h-1; Fs为来源于原SOC的CO2排放速率, mg·kg-1·h-1; Ft为土壤总CO2排放速率, mg·kg-1·h-1; δt为不同处理CO2的δ13C值, ‰; δs代表SOC的δ13C值, ‰; δa为凋落物或BC的δ13C值, ‰。
CO2累积排放量计算方法如下:
| $ W = \sum {({F_{i - 1}} + {F_i})/2 \times ({t_i} - {t_{i - 1}}) \times 24} $ | (4) |
式中, W代表CO2累积排放量, mg·kg-1; Fi-1为第i-1次采样时的CO2排放速率, mg·kg-1· h-1; Fi代表第i次采样时的CO2排放速率, mg·kg-1·h-1; ti为第i次采样时间, d; ti-1是第i-1次采样时间, d。
分解率计算方法如下:
| $ D = W \times m \times (12/44)/c \times 100\% $ | (5) |
式中, D代表外源碳或原SOC的分解率, %; W为来源于外源碳或原SOC的CO2累积排放量, mg·kg-1; m代表土样质量, kg; c代表外源碳或者原SOC的总碳量, mg。
土壤微生物PLFA含量测定用峰面积和内标曲线法, 以正十九烷酸甲酯(19:0)为内标, 参照刘波等[19]方法。
1.5 数据统计实验所有数据用Excel 2013进行整理, 统计学分析和作图采用SPSS 19.0、OriginPro 9.0软件, 处理间差异采用邓肯(Duncan)多重比较法, 图表数据均为平均值±标准差(n=4)。
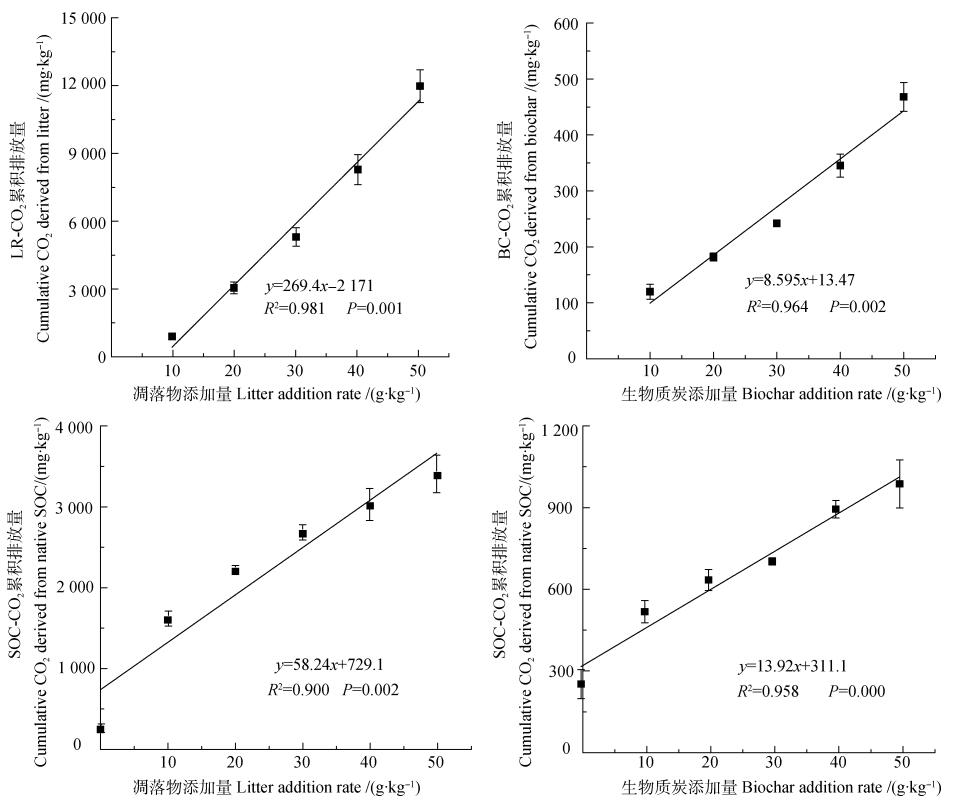
2 结果 2.1 不同处理对不同来源CO2累积排放量的影响如图 1所示, 相较对照土壤(S), 凋落物及BC添加显著提高了土壤总CO2累积排放量(∑CO2), 且前者的作用更明显。分析不同来源∑CO2可知, 来源于凋落物的∑CO2(LR-CO2)显著大于其对应BC处理(BC-CO2)的, 为其8.29倍~25.41倍。此外, 2种外源碳添加条件下来源于原SOC的∑CO2(SOC-CO2)均显著大于S处理的, 凋落物处理为S处理的6.50倍~13.74倍, 而BC处理为S处理的2.08倍~3.98倍。回归分析显示, 2种来源的∑CO2与添加量均呈极显著线性关系(P < 0.01), 且随着添加量的增加, 来源于凋落物(或BC)分解与原SOC矿化的∑CO2均呈升高的趋势。并且, 凋落物处理的回归方程斜率远大于相应BC处理的(图 2)。
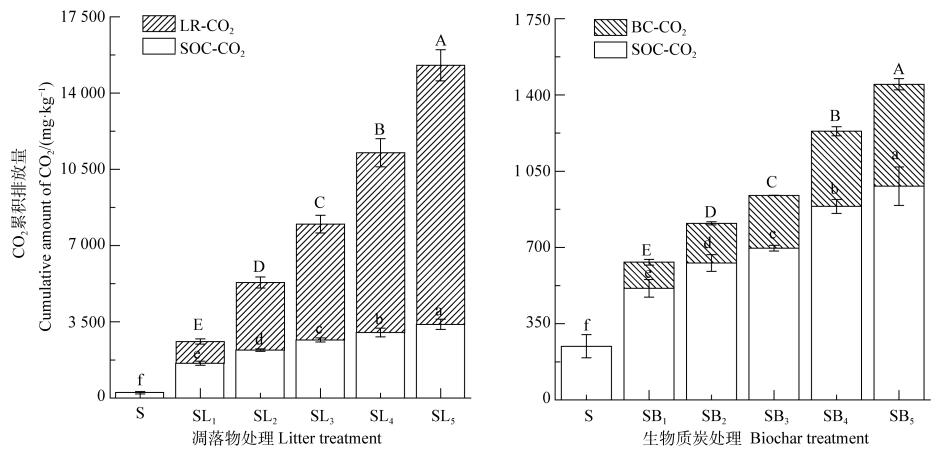
|
注:不同大写字母表示处理间CO2累积排放量来源于凋落物或生物质炭的差异显著(P < 0.05); 不同小写字母表示处理间CO2累积排放量来源于原SOC的差异显著(P < 0.05)。S:土壤; SL1:土壤+10 g·kg-1凋落物; SL2:土壤+20 g·kg-1凋落物; SL3:土壤+30 g·kg-1凋落物; SL4:土壤+40 g·kg-1凋落物; SL5:土壤+50 g·kg-1凋落物; SB1:土壤+10 g·kg-1BC; SB2:土壤+20 g·kg-1BC; SB3:土壤+30 g·kg-1BC; SB4:土壤+40 g·kg-1BC; SB5:土壤+50 g·kg-1BC; LR-CO2:来源于凋落物的CO2累积释放量; BC-CO2:来源于生物质炭的CO2累积释放量; SOC-CO2:来源于原SOC的CO2累积释放量。下同。 Note:Different uppercase letters indicate significant difference at P < 0.05 level between treatments in cumulative CO2 emission from litter or biochar; Different lowercase letters indicate significant difference at P < 0.05 level between treatments in cumulative CO2 emission from native SOC. S stands for control(soil without any addition); SL1, for soil added with 10 g·kg-1 litter; SL2, for soil added with 20 g·kg-1 litter; SL3, for soil added with 30 g·kg-1 litter; SL4, for soil added with 40 g·kg-1 litter; SL5, for soil added with 50 g·kg-1 litter; SB1, for soil added with 10 g·kg-1 BC; SB2, for soil added with 20 g·kg-1 BC; SB3, for soil added with 30 g·kg-1 BC; SB4, for soil added with 40 g·kg-1 BC; SB5, for soil added with 50 g·kg-1 BC; LR-CO2, for cumulative amount of the CO2 derived from litter; BC-CO2, for cumulative amount of the CO2 derived from biochar, and SOC-CO2, for cumulative amount of the CO2 derived from native SOC. The same below. 图 1 不同处理对2种来源CO2累积排放量的影响 Fig. 1 Effects of the treatments on cumulative CO2 emission from the two sources |
|
图 2 不同来源CO2累积排放量与凋落物碳、生物质炭碳添加量之间的关系 Fig. 2 Relationship of cumulative CO2 emission with addition rate of extraneous carbon relative to source |
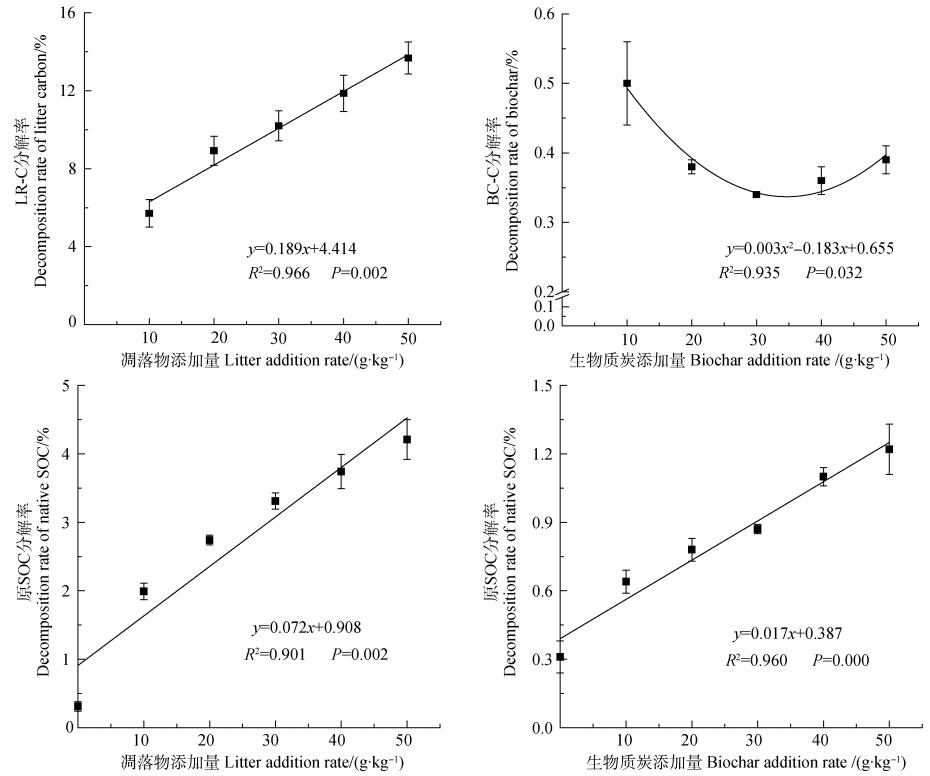
培养结束时, 凋落物碳(LR-C)分解率介于5.71%~13.68%之间, 而生物质炭碳(BC-C)分解率仅为0.34%~0.50%(表 2), 并且LR-C分解率均显著高于相应BC-C的(P < 0.01)。此外, 凋落物和BC添加亦显著促进了原SOC分解, 分别为对照处理的6.42倍~13.58倍与2.06倍~3.94倍。回归分析表明, 添加量与BC-C分解率呈显著开口向上的抛物线关系(P < 0.05), 与LR-C分解率则呈极显著的线性关系(P < 0.01); 而在2种外源碳添加条件下, 添加量与原SOC分解率也呈现极显著的线性关系(P < 0.01), 且凋落物处理的回归方程斜率明显高于BC处理(图 3)。
|
图 3 凋落物碳和生物质炭碳分解率及原SOC分解率与添加量的关系 Fig. 3 Relationships of decomposition rate of litter C, biochar C and native SOC with addition rate of litter or biochar |
|
|
表 2 凋落物碳、生物质炭和土壤原SOC分解率 Table 2 Decomposition rates of litter C, biochar C and native SOC |
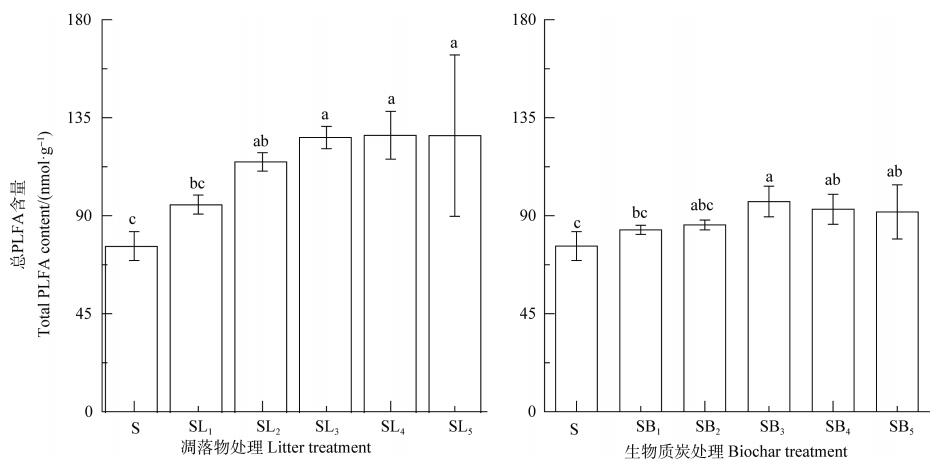
如图 4所示, 2种外源碳添加条件下土壤微生物PLFA总量均高于对照S处理, 且凋落物处理显著大于相对应BC处理的。由表 3可见, 相关分析表明, 凋落物处理中来源于凋落物的CO2累积排放量及LR-C分解率与土壤pH、全碳、全氮、C/N比以及土壤PLFA总量均呈极显著正相关(P < 0.01), 而来源于原SOC的CO2累积排放量及原SOC分解率除与pH相关性不显著外, 与其他指标均呈极显著的正相关(P < 0.01); 而BC处理中来源于原SOC的CO2累积排放量和原SOC分解率与土壤基本性质均呈极显著正相关(P < 0.01), 来源于BC的CO2累积排放量与土壤pH、全碳、全氮、C/N比呈极显著正相关(P < 0.01), 而BC-C分解率则与上述指标呈显著或极显著负相关(表 3), 但两者与土壤PLFA总量的关系均未达显著水平。
|
图 4 不同处理对土壤微生物磷脂脂肪酸(PLFA)总量的影响 Fig. 4 Effects of addition of extraneous carbon on total microbial phospholipid fatty acid(PLFA)content relative to treatment |
|
|
表 3 CO2累积排放量、分解率与土壤基本性质的相关系数 Table 3 Correlation coefficients of cumulative CO2 emission, decomposition rate and soil basic properties |
目前, 对来源于新鲜有机物质及BC的CO2累积排放量与其添加量的关系研究亦有报道:如Shahzad等[20]添加玉米秸秆(0、3、6、12、24 g·kg-1)到土壤中, 发现来源于秸秆的CO2累积排放量随添加量增加呈上升趋势; 而Smith等[21]研究表明来源于BC(500℃热解柳枝稷, 添加量为0、11.2、22.4、44.8 t·hm-2)的CO2累积排放量亦随添加量增加而增加。在本研究中, 来源于凋落物或BC的CO2累积排放量呈现了类似趋势, 并且来源于凋落物的CO2累积排放量显著大于BC的, 其原因在于凋落物含有更多易分解物质, 对微生物刺激作用更为明显(图 4), 进而促进了凋落物的分解。来源于凋落物的CO2累积排放量和LR-C分解率均与微生物PLFA总量呈极显著正相关, 进一步证实凋落物的分解主要与微生物活动有关; 但本研究中BC-C分解率与土壤pH、TC、TN、C/N均呈显著负相关, 而来源于BC的CO2累积排放量与土壤微生物PLFA总量的相关性也不显著, 其原因在于BC处理的CO2累积排放量并非完全来自微生物的降解, 也可能来自无机碳(表 1)。BC中无机碳主要以碳酸盐形式存在[22], 具有较强的碱性, 与土壤中酸性物质反应, 进而释放CO2[23]。
外源碳的分解速率与其数量和质量以及土壤性质、微生物等因素有关[24]。Maestrini等[25]将450℃热解黑麦草产生的BC添加至森林土壤中, 培养5个月后BC分解率为4.3%。而Naisse等[26]经过336 d的室内培养, 发现黑麦草碳分解率为25%, 但BC仅为0.4%~0.6%。本实验结果与上述研究基本一致, 培养28 d后凋落物碳分解率(5.71%~13.68%)亦显著高于BC分解率(0.34%~0.50%)。其原因在于BC高度碳化且芳香环和烷基结构紧密堆积, 这种稳定性机制使其不易被微生物分解, 并且BC可以与土壤黏粒或粉粒形成团聚体, 从而提高其稳定性[27]。Jiang等[28]量化了BC分解率与其添加量关系, 将BC(550℃, 橡木)以0、10、50、100、200 g·kg-1土壤质量比添加至4种土壤中进行30个月的培养, 发现BC的损失均随着添加量增加而增加。本研究也证实, 凋落物碳分解率随添加量增加而增加, 但BC分解率却未呈现这一趋势, 在10 g·kg-1添加量时即达到最大, 其原因在于BC具有大量的孔隙结构能有效隔离微生物及其产生的胞外酶[29], 添加量增加时大量BC的“隔离微生物”起主要作用, 使其分解率下降。同时, 添加量增加后土壤pH、全碳和全氮含量也相应提高, 这不利于BC分解(表 3)。
3.2 不同处理对原SOC矿化的影响研究表明, 外源碳输入对土壤原SOC矿化存在抑制作用(负激发效应)、促进作用(正激发效应)或无影响[30]。导致这种截然不同结论与土壤性质、培养条件、植物类型以及外源碳的类型、数量与质量有关。苗淑杰等[31]利用35 d的培养实验发现, 玉米秸秆不同添加量(10、50、90 g·kg-1)均显著抑制了原SOC的矿化, 且在50 g·kg-1添加量时抑制作用最强, 其原因在于外加大量玉米秸秆释放出较多易被分解的碳抑制了微生物对原SOC的利用。尹艳等[14]将不同温度制备的BC(350、550和750℃, 杉木与木荷凋落物)添加至杉木人工林土壤中培养112 d后发现, 所有BC处理均显著抑制了土壤原SOC矿化。这种抑制作用的机制可能是BC具有大量的孔隙结构与巨大的比表面积, 将土壤有机质吸附至其孔隙内或外表面上, 可降低有机质的可利用率[29]。但Farrell等[32]通过80 d的培养实验发现, 2种BC(450℃, 小麦秸秆和桉树枝)的添加均促进了土壤原SOC矿化。Cui等[33]将水稻秸秆及其制备的BC(400℃)分别添加至土壤中进行200 d的培养后, 发现秸秆及BC均促进了原SOC矿化, 且秸秆处理来源于原SOC的CO2排放量大于BC处理的。本研究结论与其一致, 相较对照土壤, 凋落物及BC处理均提高了原SOC的矿化, 且凋落物促进效果更明显。随着添加量增加, 促进效果越明显, 原因是原SOC的分解与微生物活性呈显著正相关(表 3)。凋落物或BC的添加提高了土壤微生物活性(图 4), 且凋落物对土壤微生物PLFA的影响更为明显, 而微生物产生的胞外酶存在土壤中, 在其催化作用下降解外源碳的同时也可能降解了土壤原SOC[34], 引发“共代谢”作用。
王晓峰等[7]通过13C标记杉木凋落物进行室内培养实验, 81 d培养结束时SOC分解率为3.6%~6.0%。而Zhang等[35]通过Meta分析表明在添加外源碳(植物残体及小分子物质)的实验中, SOC平均分解率增加26.5%。本实验则发现, 凋落物及BC添加条件下SOC分解率为0.64%~4.21%, 并且随着添加量的增加而增加, 进一步表明外源碳输入并未减缓微生物对原SOC的利用, 反而会促进其分解。原因可能在于凋落物与BC的易分解物质为微生物提供了生长所需的碳源及其他养分[23], BC的多孔结构还为其提供了适宜的场所, 增加了原SOC的微生物可利用性, 从而加速原SOC矿化。
4 结论利用短期实验结合同位素13C示踪技术发现, 相较于对照土壤, 凋落物或BC单独添加对原SOC矿化的促进作用随着添加量的增加而增加, 且前者的影响更为明显。杉木人工林原SOC的分解率与添加量之间均呈线性关系; 凋落物碳分解率与添加量之间呈线性关系, 但生物质炭分解率并未呈现这一趋势, 在添加量为10 g·kg-1时即达到最大值。同凋落物相比, 短期内BC的分解受微生物活动的影响较小, 生物有效性更低, 在土壤中更稳定, 有关的微生物学机制尚需进一步研究。
| [1] |
Post W M, Emanuel W R, Zinke P J, et al. Soil carbon pools and world life zones . Nature, 1982, 298(5870): 156-159. DOI:10.1038/298156a0
(  0) 0) |
| [2] |
Trumbore S. Carbon respired by terrestrial ecosystems-recent progress and challenges . Global Change Biology, 2006, 12(2): 141-153.
(  0) 0) |
| [3] |
Tan Y L, Chen J, Yan L M, et al. Mass loss and nutrient dynamics during litter decomposition under three mixing treatments in a typical steppe in Inner Mongolia . Plant and Soil, 2013, 366(1/2): 107-118.
(  0) 0) |
| [4] |
Andersson S, Nilsson S. Influence of pH and temperature on microbial activity, substrate availability of soil-solution bacteria and leaching of dissolved organic carbon in a mor humus . Soil Biology and Biochemistry, 2001, 33(9): 1181-1191. DOI:10.1016/S0038-0717(01)00022-0
(  0) 0) |
| [5] |
史学军, 潘剑君, 陈锦盈, 等. 不同类型凋落物对土壤有机碳矿化的影响. 环境科学, 2009, 30(6): 1832-1837. Shi X J, Pan J J, Chen J Y, et al. Effects of different types of litters on soil organic carbon mineralization (In Chinese). Environmental Science, 2009, 30(6): 1832-1837. DOI:10.3321/j.issn:0250-3301.2009.06.046 (  0) 0) |
| [6] |
余再鹏, 万晓华, 胡振宏, 等. 亚热带杉木和米老排人工林土壤呼吸对凋落物去除和交换的响应. 生态学报, 2014, 34(10): 2529-2538. Yu Z P, Wan X H, Hu Z H, et al. Contrasting responses of soil respiration to litter manipulation in subtropical Mytilaria laosensis and Cunninghamia lanceolata plantations (In Chinese). Acta Ecologica Sinica, 2014, 34(10): 2529-2538. (  0) 0) |
| [7] |
王晓峰, 汪思龙, 张伟东. 杉木凋落物对土壤有机碳分解及微生物生物量碳的影响. 应用生态学报, 2013, 24(9): 2393-2398. Wang X F, Wang S L, Zhang W D. Effects of Chinese fir litter on soil organic carbon decomposition and microbial biomass carbon (In Chinese). Chinese Journal of Applied Ecology, 2013, 24(9): 2393-2398. (  0) 0) |
| [8] |
Uselman S M, Qualls R, Thomas R. Effects of increased atmospheric CO2, temperature, and soil N availability on root exudation of dissolved organic carbon by a N-fixing tree (Robinia pseudoacacia L.) . Plant and Soil, 2000, 222(1/2): 191-202. DOI:10.1023/A:1004705416108
(  0) 0) |
| [9] |
Leng L J, Huang H J, Li H, et al. Biochar stability assessment methods:A review . Science of the Total Environment, 2019, 647: 210-222. DOI:10.1016/j.scitotenv.2018.07.402
(  0) 0) |
| [10] |
谢祖彬, 刘琦, 许燕萍, 等. 生物炭研究进展及其研究方向. 土壤, 2011, 43(6): 857-861. Xie Z B, Liu Q, Xu Y P, et al. Advances and perspectives of biochar research (In Chinese). Soils, 2011, 43(6): 857-861. (  0) 0) |
| [11] |
康熙龙, 张旭辉, 张硕硕, 等. 旱地土壤施用生物质炭的后效应--水分条件对土壤有机碳矿化的影响. 土壤, 2016, 48(1): 152-158. Kang X L, Zhang X H, Zhang S S, et al. Effects of biochar application history on soil:Effect of moisture regime on dynamics of soil organic carbon mineralization (In Chinese). Soils, 2016, 48(1): 152-158. (  0) 0) |
| [12] |
王富华, 黄容, 高明, 等. 生物质炭与秸秆配施对紫色土团聚体中有机碳含量的影响. 土壤学报, 2019, 56(4): 929-939. Wang F H, Huang R, Gao M, et al. Effect of combined application of biochar and straw on organic carbon content in purple soil aggregates (In Chinese). Acta Pedologica Sinica, 2019, 56(4): 929-939. (  0) 0) |
| [13] |
郑璐嘉, 黄志群, 何宗明, 等. 林龄、叶龄对亚热带杉木人工林碳氮稳定同位素组成的影响. 林业科学, 2015, 51(1): 22-28. Zheng L J, Huang Z Q, He Z M, et al. Influence of forest and foliar ages on the composition of stable carbon and nitrogen isotope of Cunninghamia lanceolata in subtropic China (In Chinese). Scientia Silvae Sinicae, 2015, 51(1): 22-28. (  0) 0) |
| [14] |
尹艳, 刘岩, 尹云锋, 等. 生物质炭添加对杉木人工林土壤原有有机碳矿化的影响. 应用生态学报, 2018, 29(5): 1389-1396. Yin Y, Liu Y, Yin Y F, et al. Effects of biochar addition on the mineralization of native soil organic carbon in Cunninghamia lanceolata plantation (In Chinese). Chinese Journal of Applied Ecology, 2018, 29(5): 1389-1396. (  0) 0) |
| [15] |
尹云锋, 杨玉盛, 高人, 等. 植物富集13C标记技术的初步研究. 土壤学报, 2010, 47(4): 790-793. Yin Y F, Yang Y S, Gao R, et al. A preliminary study on phyto-enrichment 13C labeling technique (In Chinese). Acta Pedologica Sinica, 2010, 47(4): 790-793. (  0) 0) |
| [16] |
盖霞普, 刘宏斌, 翟丽梅, 等. 生物炭对中性水稻土养分和微生物群落结构影响的时间尺度变化研究. 农业环境科学学报, 2016, 35(4): 719-728. Gai X P, Liu H B, Zhai L M, et al. Temporal fluctuations of impacts of corn-stover biochar on nutrients and microbial community structure in a neutral paddy soil (In Chinese). Journal of Agro-Environment Science, 2016, 35(4): 719-728. (  0) 0) |
| [17] |
Lang M, Cai Z C, Chang S X. Effects of land use type and incubation temperature on greenhouse gas emissions from Chinese and Canadian soils . Journal of Soils and Sediments, 2011, 11(1): 15-24. DOI:10.1007/s11368-010-0260-0
(  0) 0) |
| [18] |
Keith A, Singh B, Singh B P. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil . Environmental Science & Technology, 2011, 45(22): 9611-9618.
(  0) 0) |
| [19] |
刘波, 胡桂萍, 郑雪芳, 等. 利用磷脂脂肪酸(PLFAs)生物标记法分析水稻根际土壤微生物多样性. 中国水稻科学, 2010, 24(3): 278-288. Liu B, Hu G P, Zheng X F, et al. Analysis on microbial diversity in the rhizosphere of rice by phospholipid fatty acids biomarkers (In Chinese). Chinese Journal of Rice Science, 2010, 24(3): 278-288. DOI:10.3969/j.issn.1001-7216.2010.03.011 (  0) 0) |
| [20] |
Shahzad T, Anwar F, Hussain S, et al. Carbon dynamics in surface and deep soil in response to increasing litter addition rates in an agro-ecosystem . Geoderma, 2019, 333: 1-9. DOI:10.1016/j.geoderma.2018.07.018
(  0) 0) |
| [21] |
Smith J L, Collins H P, Bailey V L. The effect of young biochar on soil respiration . Soil Biology and Biochemistry, 2010, 42(12): 2345-2347. DOI:10.1016/j.soilbio.2010.09.013
(  0) 0) |
| [22] |
Mitchell P J, Simpson A J, Soong R, et al. Shifts in microbial community and water-extractable organic matter composition with biochar amendment in a temperate forest soil . Soil Biology and Biochemistry, 2015, 81: 244-254. DOI:10.1016/j.soilbio.2014.11.017
(  0) 0) |
| [23] |
Jones D L, Murphy D V, Khalid M, et al. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated . Soil Biology and Biochemistry, 2011, 43(8): 1723-1731. DOI:10.1016/j.soilbio.2011.04.018
(  0) 0) |
| [24] |
Butnan S, Deenik J L, Toomsan B, et al. Biochar characteristics and application rates affecting corn growth and properties of soils contrasting in texture and mineralogy . Geoderma, 2015, 237/238: 105-116.
(  0) 0) |
| [25] |
Maestrini B, Herrmann A M, Nannipieri P, et al. Ryegrass-derived pyrogenic organic matter changes organic carbon and nitrogen mineralization in a temperate forest soil . Soil Biology and Biochemistry, 2014, 69: 291-301. DOI:10.1016/j.soilbio.2013.11.013
(  0) 0) |
| [26] |
Naisse C, Girardin C, Davasse B, et al. Effect of biochar addition on C mineralisation and soil organic matter priming in two subsoil horizons . Journal of Soils and Sediments, 2015, 15(4): 825-832. DOI:10.1007/s11368-014-1002-5
(  0) 0) |
| [27] |
陈颖, 刘玉学, 陈重军, 等. 生物炭对土壤有机碳矿化的激发效应及其机理研究进展. 应用生态学报, 2018, 29(1): 314-320. Chen Y, Liu Y X, Chen C J, et al. Priming effect of biochar on the minerialization of native soil organic carbon and the mechanisms:A review (In Chinese). Chinese Journal of Applied Ecology, 2018, 29(1): 314-320. (  0) 0) |
| [28] |
Jiang X Y, Denef K, Stewart C E, et al. Controls and dynamics of biochar decomposition and soil microbial abundance, composition, and carbon use efficiency during long-term biochar-amended soil incubations . Biology and Fertility of Soils, 2016, 52(1): 1-14. DOI:10.1007/s00374-015-1047-7
(  0) 0) |
| [29] |
Kaiser K, Guggenberger G. The role of DOM sorption to mineral surfaces in the preservation of organic matter in soils . Organic Geochemistry, 2000, 31(7/8): 711-725.
(  0) 0) |
| [30] |
黄文昭, 赵秀兰, 朱建国, 等. 土壤碳库激发效应研究. 土壤通报, 2007, 38(1): 149-154. Huang W Z, Zhao X L, Zhu J G, et al. Priming effect of soil carbon pools (In Chinese). Chinese Journal of Soil Science, 2007, 38(1): 149-154. DOI:10.3321/j.issn:0564-3945.2007.01.034 (  0) 0) |
| [31] |
苗淑杰, 乔云发, 王文涛, 等. 添加玉米秸秆对黄棕壤有机质的激发效应. 土壤, 2019, 51(3): 622-626. Miao S J, Qiao Y F, Wang W T, et al. Priming effect of maize straw addition on soil organic matter in yellow-brown soil (In Chinese). Soils, 2019, 51(3): 622-626. (  0) 0) |
| [32] |
Farrell M, Kuhn T K, MacDonald L M, et al. Microbial utilisation of biochar-derived carbon . Science of the Total Environment, 2013, 465: 288-297. DOI:10.1016/j.scitotenv.2013.03.090
(  0) 0) |
| [33] |
Cui J, Ge T D, Kuzyakov Y, et al. Interactions between biochar and litter priming:A three-source 14C and δ13C partitioning study . Soil Biology and Biochemistry, 2017, 104: 49-58. DOI:10.1016/j.soilbio.2016.10.014
(  0) 0) |
| [34] |
Kuzyakov Y, Friedel J, Stahr K. Review of mechanisms and quantification of priming effects . Soil Biology and Biochemistry, 2000, 32(11/12): 1485-1498.
(  0) 0) |
| [35] |
Zhang W D, Wang X F, Wang S L. Addition of external organic carbon and native soil organic carbon decomposition:A meta-analysis . PLoS One, 2013, 8(2): e54779. DOI:10.1371/journal.pone.0054779
(  0) 0) |
 2020, Vol. 57
2020, Vol. 57


