2. 南京林业大学生物与环境学院, 南京 210037
2. College of Biology and Environment, Nanjing Forest University, Nanjing 210037, China
近年来,人为因素导致我国农田土壤普遍酸化加剧,严重制约了土壤农业可持续发展和生态环境安全。研究[1-4]表明,长期过量施用化学氮肥是集约化农业生产条件下加速土壤酸化的主要根源。铵态氮肥的硝化作用和硝酸根携带盐基离子快速淋失是氮肥造成土壤酸化的主要机制。长期施用化学氮肥后的土壤在近20年时间内,土壤pH可由5.7显著降低至4.2[5]。大量施用化学氮肥不仅加速土壤酸化过程,增加农业生产成本,还导致氮素在土壤中过量累积或发生挥发及淋溶进入水体,由此带来的一系列生态环境问题,已引起人们广泛的关注。如何针对氮肥导致土壤酸化的问题找到有效的源头阻控方法,是目前亟待解决的难题。
已有研究[6]发现,林地土壤添加葡萄糖能够促进土壤微生物对无机态氮的固持,抑制土壤氮的净矿化速率,减少氮损失。马启翔等[7]研究表明,添加高浓度葡萄糖碳源使油松林土壤微生物对氮的需求增加,倾向于固持更多的无机态氮,而减弱矿化过程;向阔叶林土壤中添加蔗糖,导致原来高矿化和硝化作用也显著降低,微生物固氮作用增强[8];甚至添加葡萄糖增加氮的固定效率远高于树叶提取物、腐植酸等碳源[9]。以上结果表明,林地土壤中丰富的有机碳源可促进无机氮的微生物同化和土壤固持。根据氮素转化与质子产消的关系,这种有机碳促进无机氮的微生物同化作用也可减缓氮肥造成的土壤酸化作用[10]。然而,有关葡萄糖等碳源对旱地农田土壤氮素转化及其酸化作用的研究鲜见报道。
因此,本研究以葡萄糖作为模式碳源,初步分析外加碳源对农田土壤(NH4)2SO4和KNO3等肥料氮的微生物同化作用,及其阻控氮转化引起土壤酸化的耦合作用。研究结果对提高氮肥利用率、阻控土壤酸化、制定合理的农田土壤氮素管理措施、降低其对环境的负面效应等均具有重要意义。
1 材料与方法 1.1 供试土壤供试土壤为第四纪红黏土发育的红壤,采自安徽郎溪县飞里镇(31° 6′N,119° 8′E)红壤酸化阻控长期定位田间试验地空白处理的表层土壤(0~20 cm),该旱地主要进行花生或红薯与油菜轮作,已长达20多年。土壤基本性状为:pH(土水比1︰2.5)为4.32,有机质18.6 g·kg-1,交换性酸55.0 mmol·kg-1,可溶性碳35.6 mg·kg-1,水解性氮88.3 mg·kg-1,NO3--N 2.6 mg·kg-1,NH4+-N 4.8 mg·kg-1,有效磷175.7 mg·kg-1,速效钾3.7 mmol·kg-1;属于黏质壤土。
1.2 实验设计称取200.0 g风干土样(过2 mm筛)置于塑料杯中,参照Quan等[11]的实验方法,用去离子水调节土壤含水量至土壤田间持水量的40%,将土样充分拌匀,塑料杯用塑料保鲜膜封口,并在保鲜膜中间留一小孔,以便气体交换并减少水分损失。然后将塑料杯置于25 ℃的恒温培养箱中预培养7 d,每隔2~3天称重1次并补充水分,以保持土壤含水量恒定。
为研究添加碳源调控土壤酸化的潜力,提供了充足的碳源供应,按照C/N比为80的比例添加了葡萄糖和氮肥(NH4)2SO4或KNO3。土壤预培养结束后,设置以下6个处理:1)对照(CK);2)(NH4)2SO4(AS);3)KNO3(PN);4)葡萄糖(G);5)(NH4)2SO4+葡萄糖(AS+G);6)KNO3+葡萄糖(PN+G),每个处理3次重复。其中葡萄糖粉末添加量为8.0 g·kg-1干土,与土壤混合均匀后添加氮肥(N)量为100.0 mg·kg-1干土,用适量蒸馏水将(NH4)2SO4或KNO3完全溶解加入土样中,再补充水分至60%田间持水量,空白添加去离子水保持60%田间持水量,土样充分拌匀。每个处理的样品再平均分成6份(鲜土重约53 g)装在100 mL离心管中,置于25 ℃恒温培养箱中培养,每隔2~3天称重1次并补充水分,以保持土壤含水量恒定。培养时间为30 d,在培养的第0、2、5、10、18、30天分别破坏性采样,每次各处理取1份样品测定新鲜土样pH及各种形态N含量。
1.3 测定方法pH的测定:称取10.0 g鲜土,按照1︰2.5(风干土︰水)加入去离子水,涡旋搅拌5 min,静置30 min,用pH计(Thermo Scientific Orion Star A211,美国)测定样品上清液。
土壤微生物生物量氮(MBN)的测定:称取10.0 g鲜土,参照鲁如坤[12]的氯仿熏蒸浸提方法,浸提的全氮采用连续流动分析仪(San++System,SAKLAR,荷兰)测定,土壤微生物生物量氮含量以熏蒸和不熏蒸土壤浸提液中全氮的差值除以转化系数(0.45)得到。
土壤中各种形态氮的测定:称取10.0 g鲜土于100 mL塑料离心管中,按1︰4的干土水比加入0.5 mol·L-1K2SO4溶液32 mL,震荡1 h,离心,上清液滤膜过滤,滤液-20℃冻存。浸提液中的NH4+-N、NO3--N采用流动分析仪测定,NH4+-N与NO3--N之和为可溶性无机氮。土样残渣风干,研磨过60目筛,用于测定难提取态氮,包括固相有机态氮、固定态铵、MBN。难提取态氮的测定:称取提取完可溶性氮的风干残渣土样,采用凯氏消煮法,蒸馏定氮测定;用KOBr-KOH法提取固定态铵[12],难提取态氮减去固定态铵和MBN即为固相有机态氮[11]。
1.4 数据处理采用SPSS20.0中邓肯(Duncan)法对葡萄糖及氮肥处理中不同氮形态的含量以及pH进行差异显著性分析,P < 0.05表示差异显著。
2 结果与讨论 2.1 添加葡萄糖/无机氮肥对土壤NH4+-N、NO3--N和总无机氮的影响NH4+-N和NO3--N是土壤中无机氮的2种主要形式,其含量变化可全面反映不同处理土壤中有机氮的矿化与无机氮的固定过程及其相对强弱。图 1结果表明,在不添加葡萄糖的处理中,对照和AS处理的NH4+-N含量随培养时间有小幅降低(图 1a)),但NO3--N含量逐渐升高(图 1b)),30 d培养结束时增量约为16 mg·kg-1,无机氮也有小幅增加,培养结束时增量为3.7~9.8 mg·kg-1(图 1c))。PN处理的NH4+-N、NO3-和无机氮含量均随培养时间呈现逐渐升高的趋势,培养结束时无机氮增量为30.1 mg·kg-1,结果说明不添加葡萄糖时,单纯添加肥料氮主要促进红壤中有机氮的净矿化和NH4+-N的净硝化过程。由于本研究所采集的农田红壤pH低至4.32,在如此强酸性条件下,由氨氧化细菌驱动的硝化过程明显受到抑制,主要由氨氧化古菌驱动[13]。因此在该红壤中虽然存在硝化作用,但作用不强烈。
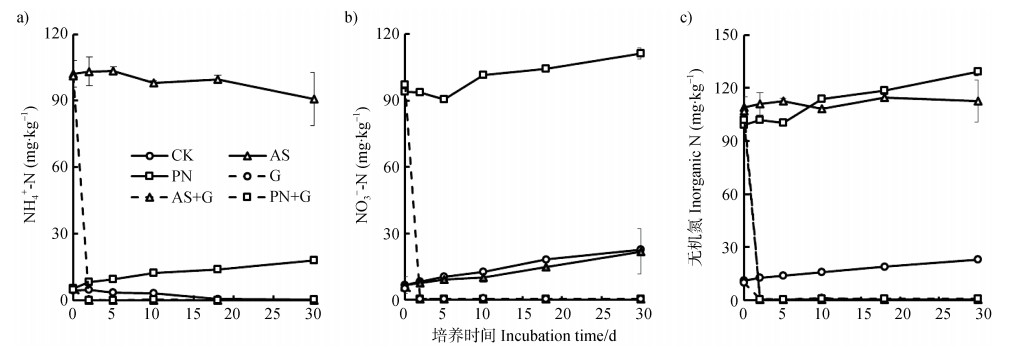
|
注:CK,对照;AS,(NH4)2SO4;PN,KNO3;G,葡萄糖;AS+G,(NH4)2SO4+葡萄糖;PN+G,KNO3+葡萄糖。下同。 Note:CK, Control; AS, (NH4)2SO4; PN, KNO3; G, glucose; AS+G, (NH4)2SO4+ glucose; PN+G, KNO3+ glucose. The same below. 图 1 添加葡萄糖和无机氮肥对土壤可溶性NH4+-N(a))、NO3--N(b))和总无机氮(c))30天培养期间的动态影响 Fig. 1 Effects of application of glucose and inorganic N fertilizer on dynamics of soluble NH4+-N(a)), NO3--N(b)), and total inorganic N(c))content during the 30-day incubation |
而在添加葡萄糖的处理中,与CK相比,G、PN+G和AS+G处理的NH4+-N、NO3--N和无机氮积累量均显著降低,土壤溶液的无机氮浓度从培养开始时的10.0、107.0和102.0 mg·kg-1,于实验第2天降至含量均低于1 mg·kg-1,而且在接下来的28 d培养期间基本保持在这一低无机氮浓度(图 1)。以上结果说明,充足的葡萄糖能快速促进红壤无机氮的固持,而且无明显有机氮的再矿化作用,这对促进土壤保氮具有重要意义。目前,无机氮的微生物同化作用在森林和草地土壤中已被广泛关注,被认为是这类生态系统氮素相对富集的主要机制[14]。森林和草地土壤的有机质含量高,而农田土壤所含的可利用碳数量较少,可能限制了微生物对硝态氮的利用;在农田生态系统,受微生物优先利用铵态氮这一传统观点的影响,人们普遍认为农田土壤微生物不利用硝态氮[15-16]。但本研究结果表明,加入足够的葡萄糖不仅可快速促进NH4+-N的微生物同化,而且也可快速促进NO3--N的微生物固持。土壤中可利用碳源的数量和质量可能是限制农田土壤NO3--N同化的关键因子,有研究发现当土壤有机碳源不足时,微生物对铵态氮的吸收同化能力强于硝态氮;当有充足的有机碳源时,土壤微生物对这两种形态氮素的固定能力几乎相当[8, 17]。
2.2 添加葡萄糖/无机氮肥对土壤微生物生物量氮、固相有机态氮和总氮的影响土壤单纯添加NH4+-N或NO3--N后,培养第2天后微生物生物量氮(MBN)含量均低于CK处理(图 2a)),说明该条件下微生物仍保持低活性状态,但随培养时间呈增加趋势,培养10 d后,微生物氮含量与CK相差不显著(P > 0.05)。土壤添加葡萄糖后,微生物氮含量均显著高于CK,特别是当葡萄糖和NH4+-N或NO3--N同时添加土壤后,培养初期土壤微生物生物量氮迅速增加,培养第5天达最大值,其中PN+G处理效果最明显,MBN含量可达143.9 mg·kg-1,是CK(78.53 mg·kg-1)的1.8倍。这一结果与前面无机氮转化的结果一致,说明葡萄糖作为良好的碳源和能源物质,加入土壤中可刺激微生物的生长,并快速利用红壤中的无机氮满足自身繁殖。
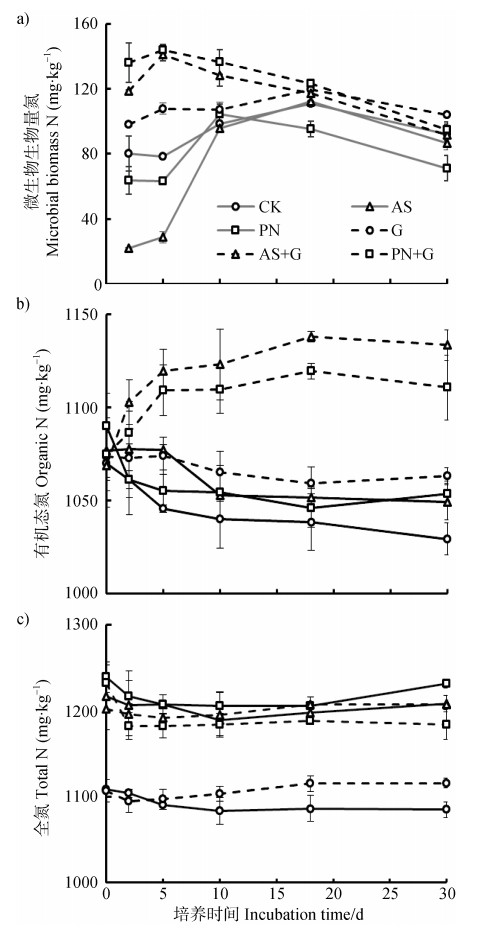
|
图 2 添加葡萄糖和无机氮肥处理对土壤微生物生物量氮(MBN,a))、有机态氮(b))和全氮(c))的动态影响 Fig. 2 Effects of application of glucose and inorganic N fertilizer on dynamics of in microbial biomass N(MBN, a)), organic N(b))and total N(c))during the 30-day incubation |
但随着培养时间的增长,添加葡萄糖处理中的MBN量逐渐下降,增幅变小,培养结束时各处理差异不显著(P > 0.05)。这主要是添加碳源后,微生物能够迅速利用养分进行生命活动和大量繁殖,当碳源或养分被利用完后,微生物无法摄取足够能源进行生命活动和大量繁殖,遂逐渐死亡,导致MBN含量逐渐降低[18]。
Quan等[11]将直接用中性盐难提取的土壤氮进一步区分为微生物生物量氮、固定态铵和固相有机态氮三种类型,发现本研究中固定态铵含量较低(均小于130 mg·kg-1),且不同处理间无明显差异(数据未列出)。但添加葡萄糖处理显著提高了土壤固相有机氮的含量,特别是与NH4+-N或NO3--N配施的处理,土壤固相有机态氮含量在培养前18 d显著增加(图 2b));AS+G处理在培养第18天,土壤有机态氮达到最大值1 138 mg·kg-1,较CK和AS处理分别增加9.6%和8.2%。培养18 d后,土壤固相有机态氮含量有下降趋势,但30 d培养期结束时,添加葡萄糖的G、AS+G和PN+G处理均较相应的CK、AS和PN处理固相有机态氮分别增加了33.7、84.2和61.4 mg·kg-1,添加的无机氮28%~50%均转化为更稳定的固相有机态氮。因此,添加足够葡萄糖可在短期内促进无机氮的微生物同化,并迅速转化为土壤固相有机氮。Quan等[11]的研究表明,绿肥和铵态氮肥同时施入土壤中,无机氮肥初期主要转化为MBN,但培养3 d后,微生物生物量碳含量逐渐下降,而固相有机氮含量则明显增加,最终23%~28%的无机氮转化为固相有机态氮从而促进土壤中NO3--N的固持,这与本实验结果相一致。这一结果也证实了图 2a)中微生物的结果,葡萄糖的添加可快速促进微生物的繁殖,微生物的失活有利于微生物固持的无机氮转化为更稳定的红壤固相有机态氮。此外,添加葡萄糖等易利用碳源可促进农田中大量NH4+-N以及NO3--N的在土壤中的固持,后期有机氮可矿化再被生物利用,这对减少红壤农田无机氮的损失、提高氮肥利用效率具有重要意义。
此外,从土壤全氮的结果看出,添加肥料氮的处理较不加氮的处理约高100 mg·kg-1,但各处理全氮含量变化不大,添加葡萄糖和肥料氮的处理全氮含量有低于相应不加葡萄糖的趋势(图 2c))。这些结果表明添加葡萄糖可在短期内促进无机氮的微生物同化,并进一步转化为土壤固相有机氮,但葡萄糖的大量添加有导致氮损失的风险,比如反硝化,特别在葡萄糖与硝态氮配施的处理更加明显,这主要是葡萄糖等易利用碳源可为氮的反硝化提供电子供体[19]。
2.3 添加葡萄糖/无机氮肥处理下土壤pH的动态变化由图 3可知,葡萄糖和氮肥单加或配合施用均对土壤pH产生不同程度的影响。与培养初始的pH相比,CK、AS和PN处理在整个30 d的培养期间土壤pH均降低了,特别是培养的第18~30天内;其中整个培养期内CK和AS分别降低了0.41和0.21个pH单位,这主要是氮的硝化作用产生了大量质子,这与图 1b))的结果相印证。与CK相比,单加葡萄糖(G)在培养前5天并未对pH产生明显影响,培养中期(第10~18天)显著降低了pH,而18 d后pH呈增加趋势,最终pH略高于对照;AS和PN加入土壤当天就显著了降低土壤的pH,由对照处理的4.32分别降低至4.05和3.85。葡萄糖和氮肥配合施用与氮肥单施的处理相比,培养当天pH无明显差异,但在培养过程中AS+G较AS处理更加显著降低了土壤pH,培养初期差异不断增大,第5天pH差值最大达0.5个pH单位,但培养结束时两个处理的差异不显著(P > 0.05)。与之相反,PN+G与PN处理相比,在第2天就显著增加了土壤pH,然后pH差值维持在0.68~0.78单位之间。
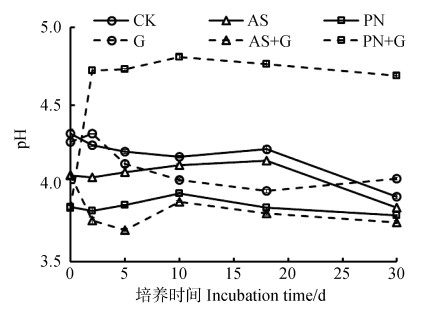
|
图 3 添加葡萄糖或无机氮肥对土壤pH的动态影响(数据标准偏差小,因此图中不易显示) Fig. 3 Effect of application of glucose and inorganic N fertilizer on dynamics of soil pH |
土壤pH变化与化学氮肥在土壤表面的化学反应以及碳氮转化过程等相关。首先是(NH4)2SO4和KNO3加入红壤,NH4+和K+会与土壤表面的交换性Al3+和H+发生交换反应,Al进入溶液很容易水解并释放出H+,因此这种盐效应是两种肥料加入红壤后土壤pH在实验开始当天就显著降低的主要原因[20]。此外,(NH4)2SO4中的SO42-在红壤中会发生专性吸附,并释放出OH-,起着一定的酸度中和作用[20],因此,单加KNO3较单加(NH4)2SO4的土壤pH更低(图 3)。而土壤pH在培养过程的波动则主要与碳氮转化过程有关。在不添加葡萄糖的处理中,由于有机氮的矿化会消耗等当量的质子,而1 mol NH4+-N的硝化会产生2 mol H+,因此各处理中pH均降低了,特别是第18~30天的培养期间(图 1b)和图 3)。单纯添加葡萄糖在第5~18天也明显降低了土壤pH,由于大量葡萄糖分解产生有机酸、促进土壤pH下降。Rukshana等[21]的结果表明,土壤中添加葡萄糖后微生物活性增强,葡萄糖分解时糖酵解、三羧酸循环等过程会产生中间产物有机酸,如乳酸、丙酮酸、柠檬酸等,促进土壤pH下降。而第18~30天内,主要是有机碳矿化成CO2过程会消耗等当量的H+,因此pH有明显的上升趋势。而在葡萄糖与无机氮配施的处理中,1 mol NH4+-N的微生物同化同样会产生1 mol H+,因此,培养前5天微生物同化作用强的阶段显著降低了土壤pH,而后期有机碳的矿化作用同样提高了土壤pH。虽然葡萄糖与(NH4)2SO4处理中NH4+-N基本全被微生物同化固定,而单施(NH4)2SO4处理由于红壤酸性强,仅有约10%的NH4+-N发生了硝化作用,但两个处理的pH相差不明显。因此,可以想象在硝化作用强烈的土壤中,NH4+-N的微生物同化作用相比大量NH4+-N硝化作用,有明显抑制土壤酸化的作用。而葡萄糖与NO3--N的配施处理中微生物同化和有机碳矿化作用均有利于OH-的释放或H+的消耗,因此,这一处理土壤pH提高0.68~0.78个单位,显著降低了土壤酸度。添加葡萄糖与氮肥的处理中,微生物同化作用主要发生在实验开始的前2天,而单加葡萄糖处理在培养第5天后才出现有机酸导致土壤pH降低的现象,因此,推测NH4+或NO3-转化是与葡萄糖共同作用的结果。而且,利用葡萄糖等碳源促进肥料氮的微生物同化,应该可以减少铵态氮的硝化和硝态氮的淋失造成的土壤酸化作用,促进土壤保氮的作用。但如何调控碳源的数量和质量,达到既促进土壤保氮、氮肥供应与植物需要相匹配,又抑制土壤酸化的作用,尚需更系统、深入的研究。
3 结论在强酸性农田红壤中添加足够的葡萄糖等易利用碳源,可快速促进微生物对肥料中铵态氮和硝态氮的同化,并同时转化为土壤固相有机氮。这一过程不但具有提高红壤保氮能力和氮肥利用率的潜力,同时可削弱由于铵态氮的硝化及硝态氮淋失导致的土壤酸化作用。因此,本研究结果对提高农田氮肥利用和阻控酸化具有重要意义,但实际条件下如何控制有机碳源的数量和质量、实现双赢的目标尚需系统的研究。
| [1] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570
(  0) 0) |
| [2] |
Barak P, Jobe B O, Krueger A R, et al. Effects of long-term soil acidification due to nitrogen fertilizer inputs in Wisconsin[J]. Plant and Soil, 1997, 197(1): 61-69. DOI:10.1023/A:1004297607070
(  0) 0) |
| [3] |
Zhao W, Cai Z C, Xu Z H. Does ammonium-based N addition influence nitrification and acidification in humid subtropical soils of China?[J]. Plant and Soil, 2007, 297(1/2): 213-221.
(  0) 0) |
| [4] |
Zhao X, Xing G X. Variation in the relationship between nitrification and acidification of subtropical soils as affected by the addition of urea or ammonium sulfate[J]. Soil Biology & Biochemistry, 2009, 41(12): 2584-2587.
(  0) 0) |
| [5] |
Cai Z J, Wang B R, Xu M G, et al. Intensified soil acidification from chemical N fertilization and prevention by manure in an 18-year field experiment in the red soil of Southern China[J]. Journal of Soils and Sediments, 2015, 15(2): 260-270. DOI:10.1007/s11368-014-0989-y
(  0) 0) |
| [6] |
Gilliam F S, Lyttle N L, Thomas A, et al. Soil variability along a nitrogen mineralization and nitrification gradient in a nitrogen-saturated hardwood forest[J]. Soil Science Society of America Journal, 2006, 69(4): 1262-1271.
(  0) 0) |
| [7] |
Ma Q, Li W, Pan K W, et al. Effect of continuous glucose addition on soil N transformation of the Pinus tabulaeformis and Cercidiphyllum japonicum plantations (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(3): 426-433. [马启翔, 李伟, 潘开文, 等. 持续碳源添加对油松和连香树林地土壤氮转化的影响[J]. 应用与环境生物学报, 2013, 19(3): 426-433.]
(  0) 0) |
| [8] |
Dong D Y, Wang D T, Ma H L, et al. Effects of adding glucose on soluble and microbial nitrogen in subtropical broad-leaved forest soil (In Chinese)[J]. Soils, 2019, 51(1): 19-24. [董冬玉, 王丹婷, 马红亮, 等. 添加葡萄糖对中亚热带阔叶林土壤氮转化的影响[J]. 土壤, 2019, 51(1): 19-24.]
(  0) 0) |
| [9] |
Magill A H, Aber J D. Variation in soil net mineralization rates with dissolved organic carbon additions[J]. Soil Biology and Biochemistry, 2000, 32(5): 597-601. DOI:10.1016/S0038-0717(99)00186-8
(  0) 0) |
| [10] |
Bolan N S, Hedley M J, White R E. Processes of soil acidification during nitrogen cycling with emphasis on legume based pastures[J]. Plant and Soil, 1991, 134(1): 53-63. DOI:10.1007/BF00010717
(  0) 0) |
| [11] |
Quan Z, Huang B, Lu C Y, et al. The fate of fertilizer nitrogen in a high nitrate accumulated agricultural soil[J]. Scientific Reports, 2016, 5: 21539.
(  0) 0) |
| [12] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.]
(  0) 0) |
| [13] |
Lu L, Han W Y, Zhang J B, et al. Nitrification of archaeal ammonia oxidizers in acid soils is supported by hydrolysis of urea[J]. The ISME Journal, 2012, 6(10): 1978-1984. DOI:10.1038/ismej.2012.45
(  0) 0) |
| [14] |
Zogg G P, Zak D R, Pregitzer K S, et al. Microbial immobilization and the retention of anthropogenic nitrate in a northern hardwood forest[J]. Ecology, 2000, 81(7): 1858-1866. DOI:10.1890/0012-9658(2000)081[1858:MIATRO]2.0.CO;2
(  0) 0) |
| [15] |
Burger M, Jackson L E. Microbial immobilization of ammonium and nitrate in relation to ammonification and nitrification rates in organic and conventional cropping systems[J]. Soil Biology & Biochemistry, 2003, 35(1): 29-36.
(  0) 0) |
| [16] |
Wang J, Sun N, Xu M G, et al. The influence of long-term animal manure and crop residue application on abiotic and biotic N immobilization in an acidified agricultural soil[J]. Geoderma, 2019, 337: 710-717. DOI:10.1016/j.geoderma.2018.10.022
(  0) 0) |
| [17] |
Cheng Y, Huang R, Yu Y F, et al. Role of microbial assimilation of soil NO3- in reducing soil NO3- concentration (In Chinese)[J]. Acta Pedologica Sinica, 2017, 54(6): 1326-1331. [程谊, 黄蓉, 余云飞, 等. 应重视硝态氮同化过程在降低土壤硝酸盐浓度中的作用[J]. 土壤学报, 2017, 54(6): 1326-1331.]
(  0) 0) |
| [18] |
Szili-Kovács T, Török K, Tilston E L, et al. Promoting microbial immobilization of soil nitrogen during restoration of abandoned agricultural fields by organic additions[J]. Biology and Fertility of Soils, 2007, 43(6): 823-828. DOI:10.1007/s00374-007-0182-1
(  0) 0) |
| [19] |
Cheng Y, Cai Z C, Chang S X, et al. Wheat straw and its biochar have contrasting effects on inorganic N retention and N2O production in a cultivated Black Chernozem[J]. Biology and Fertility of Soils, 2012, 48(8): 941-946. DOI:10.1007/s00374-012-0687-0
(  0) 0) |
| [20] |
Li J Y, Wang N, Xu R K, et al. Potential of industrial by-products in ameliorating acidity and aluminum toxicity of soils under tea plantation[J]. Pedosphere, 2010, 20(5): 645-654. DOI:10.1016/S1002-0160(10)60054-9
(  0) 0) |
| [21] |
Rukshana F, Butterly C R, Baldock J A, et al. Model organic compounds differ in their effects on pH changes of two soils differing in initial pH[J]. Biology and Fertility of Soils, 2011, 47(1): 51-62. DOI:10.1007/s00374-010-0498-0
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


