2. 山西大同大学生命科学学院, 山西大同 037004
2. School of Life Science, Shanxi Datong University, Datong, Shanxi 037004, China
氧化亚氮(N2O)作为一种重要的温室气体,温室效应潜力是二氧化碳(CO2)的298倍,其排放问题是当前全球农业面临的重要挑战之一[1]。据估算,1981—2010年间,全球陆地生态系统排放的N2O高达13 Tg·y-1[2],其中农田排放至大气中的N2O可达4.1 Tg·y-1[3]。在土壤中,硝化过程(nitrification)、反硝化过程(denitrification)、硝化微生物的反硝化过程(nitrification)以及硝酸盐歧化过程(dissimilatory nitrate reduction to ammonium,DNRA)等均可产生N2O[4]。通常认为催化氨氧化反应的氨单氧化酶(amoA编码)和催化亚硝酸盐还原反应的
过量施用氮肥是农田N2O排放增加的一个主要原因[5]。据估算,每100 kg氮肥就有约1 kg氮以N2O的形式排放到大气层[6]。因此,深入研究农田土壤N2O的影响因素并提出合理的减排措施,对全球气候变化具有重要意义。针对N2O减排的措施,主要包括施肥管理、施用硝化抑制剂和生物炭等[4]。目前土壤微生物影响N2O排放的研究主要集中在硝化细菌和反硝化细菌,关于其他微生物的描述很少。最近的研究发现,对土壤接种促生微生物(Plant growth promoting rhizobium,PGPR)Bacillus amyloliquefaciens[7]和Trichoderma viride[8]后显著降低了N2O排放,该结果与土壤中反硝化相关功能基因丰度的提高,尤其是nosZ型微生物丰度的增加与群落结构的改变有关。丛枝菌根真菌能与陆地上约80%植物形成共生体。在共生体中,菌根通过根外菌丝吸收土壤中的养分,传递给宿主植物,作为交换宿主植物会向其供应光合产物。研究表明,AMF可影响土壤中氮素转化过程,进而影响土壤氮素利用率等。最新的研究发现AMF对N2O减排也有重要作用[9-11],表明土壤有益微生物在促生增效的同时可望实现温室气体减排。本文总结了AMF减少N2O排放进展,分析了AMF介导N2O减排的可能途径,并提出了强化土著AMF进行减排的措施。
1 AMF减少土壤N2O排放的作用AMF作为在自然界中分布最广泛的一类共生微生物,可与大部分陆地植物形成共生关系[12]。研究发现AMF可以吸收铵态氮、硝态氮和氨基酸[13-14]。在一定条件下,AMF也可加速有机物的降解。与此同时,AMF还可通过地下菌丝网络影响氮素在土壤中的循环过程[15]。最新的研究报道了AMF对土壤中N2O的减排作用。Bender等[16]以番茄野生型/菌根突变体作为材料,发现接种AMF处理显著降低了野生型番茄土壤中N2O排放量。同样,在田间条件下Cavagnaro等[17]发现AMF减少了番茄根际土壤N2O排放。Zhang等[11]以水稻为材料,发现在淹水阶段AMF显著降低了水田N2O排放。Storer等[10]利用分室装置,发现AMF根外菌丝降低了菌丝际有机残体降解过程中产生的N2O。然而,Okiobe等[9]发现菌丝残体促进了菌丝际N2O排放,表明菌丝代谢活性可能显著影响AMF的减排作用。
2 AMF影响土壤N2O排放的作用机制 2.1 AMF与硝化微生物的相互作用在通气状况良好条件下,微生物硝化作用是土壤N2O的重要来源。铵态氮的硝化过程由一系列生化反应组成,首先氨氧化细菌(AOB)或氨氧化古菌(AOA)将氨氧化为亚硝酸盐[18]。亚硝酸盐再进一步被亚硝酸盐氧化细菌氧化为硝酸盐[19]。硝化作用中的氨氧化过程(NH4→
AMF与硝化微生物的互作对N2O排放有重要意义。AMF和氨氧化微生物(AOA、AOB)均以
也有研究发现,接种AMF后氨氧化微生物数量显著增加。Teutscherova等[25]发现接种AMF虽然增加了菌根际AOB丰度,但降低了N2O的排放。在该研究中,AOB的反硝化作用是N2O的主要来源,因此推测AMF菌丝分泌物促进了接种处理中N2O还原菌的生长,促进了N2O还原。AMF导致氨氧化微生物数量增加的可能原因包括:在植物生长早期,AMF侵染植物根系时对植物生长有抑制作用,导致菌根际含碳分泌物减少,抑制了异养微生物对
通常认为,在厌氧条件下N2O主要由异养反硝化作用产生。在缺氧条件下,反硝化微生物以有机碳作为电子供体进行呼吸作用,在反硝化过程中N2O可作为中间产物排放到大气中[27]。目前仅有完全反硝化过程能够将N2O还原为N2(图 1),该过程是由nosZ基因编码的氧化亚氮还原酶(N2OR)所催化。许多反硝化微生物,如Pseudomonas chlororaphis[28]和硝化微生物[29],由于缺少nosZ基因而无法合成N2OR,导致反硝化过程终产物为N2O。同时其他含有nosZ-Ⅱ基因的微生物(多数缺乏nirK和nirS基因)可进一步将N2O还原为N2[30]。
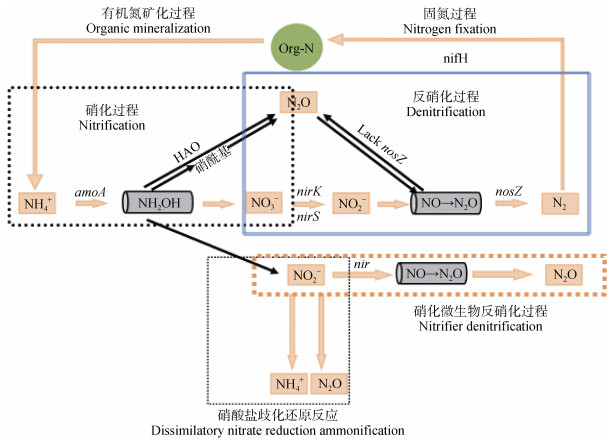
|
图 1 土壤产生N2O的主要过程(据Zhang等[33]修改) Fig. 1 Soil processes contribute to N2O formation(Adapted from Zhang et al[33]) |
Bender等[16]以番茄突变体(菌根无法侵染)作为材料,发现野生型番茄在接种AMF后土壤N2O排放量显著下降,且土壤中nirK(产生N2O的关键基因)的丰度和菌根侵染强度呈线性负相关,和nosZ(消纳N2O关键基因)丰度则呈正相关,表明AMF可能通过影响反硝化相关微生物群落结构,进而调控土壤N2O排放。其他研究发现,AMF侵染玉米根系后显著降低了玉米根际土壤中荧光假单胞细菌(一类缺乏nosZ基因的反硝化细菌)的丰度[28]。在草地中接种AMF后促进了其他微生物对硝态氮的利用,并显著降低了N2O排放[17]。这些研究表明AMF可能降低了土壤中反硝化菌的相对丰度,或者促进了反硝化菌对N2O的还原,进而降低了N2O排放。
AMF菌丝可以促进土壤反硝化潜势,其分泌物及非活性的菌丝残体可作为碳源被反硝化微生物和其他微生物所利用[31-32]。Okiobe等[9]的研究发现,硝酸盐含量较高时,菌丝残体显著促进了土壤潜性反硝化作用。可能的原因是菌丝死亡以后不再与反硝化微生物竞争氮素,其残体降解过程释放的含碳化合物对反硝化微生物具有“起爆效应(Priming)”,导致反硝化作用产生的N2O增加。
2.3 AMF影响土壤中氮素有效性农田N2O排放的一个重要影响因素是氮素有效性[34]。向土壤施用含氮肥料后,氮素有效性显著提高,硝化和反硝化作用也随之增强,进而增加了N2O的排放[35],因此降低土壤氮素有效性是AMF减少N2O排放的可能途径之一。研究表明AMF可以直接吸收土壤中的铵态氮、硝态氮和氨基酸[13-14],除了满足其自身生长对氮素需求外[36],还可传递给宿主植物以交换植物光合产物[37]。Tanaka等[13]发现AMF根外菌丝吸收的氮素占玉米地上部氮吸收量的74%。
除了可直接吸收利用无机氮,接种AMF还促进了微生物对有机氮的降解,从而提高植物对氮素的吸收,降低土壤氮含量,因而可降低反硝化过程排放的N2O[10],增加二氧化碳和氮素浓度可以强化这种效应[38]。Xu等[39]发现草地上接种AMF后黑麦草残体的矿化速率显著提高(提高228%)。在低磷条件下接种AMF后,根外菌丝显著加快了菌丝袋中玉米叶片氮素养分的释放。Leigh等[40]研究AMF对黑麦草降解的影响时,发现接种AMF后黑麦草贡献了宿主植物氮吸收量的20%。Storer等[10]发现AMF根外菌丝显著减少了玉米叶片降解过程中排放的N2O,表明AMF可有效降低有机物料降解过程中的N2O排放。
AMF对有机氮矿化的作用包括两个方面,一方面AMF加速有机氮矿化,会促进氮素向土壤中释放;然而AMF通过自身吸收或促进宿主植物吸收土壤中的无机氮,也可降低土壤总无机氮的含量。因此AMF对有机氮降解过程中N2O排放的影响取决于有机氮的矿化速率,以及植物-菌根共生体对无机氮的吸收速率。
2.4 菌丝际环境条件影响N2O排放除了直接影响土壤氮素含量和菌丝际微生物以外,AMF还可通过改变菌丝际环境条件(O2、含水量和土壤团聚体等)间接影响N2O排放(图 2)。
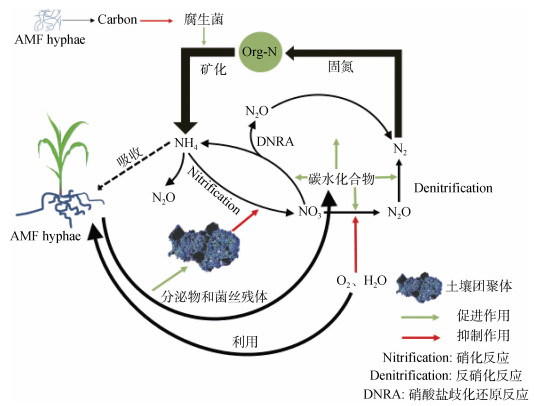
|
图 2 AMF影响N2O排放的可能途径(据Storer等[10]和Veresoglou等[9]修改) Fig. 2 Potential pathways contribute to impact of AMF on N2O emission(Adapted from Storer[10] and Veresoglou[9]) |
最近的研究发现,硝酸盐还原酶(Nap)对氧气并不敏感[41],因此有机碳和硝酸盐含量可能是影响硝态氮还原的主要因素[4]。AMF作为植物光合产物的重要中转站[32],可影响反硝化微生物和异养硝化微生物的数量和活性。AMF向菌丝际土壤分泌有机碳可增强异养微生物呼吸作用,加速厌氧环境的形成,间接影响反硝化过程[42]。土壤含水量也是影响土壤中氧气含量、微生物活性以及氧化还原状况的重要因素[43]。AMF侵染植物根系后其菌丝可生长到远离根系的土壤中吸收水分,提高植物对水分的利用率,降低土壤含水量,因此AMF可通过降低土壤含水量间接影响N2O排放。Lazcano等[44]发现,在高含水量时AMF显著提高了植物光合速率,同时降低了土壤含水量和N2O排放。可能的原因是低含水量降低了nosZ型微生物的数量或抑制了N2OR的活性。这一结果表明当土壤中产生N2O的微生物为优势类群时,AMF促进植物吸收水分降低了反硝化过程产生的N2O。相反,还原N2O的微生物为优势类群时,AMF提高了水分利用率,提高了氧气浓度进而抑制了N2OR的活性,不利于N2O还原。
土壤团聚体是影响土壤氧气含量和水分的重要因素之一,AMF菌丝分泌的球囊霉素作为土壤的黏结剂,促进了土壤中水稳性团聚体的形成[45]。Leifheit等[46]发现接种AMF促进了土壤团聚体形成,同时木本植物残体降解速率显著降低,无机氮释放速率也随之降低,进而可能减少N2O排放。大团聚体中的碳氮含量往往高于微团聚体[47],这与Diba等[48]观察到大团聚体反硝化潜势和N2O排放显著高于微团聚体的结果一致,且活性碳(labile carbon)是大团聚体中反硝化潜势的主要限制因子。此外,大团聚体中的反硝化微生物数量显著多于微团聚体[49]。因此,在土壤大团聚体中AMF根外菌丝分泌的活性碳可缓解反硝化还原酶在电子竞争中的劣势,促进N2O还原。而在微团聚体中AMF促进了氧气在土壤中的扩散,影响了N2OR的作用环境(厌氧),不利于N2O的还原[9]。因此应用AMF减少N2O排放时应考虑与保护性耕作相结合。整合分析结果发现,试验周期、土壤养分含量和植物根系共同影响AMF对土壤团聚体的作用[50]。此外,也有研究发现菌丝通过影响土壤结构提高了菌丝际N2O排放和反硝化速率[9]。
3 AMF调控N2O排放的影响因素AMF对土壤N2O排放的调控过程受多种因素影响。如土壤养分的有效性显著影响AMF-植物-土壤微生物三者相互作用的平衡[37]。在缺氮条件下,植物根系对氮素的吸收无法满足自身生长,需要依赖AMF吸收的氮素,同时植物向AMF提供光合产物以支持其生长代谢,促进其对土壤氮素的吸收,进而减少N2O排放[51]。相反,在氮素充足的条件下,由于根系吸收的氮素即可满足植物生长需求,因此植物会减少向AMF分配光合产物,减弱AMF在N2O减排中的作用。氮素含量过高还降低了AMF在土壤中的丰度和多样性[51-52],不利于AMF减排。同样,土壤磷有效性过高也显著降低了AMF侵染率及其在土壤中的丰度[39]。
由于AMF不具有宿主偏好性和专一性,根外菌丝可同时侵染同种或者不同种植物的根系,在根系之间形成菌丝桥。菌丝桥是植物间传递养分的重要途径,对植物间氮素再分配有重要意义[53]。以往研究大多基于单一宿主植物探究AMF对N2O排放的影响,Bender[16]、Storer[10]、Cavagnaro[17]和Zhang[11]等的研究中均未考虑植物多样性对菌根减排的影响。而Okiobe[54]等研究自然条件下的植物群落(不同植物混合种植)时,发现混合种植显著抑制了N2O排放潜势,而AMF对反硝化潜势(N2O+N2排放潜势)没有显著的作用。可能的原因是植物多样性的增加降低了土壤氮素有效性,此时氮素(电子受体)取代碳素(电子供体)成为反硝化过程的限制因子,进而降低了N2O排放。
4 结论与展望作为土壤中一类重要的有益微生物,农业管理措施往往忽视了菌根真菌的作用,施肥、耕作和农药的施用等显著降低了菌根真菌的多样性,影响其功能的发挥。农业绿色发展的一个核心内容是保证土壤健康,土壤健康的一个重要内容就是充分发挥有益微生物的作用。菌根庞大的菌丝网络,可以高效吸收磷素,同时具有N2O减排潜力,提高氮素利用率。AMF的这种多功能性,对充分发挥和挖掘有益微生物的作用,提高土壤的生态系统服务,促进农业绿色可持续发展具有重要的意义。
通过对AMF减排的研究进行总结,发现AMF影响N2O排放的途径主要包括:
1)AMF可通过与硝化微生物竞争
2)AMF可通过菌丝分泌物及菌丝残体直接影响反硝化微生物群落结构,也可通过影响菌丝际环境条件间接影响反硝化微生物的活性,进而影响N2O排放。
3)AMF促进菌丝际微生物分解有机氮,同时提高植物对土壤氮素的利用率,进而降低有机物料降解过程中的N2O排放。AMF还可以通过改变菌丝际环境因素(如pH,土壤结构)影响微生物代谢活性,进而调节N2O排放。
关于AMF减少土壤N2O排放的过程和机制,还需进一步开展大量的研究。尽管证据表明菌根显著影响N2O排放,但AMF与其他微生物的相互作用对N2O排放的影响尚不明确。随着参与土壤氮循环的微生物基因组测序工作的完成以及生理特性的鉴定,AMF和这些微生物的互作将成为研究N循环的一个重要热点。例如碳氮比是决定Shewanella loihica进行DNRA还是反硝化反应的决定因素[55],而AMF菌丝分泌物能够有效提高环境中的碳氮比,因此可能促进该菌进行硝酸盐歧化还原反应,抑制反硝化过程。同时研究发现许多非反硝化菌中也含有nosZ-Ⅱ基因,虽然nosZ-I型微生物对N2O的亲和力低于nosZ-Ⅱ型微生物[56],关于AMF能否影响nosZ-Ⅱ型微生物从而减少N2O排放尚没有研究,应当予以关注。此外,区域土壤气候条件、作物体系和管理措施、以及微环境等多种因素也显著影响AMF的减排强度。首先,不同农田生态系统中N2O排放的机制不同,如水田土壤主要通过反硝化过程产生N2O,而旱地中以硝化过程为主,二者间的主要功能微生物存在差异,AMF如何影响这些过程还需进一步深入的开展研究。其次,施肥、水分以及耕作等措施显著影响菌根真菌数量、多样性及群落结构,不同管理措施显著影响菌根作用的发挥。最后菌根真菌是土壤微生物的一个部分,菌根与土壤其他生物如蚯蚓线虫等的互作也会直接或者间接的影响N2O排放。
| [1] |
Domeignoz-Horta L A, Philippot L, Peyrard C, et al. Peaks of in situ N2O emissions are influenced by N2O-producing and reducing microbial communities across arable soils[J]. Global Change Biology, 2018, 24(1): 360-370. DOI:10.1111/gcb.13853
(  0) 0) |
| [2] |
Tian H Q, Chen G S, Lu C Q, et al. Global methane and nitrous oxide emissions from terrestrial ecosystems due to multiple environmental changes[J]. Ecosystem Health and Sustainability, 2015, 1(1): 1-20.
(  0) 0) |
| [3] |
Davidson E A, Kanter D. Inventories and scenarios of nitrous oxide emissions[J]. Environmental Research Letters, 2014, 9: 105012. DOI:10.1088/1748-9326/9/10/105012
(  0) 0) |
| [4] |
Zhu Y G, Wang X H, Yang X R, et al. Key microbial processes in nitrous oxide emissions of agricultural soil and mitigation strategies (In Chinese)[J]. Environmental Science, 2014, 35(2): 792-800. [朱永官, 王晓辉, 杨小茹, 等. 农田土壤N2O产生的关键微生物过程及减排措施[J]. 环境科学, 2014, 35(2): 792-800.]
(  0) 0) |
| [5] |
Reay D S, Davidson E A, Smith K A, et al. Global agriculture and nitrous oxide emissions[J]. Nature Climate Change, 2012, 2(6): 410-416. DOI:10.1038/nclimate1458
(  0) 0) |
| [6] |
Jensen E S, Peoples M B, Boddey R M, et al. Legumes for mitigation of climate change and the provision of feedstock for biofuels and biorefineries. A review[J]. Agronomy for Sustainable Development, 2012, 32(2): 329-364.
(  0) 0) |
| [7] |
Wu S H, Zhuang G Q, Bai Z H, et al. Mitigation of nitrous oxide emissions from acidic soils by Bacillus amyloliquefaciens, a plant growth-promoting bacterium[J]. Global Change Biology, 2018, 24(6): 2352-2365. DOI:10.1111/gcb.14025
(  0) 0) |
| [8] |
Xu S J, Feng S G, Sun H S, et al. Linking N2O emissions from biofertilizer-amended soil of tea plantations to the abundance and structure of N2O-reducing microbial communities[J]. Environmental Science & Technology, 2018, 52(19): 11338-11345.
(  0) 0) |
| [9] |
Okiobe S T, Augustin J, Mansour I, et al. Disentangling direct and indirect effects of mycorrhiza on nitrous oxide activity and denitrification[J]. Soil Biology & Biochemistry, 2019, 134: 142-151.
(  0) 0) |
| [10] |
Storer K, Coggan A, Ineson P, et al. Arbuscular mycorrhizal fungi reduce nitrous oxide emissions from N2O hotspots[J]. New Phytologist, 2018, 220(4): 1285-1295. DOI:10.1111/nph.14931
(  0) 0) |
| [11] |
Zhang X, Wang L, Ma F, et al. Effects of arbuscular mycorrhizal fungi on N2O emissions from rice paddies[J]. Water, Air, & Soil Pollution, 2015, 226(7): 222.
(  0) 0) |
| [12] |
Smith S E, Read D. Mycorrhizal symbiosis . 3rd ed[M]. London: Academic Press, 2008: 13-41.
(  0) 0) |
| [13] |
Tanaka Y, Yano K. Nitrogen delivery to maize via mycorrhizal hyphae depends on the form of N supplied[J]. Plant, Cell and Environment, 2005, 28(10): 1247-1254. DOI:10.1111/j.1365-3040.2005.01360.x
(  0) 0) |
| [14] |
Whiteside M D, Treseder K K, Atsatt P R. The brighter side of soils:Quantum dots track organic nitrogen through fungi and plants[J]. Ecology, 2009, 90(1): 100-108.
(  0) 0) |
| [15] |
Veresoglou S D, Chen B D, Rillig M C. Arbuscular mycorrhiza and soil nitrogen cycling[J]. Soil Biology & Biochemistry, 2012, 46: 53-62.
(  0) 0) |
| [16] |
Bender S F, Plantenga F, Neftel A, et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil[J]. The ISME Journal, 2014, 8(6): 1336-1345. DOI:10.1038/ismej.2013.224
(  0) 0) |
| [17] |
Cavagnaro T R, Barrios-Masias F H, Jackson L E. Arbuscular mycorrhizas and their role in plant growth, nitrogen interception and soil gas efflux in an organic production system[J]. Plant and Soil, 2012, 353(1/2): 181-194.
(  0) 0) |
| [18] |
Freitag A, Rudert M, Bock E. Growth of Nitrobacter by dissimilatoric nitrate reduction[J]. FEMS Microbiology Letters, 1987, 48(1/2): 105-109.
(  0) 0) |
| [19] |
Pang Y M, Liu G H, Qi L, et al. Ways and effect factors of N2O emission in biological nitrogen removal process from wastewater (In Chinese)[J]. Environmental Protection Science, 2014, 40(2): 8-13. [庞毓旻, 刘国华, 齐鲁, 等. 污水生物脱氮过程中N2O的释放途径和影响因素[J]. 环境保护科学, 2014, 40(2): 8-13.]
(  0) 0) |
| [20] |
Stein L Y. Nitrification. Washington D C.: American Society of Microbiology, 2011: 95-114.
(  0) 0) |
| [21] |
Bollmann A, Bar-Gilissen M J, Laanbroek H J. Growth at low ammonium concentrations and starvation response as potential factors involved in niche differentiation among ammonia-oxidizing bacteria[J]. Applied and Environmental Microbiology, 2002, 68(10): 4751-4757. DOI:10.1128/AEM.68.10.4751-4757.2002
(  0) 0) |
| [22] |
Kaye J P, Hart S C. Competition for nitrogen between plants and soil microorganisms[J]. Trends in Ecology & Evolution, 1997, 12(4): 139-143.
(  0) 0) |
| [23] |
Amora-Lazcano E, Vázquez M M, Azcón R. Response of nitrogen-transforming microorganisms to arbuscular mycorrhizal fungi[J]. Biology and Fertility of Soils, 1998, 27(1): 65-70. DOI:10.1007/s003740050401
(  0) 0) |
| [24] |
Veresoglou S D, Sen R, Mamolos A P, et al. Plant species identity and arbuscular mycorrhizal status modulate potential nitrification rates in nitrogen-limited grassland soils[J]. Journal of Ecology, 2011, 99(6): 1339-1349.
(  0) 0) |
| [25] |
Teutscherova N, Vazquez E, Arango J, et al. Native arbuscular mycorrhizal fungi increase the abundance of ammonia-oxidizing bacteria, but suppress nitrous oxide emissions shortly after urea application[J]. Geoderma, 2019, 338: 493-501. DOI:10.1016/j.geoderma.2018.09.023
(  0) 0) |
| [26] |
Veresoglou S D. Arbuscular mycorrhiza prevents suppression of actual nitrification rates in the(myco-)rhizosphere of Plantago lanceolata[J]. Pedosphere, 2012, 22(2): 225-229. DOI:10.1016/S1002-0160(12)60009-5
(  0) 0) |
| [27] |
Sanford R A, Wagner D D, Wu Q, et al. Unexpected nondenitrifier nitrous oxide reductase gene diversity and abundance in soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(48): 19709-19714. DOI:10.1073/pnas.1211238109
(  0) 0) |
| [28] |
Meyer J R, Linderman R G. Selective influence on populations of rhizosphere or rhizoplane bacteria and actinomycetes by mycorrhizas formed by Glomus fasciculatum[J]. Soil Biology & Biochemistry, 1986, 18(2): 191-196.
(  0) 0) |
| [29] |
Arp D J, Stein L Y. Metabolism of inorganic N compounds by ammonia-oxidizing bacteria[J]. Critical Reviews in Biochemistry and Molecular Biology, 2003, 38(6): 471-495. DOI:10.1080/10409230390267446
(  0) 0) |
| [30] |
Orellana L H, Chee-Sanford J C, Sanford R A, et al. Year-round shotgun metagenomes reveal stable microbial communities in agricultural soils and novel ammonia oxidizers responding to fertilization[J]. Applied and Environmental Microbiology, 2018, 84(2): e01646-17. DOI:10.1128/aem.01646-17
(  0) 0) |
| [31] |
Staddon P L. Rapid turnover of hyphae of mycorrhizal fungi determined by AMS microanalysis of 14C[J]. Science, 2003, 300(5622): 1138-1140. DOI:10.1126/science.1084269
(  0) 0) |
| [32] |
Kaiser C, Kilburn M R, Clode P L, et al. Exploring the transfer of recent plant photosynthates to soil microbes:Mycorrhizal pathway vs direct root exudation[J]. New Phytologist, 2015, 205(4): 1537-1551. DOI:10.1111/nph.13138
(  0) 0) |
| [33] |
Zhang J B, Müller C, Cai Z C. Heterotrophic nitrification of organic N and its contribution to nitrous oxide emissions in soils[J]. Soil Biology & Biochemistry, 2015, 84: 199-209.
(  0) 0) |
| [34] |
Xu H J, Yang X R, Li S, et al. Nitrogen inputs are more important than denitrifier abundances in controlling denitrification-derived N2O emission from both urban and agricultural soils[J]. Science of the Total Environment, 2019, 650: 2807-2817. DOI:10.1016/j.scitotenv.2018.10.001
(  0) 0) |
| [35] |
Wu D, Wei Z J, Well R, et al. Straw amendment with nitrate-N decreased N2O/(N2O+N2)ratio but increased soil N2O emission:A case study of direct soil-born N2 measurements[J]. Soil Biology & Biochemistry, 2018, 127: 301-304.
(  0) 0) |
| [36] |
Hodge A, Fitter A H. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(31): 13754-13759. DOI:10.1073/pnas.1005874107
(  0) 0) |
| [37] |
Walder F, van der Heijden M G A. Regulation of resource exchange in the arbuscular mycorrhizal symbiosis[J]. Nature Plants, 2015, 1(11): 15159. DOI:10.1038/nplants.2015.159
(  0) 0) |
| [38] |
Cheng L, Booker F L, Tu C, et al. Arbuscular mycorrhizal fungi increase organic carbon decomposition under elevated CO2[J]. Science, 2012, 337(6098): 1084-1087. DOI:10.1126/science.1224304
(  0) 0) |
| [39] |
Xu J, Liu S J, Song S R, et al. Arbuscular mycorrhizal fungi influence decomposition and the associated soil microbial community under different soil Phosphorus availability[J]. Soil Biology & Biochemistry, 2018, 120: 181-190.
(  0) 0) |
| [40] |
Leigh J, Hodge A, Fitter A H. Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material[J]. New Phytologist, 2009, 181(1): 199-207. DOI:10.1111/j.1469-8137.2008.02630.x
(  0) 0) |
| [41] |
Zhou Z M, Takaya N, Sakairi M A C, et al. Oxygen requirement for denitrification by the fungus Fusarium oxysporum[J]. Archives of Microbiology, 2001, 175(1): 19-25.
(  0) 0) |
| [42] |
Cannavo P, Richaume A, Lafolie F. Fate of nitrogen and carbon in the vadose zone:In situ and laboratory measurements of seasonal variations in aerobic respiratory and denitrifying activities[J]. Soil Biology & Biochemistry, 2004, 36(3): 463-478.
(  0) 0) |
| [43] |
Qi Y C, Dong Y S. Nitrous oxide emissions from soil and some influence factors (In Chinese)[J]. Acta Geographica Sinica, 1999, 54(6): 534-542. [齐玉春, 董云社. 土壤氧化亚氮产生、排放及其影响因素[J]. 地理学报, 1999, 54(6): 534-542.]
(  0) 0) |
| [44] |
Lazcano C, Barrios-Masias F H, Jackson L E. Arbuscular mycorrhizal effects on plant water relations and soil greenhouse gas emissions under changing moisture regimes[J]. Soil Biology & Biochemistry, 2014, 74: 184-192.
(  0) 0) |
| [45] |
Li W B, Ning C H, Xu M, et al. Arbuscular mycorrhizal fungi and Festuca elata can improve fertility of compacted soil (In Chinese)[J]. Acta Prataculturae Sinica, 2018, 27(11): 131-141. [李文彬, 宁楚涵, 徐孟, 等. 丛枝菌根真菌和高羊茅对压实土壤的改良效应[J]. 草业学报, 2018, 27(11): 131-141.]
(  0) 0) |
| [46] |
Leifheit E F, Verbruggen E, Rillig M C. Arbuscular mycorrhizal fungi reduce decomposition of woody plant litter while increasing soil aggregation[J]. Soil Biology & Biochemistry, 2015, 81: 323-328.
(  0) 0) |
| [47] |
Khalil K, Renault P, Mary B. Effects of transient anaerobic conditions in the presence of acetylene on subsequent aerobic respiration and N2O emission by soil aggregates[J]. Soil Biology & Biochemistry, 2005, 37(7): 1333-1342.
(  0) 0) |
| [48] |
Diba F, Shimizu M, Hatano R. Effects of soil aggregate size, moisture content and fertilizer management on nitrous oxide production in a volcanic ash soil[J]. Soil Science and Plant Nutrition, 2011, 57(5): 733-747. DOI:10.1080/00380768.2011.604767
(  0) 0) |
| [49] |
Sey B K, Manceur A M, Whalen J K, et al. Small-scale heterogeneity in carbon dioxide, nitrous oxide and methane production from aggregates of a cultivated sandy-loam soil[J]. Soil Biology & Biochemistry, 2008, 40(9): 2468-2473.
(  0) 0) |
| [50] |
Leifheit E F, Veresoglou S D, Lehmann A, et al. Multiple factors influence the role of arbuscular mycorrhizal fungi in soil aggregation-a meta-analysis[J]. Plant and Soil, 2014, 374(1/2): 523-537.
(  0) 0) |
| [51] |
Wang X Y, Wang D M, Huang Y Z. Effects of AMF community on the growth and nutrient uptake of white clover at different N supply levels (In Chinese)[J]. Journal of Beijing Forestry University, 2011, 33(2): 143-148. [王晓英, 王冬梅, 黄益宗. 不同施氮水平下AMF群落对白三叶草生长及养分吸收的影响[J]. 北京林业大学学报, 2011, 33(2): 143-148.]
(  0) 0) |
| [52] |
Chen Y L, Zhang X, Ye J S, et al. Six-year fertilization modifies the biodiversity of arbuscular mycorrhizal fungi in a temperate steppe in Inner Mongolia[J]. Soil Biology & Biochemistry, 2014, 69: 371-381.
(  0) 0) |
| [53] |
Chen Y L, Chen B D, Liu L, et al. The role of arbuscular mycorrhizal fungi in soil nitrogen cycling (In Chinese)[J]. Acta Ecologica Sinica, 2014, 34(17): 4807-4815. [陈永亮, 陈保冬, 刘蕾, 等. 丛枝菌根真菌在土壤氮素循环中的作用[J]. 生态学报, 2014, 34(17): 4807-4815.]
(  0) 0) |
| [54] |
Okiobe S T. Potential of effects of arbuscular mycorrhiza fungi on denitrification potential activity and nitrous oxide(N2O)emissions from a fertile agricultural soil. Berlin: Freie University., 2019.
(  0) 0) |
| [55] |
Yoon S, Cruz-García C, Sanford R, et al. Denitrification versus respiratory ammonification:Environmental controls of two competing dissimilatory NO3-/NO2- reduction pathways in Shewanella loihica strain PV-4[J]. The ISME Journal, 2015, 9(5): 1093-1104. DOI:10.1038/ismej.2014.201
(  0) 0) |
| [56] |
Yoon S, Nissen S, Park D, et al. Nitrous oxide reduction kinetics distinguish bacteria harboring clade I NosZ from those harboring clade Ⅱ NosZ[J]. Applied and Environmental Microbiology, 2016, 82(13): 3793-3800. DOI:10.1128/AEM.00409-16
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


