2. 浙江农林大学环境与资源学院, 浙江临安 3113003;
3. 浙江省临安区农业技术推广中心, 浙江临安 311300
2. School of Environmental and Resources, Zhejiang Agriculture and Forestry University, Lin'an, Zhejiang 311300, China;
3. Agricultural Technology Extension Centre of Lin'an City, Zhejiang Province, Lin'an, Zhejiang 311300, China
毛竹(Phyllostachys pubescens)生长周期短、用途广泛、经济价值高,已经成为我国南方地区尤其是山区农民的主要经济来源之一。近二十余年,为追求更高的经济效益,大量毛竹林由粗放经营模式逐渐转变为集约经营,主要措施为大量施用氮肥、深翻土壤以及林下清除灌木和杂草等,从而获得更高的竹材和竹笋产量。集约经营模式虽然增加了农户的经济收益,但是大量施用氮肥也带来了土壤酸化、微生物活性降低以及水体富营养化等一系列环境问题[1]。此外,已有学者研究发现毛竹林施肥、翻耕等集约经营措施也会导致土壤某些功能菌群如固氮菌和氨氧化微生物的群落结构发生显著改变[2],对土壤氮循环产生不利影响并且会加剧温室气体排放[3]。
丛枝菌根(Arbuscular mycorrhiza,AM)真菌是自然界分布最广泛的一类菌根真菌,能侵染超过80%的高等陆生植物根系,帮助宿主植物提高水分及养分利用效率[4]。由于氨氧化微生物是化能自养微生物,早期研究表明,AM真菌对土壤氨氧化微生物没有影响[5]。但近年来有研究发现,AM真菌可能通过与氨氧化微生物竞争土壤中的有效氮(NH4+)从而影响氨氧化微生物的丰度及群落[6-8]。Teutscherova等[7]的室内培养实验研究发现接种AM真菌处理的土壤中氨氧化细菌(Ammonia-oxidizing bacteria,AOB)的丰度显著上升,其他许多研究结果也表明AM真菌对AOB丰度的影响是积极的[9-11],并且AOB的群落结构也会因为AM真菌的存在发生显著的改变[12]。但也有一些研究发现AM真菌的存在会对氨氧化微生物产生负面的影响[6, 13-14],并且这些负面的影响大多数是在土壤NH3较低的情况下发生的,如土壤肥力低或者土壤pH较低土壤中的氨多以NH4+的形式存在,不利于被氨氧化古菌(Amonia-oxidizing archaea,AOA)或者AOB利用。
虽然在菌根共生过程中AM真菌与氨氧化微生物之间的养分竞争假设已成为目前较为流行的观点,但是这些研究未将AM真菌与根系的效果分开,因此无法准确评估AM真菌与根系对氨氧化微生物群落演变的贡献。此外,在不同的毛竹林经营强度下,菌根对氨氧化微生物影响如何目前尚未有明确的结论。因此,本研究利用原位微宇宙试验,研究毛竹林生态系统中丛枝菌根及菌丝对氨氧化微生物群落的影响及其对毛竹经营强度的响应机制,为毛竹林科学合理施用氮肥,减缓全球气候变化提供理论依据。
1 材料与方法 1.1 试验地概况试验地点位于浙江省杭州市临安区青山镇(119°42′ E,30°14′ N),海拔50 m,属亚热带季风气候,温暖湿润,光照充足,年降水量1 420 mm,年均气温约15.6 ℃,年均无霜期约230 d,地形为低山丘陵,土壤类型为红壤。选取集约经营毛竹林作为研究对象,同时选取附近立地条件相似的粗放经营毛竹林作为对照。集约经营毛竹林的经营措施主要是隔年采伐老竹留养新竹,去除林下灌木、杂草,并对毛竹进行钩梢。每年6月中下旬采用撒施的方式对毛竹林进行施肥,然后进行深翻,化肥用量为:尿素(CO(NH2)2)450 kg·hm–2、过磷酸钙(Ca(H2PO4)2)450 kg·hm–2、氯化钾(KCl)150 kg·hm–2。粗放经营毛竹林不施肥,隔年采伐老竹留养新竹,林下植被主要有连蕊茶(Camellia cuspidate)、狗脊蕨(Woodwardia japonica)、兔儿伞(Syneilesis aconitifolia)、络石(Trachelospermum jasminoides)、白花败酱草(Patriniavillosa)、宝铎草(Disporum sessile)等。
1.2 试验设计于2017年6月分别在集约经营和粗放经营的毛竹林样地各建立4个10 m×10 m的样方,各样方之间距离均大于30 m,共计8个样方。在每个样方内设置2个不同的微宇宙系统,共计16个。微宇宙系统由PVC筒(直径16 cm,高度20 cm)和尼龙筛网制成,PVC筒壁上开有8个孔(4个6 cm孔径和4个3 cm孔径),底部开有4个孔(6 cm孔径),所有的孔均安装有不同孔径的尼龙筛网以区分不同菌根分室处理,其中2 mm孔径的筛网可以使得毛竹细根及AM真菌菌丝均能通过(+细根+AM真菌),设为菌根室(RA)处理;35 μm孔径的筛网仅允许AM真菌菌丝通过(-细根+AM真菌),设为菌丝室(AH)处理。分层取出样地0~20 cm土壤,去除明显的植物根系及石块,放置好PVC筒后,再尽快按照原来顺序将土壤分层放入筒内。在微宇宙系统布置完成后原地培养3个月,用土钻采集微宇宙系统内土壤带回实验室进行分析。鲜土样混合后过2 mm筛,一部分土壤立即进行DNA提取及硝化势的测定,另一部分风干进行理化性质分析。
1.3 土壤理化性质及硝化势测定土壤理化性质参照鲁如坤等[15]方法:土壤有机质采用重铬酸钾-硫酸外加热法测定;碱解氮采用碱解扩散法测定;有效磷采用盐酸-氟化铵溶液浸提,钼锑抗比色法测定;速效钾采用醋酸铵提取,火焰分光光度计测定;土壤pH采用水土比2.5:1,玻璃电极法测定。
土壤硝化势的测定采用好气培养法[16]并作略微修改。称取10 g新鲜土样置于锥形瓶中,加入(NH4)2SO4调节NH4+-N浓度到400 mg·kg–1,以干土计算,将含水量调节至田间最大持水量的60%,同时以不加(NH4)2SO4溶液的土壤作为对照。将锥形瓶放于25 ℃的培养箱中避光培养48 h,培养结束后,用50 mL 1 mol·L–1KCl溶液浸提并过滤,流动分析仪测定NO3–-N含量。
1.4 土壤DNA提取及定量PCR土壤总DNA的提取采用MoBio PowerSoil® DNA Isolation Kit试剂盒(MoBio Laboratories,美国),称取0.5 g冷冻干燥土壤样品,按照试剂盒说明提取DNA。提取的DNA片段大小经1%(m/v)的琼脂糖凝胶电泳检测,并用微量分光光度计(NanoDrop ND-1000,Thermo Scientific,美国)进行浓度测定,保存于–40 ℃用于后续分析。
使用CFX96TM Real-Time System(Bio-Rad)仪器进行氨氧化古菌和氨氧化细菌amoA功能基因实时定量分析,以确定样品的基因拷贝数。AOA和AOB amoA基因的PCR扩增采用的引物对分别是Arch-amoAF:5′-A ATGGTCTGGCTTAGACG-3′/Arch-amoAR:5′-GCGGCCATCCATCTGATTGT-3′和amoA-1F:5′-GGGGTTTCTACTGGTGGT-3′/amoA- 2R:5′-CCCCTCGGGAAAGCCTTCTTC- 3′[17],每个样品3个重复,反应体系为:2×SYBR Premix Ex Taq 10 μL,50 μmol·L–1上游引物和下游引物各0.2 μL,DNA模板1.0 μL,无菌水补足至20 μL。AOA和AOB的扩增程序见参考文献[18]。
1.5 高通量测序及数据处理采用带barcode的AOA和AOB特异性引物,利用Illumina Miseq平台进行高通量测序,测序服务委托杭州联川生物技术有限公司完成。用QIIME2将Miseq测序完成后得到原始的下机数据进行处理,利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的有效数据。对最终获得的有效数据采用Vsearch2.3.4算法按照97%的相似度聚类,为了降低假阳性率,过滤掉singleton序列,获得最终的OTU丰度及代表序列,进一步进行多样性分析、物种分类注释和差异分析等。
1.6 数据分析采用SPSS19.0对土壤理化性质、硝化势、AOA和AOB amoA基因拷贝数、α多样性指数以及优势属相对丰度均进行单因素方差分析(One-way analysis of variance)和双因素方差分析(Two-way analysis of variance)比较各处理之间的差异显著性(P < 0.05)。对土壤理化性质与AOA和AOB的amoA基因拷贝数进行Pearson相关性分析。采用R语言Vegan包对不同处理土壤AOA和AOB群落结构进行非度量多维尺度转换排序分析(Non-metric multidimensional scaling,NMDS),并通过相似性检验(Analysis of similarities,ANOSIM)检验不同群落之间的差异显著性(P < 0.05)。为了进一步了解经营强度和不同分室处理对氨氧化微生物种群之间相互作用的影响,利用MENA平台对OTU丰度进行网络分析。
2 结果 2.1 土壤理化性质及硝化势无论是集约经营还是粗放经营毛竹林,AH处理土壤pH均显著低于RA处理(P < 0.05)。集约经营毛竹林AH处理土壤碱解氮也显著低于RA处理(P < 0.05),有机质及其他养分含量均未发生显著变化(表 1)。与不同分室处理相比,不同经营强度对土壤养分含量的影响更为明显。集约经营毛竹林RA处理土壤有机质、pH显著低于粗放经营毛竹林,而碱解氮含量显著高于粗放经营毛竹林土壤。同时,集约经营毛竹林AH处理土壤有效磷和速效钾含量显著高于粗放经营毛竹林,而pH显著降低(P < 0.05)。双因素方差分析结果表明,经营强度和分室处理均显著影响土壤pH和碱解氮含量,但两者没有显著的协同效应(表 1)。
|
|
表 1 毛竹林土壤理化性质及硝化势 Table 1 Soil physic-chemical properties and nitrification potentials of the Moso bamboo forest relative to management intensity(mean±SD, n=3) |
在同一类型毛竹林中,不同分室处理之间土壤硝化势均没有显著差异(表 1),而集约经营毛竹林RA处理土壤硝化势显著高于粗放经营毛竹林(P < 0.01)。双因素方差分析结果表明,经营强度对硝化势影响显著(P < 0.01),不同分室处理对硝化势影响不显著,但两者对土壤硝化势具有显著的协同作用(P < 0.05)。
2.2 氨氧化微生物amoA基因丰度荧光定量PCR结果显示,无论是集约经营还是粗放经营,不同分室处理之间毛竹林AOA的基因丰度均无显著差异(图 1)。而在同一分室处理条件下,集约经营毛竹林RA和AH的AOA基因丰度均显著高于粗放经营(P < 0.05)。双因素方差分析结果表明,经营强度对AOA基因丰度影响显著(P < 0.01)。
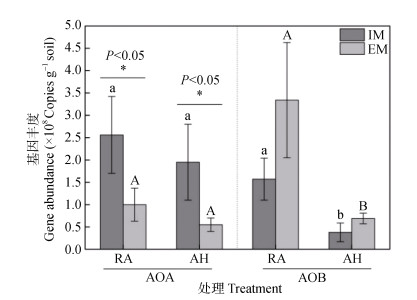
|
图 1 毛竹林土壤AOA及AOB基因丰度 Fig. 1 Abundance of AOA and AOB in Moso bamboo forest soils relative to management intensity |
无论是RA处理还是AH处理,AOB在不同经营强度毛竹林之间均无显著差异(图 1)。在同一经营强度下,无论是集约经营还是粗放经营,RA处理土壤AOB基因丰度均显著高于AH处理(P < 0.05)。双因素方差分析结果表明,经营强度和分室处理均对土壤AOB基因丰度影响显著(P < 0.05),两者交互作用也达到显著水平(P < 0.05)。
2.3 氨氧化微生物amoA基因丰度与土壤理化因子及硝化势的相关性对氨氧化微生物丰度与土壤理化因子及硝化势的Pearson相关性检验结果表明,AOA丰度与硝化势、碱解氮显著正相关,与土壤pH显著负相关,而AOB丰度则与土壤有机质和pH显著正相关(表 2)。
|
|
表 2 氨氧化微生物基因拷贝数与土壤理化及硝化势相关性分析 Table 2 Correlation analysis of abundance of ammonia oxidizers with soil properties and soil nitrification potential |
集约经营毛竹林中,AH处理AOA的物种数显著低于RA处理,而粗放经营毛竹林则相反,AH处理AOA的物种数及α多样性指数均显著高于RA处理(P < 0.05)。两种经营方式相比,粗放经营毛竹林AH处理的物种数及α多样性指数均显著高于集约经营毛竹林(表 3)。双因素方差分析显示经营强度对AOA的物种数及α多样性指数影响显著,不同分室处理无显著影响,但是两种因素对物种数和Chao1指数具有极显著的交互作用(P < 0.01)。与AOA相比,AOB物种数及α多样性指数在不同经营强度和分室处理之间均无显著差异(表 3)。双因素方差分析结果表明,仅经营强度对AOB群落Chao1指数影响显著(P < 0.05),经营强度及分室处理对AOB群落香农指数具有显著的交互作用(P < 0.05)。
|
|
表 3 毛竹林土壤AOA、AOB群落多样性指数 Table 3 Diversity indices of the AOA and AOB communities in the Moso bamboo forest soils |
ANOSIM分析结果显示,无论是经营强度还是不同分室处理均未对AOA和AOB的群落结构产生显著影响,但在集约经营毛竹林土壤中,RA和AH处理的AOA群落有明显区分。对AOB而言,不同经营强度毛竹林AH处理之间区分明显(图 2)。
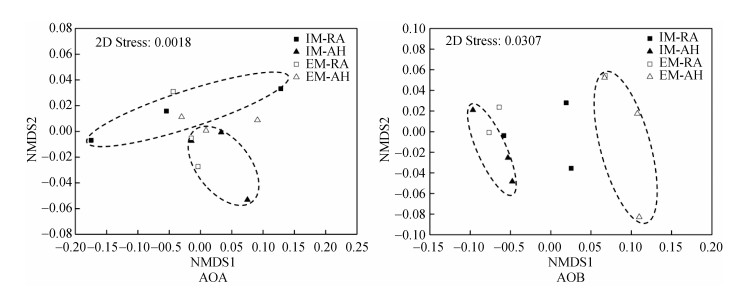
|
图 2 AOA、AOB群落组成NMDS排序图 Fig. 2 NMDS ordination plots of the community compositions of ammonia-oxidizing bacteria and archaea |
基于两种经营强度毛竹林的分组方式,对AOA和AOB的高通量测序数据进行网络分析。AOA的网络分析结果显示,粗放经营毛竹林网络中节点数高于集约经营,但是连接数和正相关比例均低于集约经营(表 4)。而AOB的网络分析结果则显示,
|
|
表 4 毛竹林土壤AOA、AOB分子生态网络特征 Table 4 The properties of the molecular ecological networks of the AOA and AOB communities in the Moso bamboo forest soils |
粗放经营毛竹林网络中节点数和连接数均高于集约经营,但正相关比例低于集约经营毛竹林(表 4)。不论AOA还是AOB,网络中正相关的连接数均表现出集约经营高于粗放经营的趋势。将网络节点与环境因子进行曼特尔相关性分析(Mantel test)发现,在每个分类水平环境因子并未对网络中的不同物种产生显著影响。
3 讨论微宇宙试验结果表明无论是集约经营还是粗放经营毛竹林,AH处理土壤pH均显著低于RA(P < 0.05),这与Veresoglou等[13]的研究结果一致,主要是由于AM菌丝体分泌的有机酸可降低土壤pH。其他学者分别以烟草和沙丁旺为宿主植物研究AM真菌对其土壤理化性质的影响也得到了相同的结果[19-20]。集约经营毛竹林AH处理土壤碱解氮也显著低于RA处理(P < 0.05)。虽然在菌根系统中,植物根系、AM真菌以及氨氧化微生物可能会竞争土壤中的有效氮素,但在有根系存在的菌根系统中,植物根系随时都在进行着更新和分解,产生氮素归还到土壤[21],而在无根系存在的菌丝室中,氮的来源补充远少于菌根室,菌丝吸收氮素导致土壤有效氮含量降低,这可能是导致RA处理中土壤碱解氮高于AH处理的主要原因。
荧光定量PCR结果表明,毛竹林经营强度对AOA基因丰度产生了显著的影响,对AOB的影响不显著,导致这一结果的原因可能是因为pH降低影响了AOA的丰度,相关性分析也显示AOA基因丰度与pH显著相关。Nicol等[22]发现,AOA基因丰度随着土壤pH的增加而降低 (在4.9~7.5之间),即相较于AOB而言AOA在自然界中拥有更广泛的生态位,更适于在酸性土壤条件下生存并且在酸性土壤中发挥的作用更大[23]。本研究中集约经营毛竹林大量的施肥导致土壤pH下降,为AOA提供了一个较为适宜的生存条件。研究结果发现不同的分室处理对AOB影响显著,不论是集约经营还是粗放经营,AH处理AOB的基因丰度均显著减少。相反,RA处理根系和AM真菌共存的菌根系统中AOB丰度更高。相关性分析显示pH极显著地影响了AOB的丰度,并且AH处理土壤pH变化规律与AOB丰度一致。因此,AH处理AOB丰度均显著减少可能是因为AM真菌菌丝通过降低pH间接地影响了AOB,较低的pH会降低AOB底物的利用效率[24]。这一结果与Teutscherova等[7]的盆栽结果一致,AM真菌与植物共生对AOA的丰度没有显著的影响,但是却显著提高了AOB的丰度。除此之外,在RA处理中植物根系与AM真菌共生也会使得土壤孔隙度增加,根系分泌物和菌丝分泌物的双重作用会增加土壤团聚体含量使得土壤更疏松[25]。鉴于AOB为一类好氧氨氧化微生物,疏松的土壤环境更有利于AOB的生存。虽然经营强度和分室处理分别对AOA和AOB的丰度产生了显著的影响,但对AOA和AOB群落结构影响并不显著。Cavagnaro等[5]在2007年对一有机农场的AOB的研究结果也发现,AM真菌并没有对其群落组成和结构产生显著的影响,其原因可能是因为研究时间相对较短导致差异性不显著。此外,AOA和AOB的群落结构对土壤理化因子的响应非常复杂,其群落结构的变化取决于多种因子的综合效应,这也是本研究中集约经营导致的土壤性质变化仅仅改变了AOA和AOB的基因丰度,而对其群落结构并未产生显著影响的可能原因。
近年来,分子生态网络已经被广泛应用于了解微生物种间交互多样性及其生态系统稳定性[26]。本研究中对网络节点数(Total nodes)、连接数(Total links)、平均度(Average degree)的对比分析均发现AOA网络中集约经营连接数和平均度大于粗放经营,说明集约经营毛竹林AOA分子生态网络中物种丰富程度、物种交互复杂性高于粗放经营。AOB网络中,粗放经营网络节点数、连接数、平均度三项指标的值均大于集约经营,说明粗放经营毛竹林AOB生态网络的物种丰富度、物种交互复杂性优于集约经营,这也说明了AOA和AOB在土壤中具有不同的生态位,对环境的响应具有较大的差异。网络中连接的正负相关性可以用于推断微生物之间的相互关系,正相关代表生态位一致或共生关系,微生物共建生物膜或者交换代谢产物,负相关代表着竞争或捕食[26]。本研究构建的四个生态网络中,网络节点连接之间均以正相关为主,表明AOA和AOB的微生物之间合作关系大于竞争关系,并且AOA和AOB的生态网络均表现出集约经营的正相关关联大于粗放经营,表明集约经营毛竹林中AOA和AOB存在更多的共生关系,而粗放经营毛竹林中氨氧化微生物之间的竞争更为激烈,可能是由于土壤养分供应少于集约经营。集约经营中氨氧化微生物之间的互作和共生关系较粗放经营更加紧密,而粗放经营毛竹林中氨氧化微生物之间的竞争比集约经营激烈,造成这一结果的原因可能是因为毛竹林集约经营过程中施肥增加了土壤中的氮素含量,一定程度上缓解了氨氧化微生物之间的养分竞争。
4 结论无论毛竹林经营强度如何AM真菌菌丝均显著降低了土壤pH,且在集约经营毛竹林中AM真菌菌丝显著降低了土壤碱解氮含量。不同菌根分室处理并未对硝化势产生显著影响,但经营强度影响显著。集约经营和AM真菌菌丝分别对AOA和AOB基因丰度影响显著,虽然两者对氨氧化微生物群落结构没有显著影响,但分子生态网络分析显示集约经营缓解了氨氧化微生物之间的养分竞争。
| [1] |
Yang M, Li Y F, Li Y C, et al. Effects of intensive management on soil C and N pools and soil enzyme activities in Moso bamboo plantations (In Chinese)[J]. Chinese Journal of Applied Ecology, 2016, 27(11): 3455-3462. [杨萌, 李永夫, 李永春, 等. 集约经营对毛竹林土壤碳氮库及酶活性的影响[J]. 应用生态学报, 2016, 27(11): 3455-3462.]
(  0) 0) |
| [2] |
田甜.毛竹林土壤氨氧化微生物功能基因多样性[D].杭州: 浙江农林大学, 2011. Tian T. Functional gene diversity of ammonia-oxidizing microbes of soil in Phyllostachys pubescens[D]. Hangzhou: Zhejiang A & F University, 2011. (  0) 0) |
| [3] |
Li Y F, Jiang P K, Liu J, et al. Effect of fertilization on water-soluble organic C, N, and emission of greenhouse gases in the soil of Phyllostachys edulis stands (In Chinese)[J]. Scientia Silvae Sinicae, 2010, 46(12): 165-170. DOI:10.11707/j.1001-7488.20101227 [李永夫, 姜培坤, 刘娟, 等. 施肥对毛竹林土壤水溶性有机碳氮与温室气体排放的影响[J]. 林业科学, 2010, 46(12): 165-170.]
(  0) 0) |
| [4] |
Cheng L, Booker F L, Tu C, et al. Arbuscular mycorrhizal fungi increase organic carbon decomposition under elevated CO2[J]. Science, 2012, 337(6098): 1084-1087. DOI:10.1126/science.1224304
(  0) 0) |
| [5] |
Cavagnaro T R, Jackson L E, Scow K M, et al. Effects of arbuscular mycorrhizas on ammonia oxidizing bacteria in an organic farm soil[J]. Microbial Ecology, 2007, 54(4): 618-626. DOI:10.1007/s00248-007-9212-7
(  0) 0) |
| [6] |
Bukovská P, Bonkowski M, Konvalinková T, et al. Utilization of organic nitrogen by arbuscular mycorrhizal fungi-is there a specific role for protists and ammonia oxidizers?[J]. Mycorrhiza, 2018, 28(3): 269-283. DOI:10.1007/s00572-018-0825-0
(  0) 0) |
| [7] |
Teutscherova N, Vazquez E, Arango J, et al. Native arbuscular mycorrhizal fungi increase the abundance of ammonia-oxidizing bacteria, but suppress nitrous oxide emissions shortly after urea application[J]. Geoderma, 2019, 338: 493-501. DOI:10.1016/j.geoderma.2018.09.023
(  0) 0) |
| [8] |
Chen Y L, Chen B D, Liu L, et al. The role of arbuscular mycorrhizal fungi in soil nitrogen cycling (In Chinese)[J]. Acta Ecologica Sinica, 2014, 34(17): 4807-4815. [陈永亮, 陈保冬, 刘蕾, 等. 丛枝菌根真菌在土壤氮素循环中的作用[J]. 生态学报, 2014, 34(17): 4807-4815.]
(  0) 0) |
| [9] |
Lü Y, Zhou L, Long G Q, et al. Effect of different nitrogen rates on the nitrification potential and abundance of ammonia-oxidizer in intercropping maize soils (In Chinese)[J]. Environmental Science, 2016, 37(8): 3229-3236. [吕玉, 周龙, 龙光强, 等. 不同氮水平下间作对玉米土壤硝化势和氨氧化微生物数量的影响[J]. 环境科学, 2016, 37(8): 3229-3236.]
(  0) 0) |
| [10] |
Liu R J. Mycorrhizology (In Chinese). Beijing: Science Press, 2007. [刘润进. 菌根学[M]. 北京: 科学出版社, 2007.]
(  0) 0) |
| [11] |
Zhang W W, Wang C, Liu M L, et al. Integrated reclamation of saline soil nitrogen transformation in the hyphosphere by earthworms and arbuscular mycorrhizal fungus[J]. Applied Soil Ecology, 2019, 135: 137-146. DOI:10.1016/j.apsoil.2018.12.005
(  0) 0) |
| [12] |
Veresoglou S D, Verbruggen E, Makarova O, et al. Arbuscular mycorrhizal fungi alter the community structure of ammonia oxidizers at high fertility via competition for soil NH4+[J]. Microbial Ecology, 2019, 78(1): 147-158. DOI:10.1007/s00248-018-1281-2
(  0) 0) |
| [13] |
Veresoglou S D, Sen R, Mamolos A P, et al. Plant species identity and arbuscular mycorrhizal status modulate potential nitrification rates in nitrogen-limited grassland soil[J]. Journal of Ecology, 2011, 99(6): 1339-1349. DOI:10.1111/j.1365-2745.2011.01863.x
(  0) 0) |
| [14] |
Chen Y L, Chen B D, Hu Y J, et al. Direct and indirect influence of arbuscular mycorrhizal fungi on abundance and community structure of ammonia oxidizing bacteria and archaea in soil microcosms[J]. Pedobiologia, 2013, 56(4/5/6): 205-212.
(  0) 0) |
| [15] |
Lu R K. Analytical methods for soil and agro- chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [16] |
Chu H Y, Fujii T, Morimoto S, et al. Community structure of ammonia-oxidizing bacteria under long-term application of mineral fertilizer and organic manure in a sandy loam soil[J]. Applied and Environmental Microbiology, 2007, 73(2): 485-491. DOI:10.1128/AEM.01536-06
(  0) 0) |
| [17] |
沈秋兰.毛竹林土壤氨氧化和固氮微生物特征及其演变规律[D].杭州: 浙江农林大学, 2015. Shen Q L. Characteristics and evolution of ammonia- oxidizing and nitrogen-fixing bacteria in moso bamboo(Phyllostachys pubescens)forest soils[D]. Hangzhou: Zhejiang A & F University, 2015. (  0) 0) |
| [18] |
Rotthauwe J H, Witzel K P, Liesack W. The ammonia monooxygenase structural gene amoA as a functional marker:Molecular fine-scale analysis of natural ammonia- oxidizing populations[J]. Applied and Environmental Microbiology, 1997, 63(12): 4704-4712. DOI:10.1128/AEM.63.12.4704-4712.1997
(  0) 0) |
| [19] |
Hua J F, Lin X G, Jiang Q. Effects of arbuscular mycorrhizal inoculation on arsenic uptake and rhizosphere pH of Nicotiana tabacum L. (In Chinese)[J]. Ecology and Environmental Sciences, 2009, 18(5): 1746-1752. DOI:10.3969/j.issn.1674-5906.2009.05.027 [华建峰, 林先贵, 蒋倩. AM真菌对烟草砷吸收及根际pH的影响[J]. 生态环境学报, 2009, 18(5): 1746-1752.]
(  0) 0) |
| [20] |
He X L, Guo H J, Wang Y Y. Effects of soil moisture and AM fungi on the soil physicochemical property in the rhizosphere of Astragalus adsurgens (In Chinese)[J]. Journal of Hebei University:Natural Science Edition, 2013, 33(5): 508-513, 519. DOI:10.3969/j.issn.1000-1565.2013.05.012 [贺学礼, 郭辉娟, 王银银. 土壤水分和AM真菌对沙打旺根际土壤理化性质的影响[J]. 河北大学学报:自然科学版, 2013, 33(5): 508-513, 519.]
(  0) 0) |
| [21] |
杨轩.宁南山区典型植物根系生产力及根系分解对土壤有机碳和养分的影响[D].陕西杨凌: 西北农林科技大学, 2019. Yang X. Effects of typical plant root productivity and its decomposition on soil organic carbon and nutrients in southern ningxia[D]. Yangling, Shaanxi: Northwest A & F University, 2019. (  0) 0) |
| [22] |
Nicol G W, Leininger S, Schleper C, et al. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J]. Environmental Microbiology, 2008, 10(11): 2966-2978. DOI:10.1111/j.1462-2920.2008.01701.x
(  0) 0) |
| [23] |
Stopnišek N, Gubry-Rangin C, Höfferle S, et al. Thaumarchaeal ammonia oxidation in an acidic forest peat soil is not influenced by ammonium amendment[J]. Applied and Environmental Microbiology, 2010, 76(22): 7626-7634. DOI:10.1128/AEM.00595-10
(  0) 0) |
| [24] |
Zhang L M, Hu H W, Shen J P, et al. ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J]. The ISME Journal, 2012, 6(5): 1032-1045. DOI:10.1038/ismej.2011.168
(  0) 0) |
| [25] |
Traoré O, Groleau-Renaud V, Plantureux S, et al. Effect of root mucilage and modelled root exudates on soil structure[J]. European Journal of Soil Science, 2000, 51(4): 575-581.
(  0) 0) |
| [26] |
Shi W L, Jiang R D, Ma T H, et al. Molecular ecological network analysis of sedimental microbial community and its response to environmental factors in different trophic status areas of Taihu Lake (In Chinese)[J]. Journal of Nanjing University:Natural Science, 2018, 54(5): 1045-1056. [石文莉, 蒋如东, 马天海, 等. 太湖不同营养水平湖区沉积环境微生物分子生态网络特征及其环境响应分析[J]. 南京大学学报:自然科学, 2018, 54(5): 1045-1056.]
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


