气候变暖是全球变化的重要方面,也是目前全世界要面临的巨大挑战。根据气候模型预测[1],中国西北沙漠气温将会持续上升,预计至2050年可能升高1.5℃。腾格里沙漠地区长期观测发现该区域呈现出气温升高而降水减少的趋势[2]。在此背景下,增温对各个生态系统的物质循环和能量转化过程产生至关重要的影响。因此,阐明荒漠生态系统物质循环过程对气候变化的响应机制就显得十分重要。
氮素是土壤的重要养分限制因子之一[3]。土壤氮库是植物吸收氮素的重要来源,土壤有机氮作为土壤氮库的核心成分,占土壤全氮的95%左右,但却不能被植物直接吸收利用,需要通过矿化作用才能转化成为植物有效利用的氮素。土壤氮矿化作用是指土壤中有机态氮在微生物的作用下转化为铵态氮和硝态氮形式的无机氮的过程。氮矿化过程是氮循环的关键过程,在一定程度上决定了土壤供氮能力水平的高低,是当前国内外研究的热点[4]。研究土壤氮素矿化特征有利于全面认识和深入了解生态系统生产力和氮循环过程。
众多研究表明,温度是限制土壤氮矿化作用最重要的环境因子之一[5]。目前,国内外学者关于室内增温对土壤氮矿化作用的影响已开展大量研究[6];然而,相较室内增温研究,野外增温研究能够有效模拟气候变暖,对正确认识生态系统对全球气候变化的响应和适应机制具有重要意义。关于野外增温对土壤氮矿化作用的研究主要集中在森林[7]、草地[8]和湿地[9]等生态系统,由于研究区域生态系统的差异,增温对氮矿化作用的影响表现为促进[10]、抑制[11]和无影响[12]。有关荒漠生态系统,尤其是该生态系统的重要组成部分——生物土壤结皮[13]覆盖土壤氮循环特征对增温的响应也有一些研究[14],但从不同水平(功能基因→微生物生物量→酶活性)阐明土壤氮矿化对增温的响应机制方面的研究涉及较少。
生物土壤结皮广泛分布于荒漠生态系统中,其繁衍和拓殖对土壤氮循环过程起着重要的调节作用[15]。因此,本研究以该区域藓类结皮为研究对象,采用开顶式生长室(Open-top chamber,OTC)模拟增温,通过野外培养原状土柱的方法,探究增温对藓类结皮土壤氮转化特征、微生物生物量、酶活性和功能基因的影响,揭示藓类结皮土壤氮转化特征对增温的响应机制,为进一步认知未来气候变暖背景下藓类结皮在土壤氮循环中的生态功能提供理论依据。
1 材料与方法 1.1 研究区概况研究区位于宁夏中卫市(37º25′N,104º36′E)以西50 km处的一碗泉天然植被区。该区位于腾格里沙漠东南缘,海拔1 339 m,属于典型的草原化荒漠向荒漠化草原的过渡带。年均气温10.6℃,极端最低气温为–25.1℃,极端最高气温为38.1℃,最明显的特征是冬夏季具有较大的昼夜温差;年降水量和年均潜在蒸发量分别为186 mm和2 900 mm;平均风速2.6 m·s–1,年降尘天数59 d。
该区灌木、半灌木群落主要以柠条(Caragana korshinskii)和油蒿(Artemisia ordosica)为主,优势草本植物有茵陈蒿(Artemisia capillaries)、小画眉草(Eragrostis poaeoides)和刺沙蓬(Salsola ruthenica)。稀疏的植被间大量分布着发育良好的藓类结皮,形成独特的地表微景观。具体土壤理化性质见表 1。
|
|
表 1 研究区0~5 cm土壤基本理化性质 Table 1 Physical and chemical properties of the top soil(0~5cm)in the study area |
以藓类结皮和无结皮为主的两个微生境进行采样,两个微生境相距5~10 m。采样时,首先去除地上部分凋落物层,用硬质聚氯乙烯(PVC)管(直径和高度均为10 cm)在每个微生境中随机采集30个样品,样品间间隔1~3 m,为保证气体交换,土壤样品底部用细网状尼龙密封。共采集了60个土壤样品(每个微生境30个样品,2个微生境)。
1.3 模拟增温试验增温装置OTC采用1m×1m×1m的透光性极好的玻璃板制成,使用数据记录器(Mlog5W-rt,德国)记录了OTC中的空气温湿度,研究期间平均气温增加0.7℃,平均降水减少10 mm。然后将每个微生境采集的样品随机选取5个分别放进3个OTC中(3个重复)进行增温处理。同时用数据采集器(EM50,UGT,美国)监测土壤表层(0~5 cm)温湿度。经过3年(2016年1月至2018年12月)增温处理后,去除表层结皮后,采集表层土壤,为了降低空间异质性,将5个样品混合成为一个样品,每种处理设三个重复,然后保存于干冰中,立即带回实验室。所有样品立即过1 mm筛,一部分土样用于各理化指标、无机氮含量、微生物生物量和酶活性测定,另一部分土样保存于-80ºC冰箱中,用于宏基因组测序。
1.4 测定方法土壤理化指标测定:土壤pH采用玻璃电极法测定(水︰土=5︰1);粒径采用激光粒度仪法测定;土壤全碳含量采用元素分析仪(Vario EL Ⅲ型,Elementar,德国)测定;土壤全氮含量采用凯氏定氮法测定,样品分析在取样后24h内完成。
无机氮含量、微生物生物量和酶活性测定:运用2 mol·L–1 KCl溶液浸提土壤,采用全自动间断化学分析仪(SmartChem140,AMS/Westco,意大利),利用靛酚蓝比色法和硫酸肼法分别测定铵态氮和硝态氮的含量,计算土壤净氨化速率、净硝化速率和净氮矿化速率。采用氯仿熏蒸法测定土壤微生物生物量碳和氮;N-乙酰-β-D-葡萄糖苷酶和亮氨酸氨基肽酶的活性用黑色聚苯乙烯96孔板进行荧光检测;测定脲酶活性的方法是使用10%尿素溶液作为基质,在37℃恒温箱中培养24 h,然后用分光光度计(721型,上海欣茂)测定578 nm波长处的
宏基因组测序法:1)DNA提取及测序:利用Fast DNA Spin Kit(MP Biomedicals,Santa Ana,CA,美国)试剂盒进行样品DNA的提取,提取后利用1%琼脂糖凝胶电泳检测DNA完整性;后通过Covaris M220(基因公司,中国)将DNA片段化,筛选约300 bp的片段;接着使用NEXTFLEX Rapid DNA-Seq(Bioo Scientific,美国)构建PE文库;然而进行桥式PCR扩增,扩增后使用Illumina Hiseq(Illumina,美国)测序平台进行宏基因组测序。2)数据质控和基因丰度的预测:利用软件Fastp对原始数据进行质控,质控后使用基于succinct de Bruijn graphs原理的拼接软件MEGAHIT对优化序列进行拼接组装,拼接组装后筛选大于等于300 bp的重叠群(contigs);接着使用MetaGene软件对重叠群(contig)进行开放阅读框(ORF)预测;然后使用CD-HIT软件对所有样品预测出来的基因序列进行聚类,构建非冗余基因集;最后使用SOAPaligner软件将每个样品中的高质量序列(reads)与非冗余基因集进行比对(95% identity),统计基因在对应样品中的丰度信息。
1.5 数据处理土壤净氨化速率=(培养后的铵态氮浓度–培养前的铵态氮浓度)/培养时间
土壤净硝化速率=(培养后的硝态氮浓度–培养前的硝态氮浓度)/培养时间
土壤净氮矿化速率=(培养后的无机氮浓度–培养前的无机氮浓度)/培养时间
其中,公式中培养时间均为3年。
采用SPSS20.0软件对数据进行单因素方差分析、双因素方差分析和配对样本T检验:单因素方差分析(One-way ANOVA)用来比较不同处理之间各个参数的差异显著性;双因素方差分析(Two-way ANOVA)用来分析增温与藓类结皮及其交互作用对土壤净氮转化速率和酶活性等指标的影响;配对样本T检验用来分析土壤净氮转化速率、酶活性等参数在对照与增温处理之间的差异显著性;利用多重比较(Tukey HSD)法进行差异显著性检验(ɑ=0.05);对基因丰度与净氮转化速率的关系做了相关性分析。运用Origin 8.5软件作图,图表中数据为平均值±标准差。
2 结果 2.1 增温处理土壤温度和湿度的动态变化如图 1所示,增温处理后藓类结皮土壤和无结皮土壤温度均呈现出增加的趋势,分别较对照增加了3.57℃和3.62℃;而土壤湿度则明显减少,分别较对照减少了1.26%和2.43%。
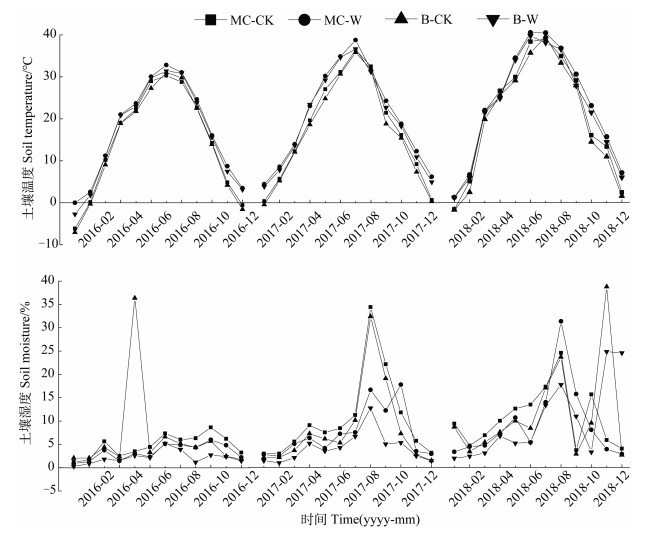
|
注:MC-CK:藓类结皮土壤对照,MC-W:藓类结皮土壤增温,B-CK:无结皮土壤对照,B-W:无结皮土壤增温。下同。 Note: MC-CK: Moss-crust covered soil as control, MC-W: Moss-crust covered soil under warming, B-CK: Bare soil as control, B-W: Bare soil under warming. The same below. 图 1 土壤温度和湿度月均动态(2016—2018年) Fig. 1 Monthly dynamics of soil temperature and humidity(2016—2018) |
增温和土壤类型均对净氨化速率、净硝化速率和净氮矿化速率具有显著影响并且两者之间存在明显的交互作用(表 2)。增温显著降低了藓类结皮土壤净氮转化速率:净氨化速率、净硝化速率和净氮矿化速率分别较对照处理降低了49.5%、63.2%和59.7%;而无结皮土壤净氮转化速率在增温与对照处理之间差异不显著。相同处理下,藓类结皮土壤净氮转化速率明显高于无结皮土壤(图 2)。
|
|
表 2 增温(W)和土壤类型(S)对土壤净氮转化速率、酶活性、微生物生物量和氮转化相关基因丰度影响的双因素分析 Table 2 Two-way analysis of the effects of warming(W)and soil type(S)on soil net nitrogen transformation rate, enzyme activity, microbial biomass and nitrogen transformation related gene abundances |

|
注:不同大写字母代表相同温度处理不同结皮之间差异显著(P < 0.05);不同小写字母代表相同结皮不同温度处理之间差异显著(P < 0.05)。下同。 Note: Different capital letters represent significant differences between the soils different in crust, but the same in temperature treatment(P < 0.05);Different lowercase letters represent significant differences between the soils different in temperature treatments, but the same in crust(P < 0.05). The same below. 图 2 增温对土壤净氮转化速率和酶活性的影响 Fig. 2 Effects of warming on soil net nitrogen transformation rate and enzyme activity |
增温和土壤类型均对N-乙酰-β-D-葡萄糖苷酶活性和脲酶活性具有显著影响并存在明显交互作用(表 2)。由图 2可以看出,经增温处理后,藓类结皮土壤相关酶活性(N-乙酰-β-D-葡萄糖苷酶活性、亮氨酸氨基肽酶活性和脲酶活性)均显著下降,分别较对照减少36.4%、21%和19.8%;而对于无结皮土壤,除土壤脲酶活性较对照显著减少20.6%外,其余酶的活性在增温前后差异不显著。此外,藓类结皮土壤酶的活性均显著高于无结皮土壤。
2.4 增温对土壤微生物生物量碳氮的影响增温和土壤类型均对微生物生物量碳氮具有显著影响,增温与土壤类型对微生物生物量碳的影响存在明显交互作用,而对微生物生物量氮的影响无明显交互作用(表 2)。由表 3可知,增温处理后,藓类结皮土壤微生物生物量碳氮含量显著降低,分别较增温前降低了28.4%和37.3%;无结皮土壤微生物生物量氮含量在增温后处理下显著降低了58.7%,而无结皮土壤微生物生物量碳含量在增温后与增温前处理之间差异不显著。此外,藓类结皮土壤微生物生物量碳氮含量明显高于无结皮土壤。
|
|
表 3 增温处理下的土壤微生物生物量碳氮 Table 3 Effects of warming on soil microbial biomass carbon and nitrogen |
增温和土壤类型均对基因gdh、hao和amoA具有显著影响且存在明显的交互作用(表 2)。藓类结皮土壤基因ureC、hao和amoA丰度在增温处理后显著降低,分别为增温前的70%、68%和49%,而基因gdh丰度则无明显变化;无结皮土壤基因ureC、gdh和hao丰度在增温处理后显著降低,分别为增温前的61%、71%和49%,而基因amoA丰度则无明显变化。相同处理下,藓类结皮土壤中ureC、gdh、hao和amoA基因丰度明显高于无结皮土壤(图 3)。基因ureC丰度和gdh丰度与净氨化速率呈显著正相关,基因hao丰度和amoA丰度与净硝化速率呈显著正相关(表 4)。
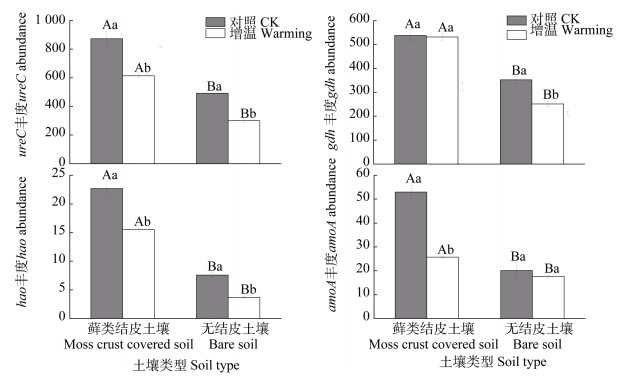
|
图 3 增温处理下的土壤氮转化相关功能基因变化 Fig. 3 Effect of warming on soil nitrogen transformation related functional gene |
|
|
表 4 功能基因与净氮转化速率的相关性 Table 4 Correlations between functional genes and net nitrogen transformation rate |
温度是影响土壤氮转化过程的关键因子之一。本研究结果表明,增温抑制了藓类结皮土壤氮转化过程。这与武丹丹等[11]在青藏高原高寒草甸土壤的研究结果一致。然而,对增温后草地[16]和森林生态系统[10]土壤氮转化过程的研究则发现,温度升高对土壤氮转化过程具有明显促进作用。造成研究结果不一致的原因可能是以下三点:1)生态系统的差异;2)增温会导致土壤湿度显著降低(图 1),土壤水分的丧失限制了土壤微生物活性,进而抑制土壤氮转化过程;3)增温会引起结皮特别是藓类结皮生物量及盖度的减少[17],结皮的退化破坏了其维持土壤微环境的能力,温度和水分的变化改变了微生物的活性,从而影响土壤氮素转化过程。此外,相比较无结皮土壤而言,藓类结皮土壤具有较高的净氮转化速率,这与结皮下较高的养分含量密切相关(表 1),这些有机物质为酶促反应提供丰富基底物质的同时也为微生物生长提供了养分[18]。可以看出,生物结皮参与并且调节了增温对氮转化速率的影响。
3.2 增温对土壤微生物生物量、酶活性和功能基因的影响土壤微生物生物量是土壤有机质组分中最具活力的部分,在土壤氮转化过程中发挥着主要作用[19]。温度是影响土壤微生物生物量的主要环境因子[20]。本研究中,增温显著减少藓类结皮土壤微生物生物量碳氮。Fu等[21]在青藏高原高寒草甸开展的研究得到的结论也支持该结果。然而,Zhang等[22]在青藏高原高寒草甸生态系统利用红外线加热器进行增温(0.8~1.1℃)试验,发现土壤温度升高可增加土壤微生物生物量碳氮;Schmidt等[23]在湿地苔原土壤使用塑料大棚进行增温处理(1~2℃),结果表明土壤微生物生物量碳对增温无响应。研究结果具有差异的原因可能是由于增温方式的不同所造成的,本研究所采用的OTC不仅能够增温而且具有减雨的效果,进而改变了土壤湿度(图 1)。此外,由于藓类结皮土壤具有较高的土壤湿度(图 1)和养分含量(表 1),这些土壤特性有助于土壤微生物的活动和繁殖[24-25],因此,微生物生物量碳氮相比无结皮土壤会出现明显增加,之前的研究也证实了这一结果[26]。因此,增温下藓类结皮对土壤湿度和养分含量的调节会显著影响微生物生物量碳氮,进而对土壤氮转化过程产生影响。
在酶活性水平上,土壤酶推动着地下生态系统氮循环,并且酶活性是衡量微生物群落功能的一个重要指示参量,也是研究对环境变化响应的有用指标[27-29]。N-乙酰-β-D-葡萄糖苷酶、亮氨酸氨基肽酶和脲酶是参与氮转化过程的主要酶类,其中N-乙酰-β-D-葡萄糖苷酶和亮氨酸氨基肽酶参与了几丁质和蛋白质中氮的矿化作用,脲酶能将尿素水解成氨[30-31]。本研究中,藓类结皮土壤酶活性在增温条件下显著下降,可能是由于增温会导致土壤变干,使土壤湿度明显降低(图 1),限制了土壤微生物活性,进而抑制酶活性。陈晓丽等[32]在贡嘎山暗针叶林土壤进行研究时也得到相同的结果。然而,Zhou等[30]和王学娟等[33]在半干旱温带草原和长白山苔原生态系统的研究也表明温度升高增加了N-乙酰-β-D-葡萄糖苷酶活性和亮氨酸氨基肽酶活性以及脲酶活性。可以看出,土壤酶对土壤温湿度变化的敏感性不同。此外,随着温度的升高,土壤微生物会减少酶的合成和分泌[34]。与无结皮土壤相比,藓类结皮土壤呈现较高的酶活性,这与藓类结皮较高的养分含量有关(表 1),藓类结皮可为土壤微生物提供更高的有机质含量,从而为微生物创造更有利的环境[35],本结论得到Liu等[36]研究结果的支持。因此,土壤酶活性的显著变化主要是由于气候变暖下藓类结皮调节的土壤养分含量的影响,进而调节氮转化过程。
对于功能基因水平而言,氮转化功能基因丰度在增温条件下显著改变,进而会影响氮转化过程[37]。本研究结果显示,功能基因丰度与氮转化过程密切相关(表 4),增温显著降低藓类结皮土壤氨化基因(ureC)和硝化基因(hao和amoA)丰度,进一步抑制氨化作用和硝化作用。编码藓类结皮土壤脲酶、羟胺氧化酶和氨单加氧酶基因的丰度在增温后显著降低。ureC基因将尿素转化为氨,amoA基因催化氨氧化,得到羟胺,hao基因进一步氧化得到亚硝酸。导致基因丰度下降的原因可能归因于几种主要细菌类群的丰度降低。Yang等[38]在高寒草原的研究也发现功能基因丰度与氮转化过程密切相关,然而增温后氨化基因ureC和硝化基因amoA丰度增加,促进了氨化作用和硝化作用。造成研究结果差异的主要原因是本研究运用的OTC模拟增温装置,其装置本身具有增温减雨的作用,因而造成土壤湿度存在差异。此外,研究还发现增温会引起藓类结皮的退化[17],进而改变土壤微环境,最终加速了这种抑制作用。
4 结论在增温条件下,土壤变干的间接影响和藓类结皮的退化丧失了对土壤微环境的调节作用,土壤微生物生物量碳氮和氮转化功能基因丰度(ureC、hao和amoA)显著降低,土壤酶活性受到明显抑制,进而影响土壤氮转化过程。
| [1] |
秦大河. 中国西部环境演变评估综合报告[R]. http://www.irgrid.ac.cn/handle/1471x/642233. [2002-12-25] [2019-06-01]. Qing D H. An integrated report on the evaluation of environmental changes of western China[R]. http://www.irgrid.ac.cn/handle/1471x/642233. [2002-12-25 [2019-06-01]. (  0) 0) |
| [2] |
Li X R, Hui R, Zhao Y. Eco-physiology of biological soil crusts in desert regions of China (In Chinese). Beijing: Higher Education Press, 2016. [李新荣, 回嵘, 赵洋. 中国荒漠生物土壤结皮生态生理学研究[M]. 北京: 高等教育出版社, 2016.]
(  0) 0) |
| [3] |
Butler S M, Melillo J M, Johnson J E, et al. Soil warming alters nitrogen cycling in a New England forest: Implications for ecosystem function and structure[J]. Oecologia, 2012, 168(3): 819-828. DOI:10.1007/s00442-011-2133-7
(  0) 0) |
| [4] |
Zhao C S, Hu C X, Huang W. Study on nitrogen mineralization of two typical vegetable soils in central China (In Chinese)[J]. Soils, 2013, 45(1): 41-45. DOI:10.3969/j.issn.0253-9829.2013.01.006 [赵长盛, 胡承孝, 黄魏. 华中地区两种典型菜地土壤中氮素的矿化特征研究[J]. 土壤, 2013, 45(1): 41-45.]
(  0) 0) |
| [5] |
Ma L, Yang L Z, Yan T M, et al. Profile distribution and mineralization characteristics of nitrogen in relation to temperature in paddy soil under long-term fertilization (In Chinese)[J]. Acta Pedologica Sinica, 2010, 47(2): 286-294. [马力, 杨林章, 颜廷梅, 等. 长期施肥水稻土氮素剖面分布及温度对土壤氮素矿化特性的影响[J]. 土壤学报, 2010, 47(2): 286-294.]
(  0) 0) |
| [6] |
Guntinas M, Leiros M C, Trasar-Cepeda C, et al. Effects of moisture and temperature on net soil nitrogen mineralization: A laboratory study[J]. European Journal of Soil Biology, 2012, 48: 73-80. DOI:10.1016/j.ejsobi.2011.07.015
(  0) 0) |
| [7] |
Garten C T Jr. Nitrogen saturation and soil N availability in a high-elevation spruce and fir forest[J]. Water, Air, and Soil Pollution, 2000, 120(3/4): 295-313. DOI:10.1023/A:1005270012802
(  0) 0) |
| [8] |
Dawes M A, Schleppi P, Hättenschwiler S, et al. Soil warming opens the nitrogen cycle at the alpine treeline[J]. Global Change Biology, 2017, 23(1): 421-434. DOI:10.1111/gcb.13365
(  0) 0) |
| [9] |
Weedon J T, Kowalchuk G A, Aerts R, et al. Summer warming accelerates sub-arctic peatland nitrogen cycling without changing enzyme pools or microbial community structure[J]. Global Change Biology, 2012, 18(1): 138-150. DOI:10.1111/j.1365-2486.2011.02548.x
(  0) 0) |
| [10] |
Butler S M, Melillo J M, Johnson J E, et al. Soil warming alters nitrogen cycling in a New England forest: Implications for ecosystem function and structure[J]. Oecologia, 2012, 168(3): 819-828. DOI:10.1007/s00442-011-2133-7
(  0) 0) |
| [11] |
Wu D D, Jing X, Lin L, et al. Responses of soil inorganic nitrogen to warming and altered precipitation in an alpine meadow on the Qinghai-Tibetan Plateau (In Chinese)[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2016, 52(5): 959-966. DOI:10.13209/j.0479-8023.2016.061 [武丹丹, 井新, 林笠, 等. 青藏高原高寒草甸土壤无机氮对增温和降水改变的响应[J]. 北京大学学报: 自然科学版, 2016, 52(5): 959-966.]
(  0) 0) |
| [12] |
Novem Auyeung D S, Suseela V, Dukes J S. Warming and drought reduce temperature sensitivity of nitrogen transformations[J]. Global Change Biology, 2013, 19(2): 662-676. DOI:10.1111/gcb.12063
(  0) 0) |
| [13] |
Whitton B A. Biological soil crust: Structure, function, and management[J]. Biological Conservation, 2002, 108(1): 129-130.
(  0) 0) |
| [14] |
Zhou X B, Smith H, Giraldo Silva A, et al. Differential responses of dinitrogen fixation, diazotrophic cyanobacteria and ammonia oxidation reveal a potential warming-induced imbalance of the N-cycle in biological soil crusts[J]. PLoS One, 2016, 11(10): e0164932. DOI:10.1371/journal.pone.0164932
(  0) 0) |
| [15] |
Heindel R C, Governali F C, Spickard A M, et al. The role of biological soil crusts in nitrogen cycling and soil stabilization in kangerlussuaq, west Greenland[J]. Ecosystems, 2019, 22(2): 243-256. DOI:10.1007/s10021-018-0267-8
(  0) 0) |
| [16] |
Ma L N, Lü X T, Liu Y, et al. The effects of warming and nitrogen addition on soil nitrogen cycling in a temperate grassland, northeastern China[J]. PLoS One, 2011, 6(11): e27645. DOI:10.1371/journal.pone.0027645
(  0) 0) |
| [17] |
Li X R, Jia R L, Zhang Z S, et al. Hydrological response of biological soil crusts to global warming: A ten-year simulative study[J]. Global Change Biology, 2018, 24(10): 4960-4971. DOI:10.1111/gcb.14378
(  0) 0) |
| [18] |
Delgado-Baquerizo M, Maestre F T, Gallardo A. Biological soil crusts increase the resistance of soil nitrogen dynamics to changes in temperatures in a semi-arid ecosystem[J]. Plant and Soil, 2013, 366(1/2): 35-47. DOI:10.1007/s11104-012-1404-3
(  0) 0) |
| [19] |
Khan K S, Mack R, Castillo X, et al. Microbial biomass, fungal and bacterial residues, and their relationships to the soil organic matter C/N/P/S ratios[J]. Geoderma, 2016, 271: 115-123. DOI:10.1016/j.geoderma.2016.02.019
(  0) 0) |
| [20] |
Wang X X, Dong S K, Gao Q Z, et al. Effects of short-term and long-term warming on soil nutrients, microbial biomass and enzyme activities in an alpine meadow on the Qinghai-Tibet Plateau of China[J]. Soil Biology and Biochemistry, 2014, 76: 140-142. DOI:10.1016/j.soilbio.2014.05.014
(  0) 0) |
| [21] |
Fu G, Shen Z X, Zhang X Z, et al. Response of soil microbial biomass to short-term experimental warming in alpine meadow on the Tibetan Plateau[J]. Applied Soil Ecology, 2012, 61: 158-160. DOI:10.1016/j.apsoil.2012.05.002
(  0) 0) |
| [22] |
Zhang W, Parker K M, Luo Y, et al. Soil microbial responses to experimental warming and clipping in a tallgrass prairie[J]. Global Change Biology, 2005, 11(2): 266-277. DOI:10.1111/j.1365-2486.2005.00902.x
(  0) 0) |
| [23] |
Schmidt I K, Jonasson S, Shaver G R, et al. Mineralization and distribution of nutrients in plants and microbes in four arctic ecosystems: Responses to warming[J]. Plant and Soil, 2002, 242(1): 93-106. DOI:10.1023/A:1019642007929
(  0) 0) |
| [24] |
Li X Q, Jia R L, Chen Y C, et al. Association of ant nests with successional stages of biological soil crusts in the Tengger Desert, Northern China[J]. Applied Soil Ecology, 2011, 47(1): 59-66. DOI:10.1016/j.apsoil.2010.10.010
(  0) 0) |
| [25] |
Li X, Sarah P. Arylsulfatase activity of soil microbial biomass along a Mediterranean-arid transect[J]. Soil Biology & Biochemistry, 2003, 35(7): 925-934. DOI:10.1016/S0038-0717(03)00143-3
(  0) 0) |
| [26] |
Liu Y M, Li X R, Xing Z S, et al. Responses of soil microbial biomass and community composition to biological soil crusts in the revegetated areas of the Tengger Desert[J]. Applied Soil Ecology, 2013, 65: 52-59. DOI:10.1016/j.apsoil.2013.01.005
(  0) 0) |
| [27] |
Blagodatskaya Е, Blagodatsky S, Khomyakov N, et al. Temperature sensitivity and enzymatic mechanisms of soil organic matter decomposition along an altitudinal gradient on Mount Kilimanjaro[J]. Scientific Reports, 2016, 6: 22240. DOI:10.1038/srep22240
(  0) 0) |
| [28] |
Sinsabaugh R L, Lauber C L, Weintraub M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264. DOI:10.1111/j.1461-0248.2008.01245.x
(  0) 0) |
| [29] |
Kardol P, Cregger M, Campany C E, et al. Soil ecosystem functioning under climate change: Plant species and community effects[J]. Ecology, 2010, 91(3): 767-781. DOI:10.1890/09-0135.1
(  0) 0) |
| [30] |
Zhou X Q, Chen C R, Wang Y F, et al. Warming and increased precipitation have differential effects on soil extracellular enzyme activities in a temperate grassland[J]. Science of the Total Environment, 2013, 444: 552-558. DOI:10.1016/j.scitotenv.2012.12.023
(  0) 0) |
| [31] |
Bai J H, Xu H F, Xiao R, et al. Path analysis for soil urease activities and nutrient contents in a mountain valley wetland, China[J]. Clean-soil Air Water, 2014, 42(3): 324-330. DOI:10.1002/clen.201200454
(  0) 0) |
| [32] |
Chen X L, Wang G X, Yang Y, et al. Response of soil surface enzyme activities to short-term warming and litter decomposition in a mountain forest (In Chinese)[J]. Acta Ecologica Sinica, 2015, 35(21): 7071-7079. DOI:10.5846/stxb201312182982 [陈晓丽, 王根绪, 杨燕, 等. 山地森林表层土壤酶活性对短期增温及凋落物分解的响应[J]. 生态学报, 2015, 35(21): 7071-7079.]
(  0) 0) |
| [33] |
Wang X J, Zhou Y M, Wang X X, et al. Responses of soil enzymes in activity and soil microbes in biomass to warming in tundra ecosystem on Changbai mountains (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(1): 166-175. [王学娟, 周玉梅, 王秀秀, 等. 长白山苔原生态系统土壤酶活性及微生物生物量对增温的响应[J]. 土壤学报, 2014, 51(1): 166-175.]
(  0) 0) |
| [34] |
McDaniel M D, Kaye J P, Kaye M W. Increased temperature and precipitation had limited effects on soil extracellular enzyme activities in a post-harvest forest[J]. Soil Biology & Biochemistry, 2013, 56: 90-98. DOI:10.1016/j.soilbio.2012.02.026
(  0) 0) |
| [35] |
Li X R, He M, Duan Z, et al. Recovery of topsoil physicochemical properties in revegetated sites in the sand-burial ecosystems of the Tengger Desert, Northern China[J]. Geomorphology, 2007, 88(3): 254-265. DOI:10.1016/j.geomorph.2006.11.009
(  0) 0) |
| [36] |
Liu Y M, Yang H Y, Li X R, et al. Effects of biological soil crusts on soil enzyme activities in revegetated areas of the Tengger Desert, China[J]. Applied Soil Ecology, 2014, 80: 6-14. DOI:10.1016/j.apsoil.2014.03.015
(  0) 0) |
| [37] |
Li L F, Zheng Z Z, Wang W J, et al. Terrestrial N2O emissions and related functional genes under climate change: A global meta-analysis[J]. Global Change Biology, 2020, 26(2): 931-943. DOI:10.1111/gcb.14847
(  0) 0) |
| [38] |
Yang Y F, Gao Y, Wang S P, et al. The microbial gene diversity along an elevation gradient of the Tibetan grassland[J]. The ISME Journal, 2014, 8(2): 430-440. DOI:10.1038/ismej.2013.146
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


