锑(Sb)是一种微量类金属元素,在土壤中的天然浓度很低,约为0.05~4.0 mg·kg–1[1]。但近几十年来,随着锑矿开采和冶炼活动的增加,区域土壤锑浓度大大超过环境背景值,引起严峻的环境风险问题。中国是世界上锑产量最大的国家,锑矿开采和冶炼区污染问题尤为突出,特别是在湖南、贵州、广西等锑矿产出地[2]。因此,锑污染土壤的治理与修复工作有十分重要的意义,而深入理解锑进入土壤后的界面化学行为是治理与修复的理论前提[3]。
土壤是一个异质多相复合体系,其中矿物约占固相组成的95%以上。锑进入土壤后,会在矿物表面发生吸附解吸、氧化还原等反应,影响其生物有效性和归宿[4]。大量研究表明,金属氧化物如铁/锰矿物对锑有较强的吸附能力[5-6],是锑在土壤中的主要吸附载体。锑在铁/锰氧化物表面主要形成稳定的内圈络合物[7],且Sb(Ⅲ)会发生氧化反应[8-9]。目前,有关锑在土壤铝氧化物表面吸附的研究还很缺乏。
土壤矿物常常与有机组分,如腐殖酸、微生物,胶结在一起形成矿质–有机复合体[10-12]。它们之间的交互作用改变了胶体的物理化学性质,如粒径、比表面积、电荷及官能团等,进而影响污染物特别是重金属在胶体界面的吸附解吸、迁移转化等行为[13]。近年来,多有研究报道重金属镉(Cd2+)、铅(Pb2+)、铜(Cu2+)等在矿物–有机物/微生物复合界面的吸附行为[14-17];有机组分不仅促进了重金属在矿物表面的吸附,还显著改变它们在复合胶体界面的分配[18-19]。但目前,尚很少有研究关注有机组分对锑在金属氧化物表面吸附的影响。
本研究拟选取代表性土壤铝氧化物(α-Al2O3)及微生物(耐锑蜡状芽孢杆菌),通过批吸附试验并结合X-射线光电子能谱和电镜能谱,从锑的吸附量、亲和力、分布、结合官能团和价态转变等方面综合探讨Sb(Ⅲ/Ⅴ)在α-Al2O3–蜡状芽孢杆菌二元复合胶体界面的吸附过程和机制,阐明微生物在吸附过程中的作用,以期对理解锑在土壤微界面的化学行为提供一定的理论支撑。
1 材料与方法 1.1 供试材料α-Al2O3购自上海阿拉丁生化科技股份有限公司,粒径小于等于200 nm。
供试菌株为一株革兰氏阳性蜡状芽孢杆菌(Bacillus cereus),其DNA序列数据库(GenBank)录入号为MH345838。该菌株为本课题组前期从锑污染土壤中筛选的一株耐锑细菌[20]。细菌的培养采用溶菌肉汤(Luria-Bertani)培养基(酵母粉5 g·L–1,蛋白胨10 g·L–1,氯化钠10 g·L–1,pH ≈ 7.0),培养至指数生长末期,离心收集,用0.01 mol·L–1 KCl洗涤三次后悬浮。
Sb(Ⅲ)和Sb(Ⅴ)标准溶液分别用三氧化二锑和焦锑酸钾配制。
1.2 α-Al2O3– 细菌二元胶体制备采用吸附方式制备矿物–细菌二元胶体:将α-Al2O3和细菌分别均匀悬浮于0.01 mol·L–1 KCl电解质中,在搅拌条件下,将两悬液均匀混合,并反应2 h,使两者的吸附达到平衡[21]。考察两种不同组分比例,即矿物:细菌质量比分别为30︰70和70︰30。制备的复合胶体置于4℃条件下保存备用。
1.3 批吸附试验取适量吸附剂(蜡状芽孢杆菌、α-Al2O3及其复合体)置于50 mL塑料离心管中,加入一定量的Sb(Ⅲ)/Sb(Ⅴ)溶液,最后用0.01 mol·L–1 KCl定容至30 mL。在试验过程中,控制吸附剂浓度为0.5 g·L–1,Sb浓度为0~100 mg·L–1,调节悬液pH为6.5,并置于恒温摇床(25℃)振荡12 h。随后将悬浮液离心,上清液用0.45 µm滤膜过滤,并用电感耦合等离子体发射光谱仪(ICP-OES,PerkinElmer Optima 8300,美国)测定总锑。离心后的沉淀物用于扫描电镜(SEM)和X-射线光电子能谱(XPS)分析。
1.4 SEM和XPS测定扫描电子显微镜(FE-SEM /EDX,Quanta F250,德国)用于观察α-Al2O3–细菌复合胶体形貌。样品用2.5%戊二醛原位固定并用乙醇脱水。将α-Al2O3–细菌复合体吸附Sb的产物进行SEM能谱面扫描测定,分析碳(C)、氮(N)、氧(O)、铝(Al)和Sb的分布。
用XPS电子光谱仪(Thermo ESCALAB 250XI,美国)记录C1s、O1s和Sb 3d高分辨图谱,用XPSPEAK41软件拟合XPS光谱。
2 结果与讨论 2.1 α-Al2O3– 细菌复合胶体形貌特征图 1呈现了α-Al2O3及α-Al2O3–细菌复合胶体形貌。氧化铝为纳米粒级的细颗粒,但多团聚在一起,形成粒径较大的团聚体。在α-Al2O3–细菌复合胶体中,细菌为杆状,氧化铝颗粒紧密吸附在细菌细胞表面。α-Al2O3的等电点大约在pH 8左右[22],因此在本实验体系中,α-Al2O3和蜡状芽孢杆菌之间会有较强的静电引力,促使它们紧密胶结在一起。但本研究发现α-Al2O3并未在细菌表面形成一层紧致的“矿物膜”,这与前人所研究的铁氧化物–细菌复合胶体[23]有显著区别,因此细菌表面位点未被α-Al2O3完全掩盖,在随后锑的吸附反应中可能发挥作用。此外还发现,在有细菌存在时,α-Al2O3颗粒很少团聚成大团聚体,而多以小颗粒形式吸附在细菌表面,较小的粒径可能进一步提供更多的吸附点位。

|
注:B. cereus代表蜡状芽孢杆菌。下同。Note:B. cereus stands for Bacillus cereus. The same below. 图 1 α-Al2O3及α-Al2O3–蜡状芽孢杆菌复合胶体扫描电镜图像 Fig. 1 Scanning electron microscopy(SEM)images of α-Al2O3 and α-Al2O3–B. cereus cell composite |
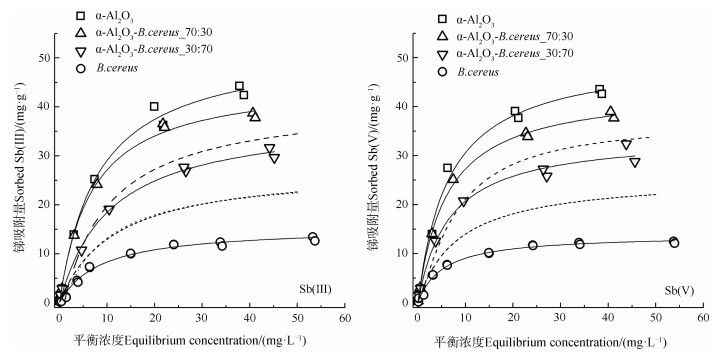
图 2为锑在pH 6.5时的等温吸附结果,吸附数据可较好地用朗格缪尔(Langmuir)方程拟合(拟合度R2 ≥0.98,表 1)。Langmuir方程式为:
|
注:实线为朗格缪尔(Langmuir)模型实际拟合,虚线是根据“组分相加”法则预测的吸附曲线[24]。Note:The solid lines stand for practical fitting with the Langmuir model,while the dotted lines for adsorption isotherms predicted in line with the component additive rule[27]. 图 2 Sb在α-Al2O3、蜡状芽孢杆菌及α-Al2O3–B. cereus复合胶体上的等温吸附 Fig. 2 Adsorption isotherms of Sb to α-Al2O3, B. cereus and α-Al2O3–B. cereus composite |
|
|
表 1 锑等温吸附Langmuir拟合 Table 1 Fitting of Sb adsorption isotherms with the Langmuir model |
| $ Q_{\mathrm{e}}=\left(\mathrm{Q}_{\mathrm{max}} \times \mathrm{K}_{\mathrm{L}} \times C_{\mathrm{e}}\right) /\left(1+\mathrm{K}_{\mathrm{L}} \times C_{\mathrm{e}}\right) $ | (1) |
式中,Qe代表在锑平衡浓度为Ce时的吸附量,mg·g–1;Qmax为最大吸附容量,mg·g–1;KL代表亲和力。
由图 2可知,α-Al2O3对锑的吸附能力要远大于细菌:α-Al2O3对Sb(Ⅲ)和Sb(Ⅴ)的最大吸附量分别为52.72和50.64 mg·g–1;而蜡状芽孢杆菌则为15.46和13.88 mg·g–1(表 1)。这主要由于在pH 6.5时,α-Al2O3携带较多的正电荷而细菌表面携带负电荷,较强的静电吸引力使α-Al2O3吸附更多的Sb含氧阴离子。锑在α-Al2O3–蜡状芽孢杆菌复合体上的吸附量介于单一矿物和细菌之间,且随着复合体中α-Al2O3质量比的增多,Sb的吸附量增加,即α-Al2O3–细菌_70:30大于α-Al2O3–细菌_30:70。
在前人的研究中,“组分相加”原则常用来预测重金属在复合胶体上的吸附量[24-26],即通过计算单一组分上的吸附量,再结合组分比例,计算得到复合体的吸附量。在之前的研究中构建了基于Langmuir模型的“组分相加”方法[27],在此,本研究计算得到α-Al2O3–细菌复合体的理论吸附量(见图 2中虚线)。由图 2可知Sb在α-Al2O3–细菌复合体上的理论吸附曲线要小于实际拟合线;理论最大吸附量(CA-Qmax,表 1)要小于实际吸附量(Qmax,表 1),这一结果表明α-Al2O3和细菌的交互作用促进了Sb的吸附。现有的研究普遍认为,带负电荷的组分会抑制As/Sb等含氧阴离子在金属氧化物表面的吸附[28-29]。本研究中这一不同结果可能主要因为在复合胶体中,α-Al2O3颗粒的团聚度低(图 1),因此有更多的矿物吸附点位暴露,从而促进Sb的吸附;此外,也不能忽视可能存在的“桥键”作用,Sb含氧阴离子可能以“阴离子桥”形式吸附于氧化铝和细菌之间;细菌本身吸附量远少于氧化铝,细菌表面位点掩盖效应对Sb的吸附影响可能极小。
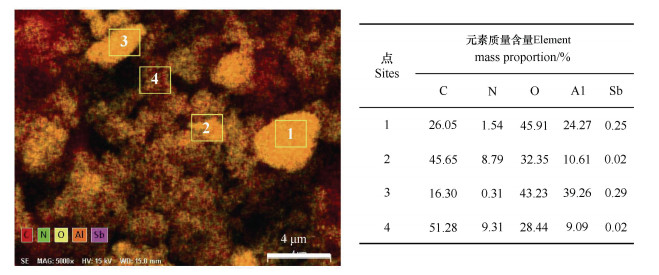
2.3 锑在复合胶体中的微观分布特征为了进一步研究Sb在α-Al2O3–细菌复合胶体上的分布,采集了C、N、O、Al及Sb元素的SEM图谱(图 3),其中C可代表细菌组分,Al代表矿物组分。由于复合胶体的不均质性,在区域中选取若干个点进行测定。在图 3的1点,C、N、O、Al及Sb的含量约为26%、1.5%、46%、24%、0.25%;在2点,对应的含量约为46%、8.8%、32%、10.6%和0.02%。本研究发现,在富含Al元素的点,其吸附Sb的量较Al含量低的点要高很多。用相似的方法对比1、2、3和4处的元素相对含量,推测α-Al2O3在二元复合胶体吸附锑的过程中起主导作用。
|
图 3 α-Al2O3–B. cereus复合胶体吸附锑的电镜-能谱及点1、2、3和4处元素的相对质量含量 Fig. 3 The SEM-energy spectrum image of α-Al2O3–B. cereus composite bonded with Sb, and relative mass content of the element at sites 1, 2, 3 and 4 |
X-射线光电子能谱(XPS)技术广泛应用于元素的定量定性分析,可从分子尺度阐释微观结合机制。本研究中分析了α-Al2O3及蜡状芽孢杆菌吸附Sb前后的C、O和Sb元素高分辨指纹图谱,以期获得参与Sb吸附反应的官能团及配位信息。虽然也采集α-Al2O3–细菌复合胶体的XPS图谱,但由于复合体的异质性,很难保证不同XPS测定点矿物:细菌比例是相同的,因此也不能准确分析其吸附Sb前后的差别,因此本研究仅分析单一组分吸附Sb前后的XPS图谱。
图 4(左)为氧化铝吸附Sb(Ⅲ/Ⅴ)前后的O 1s图谱,其中O主要包括532.1 eV处的表面氧(Al-O-H)以及530.7 eV处的晶体氧(Al-O-Al)。当吸附Sb(Ⅲ)后,Al-OH特征峰的面积由27.16%增加至32.7%;吸附Sb(Ⅴ)后增至33.64%。这一现象表明α-Al2O3表面的铝羟基参与了锑的络合,可能形成Al-O-Sb内圈络合物[5]。前人利用X射线吸收精细结构谱(EXAFS)发现锑在非晶形水铝矿表面主要形成了双齿共角络合物[30],但本研究仅基于XPS的数据很难区分在α-Al2O3表面Sb的精细配位结构。

|
图 4 α-Al2O3和蜡状芽孢杆菌吸附Sb(Ⅲ/Ⅴ)前后的O 1s和C 1s XPS高分辨光谱 Fig. 4 High-resolution O 1s and C 1s XPS spectra of α-Al2O3 and Bacillus cereus before and after adsorbing Sb(Ⅲ/Ⅴ) |
图 4(右)为细菌的C 1s图谱,可分为三个主要组分:约288.0 eV为C=O/O=C=O,主要包括羧基、酯基;286.2 eV处为C-(O,N),为醇、胺、酰胺;285 eV处为C-(C,H),猜测为脂质或者氨基酸的侧链[20]。当细菌吸附Sb(Ⅲ)后,其C=O/O=C=O组分由25%降低至22%,C-(C,H)组分由51%降低至36%;当细菌结合Sb(Ⅴ)后,这两个组分分别降至17%和45%。上述结果表明羧基和氨基参与了细菌表面锑的络合反应[31]。
虽然无法直接分析α-Al2O3–细菌复合胶体XPS图谱,但通过对单一组分的分析可知,Al-OH、COOH和NH2为复合胶体表面锑的主要结合点位,且形成了内圈络合物。
前人研究发现Sb(Ⅲ)可在铁/锰氧化物表面发生氧化反应[7-9,32],但尚未有研究报道Sb能否在α-Al2O3上发生相似的反应。因此本研究对Sb 3d3/2 XPS光谱进行拟合,如图 5所示,Sb(Ⅲ)的峰位于低能量处(~539.4 eV)而Sb(Ⅴ)位于高能量处(~540.2 eV)。当Sb(Ⅲ)吸附在α-Al2O3表面,有50%的Sb(Ⅲ)被氧化成Sb(Ⅴ)。由于Al为非变价元素,因此在氧化过程中,真正参与电子传递的是O2,α-Al2O3可能仅发挥导体或催化作用。

|
图 5 Sb(Ⅲ)在α-Al2O3和α-Al2O3–B. cereus复合体上吸附后的高分辨率Sb 3d3/2 XPS光谱 Fig. 5 High-resolution Sb 3d3/2 XPS spectra of Sb(Ⅲ)adsorbed on α-Al2O3 and α-Al2O3–B. cereus composite |
此外发现,α-Al2O3–细菌复合体吸附Sb(Ⅲ)后主要还是以Sb(Ⅲ)的形式存在,几乎不存在Sb(Ⅴ),这一现象表明细菌抑制了Sb(Ⅲ)在氧化铝表面的氧化反应。起初作者推测蜡状芽孢杆菌本身可以还原Sb(Ⅴ),从而使部分氧化的Sb(Ⅴ)重新转变为Sb(Ⅲ)。因此检测了纯细菌吸附Sb(Ⅲ)的产物,但由于Sb在细菌表面的吸附量极少,达不到XPS的检测限,因此未能直接证明。但通过文献不难发现,大部分研究报道细菌可以氧化Sb(Ⅲ),如假单胞菌属[33]、丛毛单胞菌属[34]以及农杆菌属[35],却很少有研究报道可还原Sb(Ⅴ)的微生物,特别是芽孢杆菌属。因此作者推测,细菌是通过间接作用影响Sb(Ⅲ)的还原,可能的原因推测如下:1)单一氧化铝可作为导体(介质)传递Sb(Ⅲ)与溶解O2之间的电子,而细菌由于表面官能团的质子化,负电荷较多,电子传导可能不通畅,因此,复合体中细菌表面络合的Sb(Ⅲ)很难被氧化;2)氧化铝可能会与细菌表面官能团如羧基、含磷官能团发生内圈络合反应[36],进一步影响参与氧化反应的官能团和电子传递。
3 结论由于携带电荷的不同,氧化铝可紧密吸附在蜡状芽孢杆菌表面,形成较紧致的矿物–细菌复合体。锑在α-Al2O3上的吸附量显著高于细菌;锑在矿物–细菌复合胶体上的吸附不符合“组分相加”原则,存在显著的促进效应。在复合胶体中,氧化铝对锑的吸附起主导作用。铝羟基、羧基和氨基参与了锑在复合胶体上的络合反应。细菌的存在抑制Sb(Ⅲ)在氧化铝表面的氧化反应。因此,在研究锑在土壤中的生物地球化学循环时必须考虑矿物–有机物相互作用。
| [1] |
He M C, Wan H Y. Distribution, speciation, toxicity and bioavailability of antimony in the environment (In Chinese)[J]. Progress in Chemistry, 2004, 16(1): 131-135. DOI:10.3321/j.issn:1005-281X.2004.01.020 [何孟常, 万红艳. 环境中锑的分布、存在形态及毒性和生物有效性[J]. 化学进展, 2004, 16(1): 131-135.]
(  0) 0) |
| [2] |
Yin Z Y, He J Q, Liu D H, et al. Research progress on characteristics of soil antimony pollution in China and the preliminary exploration about application prospect of antimony accumulator plants (In Chinese)[J]. Journal of Agricultural Resources and Environment, 2018, 35(3): 199-207. [殷志遥, 和君强, 刘代欢, 等. 我国土壤锑污染特征研究进展及其富集植物的应用前景初探[J]. 农业资源与环境学报, 2018, 35(3): 199-207.]
(  0) 0) |
| [3] |
Xing J F, Cang L, Ren J H. Remediation stability of in situ chemical immobilization of heavy metals contaminated soil: A review (In Chinese)[J]. Soils, 2019, 51(2): 224-234. [邢金峰, 仓龙, 任静华. 重金属污染农田土壤化学钝化修复的稳定性研究进展[J]. 土壤, 2019, 51(2): 224-234.]
(  0) 0) |
| [4] |
Herath I, Vithanage M, Bundschuh J. Antimony as a global dilemma: Geochemistry, mobility, fate and transport[J]. Environmental Pollution, 2017, 223: 545-559. DOI:10.1016/j.envpol.2017.01.057
(  0) 0) |
| [5] |
Rakshit S, Sarkar D, Punamiya P, et al. Antimony sorption at gibbsite-water interface[J]. Chemosphere, 2011, 84(4): 480-483. DOI:10.1016/j.chemosphere.2011.03.028
(  0) 0) |
| [6] |
Sun Q, Wang Y J, Fan T T, et al. Sorption of Sb(Ⅴ) on soils with different physicochemical properties and its influencing factors (In Chinese)[J]. Journal of Agro-Environment Science, 2016, 35(8): 1507-1514. [孙倩, 王玉军, 范婷婷, 等. Sb(Ⅴ)在不同类型土壤上的吸附及其影响因素研究[J]. 农业环境科学学报, 2016, 35(8): 1507-1514.]
(  0) 0) |
| [7] |
Guo X J, Wu Z J, He M C, et al. Adsorption of antimony onto iron oxyhydroxides: Adsorption behavior and surface structure[J]. Journal of Hazardous Materials, 2014, 276: 339-345. DOI:10.1016/j.jhazmat.2014.05.025
(  0) 0) |
| [8] |
Cai Y B, Mi Y T, Zhang H. Kinetic modeling of antimony(Ⅲ) oxidation and sorption in soils[J]. Journal of Hazardous Materials, 2016, 316: 102-109. DOI:10.1016/j.jhazmat.2016.05.027
(  0) 0) |
| [9] |
He M C, Ji H B, Zhao C Y. The oxidation mechanism of Sb(Ⅲ) on the surface of synthetic birnessite (In Chinese)[J]. Acta Scientiae Circumstantiae, 2003, 23(4): 483-487. DOI:10.3321/j.issn:0253-2468.2003.04.014 [何孟常, 季海冰, 赵承易. 锑(Ⅲ)在合成性δ态-MnO2表面的氧化机理[J]. 环境科学学报, 2003, 23(4): 483-487.]
(  0) 0) |
| [10] |
Kleber M, Eusterhues K, Keiluweit M, et al. Mineral-organic associations: Formation, properties, and relevance in soil environments[J]. Advances in Agronomy, 2015, 130: 1-140.
(  0) 0) |
| [11] |
Wang Q Y, Yang Y Z, Xu M G, et al. Effects of long-term straw returning on stability of mineral-complexed organic matter in Shajiang black soil (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(5): 1108-1117. [王擎运, 杨远照, 徐明岗, 等. 长期秸秆还田对砂姜黑土矿质复合态有机质稳定性的影响[J]. 土壤学报, 2019, 56(5): 1108-1117.]
(  0) 0) |
| [12] |
Wang J K, Xu Y D, Ding F, et al. Process of plant residue transforming into soil organic matter and mechanism of its stabilization: A review (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(3): 528-540. [汪景宽, 徐英德, 丁凡, 等. 植物残体向土壤有机质转化过程及其稳定机制的研究进展[J]. 土壤学报, 2019, 56(3): 528-540.]
(  0) 0) |
| [13] |
Qu C C, Chen W L, Hu X P, et al. Heavy metal behaviour at mineral-organo interfaces: Mechanisms, modelling and influence factors[J]. Environment International, 2019, 131: 104995.
(  0) 0) |
| [14] |
Du H H, Huang Q Y, Yang R J, et al. Cd sequestration by bacteria-aluminum hydroxide composites[J]. Chemosphere, 2018, 198: 75-82. DOI:10.1016/j.chemosphere.2018.01.128
(  0) 0) |
| [15] |
Du H H, Peacock C L, Chen W L, et al. Binding of Cd by ferrihydrite organo-mineral composites: Implications for Cd mobility and fate in natural and contaminated environments[J]. Chemosphere, 2018, 207: 404-412. DOI:10.1016/j.chemosphere.2018.05.092
(  0) 0) |
| [16] |
Moon E M, Peacock C L. Adsorption of Cu(Ⅱ) to ferrihydrite and ferrihydrite-bacteria composites: Importance of the carboxyl group for Cu mobility in natural environments[J]. Geochimica et Cosmochimica Acta, 2012, 92: 203-219. DOI:10.1016/j.gca.2012.06.012
(  0) 0) |
| [17] |
Qu C C, Du H H, Ma M K, et al. Pb sorption on montmorillonite-bacteria composites: A combination study by XAFS, ITC and SCM[J]. Chemosphere, 2018, 200: 427-436.
(  0) 0) |
| [18] |
Franzblau R E, Daughney C J, Swedlund P J, et al. Cu(Ⅱ) removal by Anoxybacillus flavithermus-iron oxide composites during the addition of Fe(Ⅱ) aq[J]. Geochimica et Cosmochimica Acta, 2016, 172: 139-158.
(  0) 0) |
| [19] |
Wang Y G, Gélabert A, Michel F M, et al. Effect of biofilm coatings at metal-oxide/water interfaces Ⅱ: Competitive sorption between Pb(Ⅱ) and Zn(Ⅱ) at Shewanella oneidensis/metal-oxide/water interfaces[J]. Geochimica et Cosmochimica Acta, 2016, 188: 393-406.
(  0) 0) |
| [20] |
Lei M, Tao J, Yang R J, et al. Binding of Sb(Ⅲ) by Sb-tolerant Bacillus cereus cell and cell-goethite composite: Implications for Sb mobility and fate in soils and sediments[J]. Journal of Soils and Sediments, 2019, 19(6): 2850-2858. DOI:10.1007/s11368-019-02272-z
(  0) 0) |
| [21] |
Hong Z, Rong X, Cai P, et al. Initial adhesion of Bacillus subtilis on soil minerals as related to their surface properties[J]. European Journal of Soil Science, 2012, 63(4): 457-466.
(  0) 0) |
| [22] |
del Nero M, Galindo C, Barillon R, et al. Surface reactivity of α-Al2O3 and mechanisms of phosphate sorption: In situ ATR-FTIR spectroscopy and ζ potential studies[J]. Journal of Colloid and Interface Science, 2010, 342(2): 437-444.
(  0) 0) |
| [23] |
Templeton A S, Spormann A M, Brown G E. Speciation of Pb(Ⅱ) sorbed by Burkholderia cepacia/goethite composites[J]. Environmental Science & Technology, 2003, 37(10): 2166-2172.
(  0) 0) |
| [24] |
Alessi D S, Fein J B. Cadmium adsorption to mixtures of soil components: Testing the component additivity approach[J]. Chemical Geology, 2010, 270(1/2/3/4): 186-195.
(  0) 0) |
| [25] |
Du H H, Qu C C, Liu J, et al. Molecular investigation on the binding of Cd(Ⅱ) by the binary mixtures of montmorillonite with two bacterial species[J]. Environmental Pollution, 2017, 229: 871-878.
(  0) 0) |
| [26] |
Moon E M, Peacock C L. Modelling Cu(Ⅱ) adsorption to ferrihydrite and ferrihydrite-bacteria composites: Deviation from additive adsorption in the composite sorption system[J]. Geochimica et Cosmochimica Acta, 2013, 104: 148-164.
(  0) 0) |
| [27] |
Du H H, Lin Y P, Chen W L, et al. Copper adsorption on composites of goethite, cells of Pseudomonas putida and humic acid[J]. European Journal of Soil Science, 2017, 68(4): 514-523.
(  0) 0) |
| [28] |
Otero-Fariña A, Fiol S, Arce F, et al. Effects of natural organic matter on the binding of arsenate and copper onto goethite[J]. Chemical Geology, 2017, 459: 119-128.
(  0) 0) |
| [29] |
Zhu J, Pigna M, Cozzolino V, et al. Sorption of arsenite and arsenate on ferrihydrite: Effect of organic and inorganic ligands[J]. Journal of Hazardous Materials, 2011, 189(1/2): 564-571.
(  0) 0) |
| [30] |
Ilgen A G, Trainor T P. Sb(Ⅲ) and Sb(V) sorption onto Al-rich phases: Hydrous Al oxide and the clay minerals kaolinite KGa-1b and oxidized and reduced nontronite NAu-1[J]. Environmental Science & Technology, 2012, 46(2): 843-851.
(  0) 0) |
| [31] |
Sun F H, Yan Y B, Liao H Q, et al. Biosorption of antimony(V) by freshwater cyanobacteria Microcystis from Lake Taihu, China: Effects of pH and competitive ions[J]. Environmental Science and Pollution Research, 2014, 21(9): 5836-5848.
(  0) 0) |
| [32] |
Sun Q, Cui P X, Liu C, et al. Antimony oxidation and sorption behavior on birnessites with different properties(δ-MnO2 and triclinic birnessite)[J]. Environmental Pollution, 2019, 246: 990-998.
(  0) 0) |
| [33] |
Nguyen V K, Lee J U. Isolation and characterization of antimony-reducing bacteria from sediments collected in the vicinity of an antimony factory[J]. Geomicrobiology Journal, 2014, 31(10): 855-861.
(  0) 0) |
| [34] |
Terry L R, Kulp T R, Wiatrowski H, et al. Microbiological oxidation of antimony(Ⅲ) with oxygen or nitrate by bacteria isolated from contaminated mine sediments[J]. Applied and Environmental Microbiology, 2015, 81(24): 8478-8488.
(  0) 0) |
| [35] |
Lehr C R, Kashyap D R, McDermott T R. New insights into microbial oxidation of antimony and arsenic[J]. Applied and Environmental Microbiology, 2007, 73(7): 2386-2389.
(  0) 0) |
| [36] |
Mikutta R, Zang U, Chorover J, et al. Stabilization of extracellular polymeric substances(Bacillus subtilis) by adsorption to and coprecipitation with Al forms[J]. Geochimica et Cosmochimica Acta, 2011, 75(11): 3135-3154.
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


