我国农业生产中每年产生的秸秆总量约占世界总量的30%[1]。秸秆中含有较多新鲜的有机化合物,归还土壤后经微生物分解作用而产生C、N、P、K等多种元素,从而可以提高土壤肥力[2-3]。当前,少部分秸秆还于土壤,多数秸秆通过燃烧等形式进行处理,浪费资源且也污染环境[4]。因此,秸秆还田是农业秸秆有效利用的重要途径。水稻的地上和地下生物量还田是水稻土有机碳的重要来源之一[5],水稻秸秆在土壤中的腐解规律及其腐解率受还田天数、还田时期、还田深度、气候条件等因素影响[6-12]。秸秆在腐解过程中,有机化合物在微生物作用下矿化分解并不断释放碳、氮等矿质元素,当土壤温度较高时会加速秸秆的腐解及其碳氮矿化[13-14],秸秆碳释放明显大于秸秆氮释放[15]。相同土壤环境条件下,还田8个月时,水稻根系中碳释放率明显低于茎叶中碳释放率[16],但还田达2年时,水稻根系和茎叶中碳释放率相接近[17]。稳定同位素示踪技术可以深入研究外源有机碳氮在生态系统中的分解转化与循环规律[13-14,18],Tang等[13]研究认为,利用土壤中δ13C计算的秸秆碳的分解率较传统差减法计算的分解率小。我国东北地区气候寒冷,稻田土壤休耕期长(10中旬至次年5月中旬),水稻生长期短;水稻机械收割时秸秆直接粉碎还田是当前该地区水稻秸秆还田的重要方式。在这一特殊气候条件下,水稻根系和茎叶在秋季还田后,经过寒冷漫长的休耕期和水稻生长季,秸秆腐解及其碳氮释放特征如何目前还尚不完全清楚。尽管有少量的研究报道,但采用稳定同位素示踪技术,定量、示踪水稻秸秆中碳氮释放的研究报道则较少[14]。本研究以双标记(13C和15N)水稻根系和茎叶为试材,利用同位素示踪技术,研究外源水稻根系和茎叶于秋季添加稻田土壤后,水稻根系和茎叶中碳氮释放的特征,以期为明确东北地区水稻秸秆秋季还田后秸秆碳氮的分解转化规律提供重要参考。
1 材料与方法 1.1 供试材料供试土壤采自辽宁省沈阳市新城子区连续种稻10年以上的耕层土壤,起源土壤类型为草甸土,不含有碳酸盐。土样去除土壤中残根等可见杂物,自然风干,过8 mm筛后均匀混合后备用。通过13C脉冲标记技术(以13C丰度为97%的Na213CO3脉冲标记6次)和15N示踪标记技术(以15N丰度为10.5%的(15NH4)2SO4分底肥、分蘖肥和穗粒肥均匀喷散施入)[19],获得水稻收获时双标记(13C和15N)根系和茎叶。供试双标记(13C和15N)水稻根系和茎叶、未标记水稻根系和茎叶(与双标记根系和茎叶同期获得)以及供试土壤的基本性质见表 1。
|
|
表 1 供试土壤和水稻根系、茎叶的基本性质 Table 1 Basic properties of the soil, root, stem and leaf of rice tested |
室外培养试验于2017年11月—2018年11月在沈阳农业大学后山科研基地进行。试验设三个处理,分别为:CK,不添加水稻秸秆处理;S1,添加双标记水稻根系和不标记水稻茎叶处理;S2,添加不标记水稻根系和双标记水稻茎叶处理。S1处理中双标记水稻根系按0.2%土壤质量添加,S2处理中双标记水稻茎叶按1%土壤质量添加,S1处理中未标记茎叶以S2处理双标记茎叶的等碳量添加,S2处理中未标记根系以S1处理双标记根系的等碳量添加。每一处理3次重复。
根据沈阳市地区稻田土壤休耕期和水稻生长期土壤水分状况,室外培养试验中将休耕期(2017年11月19日至2018年5月19日)土壤水分设置为80%土壤持水量,水稻生长期(2018年5月20日至2018年10月19日)土壤水分设置为2 cm淹水层,淹水停止后由于土壤水分含量较高,不再进行水分调控,处于自然状态。整个培养过程土壤温度为自然温度,根据天气预报记录每天最低、最高气温,最低与最高气温的平均值作为日均温度,日均温度累加即为积温。
将供试土壤400 g装入培养瓶(高12 cm,直径为7.5 cm),将供试水稻根系和茎叶于60 ℃下烘干并剪成约1 cm长度,按根系和茎叶的添加量混合后装入自制200目尼龙网袋(长8.5 cm宽5 cm)中、封口,将网袋竖直埋置于培养瓶的土壤中(网袋距离瓶底、土面、瓶壁约保持1 cm,以利于与土壤充分接触),然后用蒸馏水调节各处理培养瓶中所设置的土壤水分,最后用专用透气膜封口、并将培养瓶置于试验基地自制的简易遮雨棚内。根据天气情况每隔3~7 d用称重法补充土壤水分,以维持土壤休耕期和水稻生长期设置的土壤水分条件。
1.3 样品采集与分析在培养过程中,第一个月于培养的第7、14、21、30天进行取样,而后取样间隔为一个月,总共取样15次,均为破坏性取样。取样时,网袋取出清洗干净后置于60 ℃下烘干,植物样本用球磨仪粉碎混匀后,测定有机碳含量、全氮含量及其δ13C、δ15N。土样均匀混合后,部分鲜样立即测定土壤pH和Eh,部分鲜样置于-20 ℃冰箱中冷冻备用,部分则置于阴暗干燥处自然风干后,使用玛瑙研钵研磨过60目筛以用于测定有机碳含量、全氮含量及其δ13C、δ15N。
土壤pH和Eh:以土:水为1:2.5浸提,分别采用pH计(Thermo Scientific Orion Star A211)连接pH电极测定和Eh计(Thermo Scientific Orion Star A211)连接ORP(Oxidantio-potential)测定。
植物样、土样中有机碳含量、全氮含量及其δ13C、δ15N均采用元素分析-稳定同位素比例质谱联用仪(Elementar vario PYRO cube-IsoPrime100 Isotope Ratio Mass Spectrometer,德国)测定。
δ13C、δ15N及13C丰度(FC)、15N丰度(FN)计算:
| $ {{\rm{\delta }}^{13}}{\rm{C}}\left( ‰ \right) = \frac{{{R_{\rm{C}}} - {R_{{\rm{PDB}}}}}}{{{R_{{\rm{PDB}}}}}} \times 1000 $ | (1) |
| $ {{\rm{\delta }}^{15}}{\rm{C}}\left( ‰ \right) = \frac{{{R_{\rm{N}}} - {R_{{\rm{AN}}}}}}{{{R_{{\rm{AN}}}}}} \times 1000 $ | (2) |
| $ {F_{\rm{C}}}\left( \% \right) = \frac{({\rm{δ}}^{\rm{13}}C+1000)\times {R}_{\rm{PDB}}}{({\rm{δ}}^{\rm{13}}C+1000)\times {R}_{\rm{PDB}}+1000}\times 100 $ | (3) |
| $ {F_{\rm{N}}}\left( \% \right) = \frac{({\rm{δ}}^{\rm{15}}N+1000)\times {R}_{\rm{AN}}}{({\rm{δ}}^{\rm{15}}N+1000)\times {R}_{\rm{AN}}+1000}\times 100 $ | (4) |
式中,RC和RN分别为样品13C/12C原子比值和15N/14N原子比值;RPDB为0.0112372(标准物质为美国南卡罗来纳州白垩纪皮狄组层位中的拟箭石化石(Peedee Belemnite,即PDB))[20],RAN为0.0036765(以纯净大气氮为标准物质(Air Nitrogen,AN))。
1.4 数据处理基于水稻秸秆(根系和茎叶)计算水稻秸秆的腐解率(D):
| $ D\left( \% \right) = ({M_{\rm{R}}} - {M_{\rm{t}}})/{M_{\rm{R}}} \times {\rm{ }}100 $ | (5) |
式中,MR为添加水稻秸秆处理在培养前网袋内水稻秸秆质量(g·kg-1 soil);Mt为添加秸秆处理在培养后网袋内水稻秸秆质量(g·kg-1 soil)。
基于水稻秸秆碳含量计算水稻秸秆(根系和茎叶)碳(氮)残留量(R1):
| $ {R_1} = {M_{\rm{t}}} \times {C_{\rm{t}}}/1000 $ | (6) |
式中,R为水稻秸秆(根系和茎叶)碳(氮)残留量(g·kg-1 soil);Ct为添加培养后水稻秸秆碳(氮)浓度(g·kg-1);Mt同前。
基于水稻秸秆(根系和茎叶)中δ13C(δ15N)计算水稻根系、茎叶碳(氮)释放率(R2):
| $ {R_2}\left( \% \right) = ({C_{\rm{R}}} \times {F_{\rm{R}}}--{\rm{ }}{C_{\rm{t}}} \times {F_{\rm{t}}})/({C_{\rm{R}}} \times {F_{\rm{R}}}) \times {\rm{ }}100 $ | (7) |
式中,CR和Ct分别为添加秸秆处理在培养前和培养后网袋内秸秆碳(氮)量(g·kg-1 soil);FR,Ft分别为添加秸秆处理在培养前和培养后网袋内秸秆13C(15N)丰度(%),数据计算同式(3)或式(4)。
采用Microsoft Office Excel 2013进行数据处理与分析,采用OriginPro 8.5进行数据作图。使用SPSS 19.0软件进行统计分析,采用邓肯(Duncan)法(P < 0.05)进行比较。无特殊说明试验数据均为3次重复的平均值。
2 结果 2.1 水稻秸秆腐解率的变化在培养过程中,日平均温度在最初的4个月内均在0 ℃以下,在4~8个月逐渐升温,最高温度接近30 ℃,在8~2个月又呈下降趋势,最后接近0 ℃(图 1a)。累积温度在最初的4个月内逐渐降低,在4~12个月逐渐上升,累积温度达3 000 ℃以上(图 1b)。
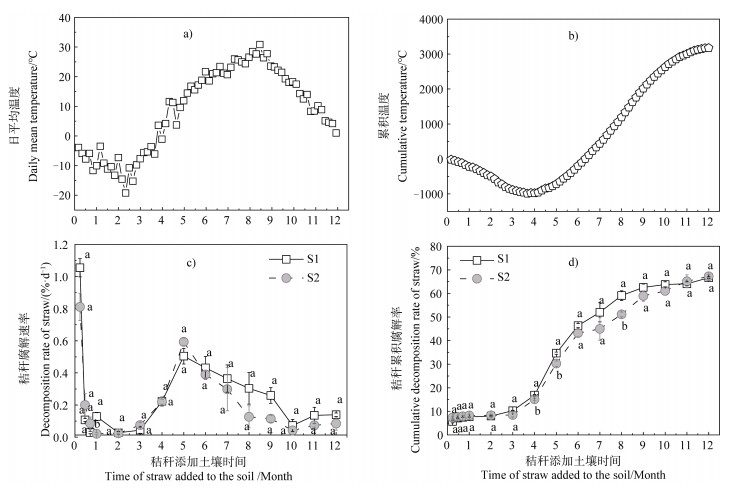
|
注:不同小写字母表示在同一取样时间,不同处理间差异达0.05显著水平。 Note: Different lowercase letters indicate difference between treatments the same in sampling time at 0.05 significant level. 图 1 环境温度和水稻秸秆腐解率的变化 Fig. 1 Variation of environmental temperature and decomposition rate of rice straw |
水稻秸秆添加土壤后,秸秆腐解速率在最初7 d时最大,尔后快速下降并在前3个月维持较低水平,在3~5个月内逐渐加快,在5~12个月逐渐降低(图 1c);秸秆腐解速率的变化趋势与日平均温度的变化趋势不完全一致。从秸秆腐解率来看(图 1d),水稻秸秆腐解率前3个月内呈非常缓慢的增加,腐解率接近10%,在3~5个月内快速增加,培养5个月时,S1、S2处理秸秆腐解率分别达30.2%、34.5%,差异达显著水平(P < 0.05);秸秆腐解率在5~10个月(淹水期)逐渐增加,在10~12月基本趋于稳定,培养1年时,S1、S2处理秸秆腐解率分别为66.5%、66.6%。相关分析显示,水稻秸秆腐解率与累积温度呈显著正相关,S1、S2处理的相关系数分别为0.860(P < 0.01)、0.818(P < 0.01)。由此可见,东北地区水稻秸秆在秋季(11月中旬)添加稻田土壤,自然温度是影响水稻秸秆腐解的关键因素。
2.2 水稻秸秆碳氮残留量及其δ13C、δ15N的变化水稻秸秆添加土壤后,两处理秸秆碳残留量在最初3个月变化很小,尔后显著降低,至9个月后趋于稳定(图 2a),两处理秸秆氮残留量随培养时间延长缓慢下降(图 2b);培养1年时两处理秸秆碳氮残留量均显著低于培养前秸秆碳氮量(P < 0.05)(图 2a和图 2b)。S1处理秸秆δ13C随培养时间延长呈波动增加趋势(图 2c),但δ15N则随培养时间延长无显著变化(图 2d),S2处理秸秆δ13C随培养时间延长无显著变化(图 2c),但δ15N则在培养3~6个月显著降低(图 2d);培养1年时S1处理秸秆δ13C显著高于培养前秸秆δ13C(P < 0.05)(图 2c),S2处理秸秆δ15N显著低于培养前秸秆δ15N(P < 0.05)(图 2d)。
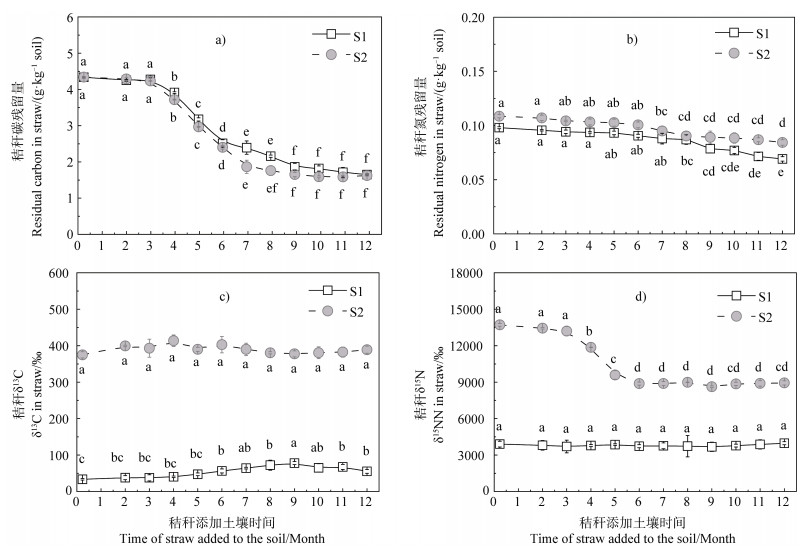
|
注:不同小写字母表示在同一处理,不同取样间差异达0.05显著水平。 Note: Different lowercase letters indicate difference between sampling times the same in treatment at 0.05 significant level. 图 2 水稻秸秆碳氮残留量及其δ13C、δ15N的变化 Fig. 2 Variation of residual carbon and nitrogen and their δ13C and δ15N in rice straw |
秸秆添加土壤后,外源水稻根系(S1处理)碳释放率略小于外源茎叶(S2处理)碳释放率,而水稻根系氮释放率则显著低于茎叶氮释放率(P < 0.05),根系和茎叶氮释放率明显低于其碳释放率(图 3)。经过漫长的休耕期,在培养5个月时,水稻根系和茎叶碳累积释放率分别达30.9%和38.2%,氮累积释放率分别达7.4%和35.0%。培养1年时,水稻根系和茎叶中碳累积释放率分别为63.7%和65.8%(图 3a);水稻根系和茎叶氮释放率分别为28.6%和51.1%(图 3b)。相关分析结果显示,水稻根系、茎叶中碳释放率与水稻秸秆腐解率之间均呈显著线性正相关(P < 0.01)(图 4a);水稻根系氮释放率与水稻秸秆腐解率之间则呈显著幂函数正相关(P < 0.01),水稻茎叶氮释放率与水稻秸秆腐解率之间仍呈显著线性正相关(P < 0.01)(图 4b)。这表明水稻根系、茎叶碳释放与水稻秸秆的腐解几乎同步进行,水稻根系氮素在前期腐解过程中释放非常缓慢,在中后期则随培养时间的延长释放逐渐加快,而水稻茎叶氮释放虽低于碳释放,但趋势大致相同。
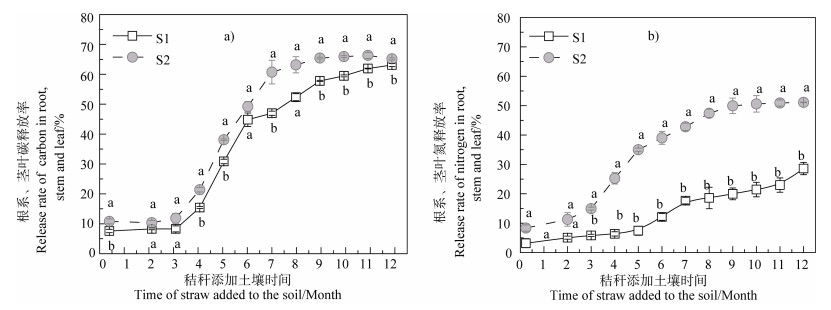
|
注:不同大写字母表示在同一取样时间,不处理间差异达0.05显著水平。 Note: Different uppercase letters indicate difference between treatments the same in sampling time and at 0.05 significant level. 图 3 水稻根系、茎叶碳氮释放率的变化 Fig. 3 Variation of release rate of carbon and nitrogen in rice root, stem and leaf |
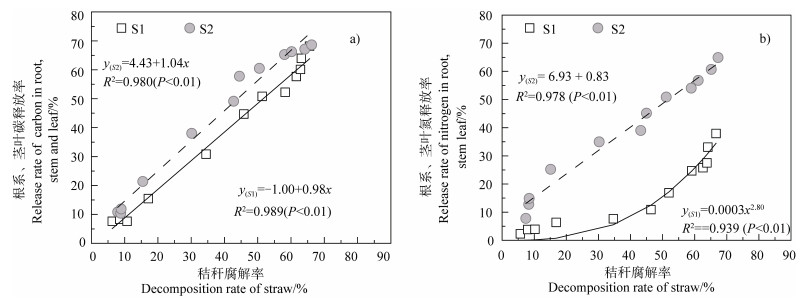
|
图 4 水稻根系、茎叶碳氮释放率与秸秆腐解率的关系 Fig. 4 Relationship between release rate of carbon and nitrogen in and decomposition rate of root, stem and leaf |
秸秆进入土壤中,在土壤微生物和酶的作用下进行腐解,影响秸秆腐解的因素包括温度、水分、还田方式及土壤养分等因素[12-14,16,21-23]。本研究中,水稻根系和茎叶添加稻田土壤1年时,水稻根系和茎叶的腐解率约达66%(图 1d),这一结果与相关研究结果相同[9,11,17,23-25]。此外,本研究中,除添加7 d时,水稻根系和茎叶的腐解速率较大外,在随后的3个月内,其腐解速率均很低(图 1c),腐解率仅为10%(图 1d),这一结果与初始腐解速率较高,秸秆还田3个月后腐解率可达50%的研究结果不相一致[10,17,24],但与谭可菲[8]、王麒[9]、龚振平[23]等的研究结果相一致。本研究中,水稻秸秆于秋季还田后(11月中旬),天气比较冷凉,温度接近0 ℃,冬季寒冷漫长,在秸秆添加土壤的前3个月内,温度多处于-10~-20℃之间(图 1a),土壤多处于冻结状态,严重抑制了微生物的活性[24],进而抑制了秸秆腐解。此外,本研究发现水稻秸秆腐解率与累积温度呈显著正相关(P < 0.01),这也进一步说明在东北寒冷地区,水稻秸秆秋季还田后,由于经过漫长寒冷冬季,土壤低温冻结是制约前期水稻秸秆的腐解非常缓慢的关键因素。但春季温度逐渐升高、土壤解冻后,微生物活动增强,微生物优先分解秸秆中多糖、氨基酸、有机酸等可溶性有机物或易分解有机物,促进水稻根系和茎叶的腐解,这在一定程度上可减缓泡田及水稻移栽时秸秆还田的不利影响。
研究发现,作物秸秆在土壤中的腐解速率及其养分的释放因作物秸秆类型[25]、秸秆的部分不同而异[16];秸秆碳释放率大于氮释放率[17,25-26],作物根系分解率小于茎叶分解率[16,27-28]。东北地区大豆、玉米和小麦秸秆于春季还田于黑土1年,大豆秸秆的腐解率(57%)明显高于玉米秸秆(52%)和小麦秸秆(45%),3种秸秆碳释放率明显大于秸秆氮释放率;随着腐解的进行,3种秸秆碳的化学成分差异逐渐增大,秸秆中纤维素、半纤维素等易分解有机物相对减少,而多酚、木质素、单宁等难分解有机物相对增加[25]。双标记(13C和15N)玉米秸秆在小麦种植前还田后,在小麦生长季结束时,秸秆碳累积释放率为47.9%~51.1%、秸秆氮释放率为32.3%~34.9%[26]。东北地区水稻秸秆春季还田1年,秸秆碳和秸秆氮累积释放率达到了75.2%和47.2%[17]。13C标记的水稻根系和茎叶添加到水稻土中在15℃下培养,结果表明水稻茎叶的腐解速率快于水稻根系,培养240 d时水稻茎叶和根系的腐解率分别达56%和73%[16]。温度升高可明显促进水稻茎叶和根系的腐解[16],秸秆碳释放率也随土壤温度的增加而增加[13-14]。本研究中,双标记(13C和15N)水稻根系和茎叶于秋季还田后,在寒冷的冬季,水稻根系和茎叶碳、氮释放速度非常慢,但随着春季温度升高而逐渐加快,还田1年时,水稻根系和茎叶中碳释放率大致相同,分别为63.7%和65.8%,而氮释放率明显低于碳释放率,分别为28.6%和51.1%,且根系氮释放率显著低于碳释放率(图 3)。这主要是由于根系和茎叶中纤维素和木质素等化学成分差异及其与土壤相互作用形成的不被生物降解的物理保护性有机物所致[27]。作物植株的茎叶主要是易分解的或可溶性的有机物质,如糖类、纤维素与半纤维素等有机物[29],水稻秸秆不同部位中纤维素、木质素含量等存在明显差异[30],导致其在同一环境中,会表现出不同的分解速率[28,31]。水稻根系与茎叶相比,有更多的纤维素、木质素,根系进入土壤后,根系中的纤维素、木质素与残余半纤维素等形成一种“保护”结构,阻碍纤维素酶的水解[32]。此外,水稻根系氮素可能存在于更为复杂、难降解的有机化合物中,导致根系氮素释放缓慢,表明根系氮比茎叶氮在土壤中更能持久存留。
此外,秸秆进入土壤后矿化分解出的有机碳,可参与土壤有机物的合成,也可在微生物作用下分解为CO2排出土体[33],同时也伴随着微生物利用矿化释放出的秸秆氮和土壤中的氮素满足自身合成,导致土壤氮素进入或吸附在秸秆表面[26,34],随后再缓慢释放或被吸附在逐渐疏松的秸秆组织中[35],因网袋隔离暂时未进入土壤,使秸秆残留氮量增加[26]。本研究中,两个处理在培养3个月后,添加双标记水稻根系处理(S1)秸秆自身C/N(25~38)明显低于添加双标记茎叶处理(S2)秸秆自身C/N(27~43),致使S2处理附着在秸秆上的微生物从邻近土壤中吸收的氮素要明显多于S1处理,从而降低了S2处理秸秆δ15N(图 2d),这在一定程度上高估了水稻茎叶氮素释放率。
4 结论东北地区水稻根系和茎叶于秋季还田1年,水稻秸秆(根系+茎叶)的腐解率经过寒冷漫长的土壤休耕期(11月至次年5月)时达30%左右,经过1年时达66%左右。水稻根系和茎叶碳释放与其腐解同步进行,还田1年时根系和茎叶碳释放率分别达63.7%和65.8%,氮释放率分别达28.6%和51.1%,根系氮素释放显著低于茎叶氮素释放,温度升高明显促进了水稻根系和茎叶的腐解及其碳氮释放。这一研究结果意味着东北地区水稻秸秆于秋季还田后,经过寒冷漫长的土壤休耕期后,约有30%左右腐解,这不仅在一定程度上可减缓春季泡田及水稻移栽时秸秆还田的不利影响,而且也可为水稻生长发育提供必须的养分供应。
| [1] |
Yang L, Liu W, Lan T, et al. Research on the status quo of technology and standard of straw returning in China (In Chinese)[J]. China Agricultural Information, 2017(21): 12-17. [杨丽, 刘文, 兰韬, 等. 我国秸秆还田技术与标准的现状研究[J]. 中国农业信息, 2017(21): 12-17.]
(  0) 0) |
| [2] |
Zhang J N, Chen G F, Sun H F, et al. Straw biochar hastens organic matter degradation and produces nutrient-rich compost[J]. Bioresource Technology, 2016, 200: 876-883. DOI:10.1016/j.biortech.2015.11.016
(  0) 0) |
| [3] |
Yadvinder-Singh, Gupta R K, Jagmohan-Singh, et al. Placement effects on rice residue decomposition and nutrient dynamics on two soil types during wheat cropping in rice-wheat system in northwestern India[J]. Nutrient Cycling in Agroecosystems, 2010, 88(3): 471-480. DOI:10.1007/s10705-010-9370-8
(  0) 0) |
| [4] |
Cao G L, Zhang X Y, Zheng F C. Inventory of black carbon and organic carbon emissions from China[J]. Atmospheric Environment, 2006, 40(34): 6516-6527. DOI:10.1016/j.atmosenv.2006.05.070
(  0) 0) |
| [5] |
Zhang G B, Yu H Y, Fan X F, et al. Effect of rice straw application on stable carbon isotopes, methanogenic pathway, and fraction of CH4 oxidized in a continuously flooded rice field in winter season[J]. Soil Biology & Biochemistry, 2015, 84: 75-82.
(  0) 0) |
| [6] |
Kuang E J, Chi F Q, Su Q R, et al. Decomposition regularity of organic materials in Sanjiang Plain region (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2010, 18(4): 736-741. [匡恩俊, 迟凤琴, 宿庆瑞, 等. 三江平原地区不同有机物料腐解规律的研究[J]. 中国生态农业学报, 2010, 18(4): 736-741.]
(  0) 0) |
| [7] |
Dai W C, Gao M, Lan M L, et al. Nutrient release patterns and decomposition characteristics of different crop straws in drylands and paddy fields (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2017, 25(2): 188-199. [代文才, 高明, 兰木羚, 等. 不同作物秸秆在旱地和水田中的腐解特性及养分释放规律[J]. 中国生态农业学报, 2017, 25(2): 188-199.]
(  0) 0) |
| [8] |
Tan K F, Wang Q, Liu C Z, et al. Decomposition characteristics of rice straw in western Heilongjiang (In Chinese)[J]. China Rice, 2018, 24(4): 96-98. [谭可菲, 王麒, 刘传增, 等. 黑龙江西部地区水稻秸秆腐解特征研究[J]. 中国稻米, 2018, 24(4): 96-98.]
(  0) 0) |
| [9] |
Wang Q, Song Q L, Feng Y J, et al. Effects of nitrogen fertilizer application on rice decay (In Chinese)[J]. Jiangsu Agricultural Sciences, 2017, 45(11): 197-201. [王麒, 宋秋来, 冯延江, 等. 施用氮肥对还田水稻秸秆腐解的影响[J]. 江苏农业科学, 2017, 45(11): 197-201.]
(  0) 0) |
| [10] |
Hu H X, Ma Z W, Shao Z Y. Decomposition characteristics of returned straw (In Chinese)[J]. Hunan Agricultural Sciences, 2012(5): 44-46. [胡宏祥, 马中文, 邵致远. 还田秸秆腐解特征研究[J]. 湖南农业科学, 2012(5): 44-46.]
(  0) 0) |
| [11] |
Liu S P, Chen W L, Nie X T, et al. Effect of embedding depth on decomposition course of crop residues in rice-wheat system (In Chinese)[J]. Plant Nutrition and Fertilizer Science, 2007, 13(6): 1049-1053. DOI:10.3321/j.issn:1008-505x.2007.06.010 [刘世平, 陈文林, 聂新涛, 等. 麦稻两熟地区不同埋深对还田秸秆腐解进程的影响[J]. 植物营养与肥料学报, 2007, 13(6): 1049-1053.]
(  0) 0) |
| [12] |
Nakajima M, Cheng W G, Tang S R, et al. Modeling aerobic decomposition of rice straw during the off-rice season in an Andisol paddy soil in a cold temperate region of Japan: Effects of soil temperature and moisture[J]. Soil Science and Plant Nutrition, 2016, 62(1): 90-98. DOI:10.1080/00380768.2015.1121116
(  0) 0) |
| [13] |
Tang S R, Cheng W G, Hu R G, et al. Simulating the effects of soil temperature and moisture in the off-rice season on rice straw decomposition and subsequent CH4 production during the growth season in a paddy soil[J]. Biology and Fertility of Soils, 2016, 52(5): 739-748. DOI:10.1007/s00374-016-1114-8
(  0) 0) |
| [14] |
侯玮. 东北地区水稻秸秆在稻田土壤中腐解及其CO2、CH4排放的特征[D]. 沈阳: 沈阳农业大学, 2019. Hou W. Decomposition of rice straw in paddy soil and characteristics of CO2 and CH4 emission in Northeast China[D]. Shenyang: Shenyang Agricultural University, 2019. (  0) 0) |
| [15] |
Ferreira D A, Franco H C J, Otto R, et al. Contribution of N from green harvest residues for sugarcane nutrition in Brazil[J]. Global Change Biology Bioenergy, 2016, 8(5): 859-866. DOI:10.1111/gcbb.12292
(  0) 0) |
| [16] |
Lu Y H, Watanabe A, Kimura M. Carbon dynamics of rhizodeposits, root-and shoot-residues in a rice soil[J]. Soil Biology & Biochemistry, 2003, 35(9): 1223-1230.
(  0) 0) |
| [17] |
Yan C, Yan S S, Jia T Y, et al. Decomposition characteristics of rice straw returned to the soil in northeast China[J]. Nutrient Cycling in Agroecosystems, 2019, 114(3): 211-224. DOI:10.1007/s10705-019-09999-8
(  0) 0) |
| [18] |
Tang S R, Cheng W G, Hu R G, et al. Decomposition of soil organic carbon influenced by soil temperature and moisture in Andisol and Inceptisol paddy soils in a cold temperate region of Japan[J]. Journal of Soils and Sediments, 2017, 17(7): 1843-1851. DOI:10.1007/s11368-016-1607-y
(  0) 0) |
| [19] |
于鹏. 不同时期光合碳和肥料氮在水稻-土壤系统中的分配[D]. 沈阳: 沈阳农业大学, 2017. Yu P. Distribution of photosynthetic carbon and fertilizer nitrogen in rice-soil system relative to rice growth stages[D]. Shenyang: Shenyang Agricultural University, 2017. (  0) 0) |
| [20] |
Lu Y H, Watanabe A, Kimura M. Contribution of plant-derived carbon to soil microbial biomass dynamics in a paddy rice microcosm[J]. Biology and Fertility of Soils, 2002, 36(2): 136-142. DOI:10.1007/s00374-002-0504-2
(  0) 0) |
| [21] |
Zhou G X, Chen L, Zhang C Z, et al. Effects of temperature and moisture on microbial community function responsible for straw decomposition (In Chinese)[J]. Soils, 2015, 47(5): 911-918. [周桂香, 陈林, 张丛志, 等. 温度水分对秸秆降解微生物群落功能多样性影响[J]. 土壤, 2015, 47(5): 911-918.]
(  0) 0) |
| [22] |
Tian P, Jiang Y, Sun Y, et al. Effect of straw return methods on maize straw decomposition and soil nutrients contents (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2019, 27(1): 100-108. [田平, 姜英, 孙悦, 等. 不同还田方式对玉米秸秆腐解及土壤养分含量的影响[J]. 中国生态农业学报: 中英文, 2019, 27(1): 100-108.]
(  0) 0) |
| [23] |
Gong Z P, Deng N Z, Song Q L, et al. Decomposing characteristics of maize straw returning in Songnen Plain in long-time located experiment (In Chinese)[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(8): 139-145. [龚振平, 邓乃榛, 宋秋来, 等. 基于长期定位试验的松嫩平原还田玉米秸秆腐解特征研究[J]. 农业工程学报, 2018, 34(8): 139-145.]
(  0) 0) |
| [24] |
Khan M I, Hwang H Y, Kim G W, et al. Microbial responses to temperature sensitivity of soil respiration in a dry fallow cover cropping and submerged rice mono-cropping system[J]. Applied Soil Ecology, 2018, 128: 98-108.
(  0) 0) |
| [25] |
Xu Y H, Chen Z M, Fontaine S, et al. Dominant effects of organic carbon chemistry on decomposition dynamics of crop residues in a Mollisol[J]. Soil Biology & Biochemistry, 2017, 115: 221-232.
(  0) 0) |
| [26] |
Huang T M, Wang Z H, Hou Y Y, et al. Effects of nitrogen application on decomposition and nutrient release of returned maize straw in Guanzhong Plain, Northwest China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2017, 28(7): 2261-2268. [黄婷苗, 王朝辉, 侯仰毅, 等. 施氮对关中还田玉米秸秆腐解和养分释放特征的影响[J]. 应用生态学报, 2017, 28(7): 2261-2268.]
(  0) 0) |
| [27] |
Puget P, Drinkwater L E. Short-term dynamics of root-and shoot-derived carbon from a leguminous green manure[J]. Soil Science Society of America Journal, 2001, 65(3): 771-779.
(  0) 0) |
| [28] |
Gale W J, Cambardella C A. Carbon dynamics of surface residue-and root-derived organic matter under simulated No-till[J]. Soil Science Society of America Journal, 2000, 64(1): 190-195.
(  0) 0) |
| [29] |
Abdoulaye A D, Yang Z L, Shen G H, et al. Comparison and rapid prediction of lignocellulose and organic elements of a wide variety of rice straw based on near infrared spectroscopy[J]. International Journal of Agricultural and Biological Engineering, 2019, 12(2): 166-172.
(  0) 0) |
| [30] |
Wu W J, Wang Z G, Jin Y C, et al. Effects of LiCl/DMSO dissolution and enzymatic hydrolysis on the chemical composition and lignin structure of rice straw[J]. Biomass and Bioenergy, 2014, 71: 357-362.
(  0) 0) |
| [31] |
Wang J J, Xi Y L, Chang Z Z, et al. The differences of biodegradation rates in the different parts of wheat straw (In Chinese)[J]. Journal of Agricultural Resources and Environment, 2015, 32(1): 74-80. [王佳佳, 奚永兰, 常志州, 等. 麦秸不同部位生物降解速率差异[J]. 农业资源与环境学报, 2015, 32(1): 74-80.]
(  0) 0) |
| [32] |
Eremeeva T, Bikova T, Eisimonte M, et al. Fractionation and molecular characteristics of cellulose during enzymatic hydrolysis[J]. Cellulose, 2001, 8(1): 69-79. DOI:10.1023/A%3A1016627031201
(  0) 0) |
| [33] |
Williams M A, Myrold D D, Bottomley P J. Distribution and fate of 13C-labeled root and straw residues from ryegrass and crimson clover in soil under western Oregon field conditions[J]. Biology and Fertility of Soils, 2006, 42(6): 523-531. DOI:10.1007/s00374-005-0046-5
(  0) 0) |
| [34] |
Huang T M, Zheng X F, Wang Z H. Nitrogen release of returned maize straw and its effects on loess N supply and nitrogen uptake by winter wheat in Guanzhong plain (In Chinese)[J]. Scientia Agricultura Sinica, 2015, 48(14): 2785-2795. [黄婷苗, 郑险峰, 王朝辉. 还田玉米秸秆氮释放对关中黄土供氮和冬小麦氮吸收的影响[J]. 中国农业科学, 2015, 48(14): 2785-2795.]
(  0) 0) |
| [35] |
Dresboll D, Magid J. Structural changes of plant residues during decomposition in a compost environment[J]. Bioresource Technology, 2006, 97(8): 973-981.
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


