2. 中国科学院沈阳应用生态研究所, 沈阳 110016
2. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China
微生物对土壤有机质(SOM)形成具有重要的作用,微生物通过自身合成代谢产物(特别是微生物细胞及其死亡残体),即微生物通过利用凋落物以及SOM合成微生物生物量,以微生物残体的形式贡献土壤有机碳(SOC)的形成和积累[1-2]。以往的研究指出微生物残体最大能贡献80%左右的SOM[3],表明微生物在SOC形成以及周转过程中具有重要的作用。微生物残体缓慢的周转速率可以表征生态系统演替过程中SOC的动态变化,反映土壤碳的“遗留效应”[4]。研究发现微生物残留物主要由化学性质稳定的氨基糖组成,氨基葡萄糖主要来自于真菌,而胞壁酸专一来源于细菌,两者能够大致区分真菌、细菌残体对SOC的相对贡献[5-6]。最近的一项研究综合评估了全球森林、草地和农田生态系统氨基糖在土壤中的含量,指出氨基糖在SOC中的比例大致为6.19%~8.33%[7]。因此,微生物标识物—氨基糖是合适的指标来评估长期森林次生演替过程中土壤微生物残体的动态变化,并被应用于评价微生物残体对SOC的贡献。
森林次生演替是森林生态系统地上和地下生物群落结构随时间变化的过程,演替时间序列可以是几十年甚至几百年[8]。森林次生演替过程中生物以及非生物因素发生变化,包括植物群落结构、生产力以及SOC的变化[9-10]。改变的植物群落结构以及不同数量、质量的植物残体输入影响了土壤有机质的数量和质量(即土壤有机质组分,通过中红外光谱特征峰表征)[10],进而导致土壤微生物群落活性、结构和功能的变化[11]。研究[12]表明,亚热带森林次生演替通过影响真菌和细菌群落变化以及土壤碳基质的可利用性提高了微生物残体在SOC中的积累。因此,探究森林次生演替过程中微生物残体对SOC存储的调控作用,有助于理解微生物对土壤碳循环的调控以及预测森林次生演替对全球气候变化的反馈。此外,凋落物分解以及根系分泌物的垂直梯度变化会导致土壤理化性质、土壤营养以及微生物群落结构和功能的变化[13],可能会改变森林演替过程中微生物残体及其在SOC库中的积累。因此,需要进一步探究土壤深度及其与森林演替间的交互作用如何影响微生物残体。
温带森林是重要的陆地生态系统,贡献大约18%的陆地生态系统碳存储[14]。Liang等[2]的研究表明微生物残体对土壤有机碳的贡献比例大于50%,因此,结合微生物残体的研究,能够更好地阐释微生物在SOC存储中的作用,有利于森林SOC的管理和评估。基于森林林龄(即空间替代时间),本研究在中国长白山森林自然保护区选取了5个森林演替序列(20 a、80 a、120 a、200 a和≥300 a),采用微生物生物标识物以及中红外光谱等技术和方法,探究长期森林次生演替过程中土壤不同深度微生物残体的变化以及微生物残体对SOC的贡献。本研究的主要目标是明确:(1)森林次生演替对微生物残体以及其对SOC贡献的影响;(2)土壤深度如何影响微生物残体以及微生物残体对SOC贡献;(3)真菌和细菌残体在微生物残体对SOC贡献中的调控作用。
1 材料与方法 1.1 研究样地概况研究地点位于中国东北吉林省长白山国家森林自然保护区(42°20′~42°24′N,127°55′~128°06′E),海拔为780~920 m。该地年均降水量大约700 mm,年均温为2.9 ℃,该区域主要的土壤类型为淋溶土(Alfisol)。基于林龄选取了5个森林次生演替序列:20 a、80 a、120 a、200 a以及大于等于300 a。森林次生演替过程中植物物种从20 a至300 a发生了较大改变,从先锋树种(如白桦、山杨)为主的阔叶林演替至顶级树种(如红松)为主的针阔混交林。森林演替20 a的主要树种为白桦、山杨;演替80 a的主要树种为白桦、山杨、蒙古栎、紫椴、色木槭以及水曲柳,还伴随着少量的红松;演替120 a的主要树种为蒙古栎、紫椴、色木槭、水曲柳以及红松,白桦以及山杨大量死亡、甚至消失;演替200 a以及300 a的主要树种为红松,伴随着蒙古栎、紫椴、色木槭、水曲柳。
1.2 土壤样品采集与处理2014年8月在各个森林次生演替序列的区域,均匀选取了6个20 m × 15 m的样方,采集有机质层(0~5 cm,主要为半分解和全腐解的凋落物、根以及土壤的混合物)和矿质层土壤(5~15 cm,主要是土壤层)。每个样方随机采集10个土壤样品,并且均匀地混成一个样品。去除有机质层土壤样品中的石头、动物、大于1 mm的粗根以及根状茎;矿质层土壤样品过2 mm筛,并去除土壤样品中的石头、动物、根以及凋落物。保存于4 ℃的新鲜土壤样品用于测定土壤铵态氮、硝态氮以及微生物生物量碳。风干土壤样品用于测定土壤pH、土壤总碳氮含量、中红外光谱以及氨基糖。
1.3 土壤化学性质以及氨基糖分析称取过2 mm筛的土壤样品按一定的比例混入去离子水中(土: 水,m/v= 1:10(有机质层)或1:2.5(矿质层土壤))。混合液用磁力搅拌器搅动2 min,然后静置30 min,用pH计测定土壤pH。
球磨仪(MM400,Retsch,德国)研磨过0.15 mm筛的土壤样品在元素分析仪(Elementar,Langenselbold,德国)上测定总的碳、氮含量。由于长白山偏酸的土壤特性,将总的土壤碳含量定义为SOC。
称量10 g过2 mm筛的土壤样品于100 mL的塑料瓶内,然后加入50 mL、2 mol·L-1的KCl溶液。混合的土壤溶液振荡、过滤,过滤后的土壤提取液在连续流动分析仪(Technicon Corporation,Oregon,美国)上测定土壤铵态氮和硝态氮。铵态氮和硝态氮的和为土壤无机氮(Soil inorganic nitrogen,SIN)。
研磨过0.15 mm筛的土壤样品与97%的溴化钾以一定比例(1:80 w/w)在玛瑙研钵中研磨混匀,用压片设备进行压片,然后在漫反射傅里叶变换中红外光谱仪(Thermo Electron Scientific Instruments Corp.,Madison,WI,美国)上测定分析SOM组分。不同特征峰用来评估SOM不同的碳组分:芳香族碳组分(1 620 cm-1)和多糖(1 034 cm-1)[15]。
氯仿熏蒸-K2SO4提取法测定土壤微生物生物量碳(Microbial biomass carbon,MBC):MBC = [C(熏蒸)− C(未熏蒸)] / 0.45[16]。微生物熵(部分土壤有机碳被微生物利用、固定并转化为微生物生物量)的计算方法:微生物熵= MBC/SOC[17]。
参照Zhang和Amelung[18]的方法提取土壤氨基糖。氨基糖提取液在气相色谱仪(Agilent 7890B GC,Agilent Technologies,Santa Clara,CA,美国)上进行测定分析。Agilent 7890B GC配置HP-5色谱柱(30 m × 0.25 mm × 0.25 μm)以及火焰离子化检测仪(Flame ionization detector,FID)。1 μL氨基糖提取液进样至色谱柱进行测定,N2作为载气,流速为0.6 mL·min-1。气相色谱进样口温度设定为250 ℃,分流比为30:1。参照标准样品中三种氨基糖的出峰时间来分离土壤氨基糖。
根据下面的公式计算微生物残体[19]:微生物残体含量/(g·kg-1)=真菌残体[(氨基葡萄糖(mmol)-2×胞壁酸(mmol))×179.2×9]+细菌残体[胞壁酸(g·kg-1)×45]。其中179.2是氨基葡萄糖的分子质量,9是真菌氨基葡萄糖转换为真菌残体碳的转换系数,45是细菌胞壁酸转换为细菌残体碳的转换系数。微生物(真菌、细菌)残体对SOC的贡献=微生物(真菌、细菌)残体含量/SOC。
1.4 数据统计分析双因素方差分析检测森林次生演替、土壤深度及其交互作用对微生物生物量参数、微生物残体以及残体对SOC贡献的显著性。单因素方差分析和析因分析(Tukey's post-hoc)用于检测不同土壤深度森林次生演替过程中微生物生物量参数、微生物残体以及残体对SOC贡献的显著性。所有的统计分析在SAS V.8.1软件(SAS Institute Inc.,Cary,NC,美国)上执行。
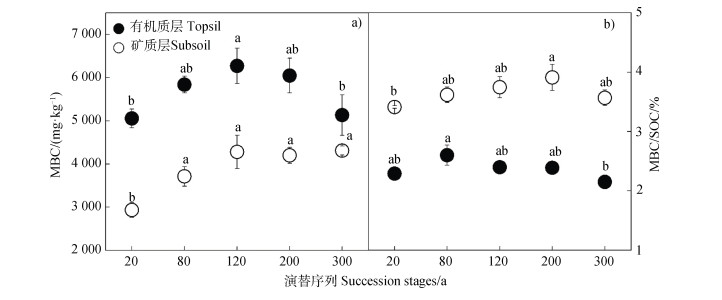
2 结果 2.1 不同森林次生演替序列和土壤深度微生物生物量的变化森林次生演替导致MBC显著变化(P < 0.01),而未影响MBC/SOC(P > 0.05);MBC和MBC/SOC在不同土壤深度(有机质层和矿质层)具有显著差异(P < 0.001),而其与森林演替之间无交互作用(表 1)。在不同土壤深度,森林次生演替过程中MBC和MBC/SOC的变化趋势存在差异(图 1)。在有机质层,森林次生演替20~120 a MBC逐渐增加,随后呈现下降趋势(图 1a));森林次生演替80 a的MBC/SOC高于其他4个演替序列(图 1b))。在矿质层,森林次生演替20~120 a MBC逐渐增加,随后保持相对不变(图 1a));森林次生演替20~200 a的MBC/SOC逐渐增加,在300 a呈现下降趋势(图 1b))。土壤有机质层MBC显著高于矿质层MBC(P < 0.001),而有机质层MBC/SOC显著低于矿质层MBC/SOC(P < 0.001)(图 1)。
|
|
表 1 森林次生演替和土壤深度作用下微生物生物量碳(MBC)、微生物残体及其对土壤有机碳(SOC)贡献 Table 1 Microbial biomass carbon(MBC), the content of microbial residues and their contributions to soil organic carbon(SOC)relative to stage of secondary forest succession and soil depth |
|
注:不同的字母代表显著性差异(P < 0.05)。下同。Note:Different letters indicate significant difference at P < 0.05. The same below. 图 1 森林次生演替过程中有机质层(0~5 cm)和矿质层(5~15 cm)土壤微生物生物量碳(MBC)和微生物熵(MBC/SOC)变化 Fig. 1 Variation of microbial biomass carbon(MBC)and microbial quotient(MBC/SOC)in topsoil(0~5 cm)and subsoil(5~15cm)with succession of secondary forest |
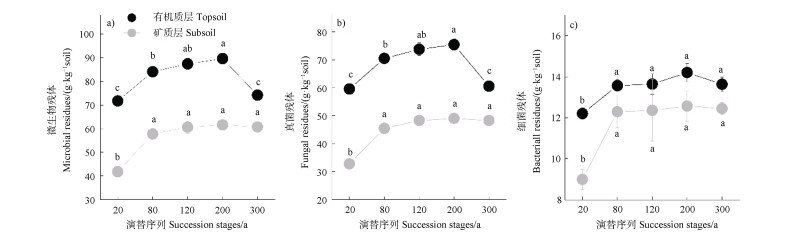
森林次生演替和土壤深度显著影响了微生物、真菌以及细菌残体的含量(P < 0.001,表 1);此外,森林演替与土壤深度对微生物和真菌残体的影响存在显著的交互作用(P < 0.001),然而对细菌残体的影响不存在交互作用(表 1)。在有机质层,从森林次生演替序列20 a到200 a微生物以及真菌残体含量显著增加(P < 0.01),而在演替300 a显著降低;在矿质层,演替20 a的微生物以及真菌残体含量低于其他4个演替序列(P < 0.01,图 2a),图 2b))。在两个土壤深度,演替80~300 a的细菌残体含量高于演替20 a的细菌残体含量(P < 0.01,图 2c))。此外,微生物、真菌和细菌残体的含量在土壤有机质层显著高于矿质层(P < 0.001)。有机质层和矿质层真菌、细菌残体占总的微生物残体的比例发生变化。从有机质层到矿质层,真菌残体占总的微生物残体的比例在下降(83.47%下降至79.23%),细菌残体占总的微生物残体的比例在增加(16.53%上升至20.77%)(图 2)。
|
图 2 森林次生演替过程中有机质层和矿质层土壤微生物残体的变化 Fig. 2 Variation of microbial residues in topsoil and subsoil with succession of secondary forest |
森林次生演替显著改变了微生物以及真菌残体对SOC的贡献(P < 0.05),而未影响细菌残体对SOC的贡献;土壤深度显著影响了微生物、真菌以及细菌残体对SOC的贡献(P < 0.001),而其与森林演替之间无交互作用(表 1;图 3)。在有机质层和矿质层,森林演替80~200 a微生物以及真菌残体对SOC的贡献显著高于森林演替20 a(P < 0.05),而在300 a呈现下降趋势(图 3a),图 3b))。此外,有机质层土壤微生物、真菌和细菌残体对SOC的贡献(微生物33.74%;真菌28.12%;细菌5.62%)显著低于矿质层土壤微生物、真菌和细菌残体对SOC的贡献(微生物54.36%;真菌42.76%;细菌11.60%)(P < 0.001,图 3)。

|
图 3 森林次生演替过程中有机质层和矿质层微生物残体对土壤有机碳的贡献 Fig. 3 Microbial residues contribution to SOC in topsoil and subsoil with succession of secondary forest |
本研究应用路径分析揭示土壤化学性质与微生物残体间的因果关系,并探究不同土壤因子对解释不同森林次生演替序列和土壤深度微生物残体变化的相对贡献(图 4)。在两个土壤深度,SOC、土壤无机氮(SIN)以及土壤有机质芳香族组分/多糖(Aro/Poly)通过影响MBC和MBC/SOC间接地导致森林次生演替过程中微生物残体含量(即真菌和细菌残体)的变化;MBC和MBC/SOC均与真菌和细菌残体含量显著正相关(P < 0.05)。微生物残体对SOC的贡献与真菌和细菌残体含量之间的相关性在两个土壤深度存在不一致:在有机质层,微生物残体对SOC的贡献与真菌残体含量间显著正相关(P < 0.01),而与细菌残体含量之间关系不显著(P > 0.05);在矿质层,微生物残体对SOC的贡献与真菌残体含量间显著正相关(P < 0.01),而与细菌残体含量间显著负相关(P < 0.01)。此外,微生物残体对SOC的贡献与MBC/SOC之间显著正相关(P < 0.001)。

|
注:。实线和虚线表示显著(P < 0.05)和非显著(P > 0.05)效果。每条路径旁边显示了标准化的路径系数(黑色和灰色线分别代表正和负的路径;线的粗细表示土壤化学贡献的比例)。R2值表示独立变量的解释强度。SS:演替序列,SOC:土壤有机碳,SOC/TN:土壤有机碳/总氮,土壤无机氮:SIN,Aro/Poly:土壤有机质芳香族组分/多糖,MBC:微生物生物量碳,MBC/SOC:微生物熵,FR:真菌残体,BR:细菌残体,MR/SOC:微生物残体对SOC的贡献。显著性:P < 0.05*,P < 0.01**,P < 0.01***。Note:Solid and dashed lines indicate significant(P < 0.05)and in-significant(P > 0.05)effects(P values inside brackets),respectively. Standardized path coefficients are listed beside each path(black and grey lines represent positive and negative paths,respectively;width of the line indicates the proportion of factorial contribution). R2 values indicate the strength of explanation by independent variables. SS:succession stages,SOC:soil organic carbon,SIN:soil inorganic nitrogen,Aro/Poly:aromatic C compoents/polysaccharides,MBC:microbial biomass carbon,FR:fungal residues,BR:bacterial residues,MR/SOC:microbial residues contribution to SOC. Significance:P < 0.05*,P < 0.01**,P < 0.01***. 图 4 森林次生演替过程中有机质层和矿质层土壤化学与微生物残体参数的路径分析 Fig. 4 Path analysis of the parameters of soil chemistry and microbial residues in topsoil and subsoil relative to succession of secondary forest |
微生物残体是相对稳定的SOM组分,对SOM的形成具有重要的贡献[20-21]。此外,微生物残体作为稳定的SOM组分,可反映长期的生态系统变化[4, 22]。森林次生演替促进了有机质层和矿质层土壤微生物残体的积累,特别是在森林次生演替序列80~200 a。森林次生演替增加了真菌残体对SOC的贡献,而未改变细菌残体对SOC的贡献(图 3b),图 3c)),这些研究表明真菌残体的积累对SOC的增加具有较大的贡献。此外,森林演替过程中微生物残体对SOC的贡献与真菌残体显著正相关,而与细菌残体负相关(图 4),也表明真菌残体在SOC积累中的重要性。真菌和细菌残体不同的化学稳定性可能是导致两者对SOC贡献差异的原因,一些研究指出真菌残体的化学稳定性高于细菌残体[23-24]。真菌残体不易被分解利用,通过与土壤团聚体以及矿物结合能在土壤中保存几十年甚至几百年[2, 25],因此真菌残体的积累有利于SOC的存储。然而,细菌残体相对易被微生物分解利用,其较快的周转代谢不利于微生物残体对SOC的直接贡献。
生态系统主要通过两个途径导致SOC存储:植物碳输入(包括凋落物以及根系分泌物)和微生物代谢产物(如微生物残体)。诸多的研究已经探究了植物在SOC存储的作用[26-27],而微生物在植物转化为SOC的过程中具有重要的作用。微生物通过释放胞外酶分解植物残体,同时微生物也利用植物来源的碳同化合成微生物生物量;微生物死亡后,部分微生物细胞以残体的形式转化为相对稳定的SOC[28-29]。森林次生演替序列80~200 a微生物残体对SOC的贡献增加(图 3a)),表明在这个演替序列更多的植物来源碳通过微生物的同化代谢合成微生物生物量,微生物快速的代谢周转导致更多微生物残体形成SOC。森林次生演替过程中可利用性氮(即无机氮)增加可能间接地影响微生物残体含量,主要是高的土壤可利用氮会促进植物生长,增加的凋落物以及植物光合碳输入(根系分泌碳)刺激微生物生长代谢,导致更多微生物生物量合成,进而促进微生物残体积累。本研究结果显示,森林次生演替过程中微生物残体与MBC之间显著正相关(图 4),表明微生物生物量通过细胞代谢转化为比较稳定的微生物残体,导致微生物残体在土壤中积累[30-31]。此外,微生物通过利用外源碳同化合成微生物生物量,凋落物化学性质以及土壤有机质组分差异会影响微生物残体的积累[32]。Shao等[10]的研究指出森林演替80~120 a植物群落主要以阔叶林为主,具有低的凋落物碳氮比,表明此演替序列的植物来源碳易于被微生物利用;而且,此演替序列高的易利用SOM组分(即低的芳香族碳组分/多糖组分)有利于微生物合成自身生物量,导致更多微生物残体对SOC的贡献。微生物残体对SOC的贡献与微生物熵(MBC/SOC)间的显著正相关性(图 4)也解释了森林次生演替80~120 a高的微生物碳利用有利于更多微生物代谢产物的积累,进而增加了微生物残体对SOC的贡献。
然而,森林次生演替300 a土壤微生物残体含量及其对SOC的贡献显著下降(图 2,图 3),主要归因于低的微生物碳利用。森林演替300 a显著增加的凋落物碳氮比以及SOM芳香族碳组分与多糖组分的比值表明凋落物以及SOM的化学性质比较稳定,更难被微生物分解利用,抑制了微生物活性以及微生物生物量合成。此外,难分解凋落物以及SOM组分导致微生物消耗更多的有机碳基质来产生胞外酶,用于有机质降解,而用于合成微生物生物量的碳基质降低,进而抑制了微生物残体的积累[33]。
3.2 不同土壤深度微生物残体的变化森林次生演替过程中有机质层土壤微生物残体的含量高于矿质层微生物残体的含量(图 2),主要归因于有机质层更高的营养(例如碳、氮);SOC以及土壤无机氮通过影响微生物生物量间接地影响了微生物残体的积累[34]。此外,从有机质层到矿质层,相对于细菌残体,真菌残体占微生物残体的比例降低(图 2b),图 2c))。不同土壤深度真菌以及细菌残体占微生物残体比例的差异可能由于真菌以及细菌对SOM的利用策略不同所导致[35]。在有机质层更高的土壤碳氮比以及难分解SOM组分(即芳香族碳组分/多糖组分),表明更多难利用的SOM组分有利于真菌的生长,真菌主导微生物群落;在矿质层,降低的土壤碳氮比以及增加的脂肪族、多糖组分导致微生物群落由真菌主导转变为细菌主导。因此,从有机质层到矿质层土壤微生物群落由真菌主导转变为细菌主导,进而导致真菌残体占微生物残体的比例下降,而细菌残体占微生物残体的比例增加。
尽管有机质层土壤微生物残体的含量高于矿质层微生物残体的含量,但有机质层微生物残体对SOC的贡献低于矿质层微生物残体的贡献(图 3)。不同土壤深度微生物熵(表征微生物对SOC基质的利用)的变化能解释有机质层和矿质层微生物残体对SOC贡献的不同。森林次生演替过程中,有机质层微生物对土壤碳基质的利用低于矿质层微生物对碳基质的利用,表明有机质层微生物仅仅能利用较少的SOM合成自身生物量,有机质层高的SOC主要来源于植物碳,微生物源碳贡献了较小的SOC;而在土壤矿质层,微生物能利用同化更多的SOM,导致更多微生物生物量合成,进而增加了微生物残体在SOC中的贡献。
4 结论微生物残体反映了微生物对环境变化的长期效应,对土壤有机碳(SOC)的存储具有重要作用。森林次生演替80~200 a促进了微生物残体的积累,而300 a微生物残体下降,归因于微生物对SOC以及其他营养(如氮)的可利用性。森林次生演替过程中真菌残体与微生物残体对SOC贡献呈正相关关系,而细菌残体与微生物残体对SOC贡献呈负相关关系,表明真菌残体的积累有利于SOC的存储。此外,从有机质层到矿质层微生物对SOC基质的利用差异导致真菌残体对SOC贡献的比例下降,而细菌残体对SOC贡献的比例增加。通过探究长期森林生态系统演替过程中微生物残体及其对SOC库的贡献,为从微生物代谢产物角度阐释生态系统碳动态提供理论参考。
致谢 感谢中国科学院长白山森林生态系统定位研究站何锡昌老师为试验样地选取提供的帮助。
| [1] |
Kallenbach C M, Frey S D, Grandy A S. Direct evidence for microbial-derived soil organic matter formation and its ecophysiological controls[J]. Nature Communications, 2016, 7: 13630. DOI:10.1038/ncomms13630
(  0) 0) |
| [2] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590. DOI:10.1111/gcb.14781
(  0) 0) |
| [3] |
Liang C, Cheng G, Wixon D L, et al. An Absorbing Markov Chain approach to understanding the microbial role in soil carbon stabilization[J]. Biogeochemistry, 2011, 106(3): 303-309. DOI:10.1007/s10533-010-9525-3
(  0) 0) |
| [4] |
Lauer F, Kösters R, du Preez C C, et al. Microbial residues as indicators of soil restoration in South African secondary pastures[J]. Soil Biology and Biochemistry, 2011, 43(4): 787-794. DOI:10.1016/j.soilbio.2010.12.012
(  0) 0) |
| [5] |
Hu G Q, Liu X, He H B, et al. Accumulation characteristics of amino sugars in salinized soils of different types in the Yellow River Delta (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(2): 390-398. [胡国庆, 刘肖, 何红波, 等. 黄河三角洲不同盐渍化土壤中氨基糖的积累特征[J]. 土壤学报, 2018, 55(2): 390-398.]
(  0) 0) |
| [6] |
Joergensen R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559-568. DOI:10.1007/s00374-018-1288-3
(  0) 0) |
| [7] |
Ni X Y, Liao S, Tan S Y, et al. A quantitative assessment of amino sugars in soil profiles[J]. Soil Biology and Biochemistry, 2020, 143: 107762. DOI:10.1016/j.soilbio.2020.107762
(  0) 0) |
| [8] |
Crouzeilles R, Curran M, Ferreira M S, et al. A global meta-analysis on the ecological drivers of forest restoration success[J]. Nature Communications, 2016, 7: 11666. DOI:10.1038/ncomms11666
(  0) 0) |
| [9] |
Deng L, Wang K B, Chen M L, et al. Soil organic carbon storage capacity positively related to forest succession on the Loess Plateau, China[J]. Catena, 2013, 110: 1-7. DOI:10.1016/j.catena.2013.06.016
(  0) 0) |
| [10] |
Shao P S, Liang C, Rubert-Nason K, et al. Secondary successional forests undergo tightly-coupled changes in soil microbial community structure and soil organic matter[J]. Soil Biology and Biochemistry, 2019, 128: 56-65. DOI:10.1016/j.soilbio.2018.10.004
(  0) 0) |
| [11] |
Smith A P, Marín-Spiotta E, Balser T. Successional and seasonal variations in soil and litter microbial community structure and function during tropical postagricultural forest regeneration: A multiyear study[J]. Global Change Biology, 2015, 21(9): 3532-3547. DOI:10.1111/gcb.12947
(  0) 0) |
| [12] |
Shao S, Zhao Y, Zhang W, et al. Linkage of microbial residue dynamics with soil organic carbon accumulation during subtropical forest succession[J]. Soil Biology and Biochemistry, 2017, 114: 114-120. DOI:10.1016/j.soilbio.2017.07.007
(  0) 0) |
| [13] |
Chu H Y, Sun H B, Tripathi B M, et al. Bacterial community dissimilarity between the surface and subsurface soils equals horizontal differences over several kilometers in the western Tibetan Plateau[J]. Environmental Microbiology, 2016, 18(5): 1523-1533. DOI:10.1111/1462-2920.13236
(  0) 0) |
| [14] |
Carvalhais N, Forkel M, Khomik M, et al. Global covariation of carbon turnover times with climate in terrestrial ecosystems[J]. Nature, 2014, 514(7521): 213-217. DOI:10.1038/nature13731
(  0) 0) |
| [15] |
Calderón F, Haddix M, Conant R, et al. Diffuse-reflectance Fourier-transform mid-infrared spectroscopy as a method of characterizing changes in soil organic matter[J]. Soil Science Society of America Journal, 2013, 77(5): 1591-1600. DOI:10.2136/sssaj2013.04.0131
(  0) 0) |
| [16] |
Vance E D, Brookes P C, Jenkinson D S. Microbial biomass measurements in forest soils: Determination of kC values and tests of hypotheses to explain the failure of the chloroform fumigation-incubation method in acid soils[J]. Soil Biology and Biochemistry, 1987, 19(6): 689-696. DOI:10.1016/0038-0717(87)90050-2
(  0) 0) |
| [17] |
Jia G M, Cao J, Wang C Y, et al. Microbial biomass and nutrients in soil at the different stages of secondary forest succession in Ziwulin, northwest China[J]. Forest Ecology and Management, 2005, 217(1): 117-125. DOI:10.1016/j.foreco.2005.05.055
(  0) 0) |
| [18] |
Zhang X D, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology and Biochemistry, 1996, 28(9): 1201-1206. DOI:10.1016/0038-0717(96)00117-4
(  0) 0) |
| [19] |
Engelking B, Flessa H, Joergensen R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil[J]. Soil Biology and Biochemistry, 2007, 39(8): 2111-2118. DOI:10.1016/j.soilbio.2007.03.020
(  0) 0) |
| [20] |
Wang X X, Zhang W, Zhou F, et al. Distinct regulation of microbial processes in the immobilization of labile carbon in different soils[J]. Soil Biology and Biochemistry, 2020, 142: 107723. DOI:10.1016/j.soilbio.2020.107723
(  0) 0) |
| [21] |
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter: Fourteen years on[J]. Soil Biology and Biochemistry, 2017, 105: A3-A8. DOI:10.1016/j.soilbio.2016.08.011
(  0) 0) |
| [22] |
Shao P S, Liang C, Lynch L, et al. Reforestation accelerates soil organic carbon accumulation: Evidence from microbial biomarkers[J]. Soil Biology and Biochemistry, 2019, 131: 182-190. DOI:10.1016/j.soilbio.2019.01.012
(  0) 0) |
| [23] |
Nakas J P, Klein D A. Decomposition of microbial cell components in a semi-arid grassland soil[J]. Applied and Environmental Microbiology, 1979, 38(3): 454-460. DOI:10.1128/AEM.38.3.454-460.1979
(  0) 0) |
| [24] |
Kaiser C, Franklin O, Dieckmann U, et al. Microbial community dynamics alleviate stoichiometric constraints during litter decay[J]. Ecology Letters, 2014, 17(6): 680-690. DOI:10.1111/ele.12269
(  0) 0) |
| [25] |
Sokol N W, Sanderman J, Bradford M A. Pathways of mineral-associated soil organic matter formation: Integrating the role of plant carbon source, chemistry, and point of entry[J]. Global Change Biology, 2019, 25(1): 12-24. DOI:10.1111/gcb.14482
(  0) 0) |
| [26] |
Liu N, Han J B, Zhao J R, et al. Soil organic carbon under typical vegetations at alpine timberline in Wutai Mountain (In Chinese)[J]. Soils, 2019, 51(5): 970-978. [刘楠, 韩进斌, 赵建儒, 等. 五台山高山林线典型植被土壤有机碳特征[J]. 土壤, 2019, 51(5): 970-978.]
(  0) 0) |
| [27] |
Li H B, Shi K, Xu D Y. Effects of plant process on soil organic carbon concentration (In Chinese)[J]. Chinese Journal of Applied Ecology, 2005, 16(6): 1163-1168. DOI:10.3321/j.issn:1001-9332.2005.06.037 [李鸿博, 史锟, 徐德应. 植物过程对土壤有机碳含量的影响[J]. 应用生态学报, 2005, 16(6): 1163-1168.]
(  0) 0) |
| [28] |
Kindler R, Miltner A, Richnow H, et al. Fate of gram-negative bacterial biomass in soil—mineralization and contribution to SOM[J]. Soil Biology and Biochemistry, 2006, 38(9): 2860-2870. DOI:10.1016/j.soilbio.2006.04.047
(  0) 0) |
| [29] |
Miltner A, Kindler R, Knicker H, et al. Fate of microbial biomass-derived amino acids in soil and their contribution to soil organic matter[J]. Organic Geochemistry, 2009, 40(9): 978-985. DOI:10.1016/j.orggeochem.2009.06.008
(  0) 0) |
| [30] |
Miltner A, Bombach P, Schmidt-Brücken B, et al. SOM Genesis: Microbial biomass as a significant source[J]. Biogeochemistry, 2012, 111(1/2/3): 41-55.
(  0) 0) |
| [31] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2(8): 17105. DOI:10.1038/nmicrobiol.2017.105
(  0) 0) |
| [32] |
Cui J, Zhu Z K, Xu X L, et al. Carbon and nitrogen recycling from microbial necromass to cope with C: N stoichiometric imbalance by priming[J]. Soil Biology and Biochemistry, 2020, 142: 107720. DOI:10.1016/j.soilbio.2020.107720
(  0) 0) |
| [33] |
Malik A A, Puissant J, Goodall T, et al. Soil microbial communities with greater investment in resource acquisition have lower growth yield[J]. Soil Biology and Biochemistry, 2019, 132: 36-39. DOI:10.1016/j.soilbio.2019.01.025
(  0) 0) |
| [34] |
Fierer N, Schimel J P, Holden P A. Variations in microbial community composition through two soil depth profiles[J]. Soil Biology and Biochemistry, 2003, 35(1): 167-176. DOI:10.1016/S0038-0717(02)00251-1
(  0) 0) |
| [35] |
Fanin N, Bertrand I. Aboveground litter quality is a better predictor than belowground microbial communities when estimating carbon mineralization along a land-use gradient[J]. Soil Biology and Biochemistry, 2016, 94: 48-60. DOI:10.1016/j.soilbio.2015.11.007
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


