2. 苏州工业园区环境监测站, 江苏苏州 215027;
3. 苏州高新区环境监测大队, 江苏苏州 215000
2. Environmental Monitoring Station of Suzhou Industrial Part, Suzhou, Jiangsu 215027, China;
3. Environmental Monitoring Brigade of Suzhou High-tech District, Suzhou, Jiangsu 215000, China
农业土壤污染已成为当前亟待解决的问题之一,多种污染物在土壤共存并互相作用促使土壤污染趋于多样化和复杂化,导致复合污染逐渐成为土壤污染的研究重点[1-2]。其中重金属(包括Cu、Zn)和抗生素常被广泛应用为饲料添加剂[3-6],但二者的施用可能导致特定微生物对其敏感性降低,减少畜禽对其他抗菌药物的易感性[4,6-7]。粪便改良农田可能具有加快土壤中抗生素和重金属共存积累和刺激土壤菌群抗生素抗性基因(Antibiotic resistance genes,ARGs)传播转移的风险[2,7-10],使土壤成为重金属、抗生素和ARGs的重要储存库之一,进而增加农作物和蔬菜的潜在健康风险[9-12]。此外,土壤生物活动主要由生态系统最重要组分之一的微生物来控制,从而导致微生物活性、多样性、群落结构和酶活性等常被建议作为土壤生态系统功能的评价指标[1,6,13-15]。
相关研究表明,重金属污染会明显影响土壤微生物、酶的活性,且不同类型、浓度重金属对土壤微生物多种功能的影响效果也会显现出较大差异性[16-17]。低浓度抗生素能促进土壤微生物呼吸,而环境浓度抗生素则不会显著影响微生物呼吸[18-19]。抗生素与重金属的络合、交互可能会对土壤微生物造成更大的毒性影响[4,9,11]。刘爱菊等[20]发现磺胺甲基嘧啶与Cu低剂量复合可能诱导土壤微生物对二者产生交互抗性,而高剂量复合污染则可能显著性地协同抑制土壤微生物生态功能。此外,环境中抗生素和重金属的释放均能够促进ARGs丰度增加;重金属与抗生素耐药性的传播间存在一定的联系[20-22]。Knapp等[21]对苏格兰土壤分析表明,土壤Cu浓度与tetM/W、blaOXA、ermB/F丰度有显著性相关关系。Cheng等[22]发现种植蔬菜、黑麦草土壤中tet ARGs丰度与四环素类抗生素浓度显著相关。
目前,国内外针对抗生素与重金属复合污染的研究所选取的抗生素类型多是青霉素、四环素、土霉素等,对强力霉素(Doxycycline,DOX)的研究还比较少[23-25]。DOX作为兽药因在抗菌效果、口服生物利用度等方面明显优于传统四环素类抗生素,与Cu一样被广泛应用于畜牧养殖业,导致其随畜禽粪便代谢的产物与残留在粪肥改良周围土壤中大量累积[26]。因此,研究DOX和Cu复合污染对土壤微生物呼吸、酶(脲酶、蔗糖酶和过氧化氢酶)活性、ARGs(tetA/C/G/M/W/X)丰度等土壤生态指标的影响,以期为土壤重金属和抗生素复合污染的生态风险评估和微生物预警体系建立等工作提供理论依据。
1 材料与方法 1.1 供试材料供试土壤样品为南京农业大学(32°01'46″N,118°50'22″E)采集的非农用裸土,随机选择三个间隔10 m的地块(范围0.5 m×0.5 m),去除1 cm表层土,收集1~20 cm土壤,风干研磨过2 mm筛备用[14-15]。土壤Cu背景值为47.71 mg·kg–1,pH为5.48±0.23,总有机碳为18.61±0.57 mg·kg–1,全氮为1.19±0.21 mg·kg–1,碳氮比为21.48±0.42,CEC为23.12±0.74 mol·kg–1。pH采用PHS-3E测定,土水比1︰5(w/v);全碳、全氮采用元素分析仪测定;CEC采用乙酸铵交换法测定[14-15,27]。
1.2 实验设计土壤样品分为三部分,加入并充分混合氯化铜溶液,使土壤中添加的Cu分别为0、100和400 mg·kg–1(以下记作Cu0、Cu100及Cu400),土壤含水量调整为18%,然后在25℃下活化48h。将三个上述Cu处理的土壤分为三部分,加入DOX溶液(98%美国药典级)使其浓度分别为0、8和15 mg·kg–1(以下记作DOX0、DOX8及DOX15),调整含水量至25%[15,27]。将处理后土壤样品放入宽口塑料瓶中,纤维膜密封,确保通风,减少水分蒸发,期间保持25℃和25%含水率恒温恒湿培养[14-15,27]。分别在培养1、3、7、15、22、30 d分析土壤微生物指标,不添加外源污染物的土壤定义为CK空白对照,处理方式及其标记见表 1。
|
|
表 1 外源污染物的添加浓度与处理组的标记方式 Table 1 Concentration of exogenous pollutants added and labeling of the treatments |
本研究采用底物诱导呼吸速率实验进行土壤样品培养。在培养1、3、7、15、22、30 d从各处理组分别称取12 g土样于塑料瓶中,加入葡萄糖(30 mg·g–1土样)与土壤充分混合以促进微生物呼吸,随后放置装有5 mL 0.2 mol·L–1 NaOH的玻璃瓶于塑料瓶中并密封,在28℃恒温培养12 h,呼吸剩余NaOH加入1.0 mol·L–1 BaCl2溶液后,用0.05 mol·L–1 HCl溶液进行滴定[14-15,27-28]。分别对各取样点土壤进行底物诱导呼吸速率实验,每次实验设置无土壤空白对照,每组3个重复。微生物呼吸强度(mg·12h–1)的计算公式表示为:
| $ 微生物呼吸强度\rm{=}\frac{\times }{\times \times }$ | (1) |
式中,V为HCl溶液的滴定值(L);C为盐酸溶液的摩尔浓度(mol·L–1);n为NaOH吸收溶液相对HCl滴定溶液的浓度倍数,取值4;M为CO2分子质量(mg·mol–1);t为底物诱导微生物呼吸实验的培养时间,12 h。
1.4 土壤酶活性分析通过3, 5-二硝基水杨酸比色法测定蔗糖酶活性,以通过每克干土24 h内产生的葡萄糖(mg)的量来表示[28-30]。通过苯酚钠比色法测定脲酶活性,表示为每克土壤24 h后残留NH3-N的质量(mg)[29]。通过高锰酸钾滴定检测过氧化氢酶活性,表示为每克干土1h内小消耗KMnO4体积(mL)[30]。
1.5 DNA提取和定量实时PCR(qPCR)分析对培养1、7、15、30 d的土壤样品提取DNA进行ARGs及微生物群落结构的测定。取约0.5 g土壤样品,根据FastDNA®Spin Kit(MP Biomedical,Santa Ana,California,USA)提供的实验操作流程提取土壤微生物DNA。提取的DNA用1% 的琼脂糖凝胶进行电泳,检测提取效果。并用紫外分光光度计ND-1000(Nano-Drop,美国)测定所提取DNA浓度及纯度[7,31-32]。提取所得到的有效DNA储存于–20 ℃冰箱,以备后续实验使用。
本次研究ARGs的测序采样HT-qPCR,选用7对引物,包含6对ARGs引物(tetA/C[33]、tetG/M/W/X[26])和1对16S rRNA gene引物(515F和907R)[32]。本实验采用SmartChip Real-time PCR Systems(WaferGen,美国)高通量荧光定量的反应平台。PCR定量体系为100 nL(1×LightCycler 480 SYBR Green I Master、1 mg·mL–1牛血清白蛋白(bovine serum albumin,BSA)、500 nmol·L–1引物以及5 ng·μL–1 DNA样品)。混合好的PCR体系由SmartChip纳米分配器分加到一个待用的SmartChip中,将密封SmartChip装到SmartChip循环仪中运行。ARGs定量PCR反应程序为:94 ℃预变性10 min;94 ℃变性40 s,退火温度对应上述顺序分别为58、54、68、55、64及57℃延伸30 s,40个循环,72℃再延伸10 min,4 ℃保存[26]。16S rRNA gene定量PCR反应程序为:95℃ 5 min;95℃ 15 s,60℃ 1 min,72 ℃ 20 s(40个循环);72℃ 4 min;4℃保存[7]。程序自动升温进行熔解曲线分析根据SmartChip Real-Time System的检测限和灵敏度。
将同一样本的PCR扩增的产物混合后用2% 琼脂糖凝胶做电泳检测,使用DNA凝胶回收试剂盒(天根生化科技(北京)有限公司)切胶回收PCR扩增得到的产物,洗脱;2%琼脂糖电泳检测。提取的质粒用紫外分光光度计测定浓度后,按10倍浓度梯度稀释系列(拷贝数从n×1010系列稀释至n×102),以拷贝数为横坐标,Ct值为纵坐标制作标准曲线。标准质粒拷贝数(C1)计算公式如下:
| $ {C_1} = \frac{{L{\rm{ \times }}C}}{{N{\rm{ \times }}M{\rm{ \times }}{{10}^9}}} $ | (2) |
耐药基因拷贝数(copies·g–1)的方法如下:
| $ 耐药基因拷贝数=\frac{{{C_1} \times V}}{{{M_1}}} $ | (3) |
式中,C1为标曲计算所得基因拷贝数(copies·μL–1);L为阿弗加德罗常数(6.02×1023);C为质粒DNA浓度(ng·μL–1);N为目标基因的模板长度(bp);M为每对DNA的平均分子量660;M1为土壤干重(g);V为洗脱DNA体积(μL)。
1.6 数据处理本研究数据统计结果用平均数±标准误(M±SE)表示,运用Excel 2016及SPSS 24.0进行数据分析,影响率=(处理组-CK)/CK×100%。采用方差分析(One-way ANOVA with LSD多重方差分析,Kruskal-Wallis test)进行差异显著性分析,采用Pearson系数进行相关性分析,显著水平P值设为0.05,极显著水平P值设为0.01。运用Origin 2017进行图像处理。
2 结果 2.1 铜和强力霉素污染对土壤微生物呼吸的影响本研究通过室内培养实验测定DOX、Cu单一及复合胁迫下土壤微生物呼吸强度,以此定量表征微生物活性。土壤微生物呼吸强度波动范围为0.61~16.21 mg·kg–1(图 1)。研究结果表明不同浓度DOX与Cu单一及复合污染在培养期内均会显著抑制土壤微生物呼吸强度(P < 0.05),且对微生物呼吸的抑制作用均在培养15/22 d最弱。此外,对于同一污染类型,微生物在培养初期(1 d)的呼吸强度均大于其在培养终期(30 d)的呼吸强度。

|
图 1 铜和强力霉素单一及复合污染对土壤微生物呼吸的影响 Fig. 1 Impacts of Cu and/or DOX pollution on respiration of soil microbes |
DOX单一污染在培养期会始终抑制对土壤微生物呼吸,抑制率在培养1 d最大。对于Cu单一污染,结果表明Cu400处理下微生物呼吸始终保持在较低水平,而Cu100处理下微生物呼吸强度在培养期内虽均低于CK,但随培养时间不断恢复增强。
对于Cu、DOX复合污染(见图 1),DOX8/15(+Cu100)单一/联合作用时的抑制率均在1 d达到最大,抑制率范围为81.47%~95.04%,且抑制强度均随时间先降低后加剧,DOX存在会加剧Cu100胁迫对微生物呼吸的抑制,且该抑制作用随DOX浓度升高增强。当DOX8/15+Cu400作用时,其在培养期间对土壤微生物呼吸维持较高的抑制作用,抑制率始终高于45%,且DOX8会加大Cu400对微生物呼吸的抑制作用,而DOX15培养期内一度缓解Cu400的该毒性作用。
2.2 铜和强力霉素污染对土壤酶活性的影响土壤酶活性常被用来衡量土壤中各种生化反应的动力和强度,是土壤肥力大小的重要标志[33]。土壤酶活性的改变一定程度可用来判断土壤受污染程度[26]。由上述污染对土壤微生物呼吸的影响可知,培养3 d多为微生物呼吸某一变化趋势的中间节点,故本研究通过在培养1、7、15、22、30 d测定脲酶、蔗糖酶及过氧化氢酶活性来比较处理间的效果差异。
由图 2可知,DOX单一污染培养期内均能明显促进土壤脲酶活性,激活率随时间逐渐升高,但两者浓度不同造成的激活率差异性不大。Cu100单一作用能促进脲酶活性;而Cu400单一作用对脲酶活性有抑制作用,抑制率在1d达到最大,但脲酶活性随时间能够基本恢复。对于Cu、DOX复合污染,其在1 d对脲酶活性为弱抑制作用,其中Cu100+DOX8/15与Cu400+DOX8复合在培养后期对脲酶活性转化为激活作用,但Cu400+DOX15处理后期仍表现出抑制作用。故上述类型污染对脲酶活性在培养期(1~30 d)均主要表现为促进作用,除Cu400+DOX15复合胁迫时在培养期对脲酶活性表现出较强的抑制作用,这可能是因为两者高浓度叠加所带来的毒性危害。
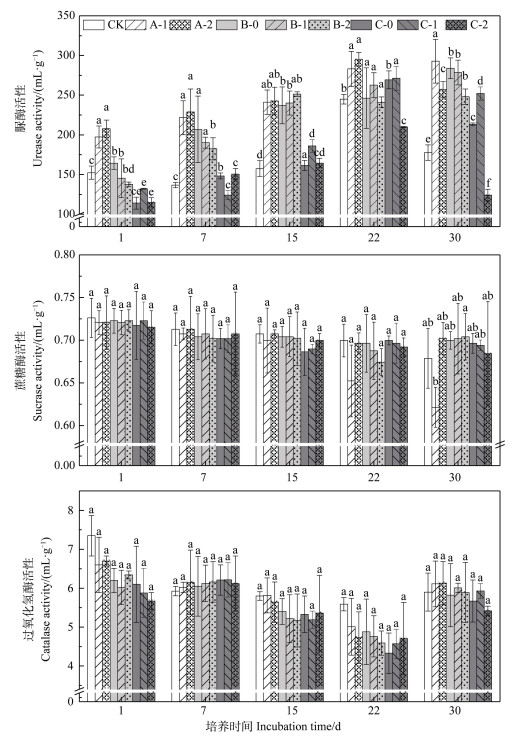
|
注:不同小写字母表示同一时间节点不同污染处理方式之间的差异性显著(P < 0.05)。 Note: Different lowercase letters represent significant differences between different treatments at the same time point(P < 0.05). 图 2 铜和强力霉素单一及复合污染对土壤脲酶、蔗糖酶及过氧化氢酶活性的影响 Fig. 2 Impacts of Cu and/or DOX pollution on activities of urease, sucrase and catalase in the soil |
DOX、Cu单一及复合污染对土壤蔗糖酶活性的影响见图 2。Cu、DOX单一及复合污染对蔗糖酶在培养期内主要为抑制作用,抑制强度随时间推移逐渐减弱,30 d基本恢复至初始水平。DOX单一处理对蔗糖酶活性整体呈抑制作用,DOX8对蔗糖酶活性的抑制率随时间逐渐增大;DOX15前期抑制酶活性,终期(30 d)激活蔗糖酶活性。单一Cu胁迫及其与DOX复合胁迫对蔗糖酶活性均呈现“抑制-激活”趋势。研究还发现Cu100+DOX8/15复合作用的修复转折点是22 d,而Cu400+DOX8/15复合作用修复转折点提前,为15 d。
培养期内,Cu、DOX单一及复合污染对过氧化氢酶活性主要表现为抑制作用,但该抑制强度要明显大于蔗糖酶(图 2),抑制强度随着培养时间逐渐减弱,且30 d基本均恢复至初始水平,即其能在30 d内恢复DOX、Cu单一及复合污染。培养期各处理方式下土壤过氧化氢酶活性的差异性并不显著,单一Cu胁迫使过氧化氢酶活性先降低后增加,激活转折点为7d,且激活强度相对较弱。复合污染处理中,仅Cu400+DOX15在30 d仍保持抑制作用,即DOX与Cu高浓度复合给过氧化氢酶活性带来不可逆毒性影响。
2.3 铜和强力霉素污染对抗生素抗性基因相对丰度的影响由于本研究对土壤系统中ARGs丰度的探究更强调Cu、DOX复合污染添加前后对其的影响差异性,但为确保该差异性的产生具有一定的合理性和过渡性,本研究又在培养前期和中期各增加一个检测点,即在培养1d、7d、15d和30d检测并计算各处理中的6种tet ARGs的相对丰度。本研究共检出tetA、tetC、tetG及tetW 4种ARGs(见图 3)。
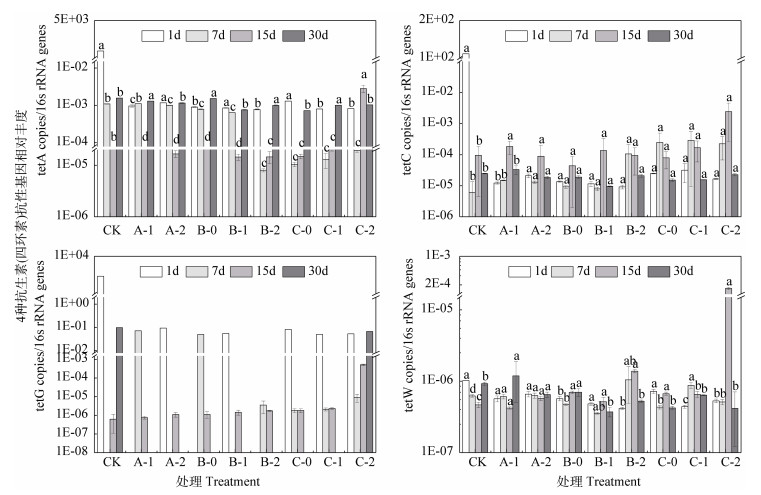
|
图 3 铜和强力霉素单一及复合污染对土壤抗生素抗性基因相对丰度的影响 Fig. 3 Impacts of Cu and/or DOX pollution on relative abundance of tetracycline resistance genes |
图 3表明,DOX、Cu单一及复合污染处理下,tetA相对丰度随时间基本呈先降低后增加的趋势,相对丰度最高值出现在培养1d的CK空白对照组,复合污染在培养7d、15d对tetA相对丰度的抑制大
于其余污染组。复合污染处理下,tetW相对丰度随时间先增加后降低,且该基因相对丰度的整体水平偏低于其他基因。此外,研究发现Cu400+DOX15在培养15d其tetA、tetW相对丰度上升约2个数量级,上升幅度远高于该时间点其余处理组。
对于检出的4种ARGs的总相对丰度(图 4),除DOX8与Cu100外,其余处理随培养时间的变化趋势为“降低-升高”,且ARGs总相对丰度在培养1d的水平基本均高于其在培养30d的水平,仅Cu400+DOX15复合在培养30d的ARGs总相对丰度略高于1d;而对DOX8、Cu100两种单一污染,ARGs总相对丰度随时间的变化趋势为“升高-降低-升高”。上述现象说明Cu、DOX单一及复合污染在培养中-后期均有一定的可能性会提高该tet ARGs的总相对丰度。所有处理中,Cu400+DOX15复合污染处理能在培养15d、30d显著提高ARGs的总丰度,且该丰度水平远高于其余处理。此外,研究发现tetA丰度对检出ARGs总相对丰度的贡献率远大于其他ARGs(图 3,图 4)。
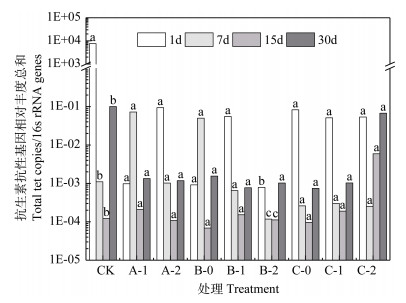
|
图 4 铜和强力霉素单一及复合污染对土壤抗生素抗性基因相对丰度总和的影响 Fig. 4 Impacts of Cu and/or DOX pollution on relative abundance of total tetracycline resistance genes |
目前,DOX和Cu广泛应用于治疗各种感染病导致其在畜禽粪便大量累积,且随着畜禽粪便作为有机肥料施用转移至农业土壤[20,26]。本研究中,强力霉素和铜单一和复合污染在培养期内均会显著抑制土壤微生物呼吸(P < 0.05)(图 1),其对微生物呼吸的抑制作用均在培养15/22 d表现最弱,且对于同一污染类型,微生物在培养末期的呼吸强度大于初期,这可能是土壤微生物在接受外源污染物时需要15 d以上的时间才能逐步适应变化并削弱污染物的负面影响,以在培养后期维持土壤生态系统的功能稳定[14-15]。
研究发现,相对于单一污染,复合污染在培养期间对微生物呼吸具有更强的抑制作用,且Cu400+DOX8/15复合污染对土壤微生物呼吸的抑制强度大于Cu100+DOX8/15(图 1),这与前人的相关研究结果类似[8,19,34]。这可能是由于复合污染条件下DOX能通过官能团与Cu2+发生络合反应,导致Cu、DOX与其形成的络合物能加大对土壤微生物的毒性作用,促使微生物的数量随着Cu100/400的添加而降低,降低幅度随Cu浓度增加而增大。另有相关研究表明土霉素、恩诺沙星、磺胺嘧啶与Cu复合能明显抑制细菌、真菌和放线菌的数量,且微生物数量随着Cu浓度增加逐渐减少,能有效支撑上述研究结果[24]。此外,Cu400+DOX8复合污染对土壤培养期间总微生物呼吸的抑制效应大于Cu400+DOX15,这可能是由于Cu400和DOX15的高浓度叠加会使微生物积极维持甚至刺激其呼吸作用,从而抵御高毒性或高浓度外源污染物的复合污染[23,35]。
3.2 铜和强力霉素对土壤酶活性的作用本研究发现,Cu、DOX单一污染在培养期内对脲酶活性主要为促进作用,Cu添加浓度与脲酶活性极显著正相关(P < 0.01)。李晓阳[26]施用含DOX粪肥改良土壤发现DOX能促进脲酶活性增高,孟庆峰等[28]发现低浓度Cd、Pb对脲酶活性有促进作用,一定程度能支持上述结果。Cu、DOX单一污染对蔗糖酶、过氧化氢酶活性主要为抑制作用,抑制作用随时间减弱甚至转为激活作用,Cu添加浓度与过氧化氢酶、蔗糖酶活性均显著负相关(P < 0.05,P < 0.01)。这与闫雷等[23]发现土壤培养实验中Cd对蔗糖酶活性的抑制率随时间先增大后减小,且Cu、Cd、Zn及Pb对蔗糖酶、过氧化氢酶活性多表现为抑制作用的结果相似[36-37]。此外,有研究发现OTC、SNR、SM2及ENR等抗生素单一污染对蔗糖酶、过氧化氢酶活性均表现出抑制作用[36,38],支持了本研究DOX污染能抑制蔗糖酶、过氧化氢酶活性的结论。
整体而言,复合污染物对于土壤酶活性的污染效应较单一污染物高(图 2),这可能与DOX能通过官能团与Cu2+发生络合反应,互相影响并改变其存在形态,从而使DOX、Cu复合时能对土壤酶活性产生协同促进/抑制作用[36]。研究发现Cu、DOX复合污染对脲酶活性多表现为先抑制后促进,但Cu400+DOX15复合胁迫对脲酶活性始终表现出强抑制作用,这可能是因为两者高浓度叠加会降低土壤脲酶专性微生物的数量、有机质含量等,导致脲酶毒性难以被修复。Cu、DOX复合污染对蔗糖酶、过氧化氢酶活性表现出抑制作用,这与前人通过土壤培养发现土霉素与Cd复合污染以及OTC、SNR、SM2与Cu复合污染对蔗糖酶、过氧化氢酶活性均表现出抑制作用,且抑制强度相较于抗生素单一污染更大的研究结果类似[23,36]。但DOX和Cu对土壤酶活性的复合污染效应,不管是协同作用还是拮抗作用,都并非各单一污染物毒性作用的加和,而是在各污染物间存在着复杂的交互作用,因此复合污染产生的抑制作用强弱还应与二者的交互作用类型有关,具体的影响机制有待进一步的研究。
3.3 铜和强力霉素污染条件下土壤微生物对污染物的适应性本研究发现,土壤微生物在应对DOX、Cu单一与复合外源胁迫时可能需要7~15 d的老化适应才能增强土壤微生物诱导产生抗性的能力,促使4种检出ARGs总相对丰度整体呈先降低后升高的趋势(图 4)。此外,研究中tet ARGs总丰度最高值出现在CK-1d(图 4),这可能是因为培养初期DOX与Cu的添加带来的环境选择压力会使土壤微生物的数量和结构发生变化,使抗性基因的潜在宿主减少[39],从而导致污染处理组ARGs的丰度在培养初期出现短暂降低。
在复合污染中,Cu400+DOX15复合对tet ARGs丰度的影响远大于其余处理(图 4),高浓度Cu的添加在培养中后期具有增强DOX诱导产生ARGs以提高其相对丰度的潜在能力,这可能是由于重金属在培养中后期适应环境后,可以促进金属和抗生素之间的金属桥接功能,使其能以存在共选择作用等方式降低外源抗生素的选择压力和丰度,并刺激ARG的增加[9,40]。de la Iglesia等[41]研究发现As、Cu等重金属和抗生素的复合污染可以增加环境中ARGs的丰度。张佳奇等[35]总结发现重金属污染地区的ARGs丰度随着重金属污染水平增加而增加。Wang等[42]类似研究表明恩诺沙星和Cd复合污染对氨氧化细菌amoA基因数的抑制率明显存在时间—效应关系,且复合污染具有更高的抑制率。Lin等[43]表明施肥土壤中ARGs丰度上升可能与Cu、Zn的积累密切相关。以上研究均有效支撑本文上述结果。
研究还发现,tetA和另三种tet基因(tetC、tetG和tetW)的相对丰度存在显著正相关关系(P < 0.05),表明tetA丰度变化在一定程度上可以表征其余三种抗性因的变化趋势。tetC丰度和tetW丰度、tetG丰度和tet ARGs总丰度存在极显著强正相关关系(P < 0.01),其相关系数分别为0.985和0.999,表明上述两两基因类型在某种程度上可以互相表达其丰度水平,但这些基因之间是否存在确切的指代关系仍需更多的研究来证明。
4 结论土壤培养条件下,Cu与DOX单一及复合污染会显著抑制土壤微生物呼吸(P < 0.05),其对脲酶活性主要为促进作用,对蔗糖酶、过氧化氢酶活性主要表现为抑制作用。相对于单一污染,复合污染对土壤微生物呼吸、酶活性及抗性基因丰度的影响程度更明显,其中Cu400+DOX8复合对酶活性的影响程度更为明显。此外,外源DOX、Cu添加带来的环境变化在培养初期会使土壤微生物数量和结构发生变化,使抗性基因的潜在宿主减少,从而导致培养初期抗性基因丰度会出现短暂降低,且添加高浓度Cu会潜在提高DOX在培养终期诱导产生ARGs的能力水平,提高tet基因的相对丰度。
| [1] |
Zhou J H, Huang R X, Fan H B, et al. A review on the progresses of remediation technologies for contaminated soil (In Chinese)[J]. Research of Soil and Water Conservation, 2016, 23(3): 366-372. [周际海, 黄荣霞, 樊后保, 等. 污染土壤修复技术研究进展[J]. 水土保持研究, 2016, 23(3): 366-372.]
(  0) 0) |
| [2] |
Chen L K, Ma T T, Pan X, et al. Sorption behavior of oxytetracycline in complex contaminated soil and its effects on desorption of heavy metals in the soil (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(1): 104-111. [陈励科, 马婷婷, 潘霞, 等. 复合污染土壤中土霉素的吸附行为及其对土壤重金属解吸影响的研究[J]. 土壤学报, 2015, 52(1): 104-111.]
(  0) 0) |
| [3] |
Bernhardt E S, Palmer M A. The environmental costs of mountaintop mining valley fill operations for aquatic ecosystems of the Central Appalachians[J]. Annals of the New York Academy of Sciences, 2011, 1223(1): 39-57. DOI:10.1111/j.1749-6632.2011.05986.x
(  0) 0) |
| [4] |
Ji X L, Shen Q H, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai; China[J]. Journal of Hazardous Materials, 2012, 235/236: 178-185. DOI:10.1016/j.jhazmat.2012.07.040
(  0) 0) |
| [5] |
Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics(VAs) in the environment[J]. Chemosphere, 2006, 65(5): 725-759. DOI:10.1016/j.chemosphere.2006.03.026
(  0) 0) |
| [6] |
Poole K. At the nexus of antibiotics and metals: The impact of Cu and Zn on antibiotic activity and resistance[J]. Trends in Microbiology, 2017, 25(10): 820-832. DOI:10.1016/j.tim.2017.04.010
(  0) 0) |
| [7] |
Chen Q L, An X L, Li H, et al. Long-term field application of sewage sludge increases the abundance of antibiotic resistance genes in soil[J]. Environment International, 2016, 92/93: 1-10. DOI:10.1016/j.envint.2016.03.026
(  0) 0) |
| [8] |
Xu Y G, Yu W T, Ma Q, et al. The combined effect of sulfadiazine and copper on soil microbial activity and community structure[J]. Ecotoxicology and Environmental Safety, 2016, 134: 43-52. DOI:10.1016/j.ecoenv.2016.06.041
(  0) 0) |
| [9] |
Xue X M, Zhu Y G. Arsenic biotransformation in soils and its relationship with antibiotic resistance (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(4): 763-772. [薛喜枚, 朱永官. 土壤中砷的生物转化及砷与抗生素抗性的关联[J]. 土壤学报, 2019, 56(4): 763-772.]
(  0) 0) |
| [10] |
Kyselková M, Kotrbová L, Bhumibhamon G, et al. Tetracycline resistance genes persist in soil amended with cattle feces independently from chlortetracycline selection pressure[J]. Soil Biology & Biochemistry, 2015, 81: 259-265.
(  0) 0) |
| [11] |
Hu X G, Zhou Q X, Luo Y. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, Northern China[J]. Environmental Pollution, 2010, 158(9): 2992-2998. DOI:10.1016/j.envpol.2010.05.023
(  0) 0) |
| [12] |
Wang L L, Oda Y, Grewal S, et al. Persistence of resistance to erythromycin and tetracycline in swine manure during simulated composting and lagoon treatments[J]. Microbial Ecology, 2012, 63(1): 32-40. DOI:10.1007/s00248-011-9921-9
(  0) 0) |
| [13] |
Zielezny Y, Groeneweg J, Vereecken H, et al. Impact of sulfadiazine and chlorotetracycline on soil bacterial community structure and respiratory activity[J]. Soil Biology & Biochemistry, 2006, 38(8): 2372-2380.
(  0) 0) |
| [14] |
Chen X Y, Yang H Z, Chen Q J, et al. Correlation between microbial community structure and soil ecosystem functional stability under heavy metal stress (In Chinese)[J]. Environmental Chemistry, 2017, 36(2): 356-364. [陈欣瑶, 杨惠子, 陈楸健, 等. 重金属胁迫下不同区域土壤的生态功能稳定性与其微生物群落结构的相关性[J]. 环境化学, 2017, 36(2): 356-364.]
(  0) 0) |
| [15] |
Chen X Y, Yang H Z, Li M, et al. Mechanism of soil eco-functional stability under pyrene/cadmium simplex and combined pollution stress (In Chinese)[J]. Environmental Science, 2017, 38(1): 352-360. [陈欣瑶, 杨惠子, 李敏, 等. 芘、镉单一及复合污染胁迫下土壤生态功能稳定性的影响机制[J]. 环境科学, 2017, 38(1): 352-360.]
(  0) 0) |
| [16] |
Sun X B, Li Y C. Impact of heavy metal pollution on soil animal communities in abandoned coal mine area in Huainan City, Anhui Province (In Chinese)[J]. Chinese Journal of Ecology, 2014, 33(2): 408-414. [孙贤斌, 李玉成. 淮南煤矿废弃地重金属污染对土壤动物群落的影响[J]. 生态学杂志, 2014, 33(2): 408-414.]
(  0) 0) |
| [17] |
唐伟. 铜污染对土壤呼吸和酶活性的影响[D]. 武汉: 湖北大学, 2014. Tang W. Effects of copper pollution on soil respiration and enzyme activities[D]. Wuhan: Hubei University, 2014. (  0) 0) |
| [18] |
Liu W, Wang H, Chen X J, et al. Progress on degradation of antibiotics in environment (In Chinese)[J]. Progress in Veterinary Medicine, 2009, 30(3): 89-94. [刘伟, 王慧, 陈小军, 等. 抗生素在环境中降解的研究进展[J]. 动物医学进展, 2009, 30(3): 89-94.]
(  0) 0) |
| [19] |
Liu A J, Cao H S, Yang Y, et al. Combinational effects of sulfomethoxazole and copper on soil microbial community and function[J]. Environmental Science and Pollution Research, 2016, 23(5): 4235-4241. DOI:10.1007/s11356-015-4892-x
(  0) 0) |
| [20] |
Liu A J, Liu M, Li M H, et al. Collaborative effects of Cu and antibiotic on soil microbial activities (In Chinese)[J]. Ecology and Environmental Sciences, 2013, 22(11): 1825-1829. DOI:10.3969/j.issn.1674-5906.2013.11.014 [刘爱菊, 刘敏, 李梦红, 等. Cu、抗生素协同污染对土壤微生物活性的影响[J]. 生态环境学报, 2013, 22(11): 1825-1829.]
(  0) 0) |
| [21] |
Knapp C W, Callan A C, Aitken B, et al. Relationship between antibiotic resistance genes and metals in residential soil samples from Western Australia[J]. Environmental Science and Pollution Research, 2017, 24(3): 2484-2494. DOI:10.1007/s11356-016-7997-y
(  0) 0) |
| [22] |
Cheng W X, Li J N, Wu Y, et al. Behavior of antibiotics and antibiotic resistance genes in eco-agricultural system: A case study[J]. Journal of Hazardous Materials, 2016, 304: 18-25. DOI:10.1016/j.jhazmat.2015.10.037
(  0) 0) |
| [23] |
Yan L, Bi S X, Zhao Q H, et al. Effects of oxytetracycline and Cd pollution on soil respiration and enzyme activity (In Chinese)[J]. Bulletin of Soil and Water Conservation, 2014, 34(6): 101-108. [闫雷, 毕世欣, 赵启慧, 等. 土霉素及镉污染对土壤呼吸及酶活性的影响[J]. 水土保持通报, 2014, 34(6): 101-108.]
(  0) 0) |
| [24] |
魏子艳. 土霉素、恩诺沙星、磺胺二甲嘧啶与铜单一及复合污染对土壤微生物的影响[D]. 山东泰安: 山东农业大学, 2014. Wei Z Y. . Single and joint toxicity of oxytetracycline, enrofloxacin, sulfadimidine and Cu on soil microorganism[D]. Taian, Shandong: Shandong Agricultural University, 2014. (  0) 0) |
| [25] |
赵保真. Cu-磺胺嘧啶单一及复合污染的生态毒性效应研究[D]. 河南新乡: 河南师范大学, 2012. Zhao B Z. Study of the ecology toxic effects of single and combined pollution of Cu and sulfadiazine[D]. Xinxiang, Henan: Henan Normal University, 2012. (  0) 0) |
| [26] |
李晓阳. 兽用抗生素强力霉素与土壤微生物的互作效应[D]. 广州: 华南农业大学, 2016. Li X Y. The interaction effects between doxycycline and soil microbial[D]. Guangzhou: South China Agricultural University, 2016. (  0) 0) |
| [27] |
Zhang Y, Deng H, Xue H J, et al. The effects of soil microbial and physiochemical properties on resistance and resilience to copper perturbation across China[J]. Catena, 2016, 147: 678-685. DOI:10.1016/j.catena.2016.08.031
(  0) 0) |
| [28] |
Meng Q F, Yang J S, Yao R J, et al. Influence of single and combined pollutions of heavy metal on soil enzyme activity (In Chinese)[J]. Ecology and Environmental Sciences, 2012, 21(3): 545-550. [孟庆峰, 杨劲松, 姚荣江, 等. 单一及复合重金属污染对土壤酶活性的影响[J]. 生态环境学报, 2012, 21(3): 545-550.]
(  0) 0) |
| [29] |
Zhou L K, Zhang Z M. Determination of soil enzyme activity (In Chinese)[J]. Chinese Journal of Soil Science, 1980, 11(5): 37-38, 49. [周礼恺, 张志明. 土壤酶活性的测定方法[J]. 土壤通报, 1980, 11(5): 37-38, 49.]
(  0) 0) |
| [30] |
Zhang L D, Li C R, Liu Y, et al. Effects of different modes of vegetation restoration on soil heavy metal contents and soil enzyme activities: A case study in damaged mountain body in Sibaoshan County, Zibo City, Shandong Province (In Chinese)[J]. Science of Soil and Water Conservation, 2012, 10(3): 87-92. [张刘东, 李传荣, 刘云, 等. 植被恢复模式对土壤重金属质量分数和土壤酶活性的影响——以山东省淄博市四宝山破坏山体为例[J]. 中国水土保持科学, 2012, 10(3): 87-92.]
(  0) 0) |
| [31] |
王凤花. 再生水回用和畜禽粪便施用对土壤中抗生素抗性基因的影响[D]. 北京: 中国科学院大学, 2014. Wang F H. The impact of reclaimed water irrigation and manure application on antibiotic resistance genes in soil[D]. Beijing: University of Chinese Academy of Sciences, 2014. (  0) 0) |
| [32] |
Ouyang W Y, Huang F Y, Zhao Y, et al. Increased levels of antibiotic resistance in urban stream of Jiulongjiang River, China[J]. Applied Microbiology and Biotechnology, 2015, 99(13): 5697-5707. DOI:10.1007/s00253-015-6416-5
(  0) 0) |
| [33] |
Lin K F, Xu X Q, Zheng L, et al. Eco-toxicological effects of Ge-pollution on soil enzyme activities in soil (In Chinese)[J]. Acta Pedologica Sinica, 2005, 42(1): 106-110. [林匡飞, 徐小清, 郑利, 等. 土壤锗污染对土壤酶活性的生态毒理效应[J]. 土壤学报, 2005, 42(1): 106-110.]
(  0) 0) |
| [34] |
Efthimiadou E K, Sanakis Y, Raptopoulou C P, et al. Crystal structure, spectroscopic, and biological study of the copper(Ⅱ) complex with third-generation quinolone antibiotic sparfloxacin[J]. Bioorganic & Medicinal Chemistry Letters, 2006, 16(14): 3864-3867.
(  0) 0) |
| [35] |
Zhang J Q, Xu Y, Luo Y, et al. Co-selection mechanisms of bacterial resistance to heavy metals and antibiotics (In Chinese)[J]. Journal of Agro-Environment Science, 2016, 35(3): 409-418. [张佳奇, 徐艳, 罗义, 等. 重金属协同选择环境细菌抗生素抗性及其机制研究进展[J]. 农业环境科学学报, 2016, 35(3): 409-418.]
(  0) 0) |
| [36] |
毛书帅. 三种抗生素和铜单一及复合污染对土壤酶和微生物群落功能多样性的影响[D]. 山东泰安: 山东农业大学, 2016. Mao S S. Single and joint toxicity of three kinds of antibiotics and copper on soil enzyme activity and microbial community function diversity[D]. Taian, Shandong: Shandong Agricultural University, 2016. (  0) 0) |
| [37] |
Yang Z X, Liu S Q. Effects of single element and compound pollution of Cd, Zn and Pb on soil enzyme activities (In Chinese)[J]. Soil and Environmental Sciences, 2000, 9(1): 15-18. [杨志新, 刘树庆. Cd、Zn、Pb单因素及复合污染对土壤酶活性的影响[J]. 土壤与环境, 2000, 9(1): 15-18.]
(  0) 0) |
| [38] |
闫赛红. 恩诺沙星与镉单一及复合污染对土壤微生物群落结构和功能的影响[D]. 山东泰安: 山东农业大学, 2015. Yan S H. Single and joint toxicity of enrofloxacin and Cd on soil microbial community structure and function[D]. Taian, Shandong: Shandong Agricultural University, 2015. (  0) 0) |
| [39] |
孙依欣. 含镉和环丙沙星有机肥对生菜中抗性基因及微生物群落的影响[D]. 陕西杨凌: 西北农林科技大学, 2017. Sun Y X. Effects of compost containing cadmium and ciprofloxacin on antibiotic resistance genes and microbial community in lettuce[D]. Yangling, Shaanxi: Northwest A & F University, 2017. (  0) 0) |
| [40] |
Zhang B, Wang M M, Wang B, et al. The effects of bio-available copper on macrolide antibiotic resistance genes and mobile elements during tylosin fermentation dregs co-composting[J]. Bioresource Technology, 2018, 251: 230-237.
(  0) 0) |
| [41] |
de la Iglesia R, Valenzuela-Heredia D, Pavissich J P, et al. Novel polymerase chain reaction primers for the specific detection of bacterial copper P-type ATPases gene sequences in environmental isolates and metagenomic DNA[J]. Letters in Applied Microbiology, 2010, 50(6): 552-562.
(  0) 0) |
| [42] |
Wang J H, Wang L J, Zhu L S, et al. Individual and combined effects of enrofloxacin and cadmium on soil microbial biomass and the ammonia-oxidizing functional gene[J]. Science of the Total Environment, 2018, 624(6): 900-907.
(  0) 0) |
| [43] |
Lin H, Sun W C, Zhang Z L, et al. Effects of manure and mineral fertilization strategies on soil antibiotic resistance gene levels and microbial community in a paddy-upland rotation system[J]. Environmental Pollution, 2016, 211: 332-337.
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


