土壤微生物是凋落物分解的主要参与者,在土壤物质转换、能量流动、生物地球化学循环过程,如有机质分解,养分循环等[1-2]中具有极其重要的作用。土壤微生物对外界条件变化敏感,可反映土壤养分状况。前期研究发现,有些土壤中,土壤微生物生物量占土壤总有机碳的5%左右[3]。由于真菌C/N比值高于细菌(15 vs 5),较高的真菌细菌比值被用来指示较高的土壤碳储存能力[4-5]。革兰氏阴性细菌偏向于利用新鲜有机碳,而革兰氏阳性细菌利用大量难以分解的碳[6]。实验研究发现,革兰氏阳性与阴性细菌比值会随着土壤碳有效性的增加而降低,因此该比值可以用来指示土壤碳的有效性或细菌群落受到能量胁迫[7]。
凋落物质量主要指凋落物的化学属性,其评价指标主要包括凋落物中易分解成分碳、氮、磷等物质以及难分解的有机成分木质素、多酚类物质等的含量、组合情况和比例结构[8]。一般而言,较高质量的凋落物(低C/N、木质素/N比值)分解速率高于较低质量的凋落物(高C/N、木质素/N比值)。实验研究发现,添加高质量凋落物会增加土壤微生物生物量,激发如革兰氏阴性细菌等富营养微生物群落活性[9-10],而添加低质量的凋落物则会激发如革兰氏阳性细菌等贫营养微生物群落的生长[11]。有研究表明,不同凋落物质量对土壤理化性质和微生物生物量影响存在差异[12]。Huang等[13]对两种树种进行凋落物交换实验并认为凋落物质量可能是导致土壤微生物生物量差异的原因,但凋落物质量同微生物生物量及群落组成间的关系仍有待进一步验证和解释。以往凋落物质量的评价指标主要是其碳、氮及木质素含量,凋落物中的有机碳库组分却很少研究。有研究表明凋落物有机碳组分影响着凋落物的分解过程,利用核磁共振技术(NMR),分析凋落物中有机碳结构的差异,有助于人们进一步认识凋落物分解并试图从中发现新的凋落物质量评价指标。
杉木是中国亚热带地区主要的造林树种,种植面积广泛。研究发现杉木多年连栽导致地力衰退、土壤肥力下降等问题[14]。近年来,在杉木立地上转换造林树种成为改善杉木土壤肥力下降问题的重要举措。但是如何筛选出适宜的造林树种,提高土壤质量是当前亟待解决的重要问题。前期研究主要集中在凋落物的分解对土壤有机质和微生物群落组成的影响[15-16]。而关于凋落物质量如何影响土壤有机质及微生物群落组成的影响研究还相对较少。因此,本研究以7年生二代杉木人工林生态系统为研究对象,选择8种不同凋落物质量的树种—毛竹(Phyllostachys heterocycla)、马尾松(Pinus massoniana),桉树(Eucalyptus robusta)、杉木(Cunninghamia lanceolate)、樟树(Cinnamomum camphora)、木荷(Schima superba)、火力楠(Michelia macclurei)、米老棑(Mytilaria laosensis),在杉木人工林内进行原位分解三年后,(1)指示不同凋落物质量指标对土壤微生物影响的差异,量化土壤微生物对不同凋落物质量添加的响应;(2)初步明确不同质量凋落物的添加影响土壤微生物的机制,旨在进一步加强有关凋落物对土壤生态过程和功能影响的了解,为合理经营和恢复杉木人工林土壤质量提供理论依据与实践指导。
1 材料与方法 1.1 试验地概况及设计试验样地位于福建省南平市峡阳林场(26°48′ N,117°59′ E),地处武夷山脉东南侧、闽江上游,海拔高度229~246 m。该区属中亚热带季风气候,年均温20.0 ℃,年均降水量1 644 mm,年均蒸发量1 370 mm,年均相对湿度75.2%。土壤主要为石英黑云母片发育的山地红壤。杉木林土壤本底值见表 1。
|
|
表 1 7年生杉木人工林土壤本底值(平均值±标准差,n=6) Table 1 Soil background value of the 7-year-old Cunninghamia lanceolate plantation(means ± SD. n=6) |
2013年9月,在7年生杉木人工林样地采用完全随机区组方法,设置6个区组,每个区组设置8种处理(即分别添加毛竹、马尾松、桉树、杉木、樟树、木荷、火力楠、米老排8个树种的凋落物),共48个小区,每个小区面积为3 m × 3 m。凋落物全碳、全氮含量和C/N用元素分析仪(Elemental EL MAX CNS analyzer,德国)测定。并采用酸性洗涤法ADF测定不同凋落物的纤维素和木质素浓度。凋落物初始性质见表 2。碳化学组分采用13C固体核磁共振波谱(13C CPMAS NMR)法测定实验条件:25 ℃,氧化硅转子转速5 kHz,接触时间2 ms,接受时间13 ms,重复延迟时间2.5 s。不同凋落物中碳化学组成见表 3。
|
|
表 2 供试凋落物性质(平均值±标准差,n=6) Table 2 Properties of the litters used in the experiment(means ± SD. n=6) |
|
|
表 3 不同凋落物中碳化学组成相对比例 Table 3 Relative proportions of the chemical components of the carbon in litter relative to type of litter/% |
根据2012年3月至2013年3月在同块样地收集的杉木人工林凋落物的数据,得到杉木人工林凋落物平均每月生产力为0.5 kg·m-2,按此量来添加凋落物量。2013年9月至2015年3月,每月定期在相应处理小区添加凋落物,均匀覆盖在小区土壤表面。
1.2 土壤样品采集与测定2016年1月,在凋落物添加处理3年后,避开人为干扰和树干径流,在各试验小区内移除地被物后用PVC管沿S形钻取6个土样(0~10 cm),并混合成一个样品,用冰盒快速转移至实验室,去除砂石、根系碎屑等并过2 mm筛。一部分土样冻干后采用磷脂脂肪酸(Phospholipid Fatty Acid,PLFA)生物标记法进行分析。磷脂脂肪酸在White等[17]方法的基础上,参考Bossio和Scow等[18]优化的步骤进行提取,最后将得到的磷脂脂肪酸甲酯化,在气相色谱仪(Agilent 7890A)上采用MIDI系统软件进行分析,测定磷脂脂肪酸各组分的含量。
称取10 g新鲜土样加入40 mL的2 mol·L-1 KCl溶液浸提,振荡0.5 h后并4 000 r·min-1离心10 min,过0.45 μm玻璃纤维滤膜,滤液采用连续流动分析仪(Skalar San++,荷兰)测定土壤铵态氮(NH4+-N)、硝态氮(NO3--N)。将部分土壤在室温下自然风干,并取部分土样过0.149 mm筛,用以测定土壤全碳、全氮含量和pH等。土壤pH用pH计测定(土水比1:2.5);土壤全碳、全氮含量和C/N采用德国Elementar公司生产的碳氮元素分析仪(Vario Max)测定。
1.3 数据处理数据录入和统计处理基于Excel 2013进行,相关分析及方差分析基于SPSS 22.0软件进行,使用Origin9.0作图。采用LSD最小显著差数法对凋落物性质和土壤理化特性进行差异显著性的比较,采用单因素方差分析(One-way ANOVA)来检验不同凋落物添加处理对土壤微生物生物量和群落结构的影响,显著水平设为α = 0.05。采用多元统计分析软件Canoco 5.0进行冗余分析,来检验土壤及凋落物等环境变量与土壤微生物群落结构之间的相关性。
2 结果 2.1 不同质量凋落物添加下土壤理化性质的比较不同凋落物添加下对土壤理化性质产生的影响不同(表 4)。8种凋落物添加下土壤碳氮比为12.80~13.72,不同凋落物添加处理下的土壤碳氮比未产生显著差异(P > 0.05)。添加高质量凋落物如马尾松、毛竹、桉树等土壤pH与低质量凋落物添加下土壤pH相比差异不显著。与杉木凋落物添加相比,除樟树凋落物添加外,其他凋落物添加均使得土壤pH表现出下降趋势。添加高质量凋落物土壤全碳、全氮差异较小,马尾松凋落物添加下土壤全碳、全氮显著低于杉木凋落物添加。除米老棑凋落物添加外,高质量凋落物添加下土壤铵态氮的含量显著降低。土壤硝态氮含量毛竹与火力楠凋落物添加下的差异不显著,但明显高于其他凋落物添加。毛竹添加下土壤矿质氮含量显著高于其他凋落物添加。
|
|
表 4 不同凋落物添加处理下土壤化学性质的变化 Table 4 Chemical properties of the soil relative to treatment |
8种凋落物添加下对土壤微生物脂肪酸生物量的影响不同(图 1)。通过土壤微生物PLFA图谱发现,不同质量凋落物添加下土壤的微生物种类和数量差异明显。桉树凋落物添加下,土壤磷脂脂肪酸总量显著高于其他凋落物添加,较杉木凋落物添加多27%。樟树凋落物添加下土壤磷脂脂肪酸总量最低,较杉木凋落物添加少29%。桉树凋落物添加下,革兰氏阳性细菌和革兰氏阴性细菌都显著高于其他凋落物添加,分别较杉木凋落物添加35%和19%。樟树凋落物下革兰氏阴性细菌量最低,较杉木凋落物添加少10%。桉树凋落物添加下细菌和真菌量最多,分别较杉木凋落物添加多25%和44%。樟树凋落物添加下放线菌量最少,较杉木凋落物添加少32%,其他凋落物添加下放线菌没有显著差异。总体而言,添加桉树凋落物增加土壤磷脂脂肪酸总量、细菌和真菌生物量以及革兰氏阳性和阴性细菌生物量,而添加樟树凋落物显著降低土壤磷脂脂肪酸总量、细菌、真菌、放线菌、革兰氏阳性和阴性细菌生物量。
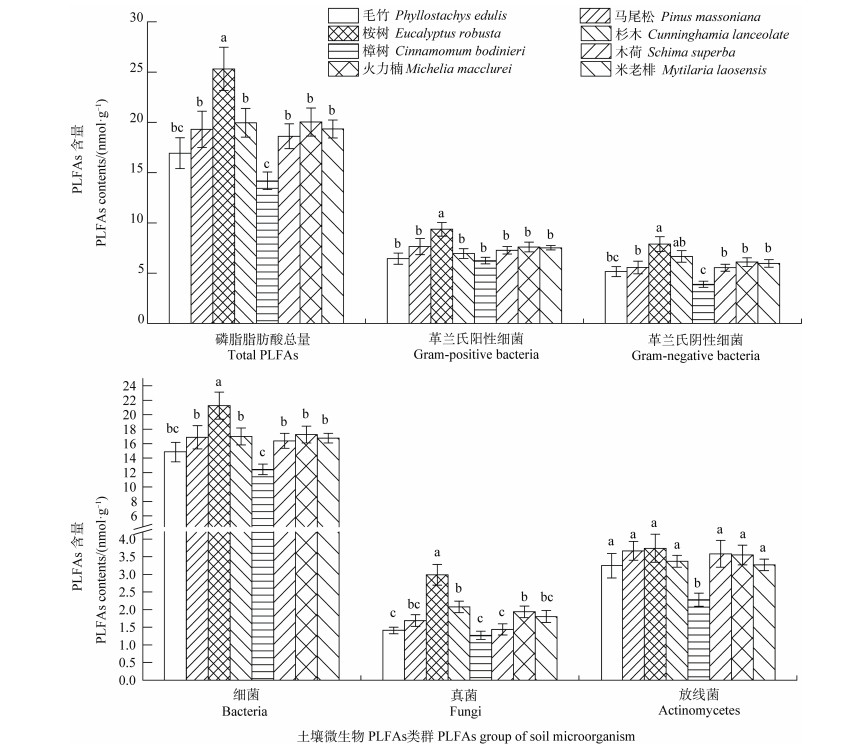
|
注:图中误差线为标准误;处理间无相同小写字母表示差异达到显著水平(P < 0.05),n=6。下同。Note:The error bars in the figure are standard error. Different letters indicated significant difference at 0.05 level between treatments. The same below. 图 1 不同树种凋落物添加下土壤微生物的特征PLFAs含量 Fig. 1 PLFAs content of soil microbial community in the soil relative to treatment |
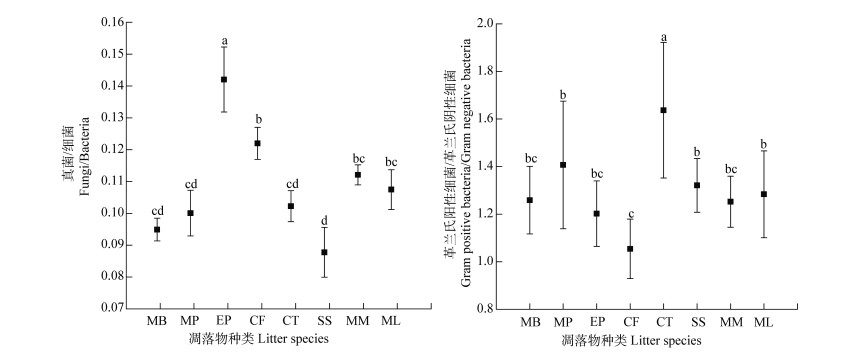
|
MB,毛竹;MP,马尾松;EP,桉树;CF,杉木;CT,樟树;SS,木荷;MM,火力楠;ML,米老棑。 图 2 不同凋落物添加下土壤中真菌/细菌、革兰氏阳性细菌/革兰氏阴性细菌比值 Fig. 2 Fungi/bacteria ratio and Gram-positive bacteria/Gram-negative bacteria ratio in the soil relative to treatment |
不同凋落物添加下真菌与细菌、革兰氏阳性细菌与革兰氏阴性细菌的比例存在显著性差异(P < 0.05)。桉树凋落物添加显著高于其他凋落物添加下真菌/细菌比值,除桉树、木荷的真菌/细菌外,其他凋落物添加下真菌/细菌无明显差异。樟树凋落物添加下的革兰氏阳性细菌/革兰氏阴性细菌(G+/G-)显著高于其他凋落物添加下革兰氏阳性细菌/革兰氏阴性细菌(G+/G-),除樟树、杉木的革兰氏阳性细菌/革兰氏阴性细菌(G+/G-),其他凋落物添加下无明显差异。
2.3 土壤微生物群落组成与土壤化学性质及凋落物质量的相关分析对微生物群落组成与凋落物质量的相关性分析(表 5),结果表明,凋落物碳含量与土壤中革兰氏阳性细菌、真菌呈极显著正相关(P < 0.01),与脂肪酸总量、革兰氏阴性细菌和菌根真菌呈显著正相关(P < 0.05)。
|
|
表 5 不同凋落物添加下土壤微生物PLFAs与凋落物质量及有机碳组分的相关性 Table 5 Correlation between PLFAs of soil microorganisms, litter quality and organic carbon components relative to treatment |
基于相关性分析探讨有机碳化学组分结构与土壤微生物的关系(表 5),其中烷基碳、烷基碳/氧烷基碳与脂肪酸总量、革兰氏阳性细菌、革兰氏阴性细菌、细菌、真菌及真菌/细菌比均呈极显著正相关(P < 0.01),与革兰氏阳性阴性细菌比均呈极显著负相关(P < 0.01)。氧烷基碳与乙缩醛与脂肪酸总量、革兰氏阳性细菌、革兰氏阴性细菌、细菌、真菌及真菌/细菌比均呈极显著负相关(P < 0.01)。甲氧基碳、氧烷基碳和芳碳与革兰氏阳性阴性细菌比呈显著正相关(P < 0.05)。
为进一步探讨土壤微生物群落组成与土壤化学性质及凋落物质量之间的关系,进行了冗余分析。从图 3可知,其中第1主轴共解释了50.6%的变异;第2主轴解释了46.7%的变异。所有的环境因子中,对土壤微生物群落结构产生显著影响的分别为Alkyl C(烷基碳)(P = 0.036)和土壤全氮(P=0.04)。物种变量和环境变量的关系表明(图 3),Alkyl C(烷基碳)与16:1ω7c、18:1ω7c、18:2ω6c、18:1ω9显著正相关。

|
Soil TN:土壤全氮;Alkyl C:烷基碳;Mineral N:矿质氮 图 3 土壤微生物群落结构与土壤化学性质及凋落物各指标的冗余分析 Fig. 3 Redundancy analysis of soil microbial community structure, soil chemical properties and indices of litter relative to treatment |
本研究发现,将不同质量凋落物放在杉木人工林内分解3年后,土壤微生物群落组成发生了显著变化。凋落物质量,尤其是烷基碳,能够很好地指示土壤微生物群落组成的变化。以往研究通常将凋落物的C/N,木质素/N比值作为凋落物质量的指标。但也有研究发现,这两个指标并不能很好地指示土壤微生物学过程,如微生物群落组成、氮循环过程等。本研究中凋落物初始碳含量与总磷脂脂肪酸、真菌和细菌含量显著相关,而其他凋落物特性(凋落物碳氮比(Litter C/N)、木质素比氮(Lignin/N)等)和微生物指标相关性不显著,Lignin/N和C/N与土壤生物学的关系不明显。不同化学组分相对含量的数据(例如,链烷碳、甲氧基碳、多糖碳、芳碳、羧基碳等),较木质素和全碳,可以更精细地区分凋落物质量差异,能够克服木质素和全碳作为评价树木凋落物质量指标的缺点。本研究发现,有机碳库组分如烷基碳、甲氧基碳、氧烷基碳、乙缩醛、酚碳以及烷基碳/氧烷基碳和微生物生物量指标之间均具有显著的相关性。烷基碳与真菌呈显著正相关,革兰氏阳性细菌与阴性细菌比值与烷基碳呈显著负相关,这与前人的研究结果一致[19],表明凋落物有机碳化学组分能够对土壤微生物群落组成产生影响。
添加其他树种凋落物3年后,土壤磷脂脂肪酸总量有显著变化。真菌细菌比值除桉树外,均低于杉木,革兰氏阳性与阴性细菌比值则高于杉木。原因可能是土壤中可利用的养分减少,有机质含量降低及难分解有机物质增加。有研究表明,随着凋落物的持续分解,微生物能够吸收利用的有机物(糖类、蛋白质等)逐渐减少[20],一般土壤有机质和有效养分减少后,土壤细菌丰度降低,真细菌比值会增加。桉树真细菌比高于杉木,可能是因为桉树独特的化感作用影响细菌的生长繁殖。其他树种比如木荷等真细菌比值低于杉木,可能是由于这些阔叶树种凋落物中含有大量的易变性有机碳,通过分解进入土壤后,能够为微生物,尤其是细菌提供大量碳源,因此较杉木真菌比值低。随着凋落物分解时间的延长,可利用养分减少,难分解有机物质(纤维素、木质素等)比例逐渐增加[8],较革兰氏阴性菌利用难分解有机物质能力更强的革兰氏阳性菌的比例也会随着凋落物分解而升高。
此外,在13C-NMR波谱解析的官能团中,烷基碳表征难分解碳如木质素、单宁等;氧烷基碳表征易被利用的碳水化合物,即易分解碳。研究表明难分解碳含量越高,有机物的分解速率越慢[20]。本研究发现其他树种的凋落物烷基碳均低于杉木和桉树,利于凋落物分解速率的加快,同时,其他凋落物中易分解的氧烷基碳相对含量均高于杉木和桉树。革兰氏阳性/阴性细菌比值高,革兰氏阳性细菌偏向于利用土壤有机质,而革兰氏阴性细菌偏向于利用新鲜的植物残体作为碳源,革兰氏阳性与阴性细菌比值高表明土壤中细菌群落碳的有效性低,说明除桉树和杉木外,其他凋落物分解快,随着时间的增加,碳的有效性逐渐降低。可能的原因是凋落物分解后,难分解有机质比例增加。由于养分的限制,不仅真菌会发生变化,细菌群落内部也会发生变化。
在杉木人工林中,凋落物质量是调控土壤养分循环和微生物生物量变化的重要因子。研究结果显示,不同质量凋落物添加后土壤磷脂脂肪酸含量之间表现出显著差异。本结果表明,添加桉树凋落物分解3年后,土壤总微生物、细菌、真菌生物量均显著高于杉木人工林,而樟树凋落物分解3年后,土壤总微生物、细菌、放线菌生物量均显著低于杉木及其他凋落物添加,这与早些的研究[21-22]结果相同,与Thoms等[23]用磷脂脂肪酸分析法测得的土壤微生物量结果相一致,即不同树种下凋落物输入的不同,使得土壤中磷脂脂肪酸含量具有显著差异。陈法霖等[24]的研究指出,不同C/N、木质素/N的凋落物导致土壤微生物群落结构发生变化,湿地松凋落物添加降低了土壤细菌和放线菌的磷脂脂肪酸含量,凋落物质量扮演着十分重要的角色。凋落物质量影响分解速率,凋落物进入土壤后,其活性有机质为微生物的生长提供了碳源,能够激发微生物生长。本研究中桉树凋落物(尤其是凋落叶)的易分解性,参与凋落物分解的土壤微生物数量较多,桉树凋落物添加下的土壤微生物量均有显著增加。因此,在杉木人工林中,凋落物输入是土壤微生物的主要碳源,不同质量凋落物的输入和分解,使杉木人工林土壤环境发生变化,微生物组成出现不同程度的差异。本研究探索了有机碳化学组分作为新的评价凋落物的指标对土壤微生物的影响,但仅讨论了多种单一凋落物添加,在一定程度上具有局限性。
4 结论在我国亚热带地区,杉木人工林添加不同凋落物分解后,林地土壤微生物群落组成存在显著差异,说明不同质量凋落物的添加对土壤微生物群落结构具有显著影响。桉树凋落物添加下土壤总磷脂脂肪酸以及细菌真菌等生物量均显著高于其他凋落物添加,其对提高土壤微生物量的作用优于其他凋落物。在此基础上继续开展凋落物多样性对杉木人工林生态系统的研究利于更好地揭示物种多样性对杉木人工林土壤环境的影响,为杉木人工林可持续经营与管理提供科学依据。
| [1] |
Jetten M S M. The microbial nitrogen cycle[J]. Environmental Microbiology, 2008, 10(11): 2903-2909. DOI:10.1111/j.1462-2920.2008.01786.x
(  0) 0) |
| [2] |
Schimel J P, Schaeffer S M. Microbial control over carbon cycling in soil[J]. Frontiers in Microbiology, 2012, 3: 348.
(  0) 0) |
| [3] |
Simpson A J, Simpson M J, Smith E, et al. Microbially derived inputs to soil organic matter: Are current estimates too low?[J]. Environmental Science & Technology, 2007, 41(23): 8070-8076.
(  0) 0) |
| [4] |
Malik A A, Chowdhury S, Schlager V, et al. Soil fungal: Bacterial ratios are linked to altered carbon cycling[J]. Frontiers in Microbiology, 2016, 7: 1247.
(  0) 0) |
| [5] |
Soares M, Rousk J. Microbial growth and carbon use efficiency in soil: Links to fungal-bacterial dominance, SOC-quality and stoichiometry[J]. Soil Biology & Biochemistry, 2019, 131: 195-205.
(  0) 0) |
| [6] |
Kramer C, Gleixner G. Variable use of plant-and soil-derived carbon by microorganisms in agricultural soils[J]. Soil Biology & Biochemistry, 2006, 38(11): 3267-3278.
(  0) 0) |
| [7] |
Fanin N, Hättenschwiler S, Fromin N. Litter fingerprint on microbial biomass, activity, and community structure in the underlying soil[J]. Plant and Soil, 2014, 379(1/2): 79-91. DOI:10.1007/s11104-014-2051-7
(  0) 0) |
| [8] |
Guo J F, Yang Y S, Chen G S, et al. A review on litter decomposition in forest ecosystem (In Chinese)[J]. Scientia Silvae Sinicae, 2006, 42(4): 93-100. [郭剑芬, 杨玉盛, 陈光水, 等. 森林凋落物分解研究进展[J]. 林业科学, 2006, 42(4): 93-100.]
(  0) 0) |
| [9] |
Bastian F, Bouziri L, Nicolardot B, et al. Impact of wheat straw decomposition on successional patterns of soil microbial community structure[J]. Soil Biology & Biochemistry, 2009, 41(2): 262-275.
(  0) 0) |
| [10] |
Potthast K, Hamer U, Makeschin F. Impact of litter quality on mineralization processes in managed and abandoned pasture soils in Southern Ecuador[J]. Soil Biology & Biochemistry, 2010, 42(1): 56-64.
(  0) 0) |
| [11] |
Fierer N, Schimel J P, Holden P A. Variations in microbial community composition through two soil depth profiles[J]. Soil Biology & Biochemistry, 2003, 35(1): 167-176.
(  0) 0) |
| [12] |
Hu Y L, Wang S L, Huang Y, et al. Effects of litter chemistry on soil biological property and enzymatic activity (In Chinese)[J]. Acta Ecologica Sinica, 2005, 25(10): 2662-2668. DOI:10.3321/j.issn:1000-0933.2005.10.030 [胡亚林, 汪思龙, 黄宇, 等. 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响[J]. 生态学报, 2005, 25(10): 2662-2668.]
(  0) 0) |
| [13] |
Huang Z Q, Wan X H, He Z M, et al. Soil microbial biomass, community composition and soil nitrogen cycling in relation to tree species in subtropical China[J]. Soil Biology & Biochemistry, 2013, 62: 68-75.
(  0) 0) |
| [14] |
Zhang Q S, Yu X T. Studies on the enzyme activities and fertilities of soils in Chinese-fir repeated plantation woodland (In Chinese)[J]. Journal of Fujian College of Forestry, 1989, 9(3): 263-271. [俞新妥, 张其水. 杉木连栽林地土壤生化特性及土壤肥力的研究[J]. 福建林学院学报, 1989, 9(3): 263-271.]
(  0) 0) |
| [15] |
Lei H D, Yin Y F, Liu Y, et al. Effects of fir(Cunninghamia lanceolata)litter and its biochar on soil microbial community structure (In Chinese)[J]. Acta Pedologica Sinica, 2016, 53(3): 790-799. [雷海迪, 尹云锋, 刘岩, 等. 杉木凋落物及其生物炭对土壤微生物群落结构的影响[J]. 土壤学报, 2016, 53(3): 790-799.]
(  0) 0) |
| [16] |
Wang S L, Huang Z Q, Wang Q K, et al. Effects of species diversity of litter on the ecological functions of Cunninghamia lanceolata(Lamb.)Hook. plantation soil (In Chinese)[J]. Acta Ecologica Sinica, 2005, 25(3): 474-480. [汪思龙, 黄志群, 王清奎, 等. 凋落物的树种多样性与杉木人工林土壤生态功能[J]. 生态学报, 2005, 25(3): 474-480.]
(  0) 0) |
| [17] |
White D C, Davis W M, Nickels J S, et al. Determination of the sedimentary microbial biomass by extractible lipid phosphate[J]. Oecologia, 1979, 40(1): 51-62. DOI:10.1007/BF00388810
(  0) 0) |
| [18] |
Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities: Phospholipid fatty acid profiles and substrate utilization patterns[J]. Microbial Ecology, 1998, 35(3): 265-278. DOI:10.1007/s002489900082
(  0) 0) |
| [19] |
Cusack D F, Silver W L, Torn M S, et al. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 2011, 92(3): 621-632. DOI:10.1890/10-0459.1
(  0) 0) |
| [20] |
Preston C M, Trofymow J A. Variability in litter quality and its relationship to litter decay in Canadian forests[J]. Canadian Journal of Botany, 2000, 78(10): 1269-1287. DOI:10.1139/b00-101
(  0) 0) |
| [21] |
Habekost M, Eisenhauer N, Scheu S, et al. Seasonal changes in the soil microbial community in a grassland plant diversity gradient four years after establishment[J]. Soil Biology & Biochemistry, 2008, 40(10): 2588-2595.
(  0) 0) |
| [22] |
Myers R T, Zak D R, White D C, et al. Landscape-level patterns of microbial community composition and substrate use in upland forest ecosystems[J]. Soil Science Society of America Journal, 2001, 65(2): 359-367. DOI:10.2136/sssaj2001.652359x
(  0) 0) |
| [23] |
Thoms C, Gattinger A, Jacob M, et al. Direct and indirect effects of tree diversity drive soil microbial diversity in temperate deciduous forest[J]. Soil Biology & Biochemistry, 2010, 42(9): 1558-1565.
(  0) 0) |
| [24] |
Chen F L, Zheng H, Yang B S, et al. Effects of exotic species slash pine(Pinus elliottii)litter on the structure and function of the soil microbial community (In Chinese)[J]. Acta Ecologica Sinica, 2011, 31(12): 3543-3550. [陈法霖, 郑华, 阳柏苏, 等. 外来种湿地松凋落物对土壤微生物群落结构和功能的影响[J]. 生态学报, 2011, 31(12): 3543-3550.]
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


