植物获取土壤养分由根系直接途径(Direct pathway)和菌根途径(Mycorrhizal pathway)两个相互独立的吸收途径共同完成。丛枝菌根真菌(Arbuscular mycorrhizal fungi,以下简称AM真菌)的一端定殖于植物根系皮层细胞内,通过丛枝结构与宿主植物进行物质交换,另一端的根外菌丝穿越根际养分耗竭区,扩大根系吸收养分(例如磷)的空间范围[1],从而提高植物对土壤养分的利用率。植物体内大约20%的光合产物分配至AM真菌体内[2],一部分用于AM真菌自身的生长代谢,另一部分以富含碳水化合物的形式从根外菌丝分泌至土壤中,菌丝分泌物中的低分子量有机物(包括果糖、葡萄糖、二聚糖、低聚寡糖、糖原和有机酸等)能够诱导包括解磷细菌在内的某些细菌类群在菌丝附近或表面定殖[3-4],形成菌丝际细菌。菌丝际细菌利用来自宿主植物的光合产物生存,同时参与土壤有机氮矿化、磷形态转化和生物周转过程,并通过菌丝将矿质养分元素运输至植物体内[5-7]。目前对菌丝际细菌的研究大多集中于描述菌丝际细菌的群落结构及其影响因素[8-9],而对于菌丝际细菌的生态功能了解较少。
生物固氮是氮素循环中的重要过程,也是自然生态系统中有效氮的主要来源,据联合国粮食及农业组织统计,地球上结合态氮总量的70%来源于生物固氮[10]。可以进行生物固氮的是固氮细菌和古细菌[11],根据其与植物的关系,固氮菌可分为共生固氮菌、联合固氮菌和自生固氮菌。固氮菌通过体内固氮酶催化生物固氮过程,nifH基因是编码固氮酶铁蛋白的基因,也是普遍用于鉴定环境中固氮菌的分子印迹[12]。前人研究发现,菌丝际可能存在一些常见的固氮菌种类[13-14],AM真菌的孢子中存在内生固氮菌,可能通过与固氮菌共生从生物固氮中获益,孢子内生固氮菌可能在孢子萌发过程中迁移至菌丝表面,成为菌丝际固氮菌[15-16]。然而,在生态系统中,菌丝际是否存在固氮菌定殖及其固氮能力特点尚不清楚。由于生态系统中有效磷缺乏,限制植物和微生物的生长,如果菌丝际定殖的细菌同时具备固氮和解磷双重功能,那将对菌根途径获取氮磷元素具有重要意义。但是,迄今尚未有类似的研究报道。
本研究的目的是在田间原位条件下,探究侵染玉米根系的AM真菌根外菌丝表面是否存在具有固氮能力的细菌定殖,这类细菌是否同时具备溶解土壤难溶性磷的能力,从而揭示菌丝际细菌的功能多样性,为进一步理解菌根途径对宿主植物氮磷营养的贡献机制提供依据。
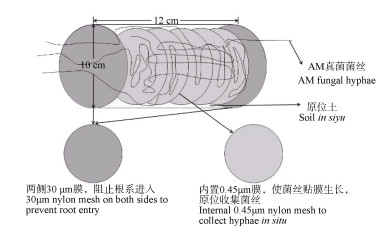
1 材料与方法 1.1 菌丝收集菌丝收集在福建省漳州市诏安县正禾有机农场(23°44′N,117°10′E)的酸性赤红壤和北京市上庄实验站(40°08′N,116°11′E)的石灰性潮土中进行,宿主植物均为玉米。福建漳州的赤红壤中采用PVC(聚氯乙烯)管收集菌丝方式(图 1),在玉米根系附近土壤中埋入两侧带有30 μm尼龙膜的PVC管(直径10 cm,高度12 cm),根系不能通过但菌丝可以通过,并在PVC管内放置0.45 μm的尼龙膜,使AM真菌菌丝能够贴膜生长。埋入3个月后,将PVC管从田间取出,取出0.45 μm膜,剪碎后置于装有灭菌水的培养皿中,在体视镜(SZX7,OLYMPUS,日本)下用镊子挑出菌丝。北京的潮土中同样采用PVC管(直径15 cm,高度10 cm)方式收集菌丝,但无内置0.45 μm的尼龙膜,PVC管中土壤为菌丝室土壤。埋入3个月后,将带有尼龙膜的PVC管从田间取出,用无菌水清洗菌丝室土壤,然后过500目筛,收集足量的菌丝。将收集到的菌丝浸泡在无菌水中,在体视镜下用镊子挑取菌丝,置于4℃冰箱中保存备用,保存时间不超过一周。
|
图 1 聚氯乙烯(PVC)管收集菌丝示意图 Fig. 1 Sketch of polyvinyl chloride (PVC) tubes used to collect AM fungal hyphae |
本试验中,将能够在无氮培养基中生长的细菌定义为固氮菌,nifH基因检测和固氮酶活性测定作为补充指标。在体视镜下用火焰灼烧灭菌过的镊子挑取保存的AM真菌菌丝,放入分离筛选无氮培养基中,在28℃培养箱中培养10 d,在分离筛选无氮培养基上连续进行3代选择培养,获得固氮能力稳定的细菌,然后在LB固体培养基(Luria-Bertani培养基)上进行分离纯化,得到纯菌落。对分离纯化得到的菌株进行革兰氏染色,在显微镜下放大1 000倍观察细菌的颜色、形态和大小,操作步骤主要包括:涂片固定-结晶紫初染-碘液媒染-酒精脱色-番红复染-油镜观察。呈紫色的为革兰氏阳性菌,呈红色的为革兰氏阴性菌。
分离筛选无氮培养基组分(1 L体系):20 g蔗糖(sucrose)、0.1 g磷酸氢二钾(K2HPO4)、0.4 g磷酸二氢钾(KH2PO4)、0.2 g七水合硫酸镁(MgSO4·7H2O)、0.01 g氯化钠(NaCl)、0.01 g氯化铁(FeCl3)、0.002 g二水合钼酸钠(Na2MoO4·2H2O)、14 g琼脂粉(Agar powder)。
1.3 菌株鉴定对分离筛选出的纯化菌株进行细菌DNA提取、nifH基因检测和16S rRNA基因测序,鉴定固氮菌株种类。首先使用细菌基因组DNA提取试剂盒(TIANGEN,目录号:DP302)提取固氮菌DNA,提取的DNA用超微量核酸蛋白分析仪(Biodropsis BD-1000,五洲东方,中国)检测纯度和浓度,–20 ℃保存。
nifH基因检测采用巢式PCR进行两轮扩增[17]。第一轮扩增反应体系25 μL:2 μL DNA模板、12.5 μL Premix Taq、正反引物(PolR和PolF)各0.5 μL(10 μmol·L–1)、1 μL牛血清蛋白(0.1% BSA)、8.5 μL ddH2O。反应过程:95℃预变性5 min;55℃退火30 S,72℃延伸30 S,94℃变性30 S,循环30次;72 ℃延伸10 min。第二轮扩增反应体系50 μL:1 μL第一轮扩增产物、25 μL Premix Taq、正反引物(PolR和PolF-GCb)各1 μL(10 μmol·L–1)、2 μL牛血清蛋白(1% BSA)、20 μL ddH2O。反应过程:95℃预变性5 min;60℃退火30 S,72℃延伸30 S,94℃变性30 S,循环30次;72℃延伸10 min。
16S rRNA基因测序前用16S通用引物扩增条带。反应体系25 μL:3 μL DNA模板、12.5 μL Premix Taq、正反引物各0.4 μL(100 μmol·L–1)、0.5 μL牛血清蛋白(0.1% BSA)、8.2 μL ddH2O。反应过程:95℃预变性3 min;95℃变性20 S,60℃退火20 S,72℃延伸75 S,循环35次;72℃延伸5 min。扩增产物在北京擎科新业生物技术有限公司完成测序和拼接,将固氮菌16S rRNA基因序列在NCBI(美国国家生物技术信息中心)官网的Blast程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行同源性比对分析,查找出14条相近的细菌16S rRNA基因序列,用MEGA软件(版本5.2),采用Neighbor-joining方法(邻接法),“p-distance”(p距离模型)方式,自展1 000次构建系统发育树。
1.4 菌株固氮酶活性测定采用乙炔还原法测定固氮菌的固氮酶活性,具体方法为:首先在LB液体培养基中对菌株进行两次活化,活化后的菌液经过离心收集菌体,灭菌水清洗2~3次,用测酶活限氮培养基悬浮洗涤后的菌体,并调节OD值(λ = 600 nm)约为0.4,取3.2 mL菌液加入20 mL厌氧管,用抽真空装置抽出空气并充入氮气,抽充6次以尽量排出管内的氧气,然后向厌氧管中注射1.68 mL的乙炔气体,在37℃,220 r·min–1的条件下胁迫培养3~4 d,用微量进样针取100 μL的管内气体注入气相色谱仪(GC-2010 Plus,岛津,日本)测定乙烯含量。完成乙烯测定后,使用考马斯亮蓝法测定菌体蛋白含量,计算得到固氮菌的固氮酶活性,单位为nmol·mgh–1(nmol为C2H4单位,mg为菌体蛋白单位,h为胁迫培养时间单位)。
测酶活限氮培养基组分(1 L体系):26 mg二水合氯化钙(CaCl2·2H2O)、30 mg七水合硫酸镁(MgSO4·7H2O)、0.33 mg一水合硫酸锰(MnSO4·H2O)、7.6 mg二水合钼酸钠(Na2MoO4·2H2O)、3.4 g磷酸二氢钾(KH2PO4)、26.3 g十二水合磷酸氢二钠(Na2HPO4·12H2O)、36 mg柠檬酸铁(C6H5O7Fe·xH2O)、4 g葡萄糖(glucose)、0.3 g谷氨酸(L‐Glutamic acid)、10 μg生物素(Biotin)、10 μg对氨基苯甲酸(C7H7NO2)。
|
|
表 1 本研究使用的引物 Table 1 Primers used in this study |
利用NBRIP固体培养基(National Botanical Research Institute's phosphate growth medium)通过平板溶磷圈法检测固氮菌株的溶磷能力,具体方法为:首先在LD液体培养基中对菌株进行两次活化,活化后的菌液经过离心收集菌体,灭菌水清洗2~3次,灭菌水悬浮洗涤后的菌体,并调节OD值(λ = 600 nm)约为0.4,吸取5 μL菌液滴加入NBRIP固体培养基的平板上,30℃恒温培养2~3 d,测定菌落直径(d)和溶磷圈直径(D),并计算比值(D/d),比值大小反映菌株的溶磷能力。
利用Salkowski比色法[18]测定固氮菌株分泌IAA的能力,具体方法为:菌株活化、洗涤方法同上,用灭菌水悬浮洗涤后的菌体,并调节OD值(λ = 600 nm)约为0.4,取100 μL菌液加入20 mL King培养液,30℃,160 r·min–1培养3 d,将培养液离心,吸取2 mL上清,加入2 mL Salkowski比色液,在黑暗中静置30 min,立即测定OD(λ = 530 nm)值,根据IAA标准曲线计算出菌株分泌IAA的量。
1.6 数据处理试验数据均采用Excel 2016进行整理,采用SPSS(版本21.0,IBM Crop.,Armonk,NY,美国)进行数据分析。对固氮酶活性数据和分泌IAA能力数据先进行方差同质性检验(Levene’s检验),随后进行单因素方差分析和LSD法(最小显著差异法)多重比较(P < 0.05)。采用MEGA软件(版本5.2)构建系统发育树。
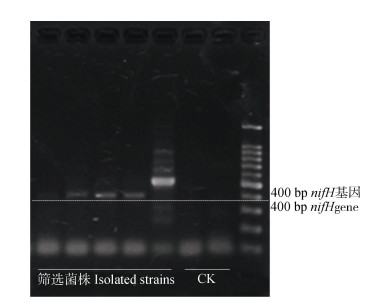
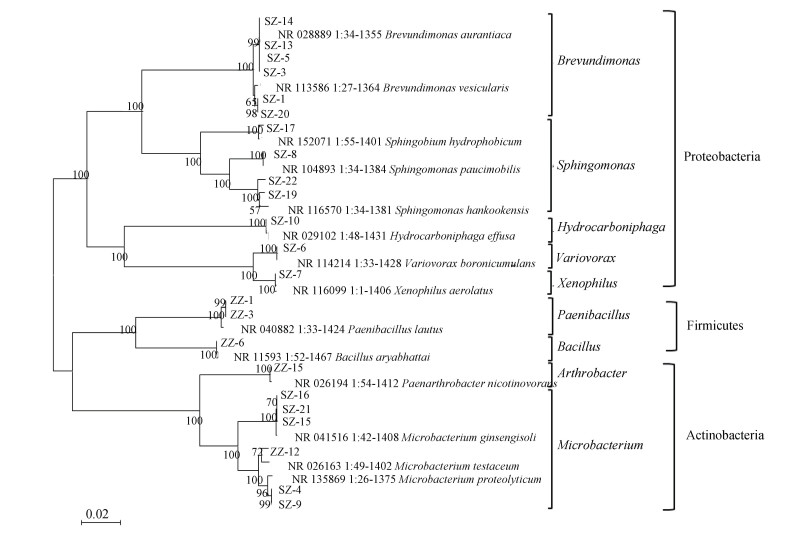
2 结果 2.1 菌丝表面分离筛选固氮菌的鉴定本研究分离筛选出23株能够在无氮培养基上生长的固氮菌株。进而提取其DNA进行了nifH基因检测(图 2),一部分菌株扩增出400 bp左右的目标条带。随后对固氮菌的16S rRNA基因序列进行系统发育树构建(图 3),结果表明23株固氮菌属于3个门下的9个不同属(表 2),在门水平上:Proteobacteria(13株,56.5%)相对丰度最高,其次是Actinobacteria(7株,30.4%),相对丰度最低的是Firmicutes(3株,13%)。在属水平上:Brevundimonas(6株,26%)和Microbacterium(6株,26%)相对丰度最高,其次是Sphingomonas(4株,17.4%)、Paenibacillus(2株,8.7%)、Variovorax(1株,4.3%)、Xenophilus(1株,4.3%)、Hydrocarboniphaga(1株,4.3%)、Arthrobacter(1株,4.3%)和Bacillus(1株,4.3%)。
|
图 2 nifH基因扩增序列 Fig. 2 nifH gene amplification sequence |
|
注:粗体标注为本研究所得菌株序列,美国国家生物技术信息中心(NCBI)数据库中的序列用登录号表示。比例尺表示2%的序列变异。 Note: Bold letters signify the sequences of strains obtained in this study, and accession numbers stand for the sequences cited from NCBI database. The scale bar represents 2% of sequence divergence. 图 3 菌丝表面筛选出的固氮菌16S rRNA基因序列系统发育树 Fig. 3 Phylogenetic tree of 16S rRNA gene sequences of N2-fixing bacteria isolated from the surface of AM fungal hyphae |
|
|
表 2 菌丝表面筛选出的固氮菌及其所属门属 Table 2 N2-fixing bacteria isolated from the surface of AM fungal extraradical hyphae |
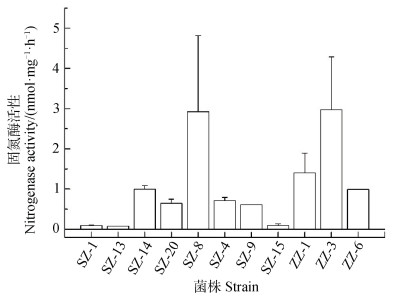
利用乙炔还原法检测了分离出的23株固氮菌的固氮酶活性,11株细菌检测到固氮酶活性(图 4)。其中,类芽孢杆菌(Paenibacillus)ZZ-3和鞘脂菌(Sphingomonas)SZ-8的固氮酶活相对较高,分别为2.97和2.92 nmol·mg–1·h–1。节杆菌(Arthrobacter)ZZ-15和短波单胞菌(Brevundimonas)SZ-1的固氮酶活性相对较低,分别为0.096和0.095 nmol·mg–1·h–1。
|
注:SZ/ZZ+数字是固氮菌的菌株代号。下同。 Note: SZ/ZZ+number represents strain code of the N2-fixing bacteria. The same below. 图 4 固氮菌株固氮酶活性 Fig. 4 Nitrogenase activity of N2-fixing bacteria strains |
采用平板溶磷圈法定性检测到12株固氮菌具有活化有机磷的能力(表 3),其中类芽孢杆菌(Paenibacillus)ZZ-1解植酸钙能力最高,D/d值为3.58 ± 0.22。11株固氮菌具有溶解难溶性无机磷的能力,其中类芽孢杆菌(Paenibacillus)ZZ-3解磷酸三钙能力最强,D/d值为2.77 ± 0.13。8株固氮菌同时具有解有机磷和难溶性无机磷的能力,并且解有机磷的能力高于解难溶性无机磷的能力。利用Salkowski比色法测定到16株固氮菌具有分泌IAA能力(图 5),其中类芽孢杆菌(Paenibacillus)ZZ-1分泌IAA能力最强,IAA分泌量为688 μg·mL–1,16株能够分泌IAA的菌中包括11株检测到固氮酶活性的细菌。
|
|
表 3 平板法测定固氮菌株溶磷圈直径和菌落直径比值 Table 3 Ratio of the diameters of phosphorus solubilizing halo (D) and colony (d) of the N-fixing bacteria strains (mean±SE, n=4) |

|
图 5 固氮菌株分泌IAA的能力 Fig. 5 Ability of N2-fixing bacteria strains to secrete IAA |
同时具备固氮酶活性、解有机磷、解难溶性无机磷和分泌IAA能力的菌株有6株(图 6),分别为短波单胞菌(Brevundimonas)SZ-13和SZ-14、微杆菌(Microbacterium)SZ-9、鞘脂单胞菌(Sphingomonas)SZ-8、类芽孢杆菌(Paenibacillus)ZZ-1和节杆菌(Arthrobacter)ZZ-15。

|
图 6 具有固氮、解植酸钙、解磷酸三钙和分泌IAA功能的菌株数量韦恩图 Fig. 6 Venn diagram of numbers of strains of bacteria capable of N2 fixation, phytin solubilization, Ca-P solubilization and IAA production |
AM真菌的菌丝际和孢子中普遍有细菌定殖[13,19]。研究表明,菌丝际存在解磷细菌、脱硫细菌、氨氧化细菌、反硝化细菌等功能细菌。AM真菌与这些功能细菌互作可促进有机形态磷、氮和硫的矿化,通过根外菌丝运输至宿主植物体内,同时对土壤矿质元素循环转化过程产生影响[5,20-24]。因此,菌丝际微生物研究成为近年来土壤学、植物营养学和微生物生态学研究领域的热点。但是在农田生态系统中,AM真菌根外菌丝表面是否定殖有固氮菌,以及这些固氮菌种类和功能特点的相关研究尚未见报道。本研究从田间玉米菌根的根外菌丝表面分离筛选出23株分布于9个不同属的固氮菌,其中,11株细菌具有固氮酶活性;12株细菌具有活化有机磷的能力,11株细菌具有溶解难溶性无机磷的能力;16株细菌具有分泌IAA的能力,6株细菌同时具有固氮酶活性、解有机磷、解难溶性无机磷和分泌IAA的能力(图 6)。就总数而言,筛选到23株细菌确实不多。这可能是由于无氮培养基的选择性过强,不适宜大多数细菌生长。此外,尽管样品采自福建赤红壤和北京石灰性潮土两种不同类型的土壤,但是在结果分析中并未比较土壤类型所导致的差异。这是因为分离筛选出的菌株样本量小,代表性不够。进一步的工作需要在更多的植物-土壤系统中开展大样本采样和分离筛选。
3.2 菌丝际细菌对AM真菌具有重要作用菌丝际细菌对AM真菌的促生作用很早就引起人们的关注,Hildebrandt等[25]发现类芽孢杆菌属的细菌具有促进AM真菌形成孢子的作用。Mansfeld-Giese等[26]从侵染黄瓜根系的AM真菌Glomus intraradices的菌丝际分离细菌时发现,类芽孢杆菌属细菌(Paenibacillus spp.)的分离菌株数量最多。Andrade等[27]从三种AM真菌(Glomus etunicatum、Glomus intraradices和Glomus mosseae)菌丝际土壤中分离得到的菌株大多是节杆菌属和芽孢杆菌属细菌。Zhang等[28]采用高通量测序技术分析了田间条件下侵染玉米的AM真菌菌丝际细菌群落结构发现,根瘤杆菌属的细菌相对丰度最高,相对丰度在50%以上。本研究从田间玉米菌根根外菌丝表面分离筛选到的菌株中,相对丰度最高的是短波单胞菌属(6株,26%)和微杆菌属细菌(6株,26%),同时也分离到2株类芽孢杆菌(ZZ-1和ZZ-3)、1株芽孢杆菌(ZZ-6)和1株节杆菌(ZZ-15),相对丰度分别为8.7%、4.3%和4.3%(表 2)。其中,类芽孢杆菌属细菌的固氮能力、解磷能力和分泌IAA能力均较强。这表明,类芽孢杆菌与AM真菌之间存在较为紧密的联系,可能在AM真菌生长发育过程中发挥重要作用。此外,采用传统分离培养方法获取菌丝际细菌有一定局限性,不能很好地反映菌丝际的优势菌群,结合不依赖培养的测序方法可更好地认识和理解菌丝际细菌的群落组成。
3.3 菌丝际固氮菌与根际固氮菌有一定的差异和共同点禾本科植物根际的自生和联合固氮菌对植物的氮营养有显著的贡献。水稻根际的联合固氮菌贡献率占植物全氮的20%~25%[29-30],联合固氮菌对甘蔗的氮贡献可达60%[31]。玉米根际存在联合固氮菌和自生固氮菌定殖,常见固氮菌有肠杆菌(Enterobacter spp.)、拉恩氏菌(Rahnella aquatilis)、类芽孢杆菌(Paenibacillus azotofixans)、芽孢杆菌(Bacillus circulans)、固氮螺菌(Azospirillum spp.)、草螺菌(Herbaspirillum seropedicae)和克雷伯氏菌(Klebsiella sp.)[32-33]。本研究从侵染玉米根系的AM真菌根外菌丝表面分离筛选到的固氮菌中,包括玉米根际常见的类芽孢杆菌和芽孢杆菌,此外,还分离出玉米根际不常见的短波单胞菌属(Brevundimonas)、微杆菌属(Microbacterium)和鞘脂单胞菌属(Sphingomonas)细菌(图 3),这表明AM真菌菌丝表面定殖的固氮菌与根际定殖的固氮菌种类存在一定的差异。固氮菌对不同碳源的感知和趋化不同[34],因此,菌丝分泌物与根系分泌物组成成分的差异可能是造成根际和菌丝际固氮菌种类差异的原因[27]。禾本科植物根际的固氮菌通过生物固氮和促生作用两种方式对宿主氮营养做出贡献[35]。本试验筛选到的固氮菌中包括类芽孢杆菌属、芽孢杆菌属、节杆菌属和短波单胞菌属的细菌,这些属的细菌被报道具有促生能力[17],因此,本研究对筛选菌株进行了分泌IAA能力的测定,发现16株固氮菌具有分泌IAA的能力,并且类芽孢杆菌属的菌株分泌IAA能力最强,为688 μg·mL–1(图 5)。这表明AM真菌菌丝表面的固氮菌也可能同时发挥固氮作用和促生作用。
3.4 菌丝际细菌的多重功能性具有重要意义自然界土壤中有效氮磷浓度和含量有限,是植物和土壤微生物生长的重要限制因素。菌丝表面同时定殖具有固氮、解磷和促生能力的细菌,甚至同一菌株兼具上述三种能力,这体现了菌根途径微生物组的功能多样性。菌丝际细菌同时具备固氮和解磷功能至少有如下益处:(1)增强细菌自身对环境的适应性(低磷低氮水平的土壤),维持细菌群落的稳定[36];(2)多功能性的菌丝际细菌与AM真菌互作可更好地发挥对宿主植物营养状况的改善作用。例如,在土壤有效氮水平较低时,细菌通过生物固氮作用获取氮素,并可能将固定的氮以NH4+的形式分泌出来,被菌丝吸收,进而通过菌丝运输至宿主植物体内;在土壤有效磷水平较低时,细菌通过分泌有机酸或者磷酸酶活化难溶性无机磷和有机磷,促进AM真菌根外菌丝对磷的获取和吸收,进而起到改善宿主植物磷营养状况的作用;(3)菌丝表面的细菌可沿菌丝移动[37],迁移至养分斑块活化有机氮、有机磷和难溶性无机磷,增强菌丝对养分的吸收和利用率;部分细菌则可能迁移至根际,成为根际促生菌,直接发挥促进植物生长的作用。
4 结论农田生态系统中的AM真菌根外菌丝表面普遍存在多种固氮菌定殖,这些固氮菌具有固氮解磷双重功能,并且大多具有分泌IAA的促生能力。宿主植物、AM真菌和菌丝际细菌三者之间可能存在协同作用,菌丝际细菌在AM真菌生长发育过程,以及AM真菌与宿主植物交换营养物质过程中发挥重要作用,在作物生产中具有潜在的应用价值。
| [1] |
Smith S E, Smith F A. Roles of arbuscular mycorrhizas in plant nutrition and growth: New paradigms from cellular to ecosystem scales[J]. Annual Review of Plant Biology, 2011, 62(1): 227-250. DOI:10.1146/annurev-arplant-042110-103846
(  0) 0) |
| [2] |
Jakobsen I, Rosendahl L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants[J]. New Phytologist, 1990, 115(1): 77-83. DOI:10.1111/j.1469-8137.1990.tb00924.x
(  0) 0) |
| [3] |
Bharadwaj D P, Alström S, Lundquist P O. Interactions among Glomus irregulare, arbuscular mycorrhizal spore-associated bacteria, and plant pathogens under in vitro conditions[J]. Mycorrhiza, 2012, 22(6): 437-447. DOI:10.1007/s00572-011-0418-7
(  0) 0) |
| [4] |
Toljander J F, Artursson V, Paul L R, et al. Attachment of different soil bacteria to arbuscular mycorrhizal fungal extraradical hyphae is determined by hyphal vitality and fungal species[J]. FEMS Microbiology Letters, 2006, 254(1): 34-40. DOI:10.1111/j.1574-6968.2005.00003.x
(  0) 0) |
| [5] |
Hodge A, Fitter A H. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(31): 13754-13759. DOI:10.1073/pnas.1005874107
(  0) 0) |
| [6] |
Wang F, Jiang R F, Kertesz M A, et al. Arbuscular mycorrhizal fungal hyphae mediating acidification can promote phytate mineralization in the hyphosphere of maize(Zea mays L.)[J]. Soil Biology and Biochemistry, 2013, 65: 69-74. DOI:10.1016/j.soilbio.2013.05.010
(  0) 0) |
| [7] |
Zhang L, Fan J Q, Ding X D, et al. Hyphosphere interactions between an arbuscular mycorrhizal fungus and a phosphate solubilizing bacterium promote phytate mineralization in soil[J]. Soil Biology and Biochemistry, 2014, 74: 177-183. DOI:10.1016/j.soilbio.2014.03.004
(  0) 0) |
| [8] |
Wang F, Kertesz M A, Feng G. Phosphorus forms affect the hyphosphere bacterial community involved in soil organic phosphorus turnover[J]. Mycorrhiza, 2019, 29(4): 351-362. DOI:10.1007/s00572-019-00896-0
(  0) 0) |
| [9] |
Qin H, Bai J F, Xu Q F, et al. Effects of arbuscular mycorrhizal fungal hyphae on soil microbial community composition and polychlorinated biphenyls degradation (In Chinese)[J]. Soils, 2015, 47(4): 704-710. [秦华, 白建峰, 徐秋芳, 等. 丛枝菌根真菌菌丝对土壤微生物群落结构及多氯联苯降解的影响[J]. 土壤, 2015, 47(4): 704-710.]
(  0) 0) |
| [10] |
Zhang H F, Hu J C, Huang J F. Application and prospect of biological nitrogen fixation on agriculture (In Chinese)[J]. Nature Magazine, 2002, 24(3): 135-138. DOI:10.3969/j.issn.0253-9608.2002.03.002 [张华峰, 胡建成, 黄巨富. 生物固氮在农业中的应用现状与展望[J]. 自然杂志, 2002, 24(3): 135-138.]
(  0) 0) |
| [11] |
Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9
(  0) 0) |
| [12] |
Raymond J, Siefert J L, Staples C R, et al. The natural history of nitrogen fixation[J]. Molecular Biology and Evolution, 2004, 21(3): 541-554. DOI:10.1093/molbev/msh047
(  0) 0) |
| [13] |
Bonfante P, Anca I A. Plants, mycorrhizal fungi, and bacteria: A network of interactions[J]. Annual Review of Microbiology, 2009, 63(1): 363-383. DOI:10.1146/annurev.micro.091208.073504
(  0) 0) |
| [14] |
Frey-Klett P, Garbaye J, Tarkka M. The mycorrhiza helper bacteria revisited[J]. New Phytologist, 2007, 176(1): 22-36. DOI:10.1111/j.1469-8137.2007.02191.x
(  0) 0) |
| [15] |
Minerdi D, Fani R, Gallo R, et al. Nitrogen fixation genes in an endosymbiotic Burkholderia strain[J]. Applied and Environmental Microbiology, 2001, 67(2): 725-732. DOI:10.1128/AEM.67.2.725-732.2001
(  0) 0) |
| [16] |
Battini F, Cristani C, Giovannetti M, et al. Multifunctionality and diversity of culturable bacterial communities strictly associated with spores of the plant beneficial symbiont Rhizophagus intraradices[J]. Microbiological Research, 2016, 183: 68-79. DOI:10.1016/j.micres.2015.11.012
(  0) 0) |
| [17] |
Zhang Y Y, Dong J D, Yang Z H, et al. Phylogenetic diversity of nitrogen-fixing bacteria in mangrove sediments assessed by PCR-denaturing gradient gel electrophoresis[J]. Archives of Microbiology, 2008, 190(1): 19-28. DOI:10.1007/s00203-008-0359-5
(  0) 0) |
| [18] |
Gordon S A, Weber R P. Colorimetric estimation of indoleacetic acid[J]. Plant Physiology, 1951, 26(1): 192-195. DOI:10.1104/pp.26.1.192
(  0) 0) |
| [19] |
Agnolucci M, Battini F, Cristani C, et al. Diverse bacterial communities are recruited on spores of different arbuscular mycorrhizal fungal isolates[J]. Biology and Fertility of Soils, 2015, 51(3): 379-389. DOI:10.1007/s00374-014-0989-5
(  0) 0) |
| [20] |
Chai X F, Zhang L, Tian Z Y, et al. Identification of phytate mineralizing bacteria colonized on the extraradical hyphal surface of arbuscular mycorrhizal fungi in a maize field (In Chinese)[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(4): 1031-1038. [柴小粉, 张林, 田芷源, 等. 玉米丛枝菌根真菌根外菌丝表面定殖细菌解磷功能鉴定[J]. 植物营养与肥料学报, 2016, 22(4): 1031-1038.]
(  0) 0) |
| [21] |
Zhang L, Xu M G, Liu Y, et al. Carbon and phosphorus exchange may enable cooperation between an arbuscular mycorrhizal fungus and a phosphate-solubilizing bacterium[J]. New Phytologist, 2016, 210(3): 1022-1032. DOI:10.1111/nph.13838
(  0) 0) |
| [22] |
Gahan J, Schmalenberger A. Arbuscular mycorrhizal hyphae in grassland select for a diverse and abundant hyphospheric bacterial community involved in sulfonate desulfurization[J]. Applied Soil Ecology, 2015, 89: 113-121. DOI:10.1016/j.apsoil.2014.12.008
(  0) 0) |
| [23] |
Bukovská P, Bonkowski M, Konvalinková T, et al. Utilization of organic nitrogen by arbuscular mycorrhizal fungi—is there a specific role for protists and ammonia oxidizers?[J]. Mycorrhiza, 2018, 28(3): 269-283. DOI:10.1007/s00572-018-0825-0
(  0) 0) |
| [24] |
Storer K, Coggan A, Ineson P, et al. Arbuscular mycorrhizal fungi reduce nitrous oxide emissions from N2O hotspots[J]. New Phytologist, 2018, 220(4): 1285-1295. DOI:10.1111/nph.14931
(  0) 0) |
| [25] |
Hildebrandt U, Ouziad F, Marner F J, et al. The bacterium Paenibacillus validus stimulates growth of the arbuscular mycorrhizal fungus Glomus intraradices up to the formation of fertile spores[J]. FEMS Microbiology Letters, 2006, 254(2): 258-267. DOI:10.1111/j.1574-6968.2005.00027.x
(  0) 0) |
| [26] |
Mansfeld-Giese K, Larsen J, Bødker L. Bacterial populations associated with mycelium of the arbuscular mycorrhizal fungus Glomus intraradices[J]. FEMS Microbiology Ecology, 2002, 41(2): 133-140. DOI:10.1111/j.1574-6941.2002.tb00974.x
(  0) 0) |
| [27] |
Andrade G, Mihara K L, Linderman R G, et al. Bacteria from rhizosphere and hyphosphere soils of different arbuscular-mycorrhizal fungi[J]. Plant and Soil, 1997, 192(1): 71-79. DOI:10.1023/A:1004249629643
(  0) 0) |
| [28] |
Zhang L, Shi N, Fan J Q, et al. Arbuscular mycorrhizal fungi stimulate organic phosphate mobilization associated with changing bacterial community structure under field conditions[J]. Environmental Microbiology, 2018, 20(7): 2639-2651. DOI:10.1111/1462-2920.14289
(  0) 0) |
| [29] |
Watanabe I, Yoneyama T, Padre B, et al. Difference in natural abundance of 15N in several rice(Oryza sativa L.)varieties: Application for evaluating N2 Fixation[J]. Soil Science and Plant Nutrition, 1987, 33(3): 407-415. DOI:10.1080/00380768.1987.10557586
(  0) 0) |
| [30] |
Roger P A, Ladha J K. Biological N2 fixation in wetland rice fields: Estimation and contribution to nitrogen balance[J]. Plant and Soil, 1992, 141(1): 41-55.
(  0) 0) |
| [31] |
Boddey R M, Polidoro J C, Resende A S, et al. Use of the 15N natural abundance technique for the quantification of the contribution of N2 fixation to sugar cane and other grasses[J]. Functional Plant Biology, 2001, 28(9): 889-895. DOI:10.1071/PP01058
(  0) 0) |
| [32] |
de Bruijn F J. Biological nitrogen fixation . Hoboken, New Jersey, USA: John Wiley & Sons, Inc., 2015.
(  0) 0) |
| [33] |
Elmerich C, Newton W E. Associative and endophytic nitrogen-fixing bacteria and cyanobacterial associations . Dordrecht, The Netherlands: Springer, 2007.
(  0) 0) |
| [34] |
Bacilio-Jiménez M, Aguilar-Flores S, Ventura-Zapata E, et al. Chemical characterization of root exudates from rice(Oryza sativa)and their effects on the chemotactic response of endophytic bacteria[J]. Plant and Soil, 2003, 249(2): 271-277. DOI:10.1023/A:1022888900465
(  0) 0) |
| [35] |
Carvalho T L G, Balsemao-Pires E, Saraiva R M, et al. Nitrogen signalling in plant interactions with associative and endophytic diazotrophic bacteria[J]. Journal of Experimental Botany, 2014, 65(19): 5631-5642. DOI:10.1093/jxb/eru319
(  0) 0) |
| [36] |
Griffiths B S, Philippot L. Insights into the resistance and resilience of the soil microbial community[J]. FEMS Microbiology Reviews, 2013, 37(2): 112-129. DOI:10.1111/j.1574-6976.2012.00343.x
(  0) 0) |
| [37] |
Kohlmeier S, Smits T H M, Ford R M, et al. Taking the fungal highway: Mobilization of pollutant-degrading bacteria by fungi[J]. Environmental Science and Technology, 2005, 39(12): 4640-4646. DOI:10.1021/es047979z
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


