2. 中国矿业大学环境与测绘学院, 江苏徐州 221116;
3. 中国矿业大学煤炭资源与安全开采国家重点实验室, 江苏徐州 221116
2. School of Environmental Science and Spatial Informatics, China University of Mining and Technology, Xuzhou, Jiangsu 221116, China;
3. State Key Laboratory of Coal Resources and Safe Mining, China University of Mining and Technology, Xuzhou, Jiangsu 221116, China
中国50%煤炭产能位于生态脆弱的黄土高原,采矿造成地表形变、沉陷、裂缝、滑坡,加剧了水土流失、植被衰减、土壤退化和生物多样性锐减等问题[1-3]。采煤每年损毁土地达4.88万hm2,累积损毁土地超800万hm2。全域生态空间修复是新时代生态文明建设的重大任务之一,但如此大规模的修复仅靠人工是无法实现的。为此,激发矿山生态系统的自恢复能力倍受关注[4]。土壤理化特征、种子库、微生物等多因素决定了生态系统的自恢复能力,其中微生物对生态恢复起着重要的催化作用[5]。半干旱受损矿山由于缺水、土壤贫瘠和环境污染等问题,如仅实施植被重建、地形改造、土壤改良等工程,而离开微生物参与,则生态恢复潜力受限,恢复效果和速率差[1-3]。因此,矿山生态修复必须重视土壤微生物演替、生态过程及其恢复潜力。
微生物是生态系统的关键组分,在全球生态修复、环境监测及污染治理、生物保护等方面具有重要的价值[6-7]。近几年有关矿山土壤微生物的研究明显增多,采煤扰动改变了土壤环境的立地条件,不可避免地造成微生物适应性下降,且微生物生物量亦呈下降态势[8]。如,Chen等[9]发现,内蒙古锡林郭勒采煤活动造成了土壤微生物多样性下降。煤矿开采带来的土壤破坏,给微生物群落和相应的生态系统服务带来不利影响[10]。Sun等[11]发现,土壤微生物在采煤矿区塌陷后减少。Ezeokoli等[12]发现丛枝菌根真菌群落随着煤矿塌陷区复垦时间的增加而呈显著变化。矿山复垦则偏向积极作用。一些学者开始关注土壤微生物群落变化与环境要素之间的关系。Dimitriu等[13]报道了采矿干扰后土壤细菌群落结构和多样性的变化。此外,不同物种之间的相互作用通常形成复杂的生态网络,它控制着菌群组装,从而影响了群落结构与功能[14]。微生物菌属之间相互作用对了解环境变化下微生物群落组装的动力学至关重要。尽管从全球图谱到特定环境微生物生态网络日益受关注,但对采矿沉陷环境中土壤微生物的相互作用知之甚少[15]。
近十年高通量测序打开了微生物黑箱之门,但如何提取、分析与综合海量信息一直是难点[16]。分子生态网络方法利用测序数据可视化表达微生物种群复杂的潜在互作关系,探索不同生态过程、生态功能稳定性与复杂性及关键类群作用[17]。Zhou等[14]和Luo等[18]使用该方法研究了CO2水平升高和土豆连作环境下土壤细菌种群在网络结构、互作关系、关键物种上联系和差异。采矿作为高强度扰动,势必影响土壤物质养分循环。探索微生物种群的互作关系、寻找适应沉陷环境的关键类群、厘清矿山微生物群落分布的主控因素,对重建矿山生态系统自恢复力至关重要[19]。为此,选取黄土高原东坪煤矿、大柳塔煤矿采矿沉陷区作为研究对象,利用高通量测序技术和生态网络分析方法,探索在矿山干旱、贫瘠、污染等特定环境条件下土壤微生物的发育与适应状况、微生物种群与环境之间互作及互馈机制,寻找对生态自恢复起关键作用的功能类群,为黄土高原生态恢复和绿色矿山建设服务。
1 材料与方法 1.1 研究区概况黄土高原聚集了中国50%煤炭生产能力,资源储量丰富,开采历史悠久,生态破坏严重。本研究区选取东坪煤矿和大柳塔煤矿,二者均为黄土高原典型的采矿沉陷区。东坪煤矿位于山西省阳泉市盂县(113°15′E~113°18′E,38°01′N~38°03′N),属于温带大陆性气候,年均气温8.7℃,年均降水450.0~550.4 mm。1982年正式投产,多年采矿造成地表塌陷、裂缝纵横,水土流失严重,土壤贫瘠,植被覆盖下降,甚至形成裸地。大柳塔煤矿位于陕西省榆林市神木县(110°12′E~110°23′E,39°13′N~39°22′N),属于温带大陆性气候,年均气温8.6℃,年均降水290.4~410.3 mm。1996年正式开采,地下采空区占比70%,长期开采造成地下水位下降,地表干砂层增厚,土壤含水率下降,灌木、草类大面积枯死。
1.2 样品采集与分析2018年8月15日—18日在东坪煤矿(Dongping,记为DP)和大柳塔煤矿(Daliuta,记为DLT)沉陷区分别采集了24个样品。土壤水分(Soil water content,SWC)、温度(Soil temperature,ST)采用便携式温度湿度仪(TR-6,广东顺科达,广州)现场速测法测定。再五点采样法采集0~10 cm表土混合样500 g,使用无菌专用袋密封包装,车载冰箱冷藏送回实验室处理。一份新鲜土样泡沫箱冷藏、密封后直接邮寄至上海派森诺测序,另一份土样室内自然风干后剔除石砾、动植物残体,磨碎过100目筛,测定土壤理化和酶活性质[20-21]。
土壤pH和电导率(Electronic Conductivity,EC)采用电位法(水︰土=1︰5)测定(DDS-307A,上海雷磁)。土壤机械组成和土壤黏粒占比(Clay percent,CP)采用比重计法测定。土壤有机质(Soil organic matter,SOM)采用重铬酸钾氧化—比色法测定,土壤有效磷(Available phosphorus,AP)釆用碳酸氢铵浸提—钼锑抗比色法测定,土壤速效钾(Available potassium,AK)釆用醋酸铵浸提—火焰光度计(TAS-990,北京普析)法测定,土壤铵态氮(Ammonium nitrogen,AN)用氯化钾浸提—紫外分光光度法测定,土壤硝态氮(Nitrate-nitrogen,NN)用氯化钙浸提—紫外分光光度法测定[20]。脱氢酶(Dehydrogenase,DHG)活性采用氯化三苯基四氮唑法测定,脲酶(Urease,URA)活性用苯酚钠—次氯酸钠比色法测定,蛋白酶(Protease,PRO)活性用茚三酮比色法测定[21]。
1.3 DNA提取与纯化及PCR扩增和高通量测序采用E.Z.N.ATM Mag-Bind Soil DNA Kit提取48个土壤样品的DNA,对16S rRNA的V4和V5区进行PCR扩增,引物为515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和907R(CCGTCAATTCMTTTRAGTTT);98℃预变性2 min,98℃变性15 s,55℃退火30 s,72℃延伸30 s,25个循环,72℃延伸5 min,降温至10℃,进行PCR扩增。再用2%琼脂糖凝胶电泳进行PCR扩增产物检测,用凝胶回收试剂盒(Axygen,美国)对目标片段进行切胶回收。按照前述电泳定量结果,选取Quant-iT PicoGreen dsDNA Assay Kit荧光试剂,Microplate reader(FLx800,BioTek,美国)定量仪器,将PCR扩增回收产物进行荧光定量,对各样本按等比混合。利用Illumina公司(Illumina,美国)开发的文库制备试剂盒制备测序文库。构建好的合格文库,使用HiSeq2500 PE2500(Illumina,美国)进行上机测序,具体委托上海派森诺测序。
1.4 分子生态网络分析选取16S rRNA测序数据使用http://ieg4.rccc.ou.edu/mena平台构建和统计分析土壤微生物分子生态网络,本研究共构建了4个网络[14,17]。具体方法为:平行样本中的OTU(Operational taxonomic unit,操作分类学单位)数加和大于等于120的OTU(前75%)按log10转换,计算OTUs之间的皮尔森(Pearson)相关系数,并转换为相似矩阵。选择最优相似阈值,利用每对节点之间的连接强度构成邻接矩阵,分析最近邻间距分布特征值预测分子生态网络。利用Cytocape 3.7.1软件可视化处理分子生态网络,一个网络被分成多个模块,每个模块代表一个功能单位。利用模块内连接度(Zi)与模块间连接度(Pi)对网络节点功能进行划分。网络节点代表微生物群落中的种群或环境因子,节点之间的连接线代表物种或者环境因子之间的相互关系。
1.5 数据统计与处理基于galaxy平台(http//:mem.rcees.ac.cn.8080/)计算阿尔法(Alpha)多样性指数,并进行主成分分析(Principal Component Analysis,PCA)、非度量多维尺度(Non-metric multidimensional scaling,NMDS)分析、典范对应分析(Canonical Correspondence Analysis,CCA)、曼特尔检验(Mantel Test)及热图分析。采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA,Analysis of Variance);用Origin9.0软件绘制土壤微生物群落在不同分类水平上的丰度图。
2 结果 2.1 采煤沉陷对土壤环境因子的影响从图 1可以看出,采煤沉陷对土壤环境因子产生了显著的影响,但不同的沉陷深度对土壤环境因子的影响程度不同,方向不一。DLT沉陷区土壤pH、土壤温度随沉陷深度变大,土壤有机质、含水率、温度随沉陷深度减小,土壤有机质、含水率、黏粒占比随沉陷深度变大,但AN呈随机分布。尽管DLT和DP均处黄土高原,但采煤沉陷造成的土壤环境黏粒占比和铵态氮随沉陷深度减小,土壤含水率和黏粒占比尤为显著。DP沉陷区土壤pH、土壤因子变化差异明显。地形特征与植被覆盖变化可能是重要因素,DLT属内蒙草原,地形平坦,沉陷深处通常土壤沙化、植被退化、盐度上升,沉陷浅处一般维持草或灌草;DP则为丘陵区,沉陷对其影响不明显,但会造成坡面上部的拉伸、断裂以及下部的挤压。上部尽管沉陷深度小,但根系和水份受损严重,植被枯死。因此,DLT和DP土壤环境因子对采煤沉陷表现为不同的响应。
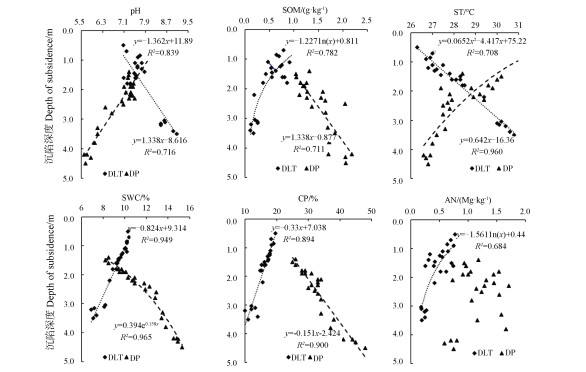
|
注:SOM:土壤有机质;ST:土壤温度;SWC:土壤含水率;CP:黏粒占比;AN:铵态氮。下同。 Note: SOM: Soil organic matter; ST: Soil temperature; SWC: Soil water content; CP: Clay percent; AN: Ammonium nitrogen. The same below. 图 1 东坪(DP)和大柳塔(DLT)煤矿采煤沉陷深度与土壤环境因子间的相互关系 Fig. 1 Relationships of depth of subsidence with soil environmental factors in the Dongping (DP) and Daliuta (DLT) Coal Mine |
本研究DP全部24个样品共检测到1 152 916条有效序列,每个样品序列数量介于30 615~54 632条。DLT全部24个样品共检测到902 912条有效序列,每个样品序列数量介于32 834~41 666,分布更为均匀。采用97%相似水平对测序获得的OTU进行归类划分,土壤微生物Alpha多样性计算结果见表 1。超1指数显示DP土壤微生物群落丰富度高于DLT,但香农(Shannon)指数接近,又说明两处微生物群落结构多样性几乎相同。反辛普森(Inv_Simpson)指数、皮洛均匀度(Pielou_evenness)指数和辛普森均匀度(Simpson_evenness)指数的计算结果表明DLT土壤微生物群落均匀度高于DP。
|
|
表 1 东坪和大柳塔煤矿采煤沉陷区土壤微生物Alpha多样性指数 Table 1 Alpha diversity index of soil microorganisms in mining subsidence area of DP and DLT Coal Mine |
DP和DLT各24个样品中的微生物被归类为34和39个细菌门,放线菌门(Actinobacteria)最为丰富,分别占25.6%和28.9%(图 2a)、图 2b))。DP所有样本中相对丰度大于1%的优势菌门有10个,而DLT所有样本中相对丰度大于1%的优势菌门有8个。尽管二处土壤主要菌门相似,但丰度有明显的不同。此外,DP较DLT多了2个优势菌门,即硝化螺旋菌门(Nitrospira,2.2%)和蓝细菌门(Cyanobacteria,1.7%)(图 2a))。为了进一步区分两组样品的差异,对相对丰度排名前15(TOP 15)的属进行分析,结果显示,DP所有样本中相对丰度大于1%的属有RB41(2.5%)、Solirubrobacter(1.9%)、Roseiflexus(1.8%)、Gaiella(1.4%)和Lysobacter(1.1%)(图 2c)),而DLT所有样本中相对丰度大于1%的属有Nocardioides(3.3%)、RB41(2.9%)、Solirubrobacter(2.1%)和Roseiflexus(1.2%)(图 2d))。其他TOP 15菌属的相对丰度也差异明显。
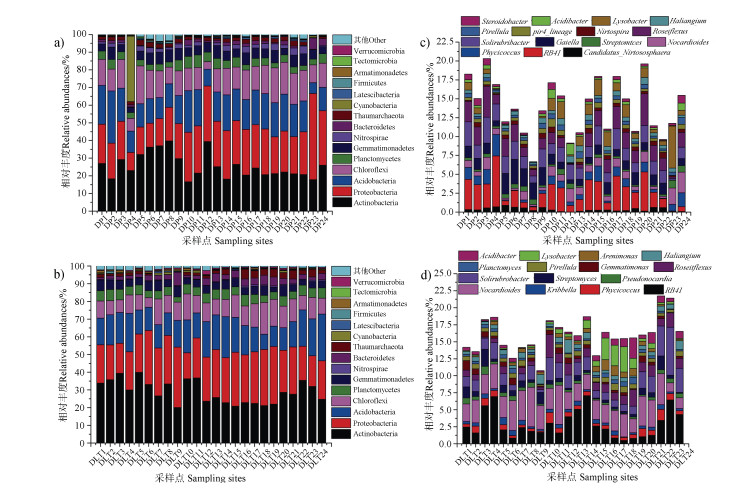
|
图 2 东坪和大柳塔煤矿采煤沉陷区土壤微生物细菌群落在门水平(a)、b))和属水平(c)、d))上丰度 Fig. 2 Abundance of soil bacterial communities at the phylum (a), b)) and genus (c), d)) levels in the DP and DLT Coal Mine |
选取24个样本序列中OTU数加和大于等于120作为输入项,构建DP和DLT微生物分子生态网络,具体参数见表 2。R2 > 0.75且主要参数高于随机网络,表明网络具有可靠性[18]。DP网络的节点、连接线和平均连接度远高于DLT,反映前者群落更为复杂。DP平均聚类系数、最大连接数、传递性指数远高于DLT,说明各菌群间联系更紧密、关系更复杂,传递性更强。但DP网络测量效率、模块属性低于DLT,表明后者对抗外界变化的抗性更高,反应更快。
|
|
表 2 东坪与大柳塔煤矿采煤塌陷区土壤微生物细菌群落的分子生态网络拓扑参数 Table 2 Topological parameter of molecular ecological networks of bacterial communities in the DP and DLT Coal Mine |
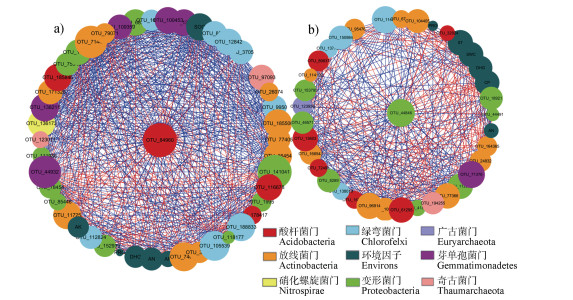
不同节点借助模块内或模块间连接性在网络中发挥作用,为此可从模块内连接度(Zi)和模块间连接度(Pi)判断一些类群或功能是否起决定作用。一般将Zi≥2.5或Pi≥0.62的节点视为关键物种[14]。从图 3可以看出,大于97.4%的节点是外围节点,DP含6个模块枢纽节点,分别是OTU_9950和OTU_105680(绿弯菌门)、OTU_11725和OTU_18161(放线菌门)、OTU_97093(奇古菌门)以及OTU_84960(酸杆菌门)。DLT仅含2个模块枢纽节点,分别是OTU_133539(变形菌门)和OTU_81764(放线菌门)。这8个OTU可能是两处群落的关键物种,但无连接节点和网络枢纽节点,说明无支配种。
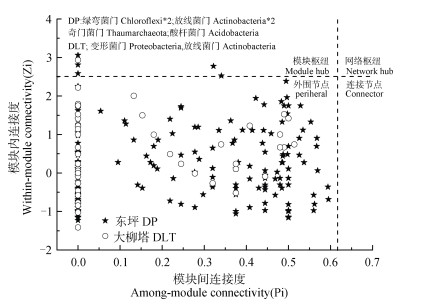
|
图 3 东坪和大柳塔煤矿采煤沉陷区土壤微生物分子生态网络Z-P图 Fig. 3 Plots of soil bacterial molecular ecological networks Z-P in the DP and DLT Coal Mine |
分子生态网络可视化图显示各物种之间的相互关系,DP网络含7个模块,OTU_84960(酸杆菌门)、OTU_105680(绿弯菌门)、OTU_44932(芽单胞菌门)、OTU_111599(变形菌门)和OTU_122057(奇古菌门)具有最高的连接度,介于50~62,它们均属于模块3(图 4a))。可以推断,模块3应为DP网络的关键模块,而OTU_84960和OTU_105680是关键物种。DLT网络含5个模块,最大的5个节点是OTU_133539(变形菌门)、OTU_74153(变形菌门)、OTU_16577(绿弯菌门)、OTU_25372和OTU_124598(放线菌门),连接度介于11~22,均属于模块1,OTU_133539是关键物种(图 4b))。此外,DP网络各节点间正相关关系优势明显,说明该区土壤微生物为应对沉陷造成的养分贫瘠时趋向相互合作(图 4a))。DLT网络中模块减少,模块间连接线也少。一些模块内正相关关系优于负相关,说明该区微生物对抗外界干扰的抗性不断增强,有助于提升土壤的自恢复潜力(图 4a))。
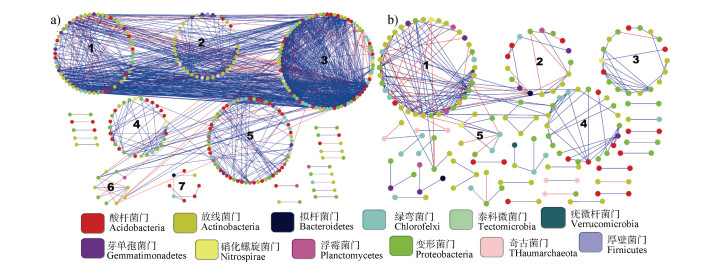
|
注:连线代表菌群之间的相互作用,蓝色代表正向,红色代表负向。阿拉伯数字1,2,3等代表模块。 Note: The connection line represents interaction between microbial groups, with blue representing positive and red representing negative. Arabic numbers, such as 1, 2 and 3, stand for module numbers. 图 4 东坪(a))和大柳塔(b))煤矿采煤沉陷区土壤微生物分子生态网络图 Fig. 4 Plots of the soil bacterial molecular ecological networks in the DP(a)) and DLT(b)) Coal Mine |
将OTUs和土壤理化性质进行Mantel Test分析,结果显示DP土壤微生物OTUs与SWC、AP、NN、AN及URA呈显著性相关(P < 0.05),DLT土壤微生物OTUs与pH、ST、SWC、CP、DHG及PRO呈显著性相关(P < 0.05)(表 3)。土壤微生物OTUs与多环境因子存在显著性相关,且驱动微生物演替的主控因子组合明显不同,说明矿山土壤微生物群落变化不是单一因子驱动的,受多重环境因子叠加作用驱动。
|
|
表 3 东坪和大柳塔煤矿采煤沉陷区土壤微生物OTUs与环境因子曼特尔检验 Table 3 Mantel Test of soil microbial OTUs with environmental factors in the DP and DLT Coal Mine |
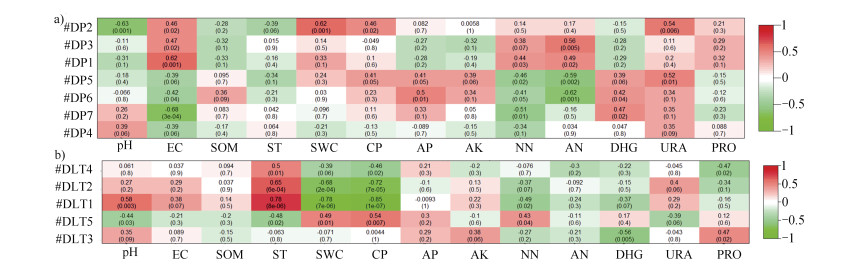
为厘清土壤微生物演替的驱动力,将图 4a)、图 4b)中大于5个节点的模块与环境因子作热图分析(图 5)。结果表明:DP网络中模块1、2、3与EC呈显著正相关,模块2与SWC呈显著正相关,模块6与AP呈显著正相关,模块1与NN呈显著正相关,模块1和3与AN呈显著正相关,模块6和7与DHG呈显著正相关,模块2和5与URA呈显著正相关。pH与模块2呈显著负相关,SOM、AK和PRO与任何模块均无显著相关性(图 5a))。DLT网络中模块1与pH、ST呈显著正相关,模块2与ST呈显著正相关,模块1、2与SWC、CP呈显著负相关,模块5与NN呈显著正相关,模块3与PRO呈显著正相关。DHG与模块3呈显著负相关(图 5b))。特征模块中优势物种通常是网络的关键物种,不同模块与环境因子之间的驱动关系解释了微生物群落对环境变化的不同响应,结果也反证了前述OTUs与环境因子之间的相互关系。
|
图 5 东坪(a))和大柳塔(b))煤矿采煤沉陷区主要模块层次结构及其与环境因子的相关关系 Fig. 5 Relationships of the hierarchies of the main modules with environmental factors in the DP(a)) and DLT(b)) Coal Mine |
尽管DP和DLT微生物群落多样性存在着一定的差异,但相对丰度最高的菌门几乎完全一致,即放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)(图 2)。这说明沉陷已干扰土壤微生物区系发育,微生物不断地调整自身的结构并对沉陷环境作普适性变化。放线菌门具有特征性丝状形态,又有降解和利用有机物的潜在能力[22],它更适应在矿山恶劣环境中生存。变形菌门具有多样化的生物地理分布,富含能降解各种污染物的好氧菌以及促生氧化酶的菌群[23]。黄土高原矿区地表沉陷后上覆土壤普遍干燥,无法形成积水,裂缝、滑坡、拉伸加大了土体孔隙度,更利于好氧菌的发育,并成为优势菌门。酸杆菌门在矿山土壤酸化生态过程起重要作用,并广泛分布于各种恶劣的自然环境中[24]。部分绿弯菌门的微生物具有固碳生态功能,这种功能在采煤沉陷区贫瘠土壤中显得尤为重要,亦有报道,当土壤变得更加缺氧时,绿弯菌门会增加[25]。这好像与变形菌门成为优势菌门存在矛盾,事实上更说明了沉陷土壤的环境复杂性,丘陵沉陷的坡底或平原沉陷的谷底通常受挤压,土体孔隙度减少,甚至形成季节性或间歇性积水。这有利于绿弯菌门的生存,并发育为相对丰度高的菌门。从微生物群落菌门组成和网络模块可以推测,土壤微生物群落依据矿山特定的环境作适应性变化,沉陷区地形特征和土地利用进一步修饰了土壤微生物区系的演替。
3.2 采煤沉陷区土壤微生物的关键类群分子生态网络分析可揭示土壤微生物菌属间相互作用,如模块化、小区域或无尺度。DP和DLT网络中存在一些蜂窝特征,有效地促进不同物种间的沟通并提升对采矿干扰的响应能力。DP网络较DLT复杂且连接更加紧密(表 2、图 4),具备更高的干扰耐受性[26]。DP和DLT网络特征显示微生物组间的相互作用以及所涉及的物种变化,尤其是优势物种的变化(图 3和图 4)。DLT网络复杂性更低,因此更易对生物地球化学功能产生负面影响,从而导致微生物群落呈不稳定或更脆弱的状态。尽管DP和DLT均属黄土高原,但二者的自然参数仍有差异,如降水、气温和土地利用。事实上在微生物群落结构与组成相似的条件下,不同的网络复杂性差异也暗示除矿山环境要素外,自然参数也重要的影响因子,如DP微生物群落多样性低于DLT(表 1、图 2)。地理特性、土地利用可能以不同的方式影响着微生物群落多样性和网络关系,未来仍需进一步证实。
分子生态网络分析也为探寻关键类群提供了便利,关键类群在微生物组中发挥重要作用,缺失或导致微生物结构和功能发生重大变化[15]。尽管先前研究报道了各种环境中的关键类群[6,22],但有关受损矿山土壤关键类群的报道几乎空白。本研究依据网络参数识别了DP土壤微生物关键类群,连接线大于50的OTU_84960(酸杆菌门)等5个节点和OTU_105680(绿弯菌门)等6个模块枢纽中优势物种作为关键类群。虽然图 2c)显示OTU_97093(奇古菌门)和OTU_44932(芽单胞菌门)的相对丰度并不高,但并不影响它们的重要作用,这表明相对丰度与关键功能之间缺乏有效的关联[27]。OTU_44932所属的芽单胞菌门被认为既可在有氧条件又可无氧条件下生长[28],具备广泛的适应性是它能够成为采煤沉陷环境中关键类群的重要原因。OTU_97093属于的奇古菌门是第一个被确定参与硝化作用的古细菌[29],可以氧化极低浓度的铵以应对采矿沉陷导致的土壤养分贫瘠环境。连接线大于11 OTU_133539(变形菌门)等5个节点和OTU_81764(放线菌门)等2个模块枢纽中优势物种作为DLT网络的关键类群,DLT的关键类群不同于DP,且较少。Ezeokoli等[30]研究露天煤矿沙化土壤微生物群落时未发现关键类群,尽管与本研究的发现有所不同,但均说明采矿扰动易损害微生物群落,并对土壤养分循环和生态系统可持续性产生负面作用。
3.3 采煤沉陷区土壤微生物群落与环境因子的互馈机制模块中OTUs的联系反映微生物菌群间的相互作用,也表明对共同环境参数的响应。负载重要功能的OTUs通常随环境变化改变在网络中的角色,模块成员、拓扑角色和系统发育提供有用的信息来识别关键OTU。因此,了解土壤微生物类群间的互作及环境适应性可为矿山生态恢复提供洞察力,尤其是对人为干扰的响应,具有重要意义[22,27]。土壤pH、水分含量、有机碳等环境因子对矿区生态恢复中土壤细菌群落结构和组成具有较大影响,Xiao等[31]研究认为土壤环境因子在不同程度上影响土壤微生物活性,且微生物在养分循环利用和土壤肥力中起着至关重要的作用;da Silva等[32]发现土壤微生物学特性在一定程度上影响微生物生物量碳和微生物的呼吸作用。微生物是矿山土壤质量提升、生物多样性恢复的重要手段,因此,理解微生物重要功能群与土壤因子间的关系对矿山生态恢复至关重要。
本研究发现模块、节点连通性与环境因子之间存在显著相关性,如DP网络中,分属模块1、2、3的是关键菌群OTU_18161(放线菌门)、OTU_97093(奇古菌门)、OTU_105680(绿弯菌门)和OTU_84960(酸杆菌门)与EC密切相关(表 3、图 4和图 5),这可能与采矿干扰土壤壤中流导致浸出液水溶性盐含量变化有关,从而影响微生物群落。Sun等[11]发现煤矿区土壤细菌分布主要受SOM、AK和AP的影响。DP网络中模块6与AP显著相关(图 5a)),这可能与模块6中关键菌群OTU_11725(放线菌门)有关,磷是不可缺少的营养元素之一,受干扰微生物溶解一些难溶的磷酸盐参与自身新陈代谢,从而影响AP含量。不同采矿活动会影响土壤微生物丰度、分类学多样性和功能多样性。pH在代谢和遗传中非常重要,这与DLT模块1中关键菌群OTU_133539(变形菌门)与pH的关系相似,说明外部环境变量影响不同微生物组之间的相互关系,且这种变化与土壤特性密切相关。土壤酶活性对采煤沉陷引起的土壤环境变化反应十分迅速,本研究发现DP网络中模块2、模块5与URA显著相关,DLT网络模块3则与DHG及PRO显著相关(图 5b))。采煤沉陷扰动降低土壤含水量,影响土壤酶活性,长期无法修复将使土壤养分循环受阻[8-10]。
就相对丰度前50的OTU与土壤环境因子的网络互作关系而言,DP网络中环境因子SOM具有最高连接度,AN、DHG、AK次之,而DLT网络中,具有较高连接度的环境因的排序依次为ST、SWC、CP、DHG(图 6)。这些高连接度环境因子与占支配地位的放线菌门、变形菌门、酸杆菌门和绿弯菌门之间的连接也多,且不同的环境因子与OUT连接的相关关系不一。就网络参数而言,DP网络中属于酸杆菌门的OTU_84960(Holophagae)的连接度最高,且与土壤SOC、AP、AK、DHG和PRO直接相连呈负相关,与AN直接相连呈正相关,关系密切。DLT网络中OTU_44846(Aquabacterium)的连接度最高,且与土壤SWC、CP、DHG、AN和PRO直接相连且呈负相关,与ST直接相连呈正相关,关系密切。就环境适应性而言,Holophagae与Aquabacterium可视为沉陷土壤微生物群落优势菌群,或可助力今后黄土高原矿区生态恢复。
|
图 6 东坪(a))和大柳塔(b))煤矿采煤沉陷区相对丰度前50的OTU与土壤理化性状分子生态网络图 Fig. 6 Molecular ecological networks of the TOP 50 genera in OTU and soil physicochemical properties in the DP(a)) and DLT(b)) Coal Mine |
采煤通常对矿山土地生态系统产生颠覆式破坏,沉陷、裂缝、滑坡和堆压等高强度扰动势必干扰土壤物质养分循环,从而影响国土空间生态修复。本研究利用高通量测序和分子生态网络方法探索微生物类群间的互作关系,厘清矿山微生物群落分布的主控因素,寻找适应沉陷环境的关键功能群。沉陷环境对土壤微生物群落多样性、结构和分布模式影响显著,但放线菌门一直最为丰富。东坪煤矿分子生态网络互作关系较大柳塔煤矿更复杂、网络节点和连接数更多。一些关键类群,如放线菌门、绿弯菌门和奇古菌门与环境因子直接相连且关系密切。此外,为适应矿山土壤营养贫瘠,微生物种群间更偏向相互合作,其中Holophagae与Aquabacterium为优势关键菌群,或可助力矿山生态修复。本研究为脆弱矿山生态系统生态修复提供了一种新思路,未来进一步加强功能网络研究,丰富对自恢复机制的理解,为黄土高原生态恢复和绿色矿山建设服务。
| [1] |
Bian Z F, Miao X X, Lei S G, et al. The challenges of reusing mining and mineral-processing wastes[J]. Science, 2012, 337(6095): 702-703. DOI:10.1126/science.1224757
(  0) 0) |
| [2] |
Bai Z K, Zhou W, Wang J M, et al. Rethink on ecosystem restoration and rehabilitation of mining areas (In Chinese)[J]. China Land Science, 2018, 32(11): 1-9. [白中科, 周伟, 王金满, 等. 再论矿区生态系统恢复重建[J]. 中国土地科学, 2018, 32(11): 1-9.]
(  0) 0) |
| [3] |
Huang M H, Luo Y M. Land remediation and ecological restoration of mined land (In Chinese)[J]. Acta Pedologica Sinica, 2003, 40(2): 161-169. DOI:10.3321/j.issn:0564-3929.2003.02.001 [黄铭洪, 骆永明. 矿区土地修复与生态恢复[J]. 土壤学报, 2003, 40(2): 161-169.]
(  0) 0) |
| [4] |
Bian Z F, Lei S G, Jin D, et al. Several basic scientific issues related to mined land remediation (In Chinese)[J]. Journal of China Coal Society, 2018, 43(1): 190-197. [卞正富, 雷少刚, 金丹, 等. 矿区土地修复的几个基本问题[J]. 煤炭学报, 2018, 43(1): 190-197.]
(  0) 0) |
| [5] |
Ayala-Orozco B, Gavito M E, Mora F, et al. Resilience of soil properties to land-use change in a tropical dry forest ecosystem[J]. Land Degradation & Development, 2018, 29(2): 315-325.
(  0) 0) |
| [6] |
Fierer N. Embracing the unknown: Disentangling the complexities of the soil microbiome[J]. Nature Reviews Microbiology, 2017, 15(10): 579-590. DOI:10.1038/nrmicro.2017.87
(  0) 0) |
| [7] |
Zhu Y G, Shen R F, He J Z, et al. China soil microbiome initiative: Progress and perspective (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2017, 32(6): 554-565. [朱永官, 沈仁芳, 贺纪正, 等. 中国土壤微生物组: 进展与展望[J]. 中国科学院院刊, 2017, 32(6): 554-565.]
(  0) 0) |
| [8] |
Meng H Q, Xiong R P, Wang C, et al. Spatial variability of soil moisture, organic matter content and soil texture in coal mining subsidence area as affected by land use (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(4): 911-922. [孟红旗, 熊仁鹏, 王崇, 等. 采煤沉陷区不同土地利用类型土壤水分、有机质和质地的空间变异性[J]. 土壤学报, 2018, 55(4): 911-922.]
(  0) 0) |
| [9] |
Chen J, Mo L, Zhang Z C, et al. Evaluation of the ecological restoration of a coal mine dump by exploring the characteristics of microbial communities[J]. Applied Soil Ecology, 2020, 147: 103430. DOI:10.1016/j.apsoil.2019.103430
(  0) 0) |
| [10] |
Ngugi M R, Fechner N, Neldner V J, et al. Successional dynamics of soil fungal diversity along a restoration chronosequence post-coal mining[J]. Restoration Ecology, 2020, 28(3): 543-552. DOI:10.1111/rec.13112
(  0) 0) |
| [11] |
Sun S Y, Sun H, Zhang D S, et al. Response of soil microbes to vegetation restoration in coal mining subsidence areas at Huaibei coal mine, China[J]. International Journal of Environmental Research and Public Health, 2019, 16(10): 1757. DOI:10.3390/ijerph16101757
(  0) 0) |
| [12] |
Ezeokoli O T, Mashigo S K, Maboeta M S, et al. Arbuscular mycorrhizal fungal community differentiation along a post-coal mining reclamation chronosequence in South Africa: A potential indicator of ecosystem recovery[J]. Applied Soil Ecology, 2020, 147: 103429. DOI:10.1016/j.apsoil.2019.103429
(  0) 0) |
| [13] |
Dimitriu P A, Prescott C E, Quideau S A, et al. Impact of reclamation of surface-mined boreal forest soils on microbial community composition and function[J]. Soil Biology and Biochemistry, 2010, 42(12): 2289-2297. DOI:10.1016/j.soilbio.2010.09.001
(  0) 0) |
| [14] |
Zhou J Z, Deng Y, Luo F, et al. Functional molecular ecological networks[J]. mBio, 2010, 1(4): e110-e169. DOI:10.1128/mbio.00169-10
(  0) 0) |
| [15] |
Delgado-Baquerizo M, Oliverio A M, Brewer T E, et al. A global atlas of the dominant bacteria found in soil[J]. Science, 2018, 359(6373): 320-325. DOI:10.1126/science.aap9516
(  0) 0) |
| [16] |
Wang S P, Brose U. Biodiversity and ecosystem functioning in food webs: The vertical diversity hypothesis[J]. Ecology Letters, 2018, 21(1): 9-20. DOI:10.1111/ele.12865
(  0) 0) |
| [17] |
Deng Y, Zhang P, Qin Y J, et al. Network succession reveals the importance of competition in response to emulsified vegetable oil amendment for uranium bioremediation[J]. Environmental Microbiology, 2016, 18(1): 205-218. DOI:10.1111/1462-2920.12981
(  0) 0) |
| [18] |
Luo C W, Rodriguez-R L M, Johnston E R, et al. Soil microbial community responses to a decade of warming as revealed by comparative metagenomics[J]. Applied and Environmental Microbiology, 2014, 80(5): 1777-1786. DOI:10.1128/AEM.03712-13
(  0) 0) |
| [19] |
Liu Y, Lei S G, Gong C G. Comparison of plant and microbial communities between an artificial restoration and a natural restoration topsoil in coal mining subsidence area[J]. Environmental Earth Sciences, 2019, 78(6): 1-13.
(  0) 0) |
| [20] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [21] |
Guan S Y. Soil enzyme and its research method (In Chinese). Beijing: China Agriculture Press, 1986. [关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.]
(  0) 0) |
| [22] |
Banerjee S, Walder F, Büchi L, et al. Agricultural intensification reduces microbial network complexity and the abundance of keystone taxa in roots[J]. bioRxiv, 2018. DOI:10.1101/416271
(  0) 0) |
| [23] |
Ma J, Zhang W Y, Zhang S L, et al. Short-term effects of CO2 leakage on the soil bacterial community in a simulated gas leakage scenario[J]. PeerJ, 2017, 5: e4024. DOI:10.7717/peerj.4024
(  0) 0) |
| [24] |
Liu J J, Sui Y Y, Yu Z H, et al. Diversity and distribution patterns of acidobacterial communities in the black soil zone of northeast China[J]. Soil Biology and Biochemistry, 2016, 95: 212-222. DOI:10.1016/j.soilbio.2015.12.021
(  0) 0) |
| [25] |
Chen F, Zhang W Y, Ma J, et al. Experimental study on the effects of underground CO2 leakage on soil microbial consortia[J]. International Journal of Greenhouse Gas Control, 2017, 63: 241-248. DOI:10.1016/j.ijggc.2017.05.017
(  0) 0) |
| [26] |
Hunt D E, Ward C S. A network-based approach to disturbance transmission through microbial interactions[J]. Frontiers in Microbiology, 2015, 6: 1182.
(  0) 0) |
| [27] |
Wang X L, Wang M X, Xie X G, et al. An amplification-selection model for quantified rhizosphere microbiota assembly[J]. Science Bulletin, 2020, 65(12): 983-986. DOI:10.1016/j.scib.2020.03.005
(  0) 0) |
| [28] |
Park D, Kim H, Yoon S. Nitrous oxide reduction by an obligate aerobic bacterium, Gemmatimonas aurantiaca strain T-27[J]. Applied and Environmental Microbiology, 2017, 83(12): 502-517. DOI:10.1128/aem.00502-17
(  0) 0) |
| [29] |
Bergauer K, Sintes E, van Bleijswijk J, et al. Abundance and distribution of archaeal acetyl-CoA/propionyl-CoA carboxylase genes indicative for putatively chemoautotrophic Archaea in the tropical Atlantic's interior[J]. FEMS Microbiology Ecology, 2013, 84(3): 461-473. DOI:10.1111/1574-6941.12073
(  0) 0) |
| [30] |
Ezeokoli O T, Mashigo S K, Paterson D G, et al. Microbial community structure and relationship with physicochemical properties of soil stockpiles in selected South African opencast coal mines[J]. Soil Science and Plant Nutrition, 2019, 65(4): 332-341. DOI:10.1080/00380768.2019.1621667
(  0) 0) |
| [31] |
Xiao L, Bi Y L, Du S Z, et al. Effects of re-vegetation type and arbuscular mycorrhizal fungal inoculation on soil enzyme activities and microbial biomass in coal mining subsidence areas of Northern China[J]. Catena, 2019, 177: 202-209. DOI:10.1016/j.catena.2019.02.019
(  0) 0) |
| [32] |
da Silva E P, de Armas R D, Ademar Avelar Ferreira P, et al. Soil attributes in coal mining areas under recovery with bracatinga(Mimosa scabrella)[J]. Letters in Applied Microbiology, 2019, 68(6): 497-504. DOI:10.1111/lam.13153
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


