硒是人体必需的微量营养元素,人体硒摄入不足会导致一系列健康问题,诸如免疫力低下、生育能力降低和增加癌症患病风险[1]。通过主食稻米来增加人体硒摄入是一条非常理想的途径,然而75%的水稻样品不能够满足人类日常硒需求[2]。叶面喷硒可增加水稻籽粒硒含量,但长期喷硒不仅加大生产成本,还可能造成局部环境污染,过量易对人体健康造成毒害[3]。如能通过合理的农艺措施来调控土壤硒的生物有效性,增加水稻可食部分的硒含量,从而增加人类硒摄入,是硒生物强化最理想的策略,是从源头上调控硒营养的根本出路。
土壤硒生物地球化学循环由化学转化过程和生物转化过程共同参与。土壤氧化还原电位(Eh)和酸碱度(pH)对土壤硒形态的化学转化起着主要作用[4],而水分管理措施很大程度上影响着稻田土壤Eh和pH,最终控制着稻田硒的生物有效性[5]。在好氧的中性至碱性土壤环境中,硒主要以硒酸盐形态存在;在厌氧的土壤环境中,主要以亚硒酸盐形态存在。在酸性条件下,元素硒和硒化物则是主要的存在形态[6]。不同形态硒的生物有效性不同,硒酸盐和亚硒酸盐是水溶性的,其中硒酸盐不能被土壤吸附,而亚硒酸盐可被土壤固相中铁锰氧化物或水化物牢牢吸附,导致溶解性降低[7],所以硒酸盐较亚硒酸盐具有更高的植物可利用性。因此,科研人员试图发现一个经济有效的稻田水分管理方法来增加水稻籽粒硒含量。研究表明,旱作较淹水栽培的土壤孔隙水中硒浓度更高,进而增加了水稻籽粒硒含量[8]。另一方面,硒的微生物转化是将硒从一种形态变为另一种形态的驱动力,近年来的研究表明,微生物能够还原Se(Ⅳ)、Se(Ⅵ)→Se(0)[9],该过程可能降低了硒的生物有效性;而微生物对硒的氧化作用Se(0)→Se(Ⅳ)、Se(Ⅵ)报道较少,该过程有望增加硒的生物有效性。然而,到目前为止,稻田水分管理方式和根域相对微氧环境对土壤硒生物有效性及根际微生物对稻田硒循环的重要作用机制尚未阐明。
近年来,各地研制并推广了多种水分管理模式(如干湿交替、好氧灌溉),不仅能够减少灌溉用水量,而且是保证水稻高产高效的重要措施[10]。水分管理很大程度上影响着稻田土壤的氧化还原电位和酸碱度,进而控制着稻田硒的化学转化以及微生物转化过程,最终影响水稻籽粒硒积累。基于以上背景,研究不同水分管理模式下水稻根际土壤中硒的形态转化规律、水稻籽粒硒积累、水稻根际土壤细菌群落多样性三者间的关系,揭示水分管理影响水稻吸收积累硒的作用机制,为从源头上、生产上有效调控硒由稻田向农产品传递以及满足人类硒营养健康具有重要的理论和现实意义。
1 材料与方法 1.1 供试材料供试水稻品种为晶两优534。供试土壤采自重庆市北碚区西南大学试验农场,采用多点取样法采集20~30 cm土层,土壤类型为普通紫色湿润雏形土(中性紫色土),其基本理化性质如下:pH 6.8,有机质10.14 g·kg–1,碱解氮73.56 mg·kg–1,有效磷15.32 mg·kg–1,速效钾171.3 mg·kg–1,全硒0.27 mg·kg–1。供试土壤经自然风干后磨碎过筛,充分混匀用于盆栽试验。
1.2 试验设计本试验在西南大学资源环境学院植物营养学植物培养室内进行(白天光照时间14 h,光强度260~350 μmol·m–2·s–1,白天温度28℃,夜晚温度20℃,相对湿度60%~70%)。盆栽试验所用的培养钵为聚乙烯盆(直径24 cm,高30 cm),每盆装土9 kg。2019年6月5日施基肥,肥料用量分别为N 300 mg·kg–1,P2O5 100 mg·kg–1,K2O 300 mg·kg–1,分别以尿素、过磷酸钙和硫酸钾作为肥源,同时所有处理添加亚硒酸钠1.00 mg·kg–1与土壤充分混匀,加水平衡一周后进行水稻移栽,移栽60 d后进行追肥,追施尿素0.3 g·kg–1,硫酸钾0.05 g·kg–1,每盆根际袋内移栽2株,水稻移栽后即进行不同水分管理处理。本试验设置3种水分管理处理,(1)淹水灌溉F(长期淹水,保持水层2 cm至作物收获前2周);(2)好氧灌溉A(长期保持土壤湿润,无明显积水);(3)干湿交替灌溉AFA(淹水与灌溉交替进行,24 d为一个周期),每个处理重复3次。
1.3 样品采集与分析自水稻移栽20 d后,每隔12天测定一次土壤pH、Eh:使用pH、Eh计测定[11]。
分别在水稻的分蘖期(40 d)、抽穗期(60 d)和成熟期(110 d)取根际袋内的土壤,风干后过0.149 mm筛待用。测定土壤中不同硒形态的含量,分级提取依据瞿建国等[12]的逐级连续浸提方法。提取之后,各形态提取液需在95℃、6 mol·L–1盐酸介质中还原15 min后用原子荧光光谱仪(AFS,AFS-920,北京吉天仪器有限公司)测定。
成熟期测定水稻根、茎、叶、籽粒中的硒含量:各部位进行分别粉碎,样品用HNO3:HClO4(4:1)混合消煮,消化同Zhang等[13]的方法。消化待测液采用原子荧光光谱仪(AFS,AFS-920,北京吉天仪器有限公司)进行测定。空白样品同时进行消化,硒回收率为95%~105%。
收获后测定水稻株高、有效穗数以及产量。
1.4 土壤微生物多样性分析水稻收获前,取根际袋中的鲜土用于土壤微生物多样性测定。1)DNA抽提和PCR扩增:水稻根际土壤总DNA的抽提使用E.Z.N.A.® soil试剂盒(Omega Bio-tek,Norcross,GA,美国),该试剂盒可快速(60 min内可处理1 g土壤)可靠地从各种土壤样本中分离出高质量的基因组DNA。用1%琼脂糖凝胶电泳检测DNA提取质量后,用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')引物对V3~V4可变区进行PCR扩增,扩增程序为:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),最后72℃延伸10 min(PCR仪:ABI GeneAmp® 9700型)。2)Illumina Miseq测序:使用2%琼脂糖凝胶回收PCR产物,纯化后洗脱检测。根据Illumina MiSeq平台(Illumina,San Diego,美国)标准操作规程构建文库,利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。Miseq测序得到的原始数据经过拼接质控后得到优化数据,区分样本后进行OTU(Operational taxonomic unit,操作分类单元)聚类分析和物种分类学分析,可以对OTU进行多种多样性指数分析,以及在各个分类水平上进行群落结构的统计分析,进而完成样本群落组成和系统发育信息的多元分析和差异显著性检验等一系列深入的统计学和可视化分析。
1.5 数据处理采用Microsoft Excel 2007软件整理数据后,用SPSS 18.0软件进行数据的方差分析,用邓肯(Duncan)检验法进行差异显著性比较。应用Mothur软件根据97%序列的相似度,将序列归为多个OTU并生成稀释曲线,计算覆盖率(Coverage)、超(Chao)、香农(Shannon)、香农埃文(Shannoneven)指数。有关指数的算法如下[14-16]:
| $C = 1 - \frac{{{n_1}}}{N} $ | (1) |
| ${S_{{\rm{chao}}}} = {S_{{\rm{obs}}}} + \frac{{{n_1}({n_1} - 1)}}{{2({n_2} + 1)}} $ | (2) |
| ${H_{{\rm{shannon}}}} = - \sum\nolimits_{i = 1}^{{S_{{\rm{obs}}}}} {\frac{{{n_i}}}{N}} \ln \frac{{{n_i}}}{N} $ | (3) |
| ${J_{{\rm{shannon}}}} = \frac{H}{{{H_{\max }}}} = \frac{H}{{{{\log }_x}S}} $ | (4) |
式中,C、Schao、Hshannon、Jshannon分别表示覆盖率、超、香农、香农埃文指数。n1为仅含有一条序列的OTU数目;n2为仅含有两条序列的OTU数目;ni为第i个OTU所含的序列数;Sobs为实际观测到的OTU数;N为抽样中出现的总序列数目;Hmax为在物种丰富度相同时能够达到的最大香农指数;S为群落物种丰富度指数;x通常使用2、e等作为底数。
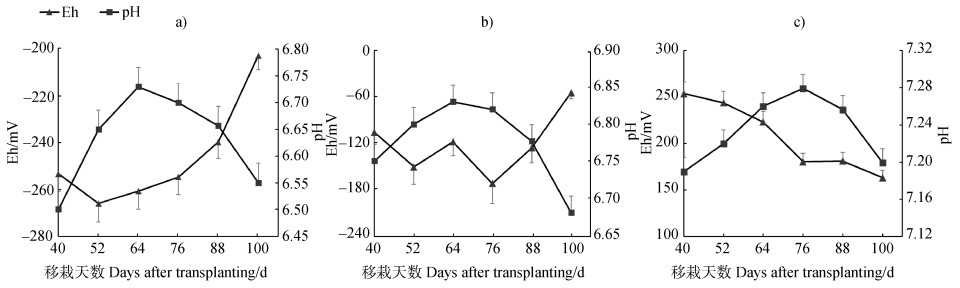
2 结果 2.1 水分管理对土壤pH和Eh的影响水稻移栽40 d后,每隔12天测定一次水稻土壤的pH、Eh。如图 1所示,好氧和干湿交替灌溉较淹水灌溉一定程度上提高了土壤pH,且随着处理时间的延长,好氧灌溉的土壤pH呈现小幅度的升高后降低的趋势,总体变化幅度不大。在整个水稻生育期,淹水(6.50~6.73)和干湿交替灌溉(6.68~6.83)的土壤pH呈现弱酸性,好氧灌溉(7.19~7.28)的土壤则接近中性。
|
图 1 淹水(F,a))、干湿交替(AFA,b))、好氧(A,c))灌溉处理下土壤pH、Eh的变化 Fig. 1 Variation of soil pH and Eh relative to treatment (flooded irrigation (F, a)), alternation of flooded and aerobic irrigation (AFA, b)) and aerobic irrigation (A, c))) |
对于土壤Eh而言,淹水和干湿交替灌溉在不同生育时期均显著低于好氧灌溉(P < 0.05)。淹水灌溉的土壤处于还原状态,氧化还原电位处于–203~261 mV,在移栽88 d之前变化幅度不大,88 d之后土壤Eh上升,这是由于在水稻收获前晒田,使得土壤含水量下降所致。干湿交替的土壤氧化还原电位随着水分管理方式的变化而改变,好氧灌溉的水稻土壤处于氧化状态,土壤Eh的变化范围为163~253 mV,随着处理时间的延长,土壤Eh有所下降。
2.2 水分管理对土壤硒组分含量变化的影响通过逐级连续浸提的方法测定了水稻根际土壤中不同形态硒含量,结果表明,不同形态硒含量由高到低依次为F5(残渣态)、F3(酸溶态)、F4(有机物结合态)、F2(可交换态)和F1(水溶态)。其中,残渣态占土壤全硒含量的52.11%~59.50%;酸溶态硒占土壤全硒含量的13.36%~16.12%;有机物结合态硒(包括碳酸盐以及铁锰氧化物结合态)占土壤全硒含量的11.73%~13.63%;可交换态硒占根际土壤全硒含量的10.01%~14.76%;水溶态硒含量最低,占土壤全硒含量的1.65%~7.28%(图 2)。

|
注:F1~F5分别表示水溶态、可交换态、酸溶态、有机物结合态、残渣态硒,下同。 Note: F1 ~ F5 stands for water-soluble, exchangeable, acid soluble, organism-bonded and residual selenium, respectively. The same below. 图 2 不同水分管理条件下根际土壤硒组分含量变化 Fig. 2 Variation of Se fractions in content in the rhizosphere soil relative to treatment |
在水稻分蘖期、抽穗期、成熟期,水稻根际土壤水溶态硒、可交换态硒含量呈现A > AFA > F处理的趋势,酸溶态硒、有机物结合态硒、残渣态硒含量呈现F > AFA > A的趋势。即好氧和干湿交替处理下,土壤有效态硒含量高于淹水处理。
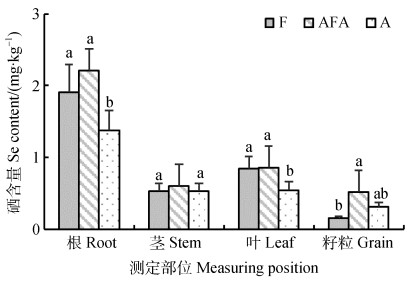
2.3 水分管理对水稻各器官硒含量变化的影响从图 3中可以看出,不同水分管理条件下水稻各器官的硒含量由高到低依次为根(1.38~2.22 mg·kg–1)、叶(0.55~0.85 mg·kg–1)、茎(0.53~0.61 mg·kg–1)、籽粒(0.15~0.53 mg·kg–1)。其中,水稻根中硒含量为水稻叶硒含量的2.26倍~2.59倍,是水稻茎的2.56倍~3.63倍,是水稻籽粒的4.21倍~9.01倍。A处理的水稻根中硒浓度最低,分别较F、AFA处理低38.33%、60.62%(P < 0.05)。三种不同水分管理条件对成熟期水稻茎中硒浓度的影响不显著,好氧灌溉下的水稻叶硒含量显著低于其他两种处理。干湿交替灌溉的水稻籽粒硒含量最高,且显著高于淹水灌溉,好氧灌溉的水稻籽粒硒含量较淹水高出0.16 mg·kg–1。
|
注:不同小写字母表示不同处理间存在显著差异(P < 0.05)。下同。 Note: Different lowercase letters indicate significant difference between treatments at P < 0.05. The same below. 图 3 不同水分管理条件下水稻各器官硒含量变化 Fig. 3 Variation of Se content in different organs of rice relative to treatment |
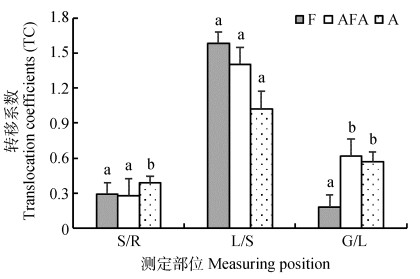
图 4呈现出不同水分管理条件对水稻硒转移系数的影响,TCS/R、TCL/S、TCG/L分别表示水稻茎/根、叶/茎、籽粒/叶中硒浓度的比值,反映出水稻硒在各器官中的转移状况。在水稻成熟期,好氧灌溉的TCS/R最高(0.39),显著高于淹水(0.29)及干湿交替(0.28)处理。三种不同水分管理条件对水稻茎向叶的转移系数不产生影响,好氧灌溉下水稻硒由叶到籽粒的转移系数显著低于其他两处理(图 4),且分别较干湿交替、淹水灌溉低70.55%、67.94%。
|
注:S、R、L、G分别表示水稻茎、根、叶、籽粒。 Note: S, R, L and G stands for stem, root, leaf and grain of rice, respectively. 图 4 不同水分管理条件下水稻各器官硒转移系数 Fig. 4 Se translocation coefficients in different organs of rice relative to treatment |
水稻收获时期,三个处理之间的株高差异不显著。干湿交替灌溉的水稻有效穗数最多,且显著高于好氧灌溉,分别较好氧、淹水灌溉高出38.10%、19.05%。干湿交替灌溉产量显著高于好氧灌溉,且较常规淹水灌溉提高了7.83%,较好氧灌溉提高13.51%(表 1)。
|
|
表 1 不同水分管理下的水稻产量 Table 1 Effect of water management on rice yield relative to treatment |
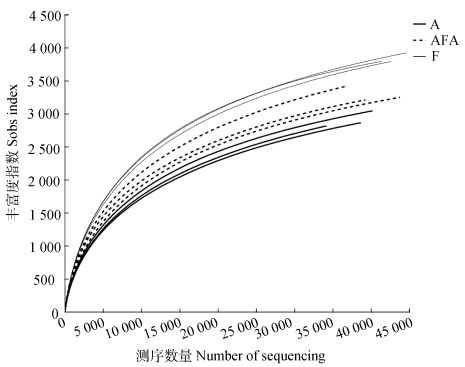
稀释曲线可用来比较测序数据量不同的样本中物种的丰富度、均一性或多样性,也可用来说明样本的测序数据量是否合理。如图 5所示,随着取样数的增加,稀释曲线逐渐趋于平稳,OTU数目逐渐饱和,说明本试验取样合理,样本数足够大且能够较为全面地反映出水稻根际土壤细菌群落状况。
|
图 5 水稻根际土壤细菌稀释曲线 Fig. 5 Rarefaction curves of the bacteria in the rice rhizosphere soil |
经过Mothur软件分析,在OTU相似水平为0.97的情况下得到能够反映水稻根际土壤细菌α多样性的指数,包括覆盖率、超、香农、香农埃文指数。不同水分管理措施下,土壤细菌群落覆盖率指数之间无显著差异,即水分管理对细菌群落的覆盖度不产生明显影响。土壤菌群丰富度表现为F(4 556) > AFA(4 140) > A(3 761),三者之间存在显著性差异,淹水处理下的根际土壤细菌丰富度最高。对于土壤细菌多样性而言,淹水处理的香农指数显著高于其他两处理,分别较A、AFA处理高出9.20%、3.14%。淹水处理的土壤菌群均匀度(0.847)最好,显著高于好氧处理(0.803),干湿交替处理处于中间水平,但与淹水处理之间差异未达显著水平(表 2)。对于土壤细菌群落覆盖度、多样性、丰富度和均匀度而言,均呈现F > AFA > A的规律,即土壤由淹水变为湿润状态时,水稻根际土壤细菌α多样性呈下降趋势。
|
|
表 2 不同水分管理条件下水稻根际土壤细菌多样性指数 Table 2 Diversity index of the bacteria in the rice rhizosphere soil relative to treatment |
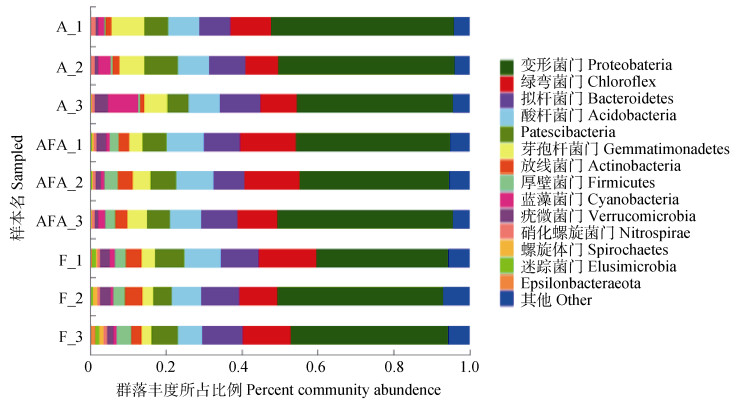
不同水分管理对细菌在门水平上的物种组成影响如图 6所示,好氧灌溉下的根际土壤优势菌为变形菌门(41.27%~48.18%)、绿弯菌门(8.49%~10.84%)、拟杆菌门(8.23%~10.81%)、酸杆菌门(8.09%~8.20%)、Patescibacteria(5.72%~8.96%)、芽单胞菌门(6.20%~8.46%)6种细菌,占总菌数的88.71%~90.35%。干湿交替灌溉下的根际土壤优势菌为变形菌门(39.54%~46.41%)、绿弯菌门(10.45%~14.76%)、拟杆菌门(8.10%~9.63%)、酸杆菌(8.26%~10.01%)、Patescibacteria(6.15%~6.73%)、芽单胞菌门(3.46%~5.12%)、放线菌门(2.83%~4.05%)、厚壁菌门(2.36%~3.54%)8种细菌,占总菌数的89.97%~91.73%。淹水灌溉下的根际土壤优势菌为变形菌门(35.02%~43.73%)、绿弯菌门(9.98%~15.21%)、拟杆菌门(10.01%~10.77%)、酸杆菌门(6.41%~9.62%)、Patescibacteria(4.91%~7.59%)、芽单胞菌门(2.54%~3.60%)、放线菌门(2.77%~4.80%)、厚壁菌门(2.80%~3.81%)8种细菌,占总菌数的87.00%~88.03%。
|
图 6 不同水分管理对水稻根际土壤细菌门水平的影响 Fig. 6 Effect of water management on bacteria at the phylum level in the rice rhizosphere soil relative to treatment |
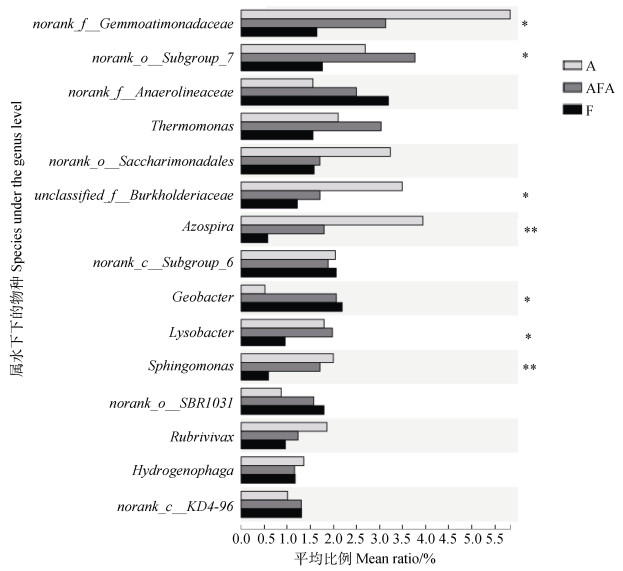
如图 7所示,对A、AFA、F三种不同水分管理方式下根际土壤样本进行优势属的组间差异显著性检验分析,结果表明在属水平,A处理下norank_f__Gemmatimonadaceae丰度最高,AFA处理次之,F处理最低,三者间存在显著差异(P < 0.05)。norank_o__Subgroup_7的丰度在AFA处理下最高,F处理下最低。A处理下,unclassified_f__Burkholderiaceae丰度显著高于其他两处理。Azospira丰度在A处理下最高,F处理下丰度最低,且差异达极显著水平(P < 0.01)。Geobacter在A处理下丰度最低,Lysobacter丰度在F处理下显著低于其他处理,Sphingomonas丰度在F处理时最低,且与其他两处理之间存在极显著差异。
|
注:右侧为P值,*0.01<P≤0.05;**P < 0.01。 Note: The right side is the P value, *0.01 < P≤0.05;** P < 0.01. 图 7 不同水分管理对水稻根际土壤细菌属水平的影响 Fig. 7 Effect of water management on bacteria at the genus level in the rice rhizosphere soil relative to treatment |
水稻根际土壤丰度前5位的细菌菌纲与不同硒形态的环境因子关联分析如图 8所示,图中不同菌纲以实线表示,虚线表示土壤Eh、pH以及不同土壤硒形态,环境因子箭头间的夹角代表正(锐角)、负相关性(钝角)。结果表明,土壤Eh、pH与土壤中有效态硒(水溶态、可交换态硒)含量呈显著正相关,且对于物种数据的影响程度(解释量)较大。土壤中丰度最高的Gammaproteobacteria与土壤Eh、pH以及水溶态、可交换态、酸溶态硒浓度呈现显著正相关,与有机物结合态、残渣态硒含量呈负相关。Deltaproteobacteria、Anaerolineae、Alphaproteobacteria、Bacteroidia丰度与土壤有机物结合态、残渣态硒含量呈正相关,与土壤Eh、pH以及土壤水溶态、可交换态、酸溶态硒含量呈负相关。

|
图 8 水稻根际土壤不同硒形态与土壤菌纲的冗余分析(RDA) Fig. 8 Redundancy analysis(RDA)of bacteria on the class level and selenium of different fractions in the rhizosphere soil |
土壤Eh和pH是影响稻田土壤硒有效性的关键因子[4]。在好氧和干湿交替灌溉下,土壤Eh和pH要高于淹水灌溉(图 1)。化学纯培养体系得出,在酸性及还原条件下(7.5 < pE+ pH < 15,pE表示电子活度),亚硒酸盐是土壤中硒主要的存在形态,土壤中的铁氧化物和氢氧化物对亚硒酸盐有很强的吸附作用,降低其在土壤溶液中的浓度进而影响亚硒酸盐的生物有效性[17];在碱性和氧化环境中(pE + pH > 15),硒酸盐是土壤中硒的主要存在形态[4],且不易被土壤胶体吸附,所以,硒酸盐较亚硒酸盐具有更高的植物有效性[7];在强还原条件下,硒还可能转化为Se(-Ⅱ,0),这两种硒形态不溶于水,所以对植物而言是无效的。科学家在含硒量较高的淹水沉积物中发现,当亚铁氧化成三价铁之后,Se(-Ⅱ,0)可部分转化为Se(Ⅳ),当氧化还原电位超过200 mV时,亚硒酸盐可缓慢氧化为硒酸盐[4,18]。因此,土壤中硒的存在形态很大程度上取决于土壤氧化还原条件以及酸碱度,不同形态的硒可在微生物、土壤腐殖化、氧化还原作用下进行转化,最终在土壤中维持一个相对平衡的状态。
本试验中,不同形态硒含量由高到低依次为:残渣态(52.11%~59.50%)、酸溶态(13.36%~16.12%)、有机物结合态(包括碳酸盐以及铁锰氧化物结合态)(11.73%~13.63%)、可交换态(10.01%~14.76%)和水溶态(1.65%~7.28%),这与先前的研究[19-20]一致。好氧和干湿交替处理下土壤有效态硒(水溶态和可交换态硒)含量高于淹水处理,而淹水处理的酸溶态硒、有机物结合态硒、残渣态硒含量则升高(图 2),说明淹水条件下土壤硒的生物有效性较低,这与先前的研究[8,21-22]一致。
在淹水条件下,稻田土壤长期处于还原状态,土壤中高价态硒可被还原为Se(0,II-),可溶性和可交换态硒逐渐转化为结合态、残渣态硒[4]。另一方面,长期的淹水处理使水稻形成了发达的通气组织[23],在通气组织的作用下,水稻根际处于一种相对氧化的状态,根际土壤溶液中的Fe2+、Mn2+被固定于根表形成铁膜,将土壤中的硒更多地固定在水稻根表铁膜中,降低其有效性[24]。综上所述,淹水灌溉相较干湿交替、好氧灌溉而言,土壤硒的生物有效性较低(图 8)。
就水稻籽粒硒含量而言,以干湿交替处理最高,表现为AFA > A > F的趋势(图 3),这说明,土壤中水溶态硒和可交换态硒含量越高,则土壤硒生物有效性越高,相应地提高了水稻籽粒中硒含量。本研究结果与Li等[8]的相同,土壤中添加亚硒酸钠和硒酸钠后,好氧灌溉处理的籽粒硒含量分别为淹水处理的2倍和25倍,可见好氧栽培可使水稻籽粒中积累更多硒。此外,本研究发现,三种水分管理中,干湿交替灌溉的水稻产量最高(表 1),这与张慎凤[25]的研究结果一致,且干湿交替灌溉可显著提高稻米出糙率、精米率、透明度、淀粉黏滞谱的最高黏度和崩解值等稻米品质指标。连同本研究结果,干湿交替灌溉可显著提高稻米硒含量(图 3),在水稻生产中,可通过控制土壤水的落干程度,可以获得高产、优质、节水的效果。但特别需要注意的是,干湿交替灌溉必须采取轻干湿交替灌溉(自然落干至土壤水势-15 kPa)方可显著提高产量,如果是重干湿交替灌溉(自然落干至土壤水势-30 kPa)则降低了产量和品质。
3.2 不同水分管理方式下水稻根际土壤细菌区系和活性与水稻硒吸收的关系土壤硒微生物转化也是硒生物地球化学循环的一个重要过程。本研究的高通量测序结果表明,水稻根际土壤优势菌为变形菌门、绿弯菌门、拟杆菌门、酸杆菌门、Patescibacteria、芽单胞菌门等,这些菌群也常被认为是稻田土壤中常见的优势微生物[26],不同水分管理显著影响着上述菌群的丰度(图 6)。变形菌门是不同水分管理方式下水稻根际土壤中丰度最高的细菌,有研究表明,变形菌门中Alphaproteobacteria是一类具有多种生理特性的有机体,它与木质素、芳香化合物的降解有关[27]。Betaproteobacteria与土壤净碳矿化率呈正相关,同时对土壤氮素循环起到关键作用[26]。Gammaproteobacteria能参与土壤固氮、溶磷过程,对植物根际铁载体的形成有促进作用[28]。Deltaproteobacteria(由Geobacter、Anaeromyxobacter、Desulfuromonas、Desulfocapsa、Desulfobulbus、Desulfovirga组成)被证明在水稻生态系统中参与还原Fe、S化合物[29-30]。就属水平而言,干湿交替和好氧灌溉中的细菌属norank_f__Gemmatimonadaceae、norank_o__Subgroup_7、unclassified_f__Burkholderiaceae、Azospir、Lysobacte、Sphingomonas等显著高于淹水灌溉(图 7),而目前尚未见报道上述菌属是否参与土壤硒的生物转化以及Fe或S的氧化还原反应,有待进一步验证。
变形菌门是本试验土壤中丰度最高的菌门,且Gammaproteobacteria丰度与土壤pH、Eh以及有效硒(水溶态、可交换态硒)含量之间呈显著正相关(图 8),即干湿交替以及好氧灌溉下Gammaproteobacteria丰度的增加在一定意义上提高了土壤硒的生物有效性。有证据证明,Gammaproteobacteria可产生的根际铁载体能与土壤中的金属离子结合形成可溶性的金属螯合物从而提高硒的生物有效性[31]。也有研究表明,添加高产铁载体根际菌后,土壤中水溶态硒含量提高了2.50倍~7.85倍[32],即变形菌所产生的根际铁载体通过螯合作用,使铁氧化物释放出硒,这也可能是干湿交替和好氧灌溉较淹水灌溉的土壤有效硒含量较高的原因。与变形菌门相比,其他菌门不直接参与铁和硫的氧化还原过程,如绿弯菌门是一类生长在极端环境中,可参与土壤碳、氮循环的菌群[33]。拟杆菌门主要作用是水解和分解大分子物质如纤维素和半纤维素[34]。芽单胞菌门、酸杆菌门被认为是寡营养细菌(Oligotrophic bacteria)中的一员,在贫营养条件下能够分解复杂的土壤基质[35]。本研究也发现,不同水分管理条件对以上菌门(除变形菌门外)无显著的影响(图 6)。
4 结论在整个水稻生育期内,干湿交替和好氧灌溉的土壤pH、Eh较淹水灌溉高,使得土壤有效态硒含量(水溶态硒和可交换态硒之和)高于淹水灌溉,从而增加了土壤硒的化学有效性。干湿交替的水分管理方式,既能达到节水的目的,而且可以显著增加水稻籽粒硒含量。通过对根际土壤细菌多样性进行分析,发现变形菌门是不同水分管理方式下水稻根际土壤中丰度最高的细菌,水分管理措施对其丰富度产生影响,干湿交替和好氧灌溉中变形菌门的丰度明显高于淹水处理,且Gammaproteobacteria丰度的增加可能是土壤硒生物有效性增加的另一个重要原因。
| [1] |
Combs G F. Selenium in global food systems[J]. British Journal of Nutrition, 2001, 85(5): 517-547. DOI:10.1079/BJN2000280
(  0) 0) |
| [2] |
Williams P N, Lombi E, Sun G X, et al. Selenium characterization in the global rice supply chain[J]. Environmental Science & Technology, 2009, 43(15): 6024-6030.
(  0) 0) |
| [3] |
Zhou X B, Shi W M, Yang L Z. Effect of foliar application of selenite on selenium accumulation and distribution in rice (In Chinese)[J]. Acta Pedologica Sinica, 2007, 44(1): 73-78. DOI:10.3321/j.issn:0564-3929.2007.01.011 [周鑫斌, 施卫明, 杨林章. 叶面喷硒对水稻籽粒硒富集及分布的影响[J]. 土壤学报, 2007, 44(1): 73-78.]
(  0) 0) |
| [4] |
Masscheleyn P H, Delaune R D, Patrick W H. Transformations of selenium as affected by sediment oxidation-reduction potential and pH[J]. Environmental Science & Technology, 1990, 24(1): 91-96.
(  0) 0) |
| [5] |
Lyubenova L, Sabodash X, Schröder P, et al. Selenium species in the roots and shoots of chickpea plants treated with different concentrations of sodium selenite[J]. Environmental Science and Pollution Research, 2015, 22(21): 16978-16986. DOI:10.1007/s11356-015-4755-5
(  0) 0) |
| [6] |
Shahid M, Niazi N K, Khalid S, et al. A critical review of selenium biogeochemical behavior in soil-plant system with an inference to human health[J]. Environmental Pollution, 2018, 234: 915-934.
(  0) 0) |
| [7] |
Neal R H, Sposito G. Selenate adsorption on alluvial soils[J]. Soil Science Society of America Journal, 1989, 53(1): 70-74. DOI:10.2136/sssaj1989.03615995005300010013x
(  0) 0) |
| [8] |
Li H F, Lombi E, Stroud J L, et al. Selenium speciation in soil and rice: Influence of water management and Se fertilization[J]. Journal of Agricultural and Food Chemistry, 2010, 58(22): 11837-11843. DOI:10.1021/jf1026185
(  0) 0) |
| [9] |
Bao Q L, Xiao K Q, Chen Z, et al. Methane production and methanogenic archaeal communities in two types of paddy soil amended with different amounts of rice straw[J]. FEMS Microbiology Ecology, 2014, 88(2): 372-385. DOI:10.1111/1574-6941.12305
(  0) 0) |
| [10] |
Mostafazadehfard F B, Jafari F, Mousavi S, et al. Effects of irrigation water management on yield and water use efficiency of rice in cracked paddy soils[J]. Australian Journal of Crop Science, 2010, 4(3): 136-141.
(  0) 0) |
| [11] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). China Agricultural Science and Technology Press, 2000: 125-233. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000: 125-233.]
(  0) 0) |
| [12] |
Qu J G, Xu B X, Gong S C. Sequential extraction techniques for determination of selenium speciation in soils and sediments (In Chinese)[J]. Environmental Chemistry, 1997, 16(3): 277-283. [瞿建国, 徐伯兴, 龚书椿. 连续浸提技术测定土壤和沉积物中硒的形态[J]. 环境化学, 1997, 16(3): 277-283.]
(  0) 0) |
| [13] |
Zhang L H, Shi W M, Wang X C. Difference in selenite absorption between high- and low-selenium rice cultivars and its mechanism[J]. Plant and Soil, 2006, 282(1/2): 183-193.
(  0) 0) |
| [14] |
Chao A N, Yang M C K. Stopping rules and estimation for recapture debugging with unequal failure rates[J]. Biometrika, 1993, 80(1): 193-201. DOI:10.1093/biomet/80.1.193
(  0) 0) |
| [15] |
Faith D P. Conservation evaluation and phylogenetic diversity[J]. Biological Conservation, 1992, 61(1): 1-10. DOI:10.1016/0006-3207(92)91201-3
(  0) 0) |
| [16] |
Hill M O. Diversity and evenness: A unifying notation and its consequences[J]. Ecology, 1973, 54(2): 427-432. DOI:10.2307/1934352
(  0) 0) |
| [17] |
Barrow N J, Whelan B R. Testing a mechanistic model. VII. The effects of pH and of electrolyte on the reaction of selenite and selenate with a soil[J]. Journal of Soil Science, 1989, 40(1): 17-28. DOI:10.1111/j.1365-2389.1989.tb01250.x
(  0) 0) |
| [18] |
Jayaweera G R, Biggar J W. Role of redox potential in chemical transformations of selenium in soils[J]. Soil Science Society of America Journal, 1996, 60(4): 1056-1063. DOI:10.2136/sssaj1996.03615995006000040014x
(  0) 0) |
| [19] |
Zhang D, Dong T, Ye J, et al. Selenium accumulation in wheat (Triticum aestivum L) as affected by coapplication of either selenite or selenate with phosphorus[J]. Soil Science and Plant Nutrition, 2017, 63(1): 37-44. DOI:10.1080/00380768.2017.1280377
(  0) 0) |
| [20] |
Bajaj M, Eiche E, Neumann T, et al. Hazardous concentrations of selenium in soil and groundwater in North-West India[J]. Journal of Hazardous Materials, 2011, 189(3): 640-646. DOI:10.1016/j.jhazmat.2011.01.086
(  0) 0) |
| [21] |
Funwie A V. Effect of soil properties on availability and mobility of selenium[D]. Faculty of Bioscience Engineering. University of Gent, Belgium, 2012: 1-65.
(  0) 0) |
| [22] |
Peng Q, Wang M K, Cui Z W, et al. Assessment of bioavailability of selenium in different plant-soil systems by diffusive gradients in thin-films(DGT)[J]. Environmental Pollution, 2017, 225: 637-643. DOI:10.1016/j.envpol.2017.03.036
(  0) 0) |
| [23] |
Armstrong W. The oxidising activity of roots in waterlogged soils[J]. Physiologia Plantarum, 1967, 20(4): 920-926. DOI:10.1111/j.1399-3054.1967.tb08379.x
(  0) 0) |
| [24] |
Shiba H, Daimon H. Histological observation of secondary aerenchyma formed immediately after flooding in Sesbania cannabina and S. rostrata[J]. Plant and Soil, 2003, 255(1): 209-215. DOI:10.1023/A:1026147301146
(  0) 0) |
| [25] |
张慎凤. 干湿交替灌溉对水稻生长发育、产量与品质的影响[D]. 江苏扬州: 扬州大学, 2009. Zhang S F. Effect of alternate wetting and drying on the growth and development, grain yield and quality of rice[D]. Yangzhou, Jiangsu: Yangzhou University, 2009. (  0) 0) |
| [26] |
Huang Q, Wang J L, Wang C, et al. The 19-years inorganic fertilization increased bacterial diversity and altered bacterial community composition and potential functions in a paddy soil[J]. Applied Soil Ecology, 2019, 144: 60-67. DOI:10.1016/j.apsoil.2019.07.009
(  0) 0) |
| [27] |
Kersters K, de Vos P, Gillis M, et al. Introduction to the proteobacteria[M]//The Prokaryotes. New York, NY: Springer New York, 2006: 3-37.
(  0) 0) |
| [28] |
Weller D M. Pseudomonas biocontrol agents of soilborne pathogens: Looking back over 30 years[J]. Phytopathology, 2007, 97(2): 250-256. DOI:10.1094/PHYTO-97-2-0250
(  0) 0) |
| [29] |
Muyzer G, Stams A J M. The ecology and biotechnology of sulphate-reducing bacteria[J]. Nature Reviews Microbiology, 2008, 6(6): 441-454. DOI:10.1038/nrmicro1892
(  0) 0) |
| [30] |
Ding L J, Su J Q, Xu H J, et al. Long-term nitrogen fertilization of paddy soil shifts iron-reducing microbial community revealed by RNA-13C-acetate probing coupled with pyrosequencing[J]. The ISME Journal, 2015, 9(3): 721-734. DOI:10.1038/ismej.2014.159
(  0) 0) |
| [31] |
Karagöz K, Ateş F, Karagöz H, et al. Characterization of plant growth-promoting traits of bacteria isolated from the rhizosphere of grapevine grown in alkaline and acidic soils[J]. European Journal of Soil Biology, 2012, 50: 144-150. DOI:10.1016/j.ejsobi.2012.01.007
(  0) 0) |
| [32] |
Long Y C, Chen X, Zhou S Q. Isolation, identification and assessment on selenium biofortification of siderophore-producing rhizobacteria (In Chinese)[J]. Current Biotechnology, 2017(5): 402-408. [龙云川, 陈轩, 周少奇. 高产铁载体根际菌的筛选鉴定及硒活化特性评价[J]. 生物技术进展, 2017(5): 402-408.]
(  0) 0) |
| [33] |
Kragelund C, Caterina L, Borger A, et al. Identity, abundance and ecophysiology of filamentous Chloroflexi species present in activated sludge treatment plants[J]. FEMS Microbiology Ecology, 2007, 59(3): 671-682.
(  0) 0) |
| [34] |
Wegner C E, Liesack W. Microbial community dynamics during the early stages of plant polymer breakdown in paddy soil[J]. Environmental Microbiology, 2016, 18(9): 2825-2842.
(  0) 0) |
| [35] |
Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631.
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


