2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 210008;
3. 浙江省农业科学院环境资源与土壤肥料研究所, 杭州 310021
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing, 210008 China;
3. Institute of Environment, Resource, Soil and Fertilizer, Zhejiang Academy of Agricultural Sciences, Hangzhou, 310021 China
反硝化是指硝态氮(
由于反硝化的最终产物N2在大气中含量高达78%,因此直接测定来自土壤反硝化过程产生的N2存在困难[10]。除N2外,反硝化过程中间产物之一的N2O会导致温室效应和破坏臭氧层,而稻田也是N2O排放的重要来源[11]。测定土壤溶液中N2O和反硝化产生N2量(Excess N2,下文中用exN2表示)的方法是一直以来研究稻田反硝化的有效手段。由于研究方法的限制,稻田剖面反硝化的研究多是室内培养实验,田间原位研究较少。近年来,随着膜进样质谱方法的成熟应用,使得快速、准确测定水中溶解性N2成为可能。由于土壤的阻滞和水压的作用使得稻田土壤溶液中的气体扩散缓慢,因此可通过测定土壤溶液中溶解性N2量,再减去自然溶解性N2量,得到反硝化产生N2量,该法被称为N2直接定量法[7]。
生物质炭是近些年来新兴起的功能性物质,施用生物质炭能够提高土壤pH,改善土壤物理性状,其中部分可降解组分还可被微生物利用,因此生物质炭施入到土壤会改变微生物主导的反硝化过程。已有的生物质炭对土壤反硝化影响研究多集中在其对地表N2O、N2排放通量的影响。例如Obia等[12]认为生物质炭可以改变酸性土壤的pH,进而抑制酸性土壤的N2O净产生,并增加N2的产量。Chintala等[13]用乙炔抑制法研究发现,生物质炭能够降低N2O的排放及总的(N2O+N2)-N的排放。还有研究发现新鲜的生物质炭可以抑制异养硝化作用,而老化的生物质炭通过增加羧基和羟基的官能团密度来增强硝化-反硝化作用[14],可见生物质炭对土壤反硝化的影响与土壤性质、老化时间等密切相关。上述研究均基于短期培养试验,并未考虑田间状况下可能发生的其他因素,比如生物质炭老化、生物质炭-土壤-植物之间的相互作用。此外稻田水分下渗量大,大量的物质会随水下渗,从而影响耕层以下土壤的理化性质及微生物活性。生物质炭可影响耕层土壤反硝化的能力已经得到了证实[15],但其对耕层以下土壤反硝化过程的影响尚不明确,考虑到深层土壤反硝化对减少地下水硝酸盐污染至关重要,因此有必要开展田间试验,研究秸秆生物质炭对稻田剖面反硝化的影响。
鉴于此,本研究开展了为期2年的野外原位观测实验,测定了不同处理稻田剖面土壤溶液中反硝化产物N2O和exN2的时空变异规律及其影响因素,以明确长期秸秆生物质炭还田对稻田土壤剖面反硝化能力的影响。
1 材料与方法 1.1 研究区概况试验地位于中国科学院常熟农业生态实验站宜兴面源污染防控技术研发与示范基地(31°07'N-31°37'N,119°31'E-120°03'E),距离太湖西北岸约1 km。属于亚热带季风气候区,年均气温15.7 ℃,年均降雨量1 177 mm。当地降水和高温主要集中在夏季,2018年8月份月均降水量高达255 mm,7月份月均气温高达29.4 ℃。
1.2 供试材料供试土壤类型为发育于湖泊沉积物上的水稻土(潜育水耕人为土),采用稻麦轮作,耕层土壤(0~20 cm)基本理化性质如下:pH6.05,有机碳15.4 g·kg–1,全氮1.79 g·kg–1;砂粒(> 0.05 mm)8.3 %,粉粒(0.002~0.05 mm)81.5 %,黏粒(< 0.02 mm)10.2 %。
供试生物质炭制备原材料为水稻秸秆,通过基于沼气能源的秸秆生物炭化炉在5 ℃ min–1的热解速率,最高温度为500 ℃限氧条件下8 h制成。秸秆生物质炭的基本性质如下:pH9.16,灰分131 g·kg–1,CEC18.9 cmol·kg–1,TOC 620 g·kg–1,碱度210 cmol· kg–1,全氮全磷分别为13.3 g·kg–1和4.40 g·kg–1,比表面积51.3 m2·g–1,有效钾、钙、钠、镁分别为13.4、4.06、5.41、1.24 g·kg–1。
1.3 试验设计试验设置4个处理:(1)对照处理(CK),不施秸秆生物质炭;(2)低倍秸秆生物质炭处理(1BC),秸秆生物质炭每季施加量为2.25 t·hm–2;(3)中倍量秸秆生物质炭处理(5BC),秸秆生物质炭每季施加量为11.3 t·hm–2;(4)高倍量秸秆生物质炭处理(10BC),秸秆生物质炭每季施加量为22.5 t·hm–2。每个处理重复3次,共计12个小区,随机区组排列,小区面积为24 m2。该地区每季秸秆生产量约为7.5 t·hm–2,秸秆生物质炭炭化炉的产率为30 %,1BC、5BC和10BC处理相当于将7.5 t·hm–2(1倍)、37.5 t·hm–2(5倍)和75 t·hm–2(10倍)作物秸秆炭化还田。秸秆生物质炭以撒施的方式均匀施入田中,并翻耕入土。各处理均按当地常规施肥量,氮肥(尿素)用量(以N计)稻季施250 kg·hm–2,麦季为200 kg·hm–2,按3:4:3的比例分别在稻麦移栽或直播、分蘖期和拔节期施用。磷、钾肥(磷酸二氢钙和氯化钾,以P2O5和K2O计)每季均按照60 kg·hm–2水平基施。
生物质炭还田始于2010年水稻季,在2018和2019年两个稻季进行观测。2018年稻季在7月初施基肥后插秧,7月和8月中旬分别进行第一次追肥和第二次追肥,10月下旬收获。2019稻季为6月中旬施基肥后移栽,2019年7月和8月中旬分别进行第一次追肥和第二次追肥,10月下旬收获。作物生长季的田间管理措施与当地农民的大田常规管理措施相同。
1.4 土壤剖面溶液采集为了采集不同深度土壤溶液,特别设计了一种土壤淋溶液采集装置并于2018年水稻种植前将装置埋入稻田。该采集装置包括采集口、集液管和5根长度不同的采集管,采集管包括抽液管和通气管,集液管设于采集口底端,有5个隔板与集液管无缝衔接并从顶端开始分段设于集液管内部,隔板中有采集管管孔,集液管管壁有小孔底部呈锥状密闭,采集管贯穿采集口和集液管内部,每组采集管及其对应隔板和所述对应隔板与下一隔板的上部形成一个采集单元,该装置可分层收集0~20 cm、20~40 cm、40~60 cm、60~80 cm和80~100 cm的土壤溶液,各层次不会交叉污染,占地面积小。于2018年6月份开始采样,约10 d 1次,施肥后适当加密采样。具体采集方法如下:提前一天将采样管中旧水排空,确保采集新鲜土壤溶液。遇稻田烤田或排水期,则提前1 d进行灌水。利用可调速蠕动泵(Kamoer,卡川尔流体科技(上海)有限公司)采集土壤溶液,流速控制在30~50 mL·min–1,以免产生气泡干扰分析结果。预先在7 mL取样瓶(Sampling bottle,Labco Limited,英国)加入40 µL饱和ZnCl2,然后将硅胶管伸入取样瓶底部采样,让水样缓慢流入,直至瓶口冒出半滴时立即拧紧盖子密封,避免空气进入污染水样。各处理相应土层溶液取3个平行水样,采集好的样品放入4℃冰箱冷藏保存,用于测定地下水中溶解性N2和Ar含量。另取100 mL水样装入塑料瓶中冷冻保存后尽快运往实验室,用于测定溶解性N2O、DOC、
地下水中来自反硝化产生的N2浓度参照Weymann等[16]所推荐的计算方法,计算过程如下:
| ${\rm{ex}}{{\rm{N}}_{\rm{2}}}{\rm{ = }}{{\rm{N}}_{{\rm{2T}}}} - {{\rm{N}}_{{\rm{2EQ}}}}{\rm{ - }}{{\rm{N}}_{{\rm{2EA}}}}$ |
式中,exN2代表反硝化产生的N2浓度,计算中该值会出现零是由于外界高温水的进入造成的稀释效应,或者是土壤水中CH4或者CO2等气体饱和度过高,出现了气泡现象,会带走大量的N2,目前的方法无法定量这一过程造成的N2损失,所以以零计。N2T表示地下水样品中溶解性N2的浓度,由膜进样质谱仪MIMS(Membrane inlet mass spectronmeter,Bay Instruments,Easton,MD,美国)测定。Ar为惰性气体,水环境中Ar溶解度一般只受温度和盐度的控制,其浓度非常稳定,N2源于物理过程(水气平衡)和生物过程(主要为反硝化),因此可以通过测定水样中N2/Ar计算水样中真实的N2浓度;N2EQ 表示N2自然溶解度,可根据Weiss[17]推导的N2溶解度方程计算得到;N2EA表示源自其他途径来源的N2,例如地下水补给过程中带入的N2,可根据地下水中Ar的浓度进行估算,方法参照Weymann等[16],具体如下:
| ${{\rm{N}}_{{\rm{2EA}}}}{\rm{ = }}\frac{{\left( {{\rm{A}}{{\rm{r}}_{\rm{T}}}{\rm{ - A}}{{\rm{r}}_{{\rm{EQ}}}}} \right){\rm{ \times }}\left( {\frac{{{{\rm{N}}_{{\rm{2EQ}}}}}}{{{\rm{A}}{{\rm{r}}_{{\rm{EQ}}}}}}{\rm{ + }}\frac{{{{\rm{N}}_{{\rm{2atm}}}}}}{{{\rm{A}}{{\rm{r}}_{{\rm{atm}}}}}}} \right)}}{{\rm{2}}}$ |
式中,ArT表示地下水中Ar的浓度,由MIMS测定;ArEQ表示地下水中Ar的自然溶解度,可根据Weiss[17]推导的Ar溶解度方程计算得到;N2atm和Aratm分别表示自然大气中N2和Ar的摩尔浓度。
水体中溶解的N2O根据Terry等[18]的方法测定。用注射器抽取5 mL水样,打入已抽真空的20 mL玻璃瓶中(日本国立农业环境研究所提供)中,并设置5个空白对照瓶打入5 mL的去离子水,通入当地空气,使其与外界大气平衡,随后放入4 ℃冰箱平衡24 h,抽取瓶内上部空气注入电子捕获(ECD)检测器的气相色谱(安捷伦-7890A)中测定N2O浓度。计算公式如下:
| ${{\rm{N}}_{\rm{2}}}{{\rm{O}}_{{\rm{diss}}}} = \frac{{\left( {{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{h}}}{\rm{ - }}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{a}}}} \right){\rm{ \times }}{{\rm{H}}_{{\rm{vol}}}}{\rm{ + \mathsf{ α} \times }}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{h}}}{\rm{ \times }}{{\rm{W}}_{{\rm{vol}}}}}}{{{{\rm{W}}_{{\rm{vol}}}}}} $ |
式中,N2Odiss表示地下水中N2O的浓度;N2Oh表示平衡后测出真空玻璃瓶空气中N2O的浓度;N2Oa表示外界空气中N2O浓度;Hvol表示加入水样后玻璃中空气的体积,为15 mL;
α表示温度是4 ℃时,N2O的本生系数,为1.12896;Wvol表示吸取水样体积,为5 mL。
1.6 氮淋溶量估算氮素淋溶损失量按照1 m深度计算[19],为1 m处土壤溶液氮浓度与淋溶水量的乘积。在稻田淹水条件下,淋溶水体积可根据测得的水分垂直下渗速率估计。本研究中实测得到CK、1BC、5BC和10BC处理小区的平均水分垂直下渗速率分别为3.42± 0.16、3.43±0.23、3.61±0.18和3.54±0.12 mm·d–1。各处理氮素淋溶量计算公式为:
| $P = C \times t \times v \times {10^{ - 2}}$ |
式中,P为氮素淋溶量(kg·hm–2),C为1 m处剖面溶液中氮平均浓度(mg·L–1),t为水稻移栽至收获之间的淹水天数(d),v为稻田淹水下连续3 d测得的土壤水分垂直下渗速率平均值,2018年和2019年间稻田淹水时长分别为98 d和103 d。
1.7 其他观测指标和分析供试土壤和秸秆生物质炭的基本理化性质分析方法参考《土壤农业化学分析方法》[20]。采集后的水样经定量滤纸过滤后,滤液用AA3连续流动分析仪(Skalar)测定NH4+、
所有数据用Microsoft excel 2016(Microsoft)软件整理并用Origin 2016作图。用IBM SPSS 22.0软件(IBM SASS Statistics,Stanford University,USA)进行统计分析。图表所列数据均为相应处理3次重复的均值,使用最小显著性差异法(LSD)对数据均值进行多重比较,误差棒为相应处理3次重复的标准误(Standard Deviation)。
2 结果 2.1 不同剖面深度土壤溶液中N2O浓度时空变化长期秸秆生物质炭还田不同程度改变了水稻生长期土壤剖面的N2O浓度,渗漏水中N2O浓度变化范围在0.00 ~3.64 μg·L–1,其最高值出现在2019年不添加秸秆生物炭CK处理60 cm深度,各处理峰值出现的时间不尽相同(图 1)。
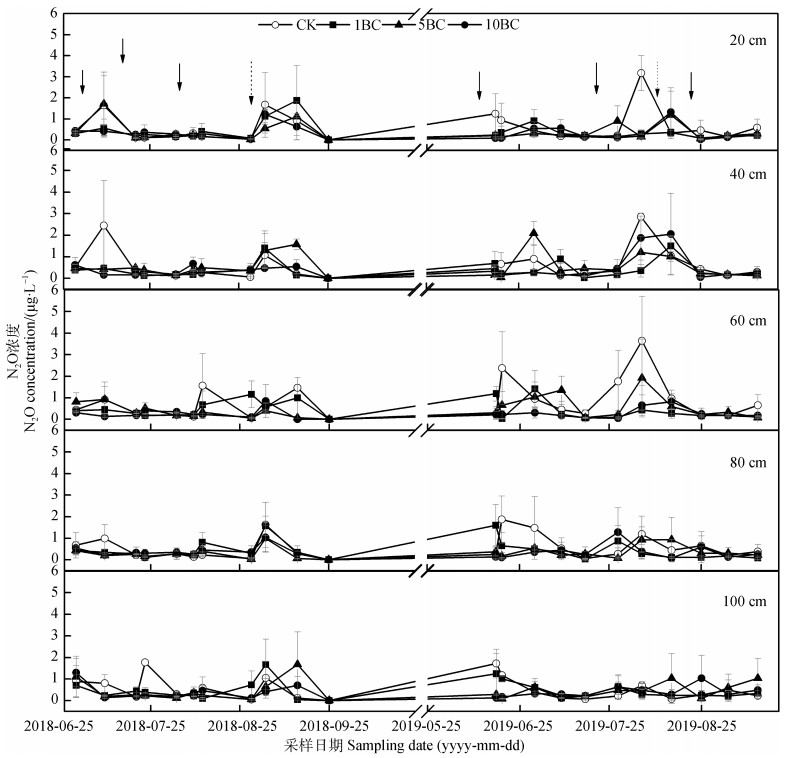
|
图 1 不同剖面深度土壤溶液中N2O浓度变化(实线箭头代表施肥日期,虚线箭头代表烤田日期,下同) Fig. 1 Variation of N2O concentration in leachate with soil depth(solid arrow represents date of fertilization, and dotted arrow date of field sunning exposure, the same as below) |
如图 2,CK处理的深层土壤溶液中N2O浓度高于耕层20 cm,峰值出现在60 cm处。秸秆生物质炭处理剖面N2O浓度变化较小,2018年1BC、5BC和10BC峰值分别在80 cm、20 cm和80 cm处,2019年1BC、5BC和10BC分别在100 cm、60 cm和80 cm处。

|
图 2 不同剖面深度土壤溶液中N2O时间加权平均浓度 Fig. 2 Time weighted average N2O concentration in leachate in soil profile relative to depth |
相较于CK处理,中、高倍量秸秆生物质炭(5BC和10BC)还田降低了深层土壤剖面N2O浓度,其中2018年5BC和10BC在60~100 cm和40 ~100 cm处,2019年5BC和10BC在60 cm和40~60 cm深度的降幅达到差异显著水平(P < 0.05)。
2.2 不同剖面深度土壤溶液中反硝化产生N2浓度的时空变化如图 3所示,2年间不同剖面深度的土壤溶液中exN2浓度呈现脉冲式变化,其范围在0.00~4.72 mg·L–1,施肥和烤田之后exN2浓度均出现峰值,最高峰出现在2018年CK处理第二次追肥3 d后的20 cm深度。
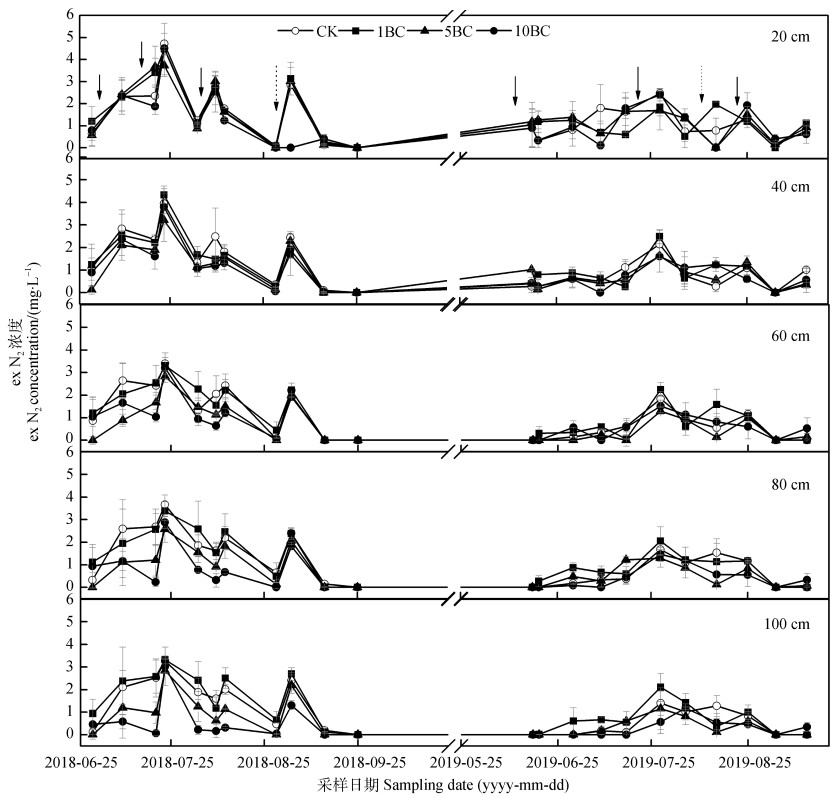
|
图 3 不同剖面深度土壤溶液中exN2浓度变化 Fig. 3 Variation of exN2 concentration in leachate in soil profile relative to depth |
如图 4所示,随着剖面深度的增加,CK处理exN2浓度有降低趋势,其中2019年的底层exN2浓度显著低于耕层(P < 0.05)。5BC和10BC处理有降低土壤剖面exN2浓度的趋势,2018的降幅显著大于2019年。低倍秸秆生物质炭(1BC)对exN2浓度影响不明显。5BC和10BC处理2年间exN2浓度均在表层20 cm处最高,底层100 cm处最低,两个深度差异显著(P < 0.05)。
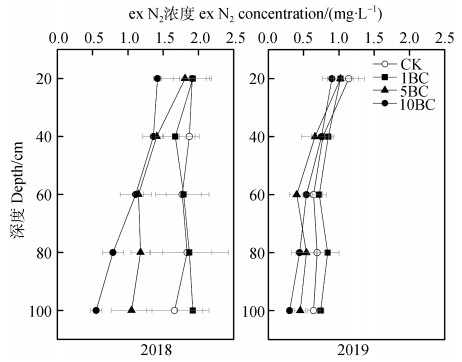
|
图 4 不同剖面深度土壤溶液中exN2时间加权平均浓度 Fig. 4 Time weighted average exN2 concentration in leachate in soil profile relative to depth |
2年间表层20 cm处各处理差异不显著,但耕层以下土层的差异明显。相较于CK,2018年5BC在40 cm处和10BC处理在40~100 cm处exN2浓度均显著下降(P < 0.05);2019年5BC在100 cm处,10BC处理在60~100 cm处exN2浓度均显著降低(P < 0.05)。
2.3 不同剖面深度土壤溶液中DOC、如图 5,2018年土壤剖面中各处理的DOC浓度无显著差异(P > 0.05);2019年各处理间差异显著,10BC处理土壤溶液中DOC浓度最高,显著高于CK和1BC处理(P < 0.05)。相比于CK,5BC土壤溶液中DOC浓度增加了14%~52%,10BC土壤溶液中DOC浓度增加了57%~85%。
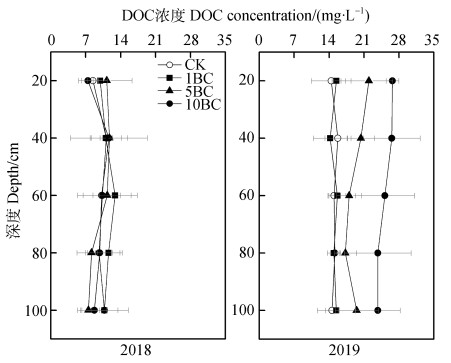
|
图 5 不同剖面深度土壤溶液中DOC时间加权平均浓度 Fig. 5 Time weighted average DOC concentration in leachate in soil profile relative to depth |
不同深度的剖面土壤溶液中
|
|
表 1 不同剖面深度土壤溶液中 |
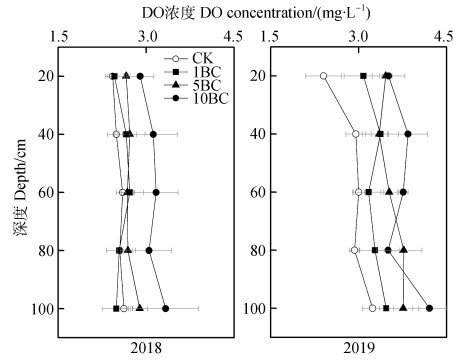
如图 6,2018年DO值的变化范围为2.43~3.33 mg·L–1,2019年为2.40~4.21 mg·L–1,最高值出现在2019年10BC处理。与CK相比,5BC和10BC处理增加了溶液DO浓度;对于相同的处理,随着深度的增加,DO值呈增加的趋势。
|
图 6 不同剖面深度土壤溶液中溶解氧(DO)时间加权平均浓度 Fig. 6 Time weighted average DO concentration in leachate in soil profile relative to depth |
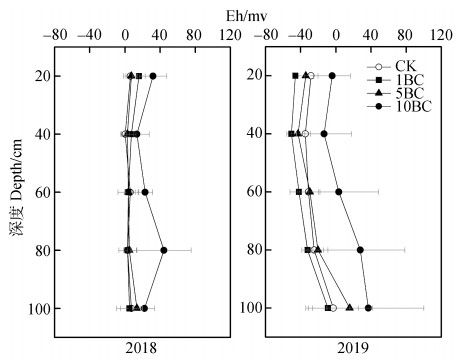
图 7为2年间渗漏水中氧化还原电位Eh值,2018年Eh值在–20~60 mv之间,2019年为–60~40 mv;其中10BC处理Eh值高于CK处理。2018年Eh值随深度变化不明显,2019年随着深度的增加Eh值有增加的趋势。
|
图 7 不同剖面深度土壤溶液中Eh时间加权平均值 Fig. 7 Time weighted average Eh in leachate in soil profile relative to depth |
多元线性回归结果表明,不添加秸秆生物质炭的处理
Fox等[21]发现exN2浓度与地下水反硝化速率之间有着很好的相关性,在反硝化速率最高的河岸地区exN2浓度较高,而在反硝化较弱的农田缓冲带地下水,exN2浓度较低。说明exN2可以真实地反映地下水反硝化的强弱,本研究表明土壤剖面exN2和N2O浓度存在明显的变异性,水稻土壤表层反硝化强烈,且随着深度的增加反硝化活性逐渐降低(图 1~图 4)。范晓晖和朱兆良[22]曾经对我国3种不同农田土壤剖面的反硝化活性进行了研究,认为反硝化活性在3种土壤中均表现出随深度加深而降低的趋势。CK处理exN2受
厌氧条件、
|
|
表 2 土壤溶液中exN2和N2O浓度与各因素的逐步回归关系 Table 2 Stepwise linear regression analysis of factors involved in exN2 and N2O concentration |
反硝化是稻田氮损失的重要途径,反硝化产物或以气态形式进入大气,或随水淋溶到地下水。Fox等[21]将以溶解性气态氮形式损失的氮定义为“消失的氮(Missing nitrogen)”,认为这一部分氮对于评估区域氮素平衡十分重要。朱兆良[29]曾对我国农田化肥氮去向进行了评估,认为有13%的氮素去向不明,以溶解性气态氮流失的氮可能就是尚不明确的去向之一。因此明确“Missing nitrogen”的量将有助于准确估算区域氮素损失[30]。根据淹水稻田水分垂直下渗速率以及淹水天数,可计算水稻生长季淋溶水量,结合剖面溶液exN2浓度,我们计算了1 m深处溶解性反硝化气态产物随水淋溶量(图 8)。结果显示,CK处理无机氮(

|
注:图中不同的小写字母表示各处理exN2浓度在0.05水平上的差异显著性。总氮淋溶量包括brrhzformula: 43:erhhz-N、NH4+-N、DON和exN2淋溶量。 Note: Different lowercase letters in the figure indicate the significant difference of exN2 concentration at 0.05 level in each treatment. Total nitrogen leaching loss includes brrhzformula: 44:erhhz-N, NH4+-N, DON and exN2. 图 8 2018和2019年稻季总氮淋溶损失量估值 Fig. 8 Estimate of total nitrogen leaching loss in the rice seasons of 2018 and 2019 |
本试验大田观测土壤20~100 cm剖面中溶解的气态氮仅是反硝化的小部分。为完整探究秸秆生物质炭长期施入对稻田反硝化的影响,需要对释放到大气中的N2O以及N2进行观测,也要对田面水溶解态N2O及N2加以考虑,并结合现代分子生物学技术探究各脱氮过程的微生物学机理。
4 结论长期配施秸秆生物质炭可减少稻田土壤剖面的N2O和exN2浓度,这种作用随秸秆生物质炭施加量和土壤剖面深度增加而显著。添加秸秆生物质炭增加了土壤溶解氧含量、提高了土壤剖面Eh,改变了反硝化发生的环境条件,是降低稻田剖面的反硝化作用及其主要产物N2O和exN2释放的主要原因。长期施用中、高量秸秆生物质炭可以降低稻田深层土壤反硝化作用,并最终减少溶解性气态氮的淋溶损失。
| [1] |
Yoo J, Woo S H, Park K D, et al. Effect of no-tillage and conventional tillage practices on the nitrous oxide(N2O) emissions in an upland soil: Soil N2O emission as affected by the fertilizer applications[J]. Applied Biological Chemistry, 2016, 59(6): 787-797. DOI:10.1007/s13765-016-0226-z
(  0) 0) |
| [2] |
Elmi A A, Astatkie T, Madramootoo C, et al. Assessment of denitrification gaseous end-products in the soil profile under two water table management practices using repeated measures analysis[J]. Journal of Environmental Quality, 2005, 34(2): 446-454. DOI:10.2134/jeq2005.0446
(  0) 0) |
| [3] |
Clément J C, Pinay G, Marmonier P. Seasonal dynamics of denitrification along topohydrosequences in three different riparian wetlands[J]. Journal of Environmental Quality, 2002, 31(3): 1025-1037. DOI:10.2134/jeq2002.1025
(  0) 0) |
| [4] |
Küstermann B, Christen O, Hülsbergen K J. Modelling nitrogen cycles of farming systems as basis of site- and farm-specific nitrogen management[J]. Agriculture, Ecosystems & Environment, 2010, 135(1/2): 70-80.
(  0) 0) |
| [5] |
Clough T, Condron L, Kammann C, et al. A review of biochar and soil nitrogen dynamics[J]. Agronomy, 2013, 3(2): 275-293. DOI:10.3390/agronomy3020275
(  0) 0) |
| [6] |
Dixon E R, Laughlin R J, Watson C J, et al. Evidence for the production of NO and N2O in two contrasting subsoils following the addition of synthetic cattle urine[J]. Rapid Communications in Mass Spectrometry, 2010, 24(5): 519-528. DOI:10.1002/rcm.4348
(  0) 0) |
| [7] |
Yan X Y, Zhou W. Groundwater nitrate removal through denitrification under farmland in Yangtze River delta (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(2): 350-362. [颜晓元, 周伟. 长江三角洲农田地下水反硝化对硝酸盐的去除作用[J]. 土壤学报, 2019, 56(2): 350-362.]
(  0) 0) |
| [8] |
Li Y, Ju X T. Rational nitrogen application is the key to mitigate agricultural nitrous oxide emission (In Chinese)[J]. Journal of Agro-Environment Science, 2020, 39(4): 842-851. [李玥, 巨晓棠. 农田氧化亚氮减排的关键是合理施氮[J]. 农业环境科学学报, 2020, 39(4): 842-851.]
(  0) 0) |
| [9] |
Xing G X, Zhao X, Xiong Z Q, et al. Nitrous oxide emission from paddy fields in China[J]. Acta Ecologica Sinica, 2009, 29(1): 45-50. DOI:10.1016/j.chnaes.2009.04.006
(  0) 0) |
| [10] |
Butterbach-Bahl K, Gasche R, Willibald G, et al. Exchange of N-gases at the höglwald forest-a summary[J]. Plant and Soil, 2002, 240(1): 117-123. DOI:10.1023/A:1015825615309
(  0) 0) |
| [11] |
Tian H Q, Yang J, Xu R T, et al. Global soil nitrous oxide emissions since the preindustrial era estimated by an ensemble of terrestrial biosphere models: Magnitude, attribution, and uncertainty[J]. Global Change Biology, 2019, 25(2): 640-659. DOI:10.1111/gcb.14514
(  0) 0) |
| [12] |
Obia A, Cornelissen G, Mulder J, et al. Effect of soil pH increase by biochar on NO, N2O and N2 production during denitrification in acid soils[J]. PLoS One, 2015, 10(9): e0138781. DOI:10.1371/journal.pone.0138781
(  0) 0) |
| [13] |
Chintala R, Owen R K, Schumacher T E, et al. Denitrification kinetics in biomass- and biochar-amended soils of different landscape positions[J]. Environmental Science and Pollution Research, 2015, 22(7): 5152-5163. DOI:10.1007/s11356-014-3762-2
(  0) 0) |
| [14] |
Duan P P, Zhang X, Zhang Q Q, et al. Field-aged biochar stimulated N2O production from greenhouse vegetable production soils by nitrification and denitrification[J]. Science of the Total Environment, 2018, 642: 1303-1310. DOI:10.1016/j.scitotenv.2018.06.166
(  0) 0) |
| [15] |
Cayuela M L, van Zwieten L, Singh B P, et al. Biochar's role in mitigating soil nitrous oxide emissions: A review and meta-analysis[J]. Agriculture, Ecosystems & Environment, 2014, 191: 5-16.
(  0) 0) |
| [16] |
Weymann D, Well R, Flessa H, et al. Groundwater N2O emission factors of nitrate-contaminated aquifers as derived from denitrification progress and N2O accumulation[J]. Biogeosciences, 2008, 5(5): 1215-1226. DOI:10.5194/bg-5-1215-2008
(  0) 0) |
| [17] |
Weiss R F. The solubility of nitrogen, oxygen and argon in water and seawater[J]. Deep Sea Research and Oceanographic Abstracts, 1970, 17(4): 721-735. DOI:10.1016/0011-7471(70)90037-9
(  0) 0) |
| [18] |
Terry R E, Tate R L III, Duxbury J M. The effect of flooding on nitrous oxide emissions from an organic soil[J]. Soil Science, 1981, 132(3): 228-232. DOI:10.1097/00010694-198109000-00006
(  0) 0) |
| [19] |
Zhao X, Zhou Y, Wang S Q, et al. Nitrogen balance in a highly fertilized rice-wheat double-cropping system in Southern China[J]. Soil Science Society of America Journal, 2012, 76(3): 1068-1078. DOI:10.2136/sssaj2011.0236
(  0) 0) |
| [20] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [21] |
Fox R J, Fisher T R, Gustafson A B, et al. Searching for the missing nitrogen: Biogenic nitrogen gases in groundwater and streams[J]. Journal of Agricultural Science, 2014, 152(S1): 96-106. DOI:10.1017/S0021859614000070
(  0) 0) |
| [22] |
Fan X H, Zhu Z L. Investigations on denitrification potential in agricultural soils as related with affected factors (In Chinese)[J]. Plant Nutrition and Fertilizer Science, 1997, 3(2): 97-104. DOI:10.3321/j.issn:1008-505X.1997.02.001 [范晓晖, 朱兆良. 农田土壤剖面反硝化活性及其影响因素的研究[J]. 植物营养与肥料学报, 1997, 3(2): 97-104.]
(  0) 0) |
| [23] |
He L L, Shan J, Zhao X, et al. Variable responses of nitrification and denitrification in a paddy soil to long-term biochar amendment and short-term biochar addition[J]. Chemosphere, 2019, 234: 558-567. DOI:10.1016/j.chemosphere.2019.06.038
(  0) 0) |
| [24] |
Cayuela M L, Sánchez-Monedero M A, Roig A, et al. Biochar and denitrification in soils: When, how much and why does biochar reduce N2O emissions?[J]. Scientific Reports, 2013, 3: 1732. DOI:10.1038/srep01732
(  0) 0) |
| [25] |
Zhou W, Xia L L, Yan X Y. Vertical distribution of denitrification end-products in paddy soils[J]. Science of the Total Environment, 2017, 576: 462-471. DOI:10.1016/j.scitotenv.2016.10.135
(  0) 0) |
| [26] |
Rivett M O, Buss S R, Morgan P, et al. Nitrate attenuation in groundwater: A review of biogeochemical controlling processes[J]. Water Research, 2008, 42(16): 4215-4232. DOI:10.1016/j.watres.2008.07.020
(  0) 0) |
| [27] |
Xu D F, Pan Q C, Li Y X, et al. Effect of biochar on root morphological characteristics of wetland plants and purification capacity of constructed wetland (In Chinese)[J]. Environmental Sciences, 2018, 39(7): 3187-3193. [徐德福, 潘潜澄, 李映雪, 等. 生物炭对人工湿地植物根系形态特征及净化能力的影响[J]. 环境科学, 2018, 39(7): 3187-3193.]
(  0) 0) |
| [28] |
Wang N, Huang L, Luo X, et al. Impact of biochar on nitrogen removal and nitrous oxide emission in aerated vertical flow constructed wetland (In Chinese)[J]. Environmental Science, 2018, 39(10): 4505-4511. [王宁, 黄磊, 罗星, 等. 生物炭添加对曝气人工湿地脱氮及氧化亚氮释放的影响[J]. 环境科学, 2018, 39(10): 4505-4511.]
(  0) 0) |
| [29] |
Zhu Z L. Research on soil nitrogen in China (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(5): 778-783. DOI:10.3321/j.issn:0564-3929.2008.05.003 [朱兆良. 中国土壤氮素研究[J]. 土壤学报, 2008, 45(5): 778-783.]
(  0) 0) |
| [30] |
Gardner J R, Fisher T R, Jordan T E, et al. Balancing watershed nitrogen budgets: Accounting for biogenic gases in streams[J]. Biogeochemistry, 2016, 127(2/3): 231-253.
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


