2. 中国农业大学资源与环境学院, 农田土壤污染防控与修复北京市重点实验室, 北京 100193
2. Beijing Key Laboratory of Farmland Soil Pollution Prevention and Remediation, College of Resources and Environmental Sciences, China Agricultural University, Beijing 100093, China
在富含碳酸盐的石灰性或石灰性改良土壤上,以往研究认为土壤无机碳(soil inorganic carbon,SIC)比较稳定,土壤CO2释放仅来自土壤有机碳(soil organic carbon,SOC)的分解,较少考虑SIC溶解的贡献[1-3]。然而随着碳同位素技术在碳循环研究的深入,最近发现SIC溶解对土壤CO2释放的贡献是不容忽视的,例如,近期石灰性土壤室内培养结果发现,SIC源CO2对土壤本身碳(SOC和SIC)排放的贡献分别为13%[1]、35%[4]和30%[5],甚至高达62%~80%[6]。因此,SIC库的稳定性直接影响大气CO2的浓度和土壤碳平衡的评估。
秸秆还田是影响土壤CO2排放的重要农业措施,在短期内,可以促进或抑制SOC的分解速率,即呈现正或负的“激发效应”(priming effects,PE)[7]。石灰性土壤中存在着碳酸盐溶解与沉淀平衡,秸秆碳与SOC耦合矿化增加土壤CO2的分压,可能加剧SIC的溶解与释放[3,8]。在秸秆还田条件下,石灰性土壤CO2释放来源达到三个,包括秸秆碳、SOC和SIC。区分土壤CO2的释放来源是量化石灰性土壤内外源碳释放的前提,由于三源区分CO2方法的限制,目前关于秸秆碳输入对石灰性土壤中SOC和SIC源CO2释放的影响还很模糊,导致秸秆还田下石灰性农田土壤碳释放评估不准确,因此这种不确定性急需评估[5,9],尤其在华北地区将秸秆还田作为普遍农业措施的石灰性农田。
根据13C同位素质量平衡方程,以及释放碳源之间的δ13C差异,通常单一的碳同位素技术仅可以两源区分土壤CO2的释放[7-9]。但是,借助稳定同位素溯源模型IsoSource,仅通过δ13C值就可以三源区分土壤CO2释放的贡献,例如在石灰性土壤上,Plestenjak等[10]利用稳定同位素溯源模型IsoSource三源区分土壤CO2源于SOC、SIC和大气的贡献。为了明确秸秆添加量对石灰性土壤有机和无机碳释放的影响,本研究以山东省桓台县的石灰性粮田土壤为研究对象,添加13C标记的玉米秸秆,控制条件下广口瓶培养32周。试验设置4个处理,分别为无秸秆的对照土壤(CK)、低量秸秆添加(S1,秸秆还田量为9.6 t·hm–2)、中量秸秆添加(S2,还田量为28.8 t·hm–2)和高量秸秆添加(S3,还田量为48.0 t·hm–2),利用秸秆碳、SOC与SIC之间的δ13C值差异,借助稳定同位素溯源模型IsoSource,三源拆分土壤CO2的释放,量化不同秸秆添加量对SOC和SIC源CO2释放的影响。本研究将有助于提高华北地区秸秆还田下石灰性土壤碳释放评估的准确性。
1 材料与方法 1.1 供试土壤和13C标记玉米秸秆供试土壤为山东省桓台县内华北集约农业生态系统试验站的耕层土壤(0~20 cm),试验站(117°59' E,36°57' N)建于2008年,海拔18 m。土壤类型为潮土类,具有黏壤土质结构(砂粒293 g·kg–1、粉粒321 g·kg–1和黏粒386 g·kg–1),土壤具体理化参数如表 1。
|
|
表 1 供试土壤理化性质 Table 1 Physical and chemical properties of soil |
供试13C标记玉米秸秆利用13CO2脉冲标记玉米地上部植株获取,具体标记步骤如下:在透光和密闭的标记室内,用13CO2(利用13C丰度为98 atom %的Ba13CO3与1 mol·L–1的HCl反应生成)对拔节期(出苗后第29天)玉米地上部持续标记7 h,标记结束经过27 d示踪期,然后破坏性取样,挑选富集度相对均匀的13C标记秸秆(δ13C值为144‰±0.6‰,C和N含量分别为425和7 g·kg–1)[11],在60℃下恒温烘干后,磨细过2 mm筛,装入自封袋中密封备用。
1.2 试验设计及方法为了研究秸秆投入量对SOC和SIC源CO2释放的影响,基于当地夏玉米秸秆还田量为9.6 t·hm–2,本研究秸秆还田量设置4个水平,分别设置空白对照、9.6、28.8和48.0 t·hm–2,换算为200 g土壤的秸秆添加量分别为0、0.72、2.16和3.60 g,分别用CK、S1、S2、S3表示,每个处理重复3次。
取过2 mm筛的新鲜土壤200 g(按干基计算),预培养7 d,然后S1、S2、S3处理土壤分别加入0.72、2.16和3.60 g 13C标记玉米秸秆,充分混匀后,装入300 mL广口瓶中培养。土壤含水量是影响秸秆和SOC分解以及SIC溶解的重要环境因子,考虑到华北田间冬小麦季除了常规降水之外,同时也频繁灌溉(通常4次灌溉,灌水总量约为300 mm),因此,为了模拟田间实际情况,本研究各处理按80%的田间持水量添加去离子水。然后,在培养瓶内部放置盛10 mL 1.0 mol·L–1 NaOH溶液的小塑料瓶,用来捕获土壤释放的CO2,最后瓶塞周围涂上凡士林密闭,以防漏气。在20℃恒温箱中培养32周,每隔3 d向培养瓶内通入一定量无CO2的空气,定期用称重法调节土壤含水量。
1.3 取样和测定在整个32周的培养期,土壤释放的CO2取样16次,分别在培养后的1、3、5、7、10、14、18、22、29、43、57、85、113、141、183和224 d取出CO2吸收瓶内的NaOH溶液,更换新的再放入。一部分取出的NaOH溶液用稀盐酸滴定,根据滴定液体积和浓度计算CO2的吸收量。为了测定CO2-δ13C值,用过量CaCl2溶液与另一部分吸收液中的CO32–反应生成CaCO3沉淀,低温烘干,用质谱仪(Finningan MAT 251型,菲尼根公司,德国)测定CaCO3-δ13C值[12]。设置3个空白瓶子,用于矫正操作过程中空气污染的CO2量和δ13C值[13]。
培养224 d后,取约20 g培养土壤置于白色板上,挑去残留的肉眼可见秸秆,为了测定SOC和SOC-δ13C值,首先去除SIC,具体步骤如下:(1)称取2~3 g土壤置于50 mL离心管,加入3 mol·L–1的HCl溶液20 mL,用振荡器充分震荡,静止反应2 d;(2)离心管置于低速离心机中,以3 000 r·min–1的转速离心3 min,将上清液倒掉,重复此过程,用pH试纸检测上清液的pH,洗到中性为止;(3)将酸化前的土壤上清液倒回离心管中,回收可溶性有机碳[11],在60℃条件下烘干,用球磨仪研磨,过0.15 mm筛,利用质谱仪(DELTAplus XP型,赛默飞世尔科技公司,美国)测定SOC-δ13C值。
1.4 计算方法 1.4.1 无秸秆添加条件下两源区分土壤释放的CO2石灰性土壤本身CO2的释放来自SOC分解和SIC溶解。SIC的δ13C值偏高(本研究为–4.10‰),而SOC的δ13C值偏低(–23.98‰),基于13C同位素质量守恒定律,借助13C两元线性模型,两源拆分土壤释放的CO2[5,9]:
| ${\delta _{\rm{t}}} = \left( {{C_{\rm{T}}}{\delta _{\rm{T}}} - {C_{\rm{C}}}{{\rm{ \mathit{ δ} }}_{\rm{C}}}} \right)/\left( {{C_{\rm{T}}} - {C_{\rm{C}}}} \right)$ | (1) |
式中,CT和CC分别代表土壤CO2释放量(包含培养瓶中空气CO2)和空白对照培养瓶中空气CO2释放量,g·kg–1;δT和δC分别代表CT和CC的δ13C值,其中CC-δ13C值为-8‰;δt为矫正后的土壤CO2的δ13C值[13]。
| $1 = {f_{{\rm{SOC}}}} + {f_{{\rm{SIC}}}} $ | (2) |
| ${\delta _{\rm{t}}} = {{\rm{ \mathit{ δ} }}_{{\rm{SOC}}}}{f_{{\rm{SOC}}}} + {\delta _{{\rm{SIC}}}}{f_{{\rm{SIC}}}} $ | (3) |
式中,fSOC和fSIC分别代表土壤CO2源于SOC分解和SIC溶解的贡献;δt、δSOC和δSIC分别代表土壤释放CO2(矫正后)、SOC和SIC的δ13C值。
1.4.2 添加秸秆条件下三源区分土壤释放的CO2在13C标记玉米秸秆(13C值为144‰)添加条件下,石灰性土壤CO2的释放来源包括秸秆和SOC的分解以及SIC的溶解,对式(2)和式(3)扩展至三个来源的土壤CO2的排放[10]:
| $1 = {f_{{\rm{SOC}}}} + {f_{{\rm{SIC}}}} + {f_{{\rm{Straw}}}}$ | (4) |
| ${\delta _{\rm{t}}} = {{\rm{ \mathit{ δ} }}_{{\rm{SOC}}}}{f_{{\rm{SOC}}}} + {{\rm{ \mathit{ δ} }}_{{\rm{SIC}}}}{f_{{\rm{SIC}}}} + {{\rm{ \mathit{ δ} }}_{{\rm{Straw}}}}{f_{{\rm{Straw}}}}$ | (5) |
式中,fSOC、fSIC和fStraw分别代表土壤CO2的释放源于SOC、SIC和秸秆的贡献(未知量);δt、δSOC、δSIC和δStraw分别代表土壤释放CO2、SOC、SIC和秸秆碳的δ13C值(已知量)。这个由两个方程和三个未知数组成的不确定方程系统,通过IsoSource软件计算求解,三源划分土壤释放的CO2[10]。
1.4.3 量化秸秆添加对SOC和SIC源CO2释放的影响在秸秆添加条件下,利用式(4)和式(5)量化SOC源CO2释放量,减去对照土壤的SOC释放碳量[式(2)和式(3)],量化秸秆添加引起的SOC源CO2额外释放量,即SOC分解的PE[8]:
| ${\rm{P}}{{\rm{E}}_{{\rm{SOC}}}} = \left( {{\rm{PE}}_{{\rm{SOC}}}^{\rm{S}} - {\rm{PE}}_{{\rm{SOC}}}^{{\rm{CK}}}} \right)/{\rm{PE}}_{{\rm{SOC}}}^{{\rm{CK}}} \times 100 $ | (6) |
式中,PESOC代表PE的相对值,%;PESOCS和PESOCCK分别代表秸秆添加和对照土壤中SOC源CO2释放量,g·kg–1。
秸秆碳和SOC耦合矿化增加土壤CO2分压,这可能加剧SIC源CO2释放[5],利用式(4)和式(5)定量SIC源CO2释放量,减去对照土壤的SIC源CO2释放量[式(2)和式(3)],量化秸秆添加导致SIC源CO2额外释放量:
| ${\rm{P}}{{\rm{E}}_{{\rm{SOC}}}} = \left( {{\rm{PE}}_{{\rm{SOC}}}^{\rm{S}} - {\rm{PE}}_{{\rm{SOC}}}^{{\rm{CK}}}} \right)/{\rm{PE}}_{{\rm{SOC}}}^{{\rm{CK}}} \times 100$ | (7) |
式中,PESIC代表SIC源CO2释放量变化的相对值,%;PESICS和PESICCK分别代表秸秆添加和对照土壤中SIC源CO2释放量,g·kg–1。
1.5 数据分析用Excel 2013软件作图。方差分析用SPSS 17.0软件计算。土壤CO2的累计释放量在不同时间和不同秸秆添加量之间的差异显著性分析以及SOC与SIC源CO2累计释放量在不同秸秆添加量之间的比较采用最小显著差异法(least significant difference,LSD;P < 0.05水平)。
2 结果 2.1 秸秆添加对土壤CO2累计释放量的影响在整个培养期,培养时间和秸秆添加处理对土壤CO2的累计释放量存在显著交互作用(P < 0.001;图 1);随着培养时间的进行,秸秆添加显著增加土壤CO2的累计释放量(P < 0.001);并且随着秸秆添加量的递增,提高幅度显著增加(P < 0.001),至培养期末,S3、S2和S1土壤CO2的累计释放量较CK分别提高了5.4倍、3.4倍和1.3倍。
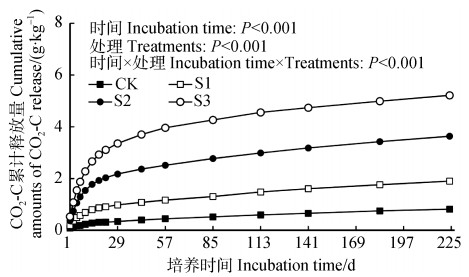
|
注:CK、S1、S2和S3分别代表对照、低量秸秆添加、中量秸秆添加和高量秸秆添加。下同。 Note: CK, S1, S2 and S3 represent no straw addition, low rates of straw addition, medium rates of straw addition and high rates of straw addition, respectively. The same below. 图 1 土壤CO2的累计释放量 Fig. 1 Cumulative amounts of soil-released CO2 over the whole incubation period |
随着培养时间的进行,秸秆添加土壤释放CO2的δ13C值呈下降趋势,从培养初期(第1天)的47.7‰~115.7‰下降至培养期末的–0.5‰~41.2‰(图 2),而CK土壤释放CO2的δ13C值变化范围较小,在–22.2‰~–14.5‰之间。
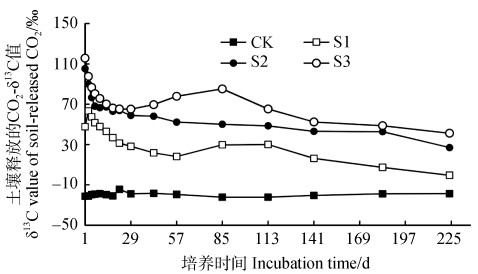
|
图 2 土壤释放CO2-δ13C值的动态变化 Fig. 2 Dynamic changes of δ13C value in soil-released CO2 |
CK土壤CO2释放仅有SOC分解和SIC溶解,在整个培养期,除第22天取样外,土壤CO2的释放主要源于SOC的分解(贡献为0.73~0.91),SIC源CO2的贡献仅为0.09~0.27(图 3a)。在整个培养期,秸秆源CO2的贡献随着秸秆添加量增加而增加,并且随着培养时间的进行,秸秆源CO2的贡献呈下降趋势,如,S1处理从培养初10 d内的0.39~0.49下降至培养期末的0.09(图 3b),S2处理从0.50~0.75下降至0.25(图 3c),S3处理从0.56~0.82下降至0.34(图 3d)。
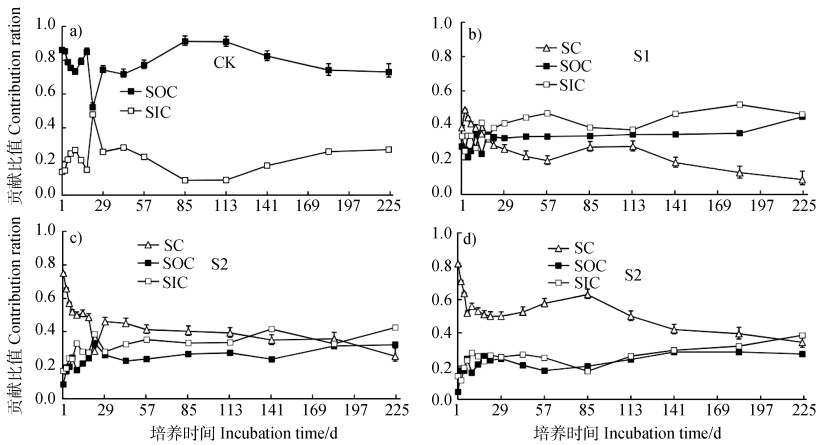
|
图 3 土壤CO2释放源于秸秆碳(SC)、土壤有机碳(SOC)和土壤无机碳(SIC)的贡献 Fig. 3 Contribution of straw-C(SC), soil organic carbon(SOC)and soil inorganic carbon(SIC)to soil-released CO2 |
在整个培养期,除了S1与CK之间的SOC源CO2累计释放量无显著差异之外,秸秆、SOC和SIC源CO2的累计释放量均随着秸秆添加量增加而显著增加(图 4a)。CK土壤CO2累计释放量源于SOC分解和SIC溶解的贡献分别为0.81和0.19;对于秸秆添加处理,秸秆分解对土壤CO2累计释放量的贡献随着秸秆添加量增加而增加,例如,S1、S2和S3处理的贡献分别为0.30、0.49和0.57,而土壤源CO2的贡献降低,在S1、S2和S3处理,SOC源CO2的贡献分别为0.32、0.22和0.20,SIC源CO2的贡献分别为0.39、0.29和0.23(图 4b)。
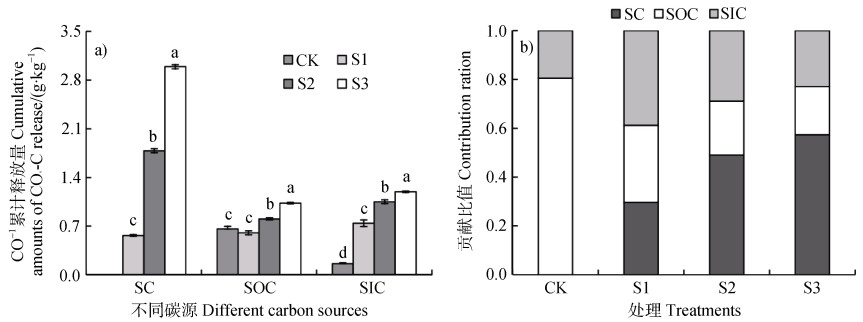
|
注:不同小写字母表示在相同碳源下不同秸秆量间的差异显著(P < 0.05)。 Note: Different lowercase letters in the same carbon source indicate a significant difference between different rates of straw addition at P < 0.05 level. 图 4 不同来源的CO2累计释放量(a)和对应的贡献比值(b) Fig. 4 Cumulative soil-released CO2 from different carbon sources(a)and their contribution ratio(b) |
与CK处理相比,S1处理抑制SOC的分解,PE为–9%,随着秸秆添加量的增加,秸秆添加对SOC分解由抑制逆转为促进,S2和S3处理促进SOC的分解,PE分别为22%和57%(图 5a)。SIC溶解的释放随秸秆添加量增加而显著提高,S1处理对SIC释放的增加幅度从368%提高至S3处理的652%(图 5b)。

|
注:不同小写字母表示不同处理下差异显著(P < 0.05)。 Note: Different lowercase letters indicate significant differences between different treatments at P < 0.05 level. 图 5 秸秆添加对SOC矿化的激发效应(a)和SIC释放的影响(b) Fig. 5 Effects of straw addition on priming effect of SOC mineralization(a)and SIC release(b) |
区分土壤释放CO2来源是量化石灰性土壤内外源碳释放的前提,而三源碳体系(包括秸秆碳、SOC和SIC)的存在给土壤释放CO2的区分带来困难[11,14]。本研究借助同位素溯源模型IsoSource,利用秸秆碳、SOC和SIC之间的δ13C差异,基于13C质量守恒定律,三源拆分土壤CO2排放,量化土壤CO2释放源的贡献范围[10]。然而,IsoSource模型未考虑稳定同位素值及分馏因子等的变异和不确定性,模型的容差参数的调整会带来贡献范围较大变化[15]。为了提高三源区分石灰性土壤内外源CO2释放的精确度,今后可以考虑采用高低富集度和均匀标记的13C秸秆,构建13C三元质量守恒方程,拆分土壤CO2中源于外源秸秆碳、内源SOC和SIC的比例[16-17]。例如Whitman和Lehmann[18]将13C标记和自然丰度玉米生物质炭分别按1:15(低富集度)和1:6(高富集度)等质量投入,来三源区分土壤释放CO2中源于生物质炭、根系和SOC的比例,但是,由于这个混合生物质炭材料的13C富集度是不均匀,可能导致得出不正确的分解研究结论。因此,为了提高区分结果的准确性,采用13C标记均匀的植物材料是前提,13C重复脉冲标记克服了单次标记不均匀的缺陷和连续标记的昂贵,可以获取高低13C富集较均匀的秸秆[19]。
本研究中,SOC和SIC的背景含量分别为14.6和6.1 g·kg–1,经过约8个月的土壤培养,各处理SOC和SIC的平均累计释放CO2-C量分别为0.77和0.79 g·kg–1(图 4a),仅为SOC背景值的5%和SIC背景值的13%。因此,在短期内,土壤本身碳库的变化相对背景值来说很小,因此,不能直接通过测定土壤碳含量的前后差值来研究土壤碳的释放,而是间接测定土壤CO2释放来量化[7]。13C自然丰度通常用于区分石灰性土壤CO2的释放来源:利用SIC-δ13C值偏高,SOC-δ13C值偏低,以及13C同位素线性方程量化SOC与SIC源CO2的贡献[1-2,4-6]。但是,这个方法需要假设SIC-δ13C值等同于SIC源CO2-δ13C值,以及SOC-δ13C值等同于SOC源CO2-δ13C值[1,4-6]。但是,最近研究表明SIC和SOC与对应的CO2释放之间是存在13C分馏的,但是大部分研究忽略这个分馏[2]。为了提高石灰性土壤碳平衡评估的精确度,这个13C分馏系数需要被量化。由于石灰土壤中的SOC和SIC是同时存在的,为了量化SIC与SIC源CO2之间的13C分馏,需要去除SOC源CO2的干扰,土壤高温或者化学灭菌法可能是有效方法[20]。在灭菌条件下,SIC与土壤释放CO2之间的δ13C值差异即是SIC与SIC源CO2之间的13C分馏系数。同样,为了定量SOC与SOC源CO2之间的13C分馏,通过酸洗法去除SIC,然后pH再调节至原来数值,这样可以排除SIC溶解的干扰[21],这种情况下SOC与土壤释放CO2之间的δ13C值差异即是SOC与SOC源CO2之间的13C分馏系数。
3.2 秸秆添加量对SOC矿化激发效应的影响本研究表明,SOC矿化PE随秸秆添加量的增加而改变其强度,甚至方向,即PE方向由负(抑制SOC矿化)变为正(促进SOC矿化)(图 5a)。在低量秸秆添加下,这可能利用易分解碳源的r型微生物(生长较快)取得竞争优势,优先利用易降解非结构性秸秆碳,降低对SOC的分解,导致负PE(底物偏好利用机制)[22];在中、高量秸秆添加下,即在土壤有碳缺氮条件下,可兼性利用易分解和难分解碳源的K策略微生物(生长较慢)在竞争中处于优势,通过微生物掘取土壤有机质的氮素,来缓解微生物氮素缺乏,呈现正PE,并且随着秸秆添加量增加而增加(图 5a),这是由于微生物氮素缺乏随碳输入量而上升[22-24]。Cui等[23]发现外源活性碳输入量相当于50%~300%微生物生物量碳时较为适宜,碳输入量过高或过低均可能导致PE程度降低,甚至变为负值,在活性碳输入量过高的情况下(例如高于300%~500%的微生物碳时),土壤微生物无法通过单纯加快土壤有机质(较难利用)分解而迅速获得足够的氮素,转而通过死微生物生物量的再利用而解决严重的微生物氮素缺乏。
3.3 土壤无机碳溶解对石灰性土壤CO2释放的贡献本研究所用的土壤中SIC含量较高(6.1 g·kg–1),约为SOC含量的42%,SIC与SOC密切相关,体现在SOC分解释放的CO2与水作用后形成碳酸,可以驱动碳酸盐的溶解和释放[11,14,25-26]。本研究中,CK土壤释放的CO2源于SIC溶解的贡献约为19%(图 4b)。通过文献整合分析发现,石灰性土壤中SIC溶解对土壤释放CO2的平均贡献率为46%[16],高于本研究的结果。这表明石灰性土壤中SIC溶解对土壤CO2的释放贡献,超出以往的传统认识。以往研究通常认为SIC相对SOC而言较为稳定,对农业措施的响应不够敏感,因此很少关注SIC溶解对土壤CO2释放的贡献。长期以来,土壤本身CO2排放等同于土壤呼吸,这种认识在酸性和中性土壤中可能是正确的[4]。但是,最新的研究表明,在我国华北半湿润地区,农田管理措施(施肥、灌溉、耕作等)对于SIC影响的程度甚至高于SOC[25],尤其在高氮肥投入的农田,土壤施用铵态氮肥或者尿素后,通过硝化作用产生硝酸,这对土壤碳酸盐的溶解-沉淀平衡产生重要影响,甚至超过溶解-沉淀平衡关系的影响,属于强酸与碳酸盐直接反应,加剧SIC源CO2的释放[3,26]。此外,酸性农田通过撒石灰(主要成分为CaCO3)措施进行改良土壤酸化,这个中和过程会导致全球每年0.27 Gt C的CaCO3释放,甚至高于石灰性土壤本身SIC的释放(0.04 Gt C)[27]。因此,在石灰性土壤或石灰改良酸性土壤上,若忽视碳酸盐溶解对土壤CO2的释放贡献,可能导致对SOC分解的高估。
3.4 秸秆碳与SOC矿化促进SIC源CO2的释放在华北半湿润区土壤,包括褐土、潮土等,含有相当比例的SIC,甚至超过SOC的含量[14,28]。严格意义上,SIC包括固、液和气三相,分别为沉积碳酸盐(CaCO3和MgCO3)、土壤溶液中的HCO3–和H2CO3以及土壤空气中的CO2,土壤中存在着CaCO3(固相)-CO2(气相)-HCO3–(液相)的三相平衡(pH > 6.4)[29]:
| $\begin{align} & \text{CaC}{{\text{O}}_{\text{3}}}(固相)+{{\text{H}}_{\text{2}}}\text{O+C}{{\text{O}}_{\text{2}}}(气相)\fallingdotseq 2\text{HCO}_{\text{3}}^{-} \\ & (液相)+\text{C}{{\text{a}}^{2+}} \\ \end{align} $ | (8) |
因此,这个化学平衡涉及碳酸盐溶解(平衡向右移动)和再结晶形成(反方向),主要受土壤CO2分压[30]、pH[3]、湿度[31]和钙镁离子有效性[14]等的影响。在秸秆还田措施下,秸秆碳与SOC耦合矿化,通常产生正PE、促进SOC分解,因此激发SOC额外分解产生的CO2和秸秆分解的CO2会进一步增加土壤中CO2的分压[8,22](图 6),例如在本研究,SOC和秸秆矿化量随着秸秆投入量增加而显著增加(图 4a)。如果同时土壤湿度较高,就会导致碳酸盐的溶解,由此产生的HCO3–可能与有效的H+反应生成H2CO3,因此,当土壤溶液H2CO3饱和时,可以从土壤中释放出CO2[3,5]。此外,秸秆腐解过程中伴随着秸秆氮硝化和还原硫氧化产生质子,以及有机酸的产生,这势必进一步加剧碳酸钙的溶解[5]。例如本研究中,SIC源CO2释放量随着秸秆添加量增加而显著增加(图 4a)。
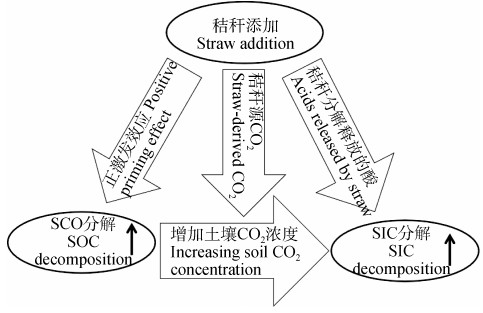
|
图 6 秸秆添加增加石灰性土壤无机碳溶解的模式图 Fig. 6 Model diagram of straw addition increasing SIC release from calcareous soils |
在富含碳酸盐的土壤上,土壤水分增加通常可提高SIC源CO2的释放[32–33]。这通常由两个主要机制引起:(1)土壤湿度增加一般可增加SOC矿化,进而增加土壤中CO2分压,并且土壤水分相对充足,最终可能促进CaCO3的溶解[32,34];(2)土壤水分含量提高可导致CaCO3-CO2-HCO3−平衡方程式[式(8)]向右移动[31-32,34]。需要注意的是,灌溉或降雨虽然可以增加土壤水分,进而提高SOC矿化,伴随着土壤CO2分压增加,但是不一定显著增加SIC源CO2的释放。这是由于田间条件下,土壤CO2与H2O形成的H2CO3在灌溉或降雨作用下流向深层土壤[35],这导致表层土壤pH增加,以及SIC源CO2释放增加不显著[34]。目前大部分关于土壤水分对SIC溶解影响的研究,通常是在广口瓶培养条件下,这仅考虑了SIC源CO2的释放,忽略了土壤无机碳淋洗的影响[34],今后研究应当采用原状土柱培养,同时考虑SIC源CO2释放和淋洗的问题[36]。
4 结论经过8个月的培养期,秸秆、SOC和SIC源CO2对土壤总CO2排放的贡献范围分别为0.30~0.57、0.20~0.32和0.23~0.39;SOC分解的激发效应(PE)大小随秸秆碳添加量的增加而增加,甚至改变PE的方向,即秸秆还田量为9.6 t·hm–2下PE为-9%,而秸秆还田量为28.8和48 t·hm–2下PE分别为22%和57%;SIC源CO2的累计释放量随着秸秆添加量增加而增加,这可能与秸秆分解和SOC激发效应增加土壤CO2浓度有关。
| [1] |
Stevenson B A, Verburg P S J. Effluxed CO2-13C from sterilized and unsterilized treatments of a calcareous soil[J]. Soil Biology and Biochemistry, 2006, 38(7): 1727-1733. DOI:10.1016/j.soilbio.2005.11.028
(  0) 0) |
| [2] |
Chevallier T, Cournac L, Hamdi S, et al. Temperature dependence of CO2 emissions rates and isotopic signature from a calcareous soil[J]. Journal of Arid Environments, 2016, 135: 132-139. DOI:10.1016/j.jaridenv.2016.08.002
(  0) 0) |
| [3] |
Zamanian K, Zarebanadkouki M, Kuzyakov Y. Nitrogen fertilization raises CO2 efflux from inorganic carbon: A global assessment[J]. Global Change Biology, 2018, 24(7): 2810-2817. DOI:10.1111/gcb.14148
(  0) 0) |
| [4] |
Bertrand I, Delfosse O, Mary B. Carbon and nitrogen mineralization in acidic, limed and calcareous agricultural soils: Apparent and actual effects[J]. Soil Biology and Biochemistry, 2007, 39(1): 276-288. DOI:10.1016/j.soilbio.2006.07.016
(  0) 0) |
| [5] |
Tamir G, Shenker M, Heller H, et al. Can soil carbonate dissolution lead to overestimation of soil respiration?[J]. Soil Science Society of America Journal, 2011, 75(4): 1414-1422. DOI:10.2136/sssaj2010.0396
(  0) 0) |
| [6] |
Ramnarine R, Wagner-Riddle C, Dunfield K E, et al. Contributions of carbonates to soil CO2 emissions[J]. Canadian Journal of Soil Science, 2012, 92(4): 599-607. DOI:10.4141/cjss2011-025
(  0) 0) |
| [7] |
Kuzyakov Y. Review: Factors affecting rhizosphere priming effects[J]. Journal of Plant Nutrition and Soil Science, 2002, 165(4): 66-70.
(  0) 0) |
| [8] |
Meng F, Dungait J A J, Xu X, et al. Coupled incorporation of maize(Zea mays L.) straw with nitrogen fertilizer increased soil organic carbon in Fluvic Cambisol[J]. Geoderma, 2017, 304: 19-27. DOI:10.1016/j.geoderma.2016.09.010
(  0) 0) |
| [9] |
Fang Y Y, Singh B P, Collins D, et al. Nutrient stoichiometry and labile carbon content of organic amendments control microbial biomass and carbon-use efficiency in a poorly structured sodic-subsoil[J]. Biology and Fertility of Soils, 2020, 56(2): 219-233. DOI:10.1007/s00374-019-01413-3
(  0) 0) |
| [10] |
Plestenjak G, Eler K, Vodnik D, et al. Sources of soil CO2 in calcareous grassland with woody plant encroachment[J]. Journal of Soils and Sediments, 2012, 12(9): 1327-1338. DOI:10.1007/s11368-012-0564-3
(  0) 0) |
| [11] |
Meng F, Dungait J A J, Zhang X, et al. Investigation of photosynthate-C allocation 27 days after 13C-pulse labeling of Zea mays L. at different growth stages[J]. Plant and Soil, 2013, 373(1/2): 755-764.
(  0) 0) |
| [12] |
Harris D, Porter L K, Paul E A. Continuous flow isotope ratio mass spectrometry of carbon dioxide trapped as strontium carbonate[J]. Communications in Soil Science and Plant Analysis, 1997, 28(9/10): 747-757.
(  0) 0) |
| [13] |
Cheng W, Johnson D W, Fu S. Rhizosphere effects on decomposition: Controls of plant species, phenology and fertilization[J]. Soil Science Society of America Journal, 2003, 67(5): 1418-1427. DOI:10.2136/sssaj2003.1418
(  0) 0) |
| [14] |
Sun Z, Wu S, Zhang Y, et al. Effects of nitrogen fertilization on pot-grown wheat photosynthate partitioning within intensively farmed soil determined by 13C pulse-labeling[J]. Journal of Plant Nutrition and Soil Science, 2019, 182(6): 896-907. DOI:10.1002/jpln.201800603
(  0) 0) |
| [15] |
Phillips D L, Gregg J W. Source partitioning using stable isotopes: Coping with too many sources[J]. Oecologia, 2003, 136(2): 261-269. DOI:10.1007/s00442-003-1218-3
(  0) 0) |
| [16] |
Sun Z A, Zhang B R, He M Y, et al. Three-source partitioning of CO2 emissions from maize-planted soil using 13C labeling and natural abundance (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(5). [孙昭安, 张保仁, 何敏毅, 等. 利用13C标记和自然丰度三源区分玉米根际CO2释放[J]. 土壤学报, 2021, 58(5).]
(  0) 0) |
| [17] |
Kerré B, Hernandez-Soriano M C, Smolders E. Partitioning of carbon sources among functional pools to investigate short-term priming effects of biochar in soil: A 13C study[J]. Science of the Total Environment, 2016, 547: 30-38. DOI:10.1016/j.scitotenv.2015.12.107
(  0) 0) |
| [18] |
Whitman T, Lehmann J. A dual-isotope approach to allow conclusive partitioning between three sources[J]. Nature Communications, 2015, 6: 8708. DOI:10.1038/ncomms9708
(  0) 0) |
| [19] |
Sun Z, Wu S, Zhu B, et al. Variation of 13C and 15N enrichments in different plant components of labeled winter wheat(Triticum aestivum L.)[J]. PeerJ, 2019, 7: e7738. DOI:10.7717/peerj.7738
(  0) 0) |
| [20] |
Bruun S, Clauson-Kaas S, Bobulska L, et al. Carbon dioxide emissions from biochar in soil: Role of clay, microorganisms and carbonates[J]. European Journal of Soil Science, 2014, 65: 52-59. DOI:10.1111/ejss.12073
(  0) 0) |
| [21] |
Jones D L, Murphy D V, Khalid M, et al. Short-term biochar-induced increase in soil CO2 release is both biotically and abiotically mediated[J]. Soil Biology and Biochemistry, 2011, 43(8): 1723-1731. DOI:10.1016/j.soilbio.2011.04.018
(  0) 0) |
| [22] |
Wang H, Boutton T, Xu W, et al. Quality of fresh organic matter affects priming of soil organic matter and substrate utilization patterns of microbes[J]. Scientific Reports, 2015, 5: 10102. DOI:10.1038/srep10102
(  0) 0) |
| [23] |
Cui J, Zhu Z, Xu X, et al. Carbon and nitrogen recycling from microbial necromass to cope with C: N stoichiometric imbalance by priming[J]. Soil Biology and Biochemistry, 2020, 142: 107720. DOI:10.1016/j.soilbio.2020.107720
(  0) 0) |
| [24] |
Zhu Z, Ge T, Luo Y, et al. Microbial stoichiometric flexibility regulates rice straw mineralization and its priming effect in paddy soil[J]. Soil Biology and Biochemistry, 2018, 121: 67-76. DOI:10.1016/j.soilbio.2018.03.003
(  0) 0) |
| [25] |
Bughio M A, Wang P, Meng F, et al. Neoformation of pedogenic carbonates by irrigation and fertilization and their contribution to carbon sequestration in soil[J]. Geoderma, 2016, 262: 12-19. DOI:10.1016/j.geoderma.2015.08.003
(  0) 0) |
| [26] |
Raza S, Na M, Wang P, et al. Dramatic loss of inorganic carbon by nitrogen-induced soil acidification in Chinese croplands[J]. Global Change Biology, 2020, 26: 3738-3751. DOI:10.1111/gcb.15101
(  0) 0) |
| [27] |
Zamanian K, Zhou J, Kuzyakov Y. Soil carbonates: The unaccounted, irrecoverable carbon source[J]. Geoderma, 2021, 384: 114817. DOI:10.1016/j.geoderma.2020.114817
(  0) 0) |
| [28] |
Dong X, Singh B P, Li G, et al. Biochar increased field soil inorganic carbon content five years after application[J]. Soil and Tillage Research, 2019, 186: 36-41. DOI:10.1016/j.still.2018.09.013
(  0) 0) |
| [29] |
Pan G X. Study on carbon reservoir in soils of China (In Chinese)[J]. Bulletin of Science and Technology, 1999, 15(5): 330-332. DOI:10.3969/j.issn.1001-7119.1999.05.002 [潘根兴. 中国土壤有机碳和无机碳库量研究[J]. 科技通报, 1999, 15(5): 330-332.]
(  0) 0) |
| [30] |
Kristiansen S M, Brandt M, Hansen E M, et al. 13C signature of CO2 evolved from incubated maize residues and maize-derived sheep faeces[J]. Soil Biology and Biochemistry, 2004, 36: 99-105. DOI:10.1016/j.soilbio.2003.07.002
(  0) 0) |
| [31] |
Dong Y J, Cai M, Zhou J B. Effects of moisture and carbonate additions on CO2 emission from calcareous soil during closed-jar incubation[J]. Journal of Arid Land, 2014, 6(1): 37-43. DOI:10.1007/s40333-013-0195-6
(  0) 0) |
| [32] |
Lardner T, George S, Tibbett M. Interacting controls on innate sources of CO2 efflux from a calcareous arid zone soil under experimental acidification and wetting[J]. Journal of Arid Environments, 2015, 122: 117-123. DOI:10.1016/j.jaridenv.2015.07.001
(  0) 0) |
| [33] |
Bramble D S E, Gouveia G A, Ramnarine R, et al. Organic residue and agricultural lime interactions on CO2 emissions from two contrasting soils: Implications for carbon management in acid soils[J]. Journal of Soils and Sediments, 2021, 21(1): 172-188. DOI:10.1007/s11368-020-02736-7
(  0) 0) |
| [34] |
Inglima I, Alberti G, Bertolini T, et al. Precipitation pulses enhance respiration of Mediterranean ecosystems: the balance between organic and inorganic components of increased soil CO2 efflux[J]. Global Change Biology, 2009, 15(5): 1289-1301. DOI:10.1111/j.1365-2486.2008.01793.x
(  0) 0) |
| [35] |
Li Y, Wang Y G, Tang L S. The effort to re-activate the inorganic carbon in soil (In Chinese)[J]. Acta Pedologica Sinica, 2016, 53(4): 845-849. [李彦, 王玉刚, 唐立松. 重新被"激活"的土壤无机碳研究[J]. 土壤学报, 2016, 53(4): 845-849.]
(  0) 0) |
| [36] |
Guo L, Nishimura T, Imoto H, et al. Applicability of soil column incubation experiments to measure CO2 efflux[J]. International Agrophysics, 2015, 29(4): 413-421. DOI:10.1515/intag-2015-0047
(  0) 0) |
 2021, Vol. 58
2021, Vol. 58


