2. 江苏隆昌化工有限公司, 江苏如皋 226532;
3. 扬州大学化学化工学院, 江苏扬州 225002;
4. 国立高雄大学土木与环境工程系, 台湾高雄 81148;
5. 国立环境研究所资源循环废弃物研究中心, 日本筑波 305-8506;
6. 天津大学环境科学与工程学院, 天津 300072
2. Jiangsu Longchang Chemical Co., Ltd., Rugao, Jiangsu 226532, China;
3. School of Chemistry and Chemical Engineering, Yangzhou University, Yangzhou, Jiangsu 225002, China;
4. Department of Civil and Environmental Engineering, National University of Kaohsiung, Kaohsiung 81148, Taiwan;
5. Center for Material Cycles and Waste Management Research, National Institute for Environmental Studies, Tsukuba 305-8506, Japan;
6. School of Environmental Science and Engineering, Tianjin University, Tianjin 300072, China
土壤砷污染是全球性的环境问题。作为一级致癌物,砷可通过食物链或者直接经口部无意地摄入、呼吸以及皮肤接触等途径进入人体[1-2]。随着各国在食物链途径砷摄入方面的有效把控,对于长期进行户外工作而无有效防护措施的人群(农民、矿工等),以及常在户外活动但缺乏卫生意识的儿童等而言,直接经口部摄入土壤砷已成为其砷暴露的主要途径[3]。近年来我国颁布了具有里程碑意义的《土壤污染防治行动计划》及《土壤污染防治法》等。积极开展土壤环境质量状况调查并评估其健康风险,因地制宜地选用修复技术以降低乃至消除其风险和危害,是顺应我国土壤污染防治基本国策的重要事业。
以往我国对于土壤污染及其健康风险的评估均是基于污染物的总含量。新近颁布的《土壤环境质量建设用地土壤污染风险管控标准》(GB 36600-2018)[4]亦仍如此,而相应推出的《建设用地土壤污染风险评估技术导则》(HJ 25.3-2019)[5]虽已考虑土壤污染物经口摄入的吸收因子,但仍以100%作为其参考值。这样的做法通常高估土壤砷的人体健康风险[6]。而其他诸如浸出毒性实验方法(TCLP)等虽然能对土壤砷的生态风险进行较为准确的评估,却无法“直接”反映其对人体健康风险方面的信息。近年来,基于砷等污染物的生物可给性(Bioaccessibility)/生物有效性(Bioavailability)来科学准确地评估其健康风险的方法得到越来越广泛的认可[7]。砷的生物可给性即经口部摄入的土壤砷在人体胃肠道消化过程中被溶出而进入消化液的比率,而其生物有效性则是进一步为人体所吸收而进入体循环的比率[8]。体外(In vitro)试验可对人体特定器官的消化和吸收过程进行模拟,获取摄入的土壤砷的生物可给性/生物有效性信息,已成为砷等土壤污染物健康风险评估研究方面最重要的技术手段之一。Ruby等[9]较早提出了基于生理学的提取试验(Physiologically Based Extraction Test,PBET)模型,成功模拟人体胃和小肠(最主要的消化和吸收器官)的消化过程,并在众多研究土壤砷的生物可给性的体外试验模型中成为被广泛接受和应用的主流模型之一。而在砷的生物有效性研究方法方面,专用的超滤(Ultrafiltration,UF)装置可较为简便快速地模拟小肠上皮细胞对消化液中生物可给态砷的吸收过程,得到了成功应用[10]。随着in vitro试验模型不断地发展完善,应用其探索土壤砷等重(类)金属污染物的生物可给性/生物有效性的影响因素成为该领域的研究热点。
土壤砷的生物可给性/生物有效性的影响因素复杂,既包括诸多土壤基本理化特性,又包括砷的赋存形态。在土壤基本理化特性方面,土壤pH是研究较多的影响因素之一,Das等[11]发现其与土壤砷的生物可给性存在极显著正相关,而亦有土壤pH对砷的生物可给性无显著影响的报道[12];土壤有机质可与砷形成络合物而降低砷的生物可给性/生物有效性,但也有研究得到了截然相反的结论[13];一般认为,砷在粒径较小的土壤颗粒中的生物可给性更高,而Qin等[14]的研究却得到不同的结果;土壤阳离子交换量(CEC)是衡量土壤吸附固定重金属能力的指标,可影响土壤砷的生物可给性[15];除了土壤中钙镁的总含量[16]和草酸盐提取态铁、铝、锰的含量[17]以外,土壤中游离氧化铁铝作为可变电荷的主要载体,能专性吸附包括砷酸根在内的多价含氧酸根,也被认为是影响砷的生物可给性/生物有效性的重要因素[18];砷还易与土壤矿物发生反应,影响其在土壤中的保留及固相形态,进而影响砷在土壤中的迁移及其生物可给性/生物有效性[19-20]。在砷的赋存形态方面,Shiowatana连续提取法及Wenzel连续提取法是解析土壤砷化学形态的经典土壤化学方法[21]。Li等[22]的研究表明土壤砷的生物可给性与非专性吸附态砷和专性吸附态砷有显著的相关性,而Smith等[23]却发现砷的生物可给性与无定形和弱结晶铁铝氧化物结合态砷显著相关。总结前人对土壤性质与砷的生物可给性/生物有效性之间关联的研究可发现诸多不确定的甚至是相互矛盾的结论,其原因是上述研究大多仅针对个别土壤,并对单个或几个影响因素独立地进行探讨;缺乏针对多种类型土壤,并综合地对可能的影响因素进行的整合研究。
综上,本研究针对我国典型土壤砷污染问题,利用体外试验(PBET-UF模型)研究经口部摄入的土壤砷在人体消化道不同阶段的生物可给性/生物有效性及其健康风险,并进一步从土壤性质角度(包括土壤基本理化特性和砷的赋存形态)综合地探讨砷的生物可给性/生物有效性的影响因素,以期为砷污染土壤健康风险评估技术手段的持续改进提供科学依据与参考。
1 材料与方法 1.1 砷污染土壤的制备分别于福建、黑龙江、北京、江苏和湖南采集红壤、黑土、褐土、棕壤和黄壤这五种我国的典型土壤。按标准方法进行前处理[18]。在通常的好氧条件下,As(V)为土壤砷主要的存在形态,故采用常见的添加Na2HAsO4·7H2O的方式[24]将上述土壤制备成砷含量为600 mg·kg–1的污染土壤(达到国标GB36600-2018[4]中第一类用地砷含量管制值120 mg·kg–1的5倍)。保持土壤含水率30%左右,培养1个月。进而风干后,分别过10目和100目筛,保存以备用。其中过10目筛的土壤用于土壤pH、质地及可溶性钙镁离子含量测定,其余项目均使用过100目筛的土壤。各土壤相关实验均进行3次重复。
1.2 土壤基本理化特性分析土壤pH采用CaCl2提取法[18],土液比为1︰2.5,pH计(PHS-3C,雷磁,上海)测定。土壤有机质含量采用水合热重铬酸钾预处理[18],紫外分光光度计(UV 2006,天美)测定。土壤质地采用比重计法,甲种比重计测定[18]。土壤阳离子交换量(CEC)采用BaCl2提取法[25]测定。土壤中可溶性钙镁离子含量采用去二氧化碳超纯水提取法[18]测定。土壤中草酸盐提取态铁、铝、锰含量采用草酸-草酸铵提取法[26]测定。土壤中游离氧化铁铝含量采用连二亚硫酸钠-柠檬酸钠-重碳酸钠(DCB)提取法[18]测定。上述提取液中金属元素含量均先使用ICP-OES(ICP-ONS,Optima,美国)测定,若低于其检测限则进一步使用ICP-MS(ThermoFisher X SERIES II,美国)测定。后续砷的赋存形态及in vitro试验的样品中砷含量的测定方法亦同。土壤的矿物学表征采用X射线衍射技术(X-ray diffraction,XRD),测试仪器为Rigaku Mini Flex 600射线粉末衍射光谱仪,X射线采用Cu Kα辐射,扫描范围5°~80°,扫描步长为0.02°,扫描速率8°·min–1。
1.3 土壤砷的赋存形态分析(1)Shiowatana连续提取法是基于McLaren法改进的一种适用于土壤砷赋存形态分析的方法[21,27]。其将土壤中的砷分为水溶态砷(S1)、表层吸附态砷(S2)、铁铝结合态砷(S3)、钙结合态砷(S4)及残渣态砷(S5)。每步提取所得样品经离心后过0.45 μm滤膜,4℃保存待测砷含量。
(2)Wenzel连续提取法是目前土壤砷赋存形态分析最常用的方法之一[28]。其将土壤中的砷分为非专性吸附态砷(W1)、专性吸附态砷(W2)、无定形和弱结晶铁铝氧化物结合态砷(W3)、结晶铁铝氧化物结合态砷(W4)及残渣态砷(W5)。每步提取所得样品经离心后过0.45 μm滤膜,4℃保存待测砷含量。
(3)迁移系数:在连续提取法中,最先被提取出的两种形态(F1和F2)相较后续提取出的形态(F3、F4和F5)更为活跃,迁移到环境中的可能性更大,通常被认为是土壤总砷中对环境造成最大风险的赋存形态。
卢聪等[29]用迁移系数表征其在土壤总砷中的比例,公式为:
| $ 迁移系数 = \left( {{\rm{F1 + F2}}} \right)/\left( {{\rm{F1 + F2 + F3 + F4 + F5}}} \right) $ | (1) |
对于Shiowatana连续提取法和Wenzel连续提取法而言,上述公式演变为:
| $ 迁移系数{\rm{s}} = \left( {{\rm{S1 + S2}}} \right){\rm{/}}\left( {{\rm{S1 + S2 + S3 + S4 + S5}}} \right) $ | (2) |
| $ 迁移系数{\rm{w = }}\left( {{\rm{W1 + W2}}} \right){\rm{/}}\left( {{\rm{W1 + W2 + W3 + W4 + W5}}} \right) $ | (3) |
对于人体胃肠道消化过程的模拟主要采用Ruby等[9]提出的PBET模型,同时借鉴Rodriguez等[30]提出的体外胃肠(In Vitro Gastrointestinal,IVG)模型进行改进;进而与Chen等[10]提出的UF装置结合,对吸收过程进行模拟。PBET-UF模型的详细实验步骤如下:
胃阶段消化过程:每批样品配制1 L模拟胃液(含0.15 mol·L–1氯化钠、0.50 g柠檬酸、0.50 g苹果酸、0.42 mL乳酸和0.50 mL冰乙酸),用12 mol·L–1浓HCl调节pH至1.5,加入1.25 g胃蛋白酶(Porcine Pepsin P7000,Sigma-Aldrich,美国)。将0.30 g土壤样品及30.00 mL胃液混合于50 mL离心管内,并置于37℃,200 r·min–1水浴振荡器。1 h后,用针筒从离心管中吸取10 mL反应液,过0.45 μm膜,4℃保存待测砷含量。
小肠阶段消化过程:向50 mL离心管中添加NaHCO3粉末将反应液的pH调至7.0,加入0.018 g胰酶(Porcine Pancreatin P1500,Sigma-Aldrich,美国)和0.06 g胆盐(Bile Extract B8631,Sigma-Aldrich,美国),继续以前述条件反应4 h。其间,间隔30 min监测反应液pH,若偏离初始值,则用12 mol·L–1的浓HCl或NaHCO3粉末调节,使反应液pH维持稳定。4 h后,吸取10 mL反应液,过0.45 μm膜,4℃保存待测砷含量。
小肠阶段吸收过程:将50 mL离心管中的剩余液体以2 500 r·min–1的速度离心25 min,之后将上清液全部倒入超滤离心管(UFC800308,Millipore,美国)中,以5 500 r·min–1的速度离心1 h,弃去超滤装置部分,4℃保存待测砷含量。
1.5 砷的生物可给性/生物有效性计算砷在胃阶段或小肠阶段的生物可给性/生物有效性的计算公式:
| $ {\rm{BA = }}\left( {{C_{{\rm{IV}}}}{{\rm{V}}_{{\rm{IV}}}}} \right){\rm{/}}\left( {{{\rm{T}}_{\rm{S}}}{{\rm{M}}_{\rm{S}}}} \right){\rm{ \times 100}} $ | (4) |
式中,BA为砷的生物可给性/生物有效性,%;CIV为in vitro试验的胃阶段或小肠阶段所得待测液中砷的可溶态浓度,mg·L–1,即ICP-OES或ICP-MS的测定值;VIV为离心管内的反应液体积,L,本实验为0.03 L;TS为土壤样品中的砷总量,mg·kg–1,本实验为600 mg·kg–1;MS为添加入离心管的土壤样品的质量,kg,本实验为0.0003 kg。
1.6 土壤砷对人体的健康风险评估根据《建设用地土壤污染风险评估技术导则》(HJ 25.3-2019)[5],在一类用地场景中对经口部摄入暴露途径下土壤砷的人体健康风险进行评估,并分别以砷对人体的致癌风险和非致癌风险进行结果表征。其中,致癌风险考虑人群在儿童期和成人期暴露的终生危害,而非致癌风险仅考虑人群在儿童期暴露受到的危害。此外,经口摄入吸收因子使用本研究获得的胃阶段或小肠阶段砷的生物可给性/生物有效性值。结果解读方面,当土壤砷的致癌风险超过10–6或非致癌风险(危害商)超过1时,则表示该土壤存在不可接受的风险。
1.7 数据分析采用SPSS 20.0对相关数据进行差异显著性分析(包括配对样本T检验和单因素方差分析,组间采用最小显著差异法(LSD)多重比较)、皮尔森(Pearson)相关分析及逐步多元回归分析。Origin 9.1或Excel 2016进行图表绘制。
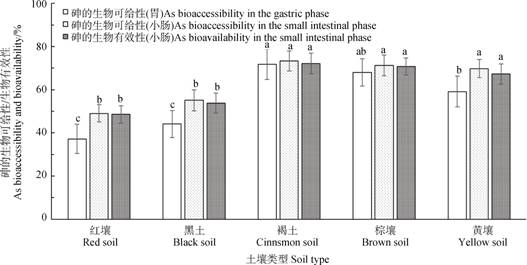
2 结果与讨论 2.1 土壤砷的生物可给性/生物有效性土壤砷在胃阶段与小肠阶段的生物可给性/生物有效性见图 1。土壤砷在胃阶段的生物可给性为37.2%~71.8%,小肠阶段的生物可给性为49.0%~73.3%,小肠阶段的生物有效性为48.6%~72.1%。首先,砷在小肠阶段的生物可给性极显著高于其在胃阶段的生物可给性(P < 0.01),反映出土壤中砷从胃到小肠是一个逐步被消化溶出的过程。这与付瑾和崔岩山[31]观察到的现象一致,可能是因从胃阶段进入小肠阶段后pH明显升高导致的[7],而该过程涉及的机理较为复杂。王金翠等[32]认为pH的升高导致土壤负电荷量增加,使其对砷酸根等的吸附能力降低,进而出现砷的解吸现象。也有一些学者则认为土壤中的铁元素对砷的溶解起到了重要的控制作用,而pH的升高促进了铁的溶解,进而导致了砷的解吸[33-34]。当然,还有部分学者将铁的溶解归结于小肠阶段更为多样的有机酸等对铁的强结合能力[35]。其次,砷在小肠阶段的生物可给性与生物有效性间无显著差异(P > 0.05),这说明小肠液中溶解态的砷或以离子形态存在,或与各种消化酶结合后的质量仍可透过模拟小肠上皮细胞的专用超滤膜。此外,在胃肠道各阶段,不同土壤间砷的生物可给性/生物有效性存在极显著差异(P < 0.01),多重比较结果见图 1。本研究结果再次表明最新的《建设用地土壤污染风险评估技术导则》(HJ 25.3-2019)等将土壤砷经口摄入吸收因子默认为100%来评估其健康风险的做法在科学性、准确性上存在明显的不足,必须改进。
|
注:在胃肠道同一阶段,不同字母表示土壤间存在显著差异(P < 0.05)。 Note:Different letters indicate significant differences between different soils in the same gastrointestinal tract(P < 0.05). 图 1 土壤砷在胃阶段与小肠阶段的生物可给性/生物有效性 Fig. 1 Bioaccessibility/bioavailability of soil As in the gastric and small intestinal phases |
以胃阶段土壤砷的生物可给性数据进行健康风险评估,五种土壤砷的致癌风险范围在4.28×10–4~8.26×10–4,均超过可接受限值1×10–6两个数量级,存在致癌风险;非致癌风险范围在14.86~28.69,均超过可接受限值(1)一个数量级,存在非致癌风险。不同土壤间砷对人体的致癌风险和非致癌风险均存在极显著差异(P < 0.01),多重比较结果与土壤砷在胃阶段的生物可给性的(图 1)相同。
因小肠阶段土壤砷的生物可给性和生物有效性间无显著差异,故以更为直接反映人体对砷吸收状况的生物有效性数据进行健康风险评估。五种土壤砷的致癌风险范围在5.59×10–4~8.30×10–4,均超过可接受限值1×10–6两个数量级,存在致癌风险;非致癌风险范围在19.40~28.81,均超过可接受限值(1)一个数量级,存在非致癌风险。不同土壤间砷对人体的致癌风险和非致癌风险均存在极显著差异(P < 0.01),多重比较结果与土壤砷在小肠阶段的生物有效性的(图 1)相同。
2.3 土壤砷的生物可给性/生物有效性的影响因素 2.3.1 土壤基本理化特性的影响砷污染土壤的部分基本理化特性见表 1。
|
|
表 1 土壤基本理化特性 Table 1 Basic physicochemical properties of the soils |
土壤基本理化特性与土壤砷在胃阶段的生物可给性的相关分析仅发现土壤pH与其存在极显著正相关性(r=0.993,P < 0.01),游离氧化铁铝含量与其存在显著负相关性(r= –0.934,P < 0.05)。土壤基本理化特性与土壤砷在小肠阶段的生物可给性/生物有效性的相关分析仅发现土壤pH与其存在极显著正相关性(r=0.987,P < 0.01;r=0.995,P < 0.01),游离氧化铁铝含量与其存在极显著负相关性(r= –0.966,P < 0.01;r= –0.968,P < 0.01)。无论在胃阶段还是小肠阶段,土壤pH和游离氧化铁铝含量均与土壤砷的生物可给性/生物有效性存在显著或极显著相关性。
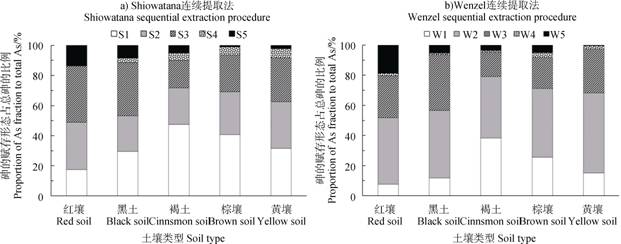
2.3.2 土壤砷赋存形态的影响土壤砷的各赋存形态及其占总砷的百分比见图 2。由图 2a)可知,迁移系数s的由高到低依次为褐土(72%)、棕壤(68%)、黄壤(63%)、黑土(53%)、红壤(49%),平均为61%。不同土壤间迁移系数s存在显著差异(P < 0.05)。由图 2b)可知,迁移系数W由高到低依次为褐土(79%)、棕壤(71%)、黄壤(68%)、黑土(57%)、红壤(52%),平均为65%。不同土壤间迁移系数w存在显著差异(P < 0.05)。Shiowatana连续提取法和Wenzel连续提取法作为两种经典的分析土壤砷赋存形态的土壤化学方法,其所得结果较为接近,在相互验证之余,也为几种类型的砷污染土壤的环境风险状况提供了科学参考。
|
注:S1~S5分别表示水溶态砷、表层吸附态砷、铁铝结合态砷、钙结合态砷及残渣态砷;W1~W5分别表示非专性吸附态砷、专性吸附态砷、无定形和弱结晶铁铝氧化物结合态砷、结晶铁铝氧化物结合态砷及残渣态砷。 Note:S1~S5 represent water-soluble As,surface-adsorbed As,Fe and Al associated As,Ca associated As and residual As;W1~W5 represent non-specifically sorbed As,specifically-sorbed As,amorphous and poorly-crystalline hydrous oxides of Fe and Al associated As,well-crystallized hydrous oxides of Fe and Al associated As and residual As. 图 2 土壤砷的赋存形态及其占总砷的比例 Fig. 2 Fractions of soil As and their proportions to total As |
迁移系数与土壤砷在胃阶段和小肠阶段的生物可给性/生物有效性的相关分析结果见表 2。无论在胃阶段还是小肠阶段,迁移系数s、迁移系数w均与土壤砷的生物可给性/生物有效性存在极显著正相关性。
|
|
表 2 迁移系数与土壤砷在胃阶段和小肠阶段的生物可给性/生物有效性之间的相关性 Table 2 Correlations between migrations coefficients and bioaccessibility/bioavailability of soil As in the gastric and small intestinal phases |
多元回归分析可在一定程度上消除自变量之间的多重共线性问题,真实反映出各自变量与因变量间的关系。分别以胃阶段土壤砷的生物可给性、小肠阶段土壤砷的生物可给性/生物有效性为因变量,主要影响因素为自变量,进行逐步多元回归分析,结果见表 3。
|
|
表 3 土壤砷的生物可给性/生物有效性与影响因素的多元回归 Table 3 Multivariate regression analysis between bioaccessibility/bioavailability of soil As and the influencing factors |
上述各回归方程的R2均较大,表明相应的影响因素能够较好地反映胃肠道各阶段中土壤砷的生物可给性/生物有效性。迁移系数s为影响土壤砷在胃阶段的生物可给性的主导因子,而土壤pH是影响其在小肠阶段的生物可给性/生物有效性的主导因子。
2.4 土壤间砷生物可给性/生物有效性差异的可能机理综合上述结果可以看出,经口部摄入的土壤砷在人体胃肠道中的生物可给性/生物有效性与土壤pH、游离氧化铁铝含量、迁移系数s及迁移系数w关系密切。在消除各影响因素间共线性问题后,土壤砷在胃阶段的生物可给性与小肠阶段的生物可给性/生物有效性的主导因子分别为迁移系数S及土壤pH。可以此为依据,对砷的生物可给性/生物有效性的土壤间差异进行探讨。
土壤pH与土壤砷的生物可给性/生物有效性存在极显著正相关,这与Das等[11]报道的现象一致,且pH是影响土壤砷在小肠阶段的生物可给性/生物有效性的主导因子。土壤pH对大多数重金属离子和酸根的活性有着较大的影响。土壤pH较高时,土壤表面负电荷增多,土壤对砷的吸附减弱,促进了含砷阴离子的溶解[36],其砷的生物可给性/生物有效性也较高,反之亦然。故土壤pH最高的褐土,其砷的生物可给性/生物有效性也较高;而土壤pH最低的红壤,其砷的生物可给性/生物有效性也较低。
迁移系数s和迁移系数w与土壤砷的生物可给性/生物有效性存在极显著正相关,且迁移系数s是影响土壤砷在胃阶段的生物可给性的主导因子。Shiowatana连续提取法的S1和S2与Wenzel连续提取法的W1和W2的砷赋存形态的活性最高,通常在土壤环境中属于易溶出态[21]。在人体的消化道环境中,这些赋存形态的砷自然也较易溶出而进入消化液中,进而为人体吸收。因此,迁移系数s和迁移系数w最高的褐土,其砷的生物可给性/生物有效性也较高;同理,红壤的迁移系数s和迁移系数w最低,故其砷的生物可给性/生物有效性也较低。通过运用经典的连续提取法,获取砷的前两个赋存形态的含量并计算得到迁移系数,进而对土壤砷的生物可给性/生物有效性进行预测,不失为一种可取的方法。当然,连续提取法所要消耗的实验时间(至少26 h)远长于in vitro试验(至少6 h),在进行大量土壤样品的健康风险评估工作时,in vitro试验方法显然更具优势。
土壤中游离氧化铁铝含量虽不是直接影响土壤砷在胃肠道中的生物可给性/生物有效性的主导因子,但其与土壤砷的生物可给性/生物有效性存在显著或极显著负相关。砷易与土壤中的游离铁铝氧化物结合生成非晶形和晶形矿物,从而导致其在土壤中的活性降低[37]。对照Wenzel连续提取法结果(图 2b))可知,土壤中的砷与铁铝氧化物结合后主要以无定形和弱结晶铁铝氧化物结合态形式存在。红壤形成过程中,成土母质经历脱硅富铁铝化这一典型过程,其富含铁铝氧化物,故其中游离氧化铁铝含量也相对较高,导致砷的生物可给性/生物有效性较低;而褐土为碳酸盐母质风化发育形成的土壤,所含铁铝氧化物相对较少,其中游离氧化铁铝含量自然也较低,故砷的生物可给性/生物有效性较高。
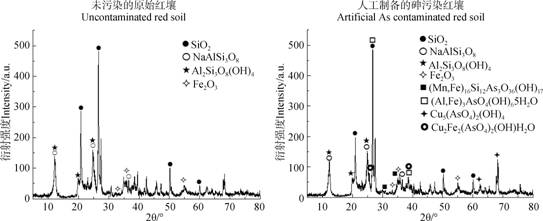
而砷除了易与铁铝氧化物结合生成新的矿物外,还易吸附于赤铁矿及高岭石等矿物的表面[38-39],这些矿物恰丰富存在于红壤中(图 3)。而在其他类型土壤中,形成的新矿物种类较少。上述也可作为红壤中砷的生物可给性/生物有效性较低的辅助解释。
|
图 3 原始红壤和人工制备砷污染红壤的X射线粉末衍射图 Fig. 3 X-ray diffraction(XRD)patterns of the uncontaminated red soil and the artificial As contaminated red soil |
针对我国红壤、黑土、褐土、棕壤和黄壤这五种典型土壤的研究,为后续开展更加符合现实土壤污染情景及经口部摄入暴露途径的健康风险评估提供一定科学依据与参考。在相同砷污染程度下(600 mg·kg–1),不同土壤在砷的生物可给性/生物有效性上均存在极显著差异;从胃到小肠,土壤砷被逐步消化溶出,而小肠中溶解态砷均可透过模拟其上皮细胞的专用超滤膜;不同土壤间砷对人体的健康风险存在极显著差异,致癌风险和非致癌风险分别超过可接受限值两个和一个数量级。土壤砷的生物可给性/生物有效性与土壤pH、游离氧化铁铝含量、迁移系数s和迁移系数w关系密切,而迁移系数s和土壤pH分别为影响土壤砷在胃阶段的生物可给性和小肠阶段的生物可给性/生物有效性的主导因子。其中,pH与土壤砷的生物可给性/生物有效性存在极显著正相关;经典的Shiowatana连续提取法与Wenzel连续提取法获得的迁移系数s和迁移系数w均可较好地预测土壤砷的生物可给性/生物有效性,但相对较为耗时;游离氧化铁铝与土壤砷的生物可给性/生物有效性存在显著或极显著负相关。在今后开展较大范围的污染土壤健康风险评估工作时,建议尝试将in vitro试验(PBET-UF模型)方法引入。
| [1] |
Zhao F J, Xie W Y, Wang P. Soil and human health (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 1-11. [赵方杰, 谢婉滢, 汪鹏. 土壤与人体健康[J]. 土壤学报, 2020, 57(1): 1-11.]
(  0) 0) |
| [2] |
Yager J W, Greene T, Schoof R A. Arsenic relative bioavailability from diet and airborne exposures: Implications for risk assessment[J]. The Science of the Total Environment, 2015, 536: 368-381. DOI:10.1016/j.scitotenv.2015.05.141
(  0) 0) |
| [3] |
Mohammed Abdul K S, Jayasinghe S S, Chandana E P S, et al. Arsenic and human health effects: A review[J]. Environmental Toxicology and Pharmacology, 2015, 40(3): 828-846. DOI:10.1016/j.etap.2015.09.016
(  0) 0) |
| [4] |
生态环境部. 土壤环境质量建设用地土壤污染风险管控标准: GB36600-2018[S]. 北京: 中国环境出版社, 2019. Ministry of Ecology and Environment. Soil environmental quality-Risk control standard for soil contamination of development land: GB36600-2018[S]. Beijing: China Environment Press, 2019. (  0) 0) |
| [5] |
生态环境部. 建设用地土壤污染风险评估技术导则: HJ25.3-2019[S]. 北京: 中国环境出版社, 2019. Ministry of Ecology and Environment. Technical guidelines for risk assessment of soil contamination of land for construction: HJ25.3-2019[S]. Beijing: China Environment Press, 2019. (  0) 0) |
| [6] |
Li H B, Li J, Zhu Y G, et al. Comparison of arsenic bioaccessibility in housedust and contaminated soils based on four in vitro assays[J]. The Science of the Total Environment, 2015, 532: 803-811. DOI:10.1016/j.scitotenv.2015.06.060
(  0) 0) |
| [7] |
Bradham K D, Diamond G L, Burgess M, et al. In vivo and in vitro methods for evaluating soil arsenic bioavailability: Relevant to human health risk assessment[J]. Journal of Toxicology and Environmental Health, Part B, 2018, 21(2): 83-114. DOI:10.1080/10937404.2018.1440902
(  0) 0) |
| [8] |
Yin N Y, Cai X L, Du H L, et al. In vitro study of soil arsenic release by human gut microbiota and its intestinal absorption by Caco-2 cells[J]. Chemosphere, 2017, 168: 358-364. DOI:10.1016/j.chemosphere.2016.10.091
(  0) 0) |
| [9] |
Ruby M V, Davis A, Schoof R A, et al. Estimation of lead and arsenic bioavailability using a physiologically based extraction test[J]. Environmental Science & Technology, 1996, 30(2): 422-430.
(  0) 0) |
| [10] |
Chen X C, Niu J, Cui Y S. In vitro digestion/centrifugal ultrafiltration to determine the oral bioavailability of lead in soils[J]. Journal of Food, Agriculture and Environment, 2012, 10(1): 681-684.
(  0) 0) |
| [11] |
Das S, Jean J S, Kar S. Bioaccessibility and health risk assessment of arsenic in arsenic-enriched soils, Central India[J]. Ecotoxicology and Environmental Safety, 2013, 92: 252-257. DOI:10.1016/j.ecoenv.2013.02.016
(  0) 0) |
| [12] |
Juhasz A L, Smith E, Weber J, et al. In vitro assessment of arsenic bioaccessibility in contaminated(anthropogenic and geogenic) soils[J]. Chemosphere, 2007, 69(1): 69-78. DOI:10.1016/j.chemosphere.2007.04.046
(  0) 0) |
| [13] |
Suriyagoda L D B, Dittert K, Lambers H. Arsenic in rice soils and potential agronomic mitigation strategies to reduce arsenic bioavailability: A review[J]. Pedosphere, 2018, 28(3): 363-382. DOI:10.1016/S1002-0160(18)60026-8
(  0) 0) |
| [14] |
Qin J H, Nworie O E, Lin C X. Particle size effects on bioaccessible amounts of ingestible soil-borne toxic elements[J]. Chemosphere, 2016, 159: 442-448. DOI:10.1016/j.chemosphere.2016.06.034
(  0) 0) |
| [15] |
Cui Y S, Chen X C. Lead(Pb) and arsenic(As) bioaccessibility in various soils from South China[J]. Environmental Monitoring and Assessment, 2011, 177(1/2/3/4): 481-492.
(  0) 0) |
| [16] |
Sarkar D, Makris K C, Parra-Noonan M T, et al. Effect of soil properties on arsenic fractionation and bioaccessibility in cattle and sheep dipping vat sites[J]. Environment International, 2007, 33(2): 164-169. DOI:10.1016/j.envint.2006.09.004
(  0) 0) |
| [17] |
Yin N Y, Cui Y S, Zhang Z N, et al. Bioaccessibility and dynamic dissolution of arsenic in contaminated soils from Hunan, China[J]. Journal of Soils and Sediments, 2015, 15(3): 584-593. DOI:10.1007/s11368-014-1022-1
(  0) 0) |
| [18] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.]
(  0) 0) |
| [19] |
Kim E J, Yoo J C, Baek K. Arsenic speciation and bioaccessibility in arsenic-contaminated soils: Sequential extraction and mineralogical investigation[J]. Environmental Pollution, 2014, 186: 29-35. DOI:10.1016/j.envpol.2013.11.032
(  0) 0) |
| [20] |
An L H, Liu M C, Zhang J Q, et al. Sources of arsenic in soil and affecting factors of migration and release: A review (In Chinese)[J]. Soils, 2020, 52(2): 234-246. [安礼航, 刘敏超, 张建强, 等. 土壤中砷的来源及迁移释放影响因素研究进展[J]. 土壤, 2020, 52(2): 234-246.]
(  0) 0) |
| [21] |
Liu G N, Chen M, Li W Q, et al. A critical review on the speciation and development of sequential extraction procedures for arsenic in soils (In Chinese)[J]. Journal of Agro-Environment Science, 2018, 37(12): 2629-2638. DOI:10.11654/jaes.2018-0544 [刘冠男, 陈明, 李悟庆, 等. 土壤中砷的形态及其连续提取方法研究进展[J]. 农业环境科学学报, 2018, 37(12): 2629-2638.]
(  0) 0) |
| [22] |
Li S W, Li J, Li H B, et al. Arsenic bioaccessibility in contaminated soils: Coupling in vitro assays with sequential and HNO3 extraction[J]. Journal of Hazardous Materials, 2015, 295: 145-152. DOI:10.1016/j.jhazmat.2015.04.011
(  0) 0) |
| [23] |
Smith E, Naidu R, Weber J, et al. The impact of sequestration on the bioaccessibility of arsenic in long-term contaminated soils[J]. Chemosphere, 2008, 71(4): 773-780. DOI:10.1016/j.chemosphere.2007.10.012
(  0) 0) |
| [24] |
Silvetti M, Garau G, Demurtas D, et al. Influence of lead in the sorption of arsenate by municipal solid waste composts: Metal(loid) retention, desorption and phytotoxicity[J]. Bioresource Technology, 2017, 225: 90-98. DOI:10.1016/j.biortech.2016.11.057
(  0) 0) |
| [25] |
Hendershot W H, Duquette M. A simple Barium chloride method for determining cation exchange capacity and exchangeable cations[J]. Soil Science Society of America Journal, 1986, 50(3): 605-608. DOI:10.2136/sssaj1986.03615995005000030013x
(  0) 0) |
| [26] |
Klute A. Methods of soil analysis[M]. Madison, WI, USA: Soil Science Society of America, American Society of Agronomy, 1986.
(  0) 0) |
| [27] |
Shiowatana J, McLaren R G, Chanmekha N, et al. Fractionation of arsenic in soil by a continuous-flow sequential extraction method[J]. Journal of Environmental Quality, 2001, 30(6): 1940-1949. DOI:10.2134/jeq2001.1940
(  0) 0) |
| [28] |
Wenzel W W, Kirchbaumer N, Prohaska T, et al. Arsenic fractionation in soils using an improved sequential extraction procedure[J]. Analytica Chimica Acta, 2001, 436(2): 309-323. DOI:10.1016/S0003-2670(01)00924-2
(  0) 0) |
| [29] |
Lu C, Li Q Q, Luo Q S, et al. Stabilization treatment of available arsenic in contaminated soils and mechanism studies (In Chinese)[J]. China Environmental Science, 2013, 33(2): 298-304. DOI:10.3969/j.issn.1000-6923.2013.02.016 [卢聪, 李青青, 罗启仕, 等. 场地土壤中有效态砷的稳定化处理及机理研究[J]. 中国环境科学, 2013, 33(2): 298-304.]
(  0) 0) |
| [30] |
Rodriguez R R, Basta N T, Casteel S W, et al. An in vitro gastrointestinal method to estimate bioavailable arsenic in contaminated soils and solid media[J]. Environmental Science & Technology, 1999, 33(4): 642-649.
(  0) 0) |
| [31] |
Fu J, Cui Y S. In vitro model system to evaluate the influence of pH and soil-gastric/intestinal juices ratio on bioaccessibility of Pb, Cd and As in two typical contaminated soils (In Chinese)[J]. Journal of Agro-Environment Science, 2012, 31(2): 245-251. [付瑾, 崔岩山. In vitro系统评价胃肠液pH及土液比对铅、镉、砷生物可给性的影响[J]. 农业环境科学学报, 2012, 31(2): 245-251.]
(  0) 0) |
| [32] |
Wang J C, Sun J C, Huang G X, et al. Research on speciation and bioavailability of arsenic in soil (In Chinese)[J]. Earth and Environment, 2011, 39(1): 32-36. [王金翠, 孙继朝, 黄冠星, 等. 土壤中砷的形态及生物有效性研究[J]. 地球与环境, 2011, 39(1): 32-36.]
(  0) 0) |
| [33] |
Mercer K L, Tobiason J E. Removal of arsenic from high ionic strength solutions: Effects of ionic strength, pH, and preformed versus in situ formed HFO[J]. Environmental Science & Technology, 2008, 42(10): 3797-3802.
(  0) 0) |
| [34] |
Yin N Y, Du H L, Zhang Z N, et al. Variability of arsenic bioaccessibility and metabolism in soils by human gut microbiota using different in vitro methods combined with SHIME[J]. The Science of the Total Environment, 2016, 566/567: 1670-1677. DOI:10.1016/j.scitotenv.2016.06.071
(  0) 0) |
| [35] |
Juhasz A L, Smith E, Nelson C, et al. Variability associated with as in vivo-in vitro correlations when using different bioaccessibility methodologies[J]. Environmental Science & Technology, 2014, 48(19): 11646-11653.
(  0) 0) |
| [36] |
Zhang R, Yu G H, Li Y Q. Effects of long-term fertilization regimes on as accumulation in upland red earth and the crops growing on it (In Chinese)[J]. Chinese Journal of Environmental Science, 2018, 39(4): 1901-1909. [张蓉, 余光辉, 李亚青. 长期施肥对旱地红壤及作物中砷累积的影响[J]. 环境科学, 2018, 39(4): 1901-1909.]
(  0) 0) |
| [37] |
Wang S L, Mulligan C N. Natural attenuation processes for remediation of arsenic contaminated soils and groundwater[J]. Journal of Hazardous Materials, 2006, 138(3): 459-470. DOI:10.1016/j.jhazmat.2006.09.048
(  0) 0) |
| [38] |
Zhong S X, He H F, Chen Z L, et al. Advancement in study on biochemical behavior of arsenic in flooded paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(1): 1-17. [钟松雄, 何宏飞, 陈志良, 等. 水淹条件下水稻土中砷的生物化学行为研究进展[J]. 土壤学报, 2018, 55(1): 1-17.]
(  0) 0) |
| [39] |
Rahman M S, Clark M W, Yee L H, et al. Arsenic solid-phase speciation and reversible binding in long-term contaminated soils[J]. Chemosphere, 2017, 168: 1324-1336. DOI:10.1016/j.chemosphere.2016.11.130
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


