2. 湖北秭归三峡库区生态系统水利部野外科学观测研究站, 湖北秭归 443605;
3. 中国科学院大学资源与环境学院, 北京 100049
2. Zigui Three Gorges Reservoir Ecosystem, Observation and Research Station of Ministry of Water Resources of the People's Republic of China, Zigui, Hubei 443605, China;
3. College of Advanced Agricultural Sciences, University of Chinese Academy of Sciences, Beijing 100193, China
周丛生物是生长在淹水基质表面且在自然环境条件下形成的微生物聚集体及其交织的非生物物质(如铁锰氧化物)的集合体,广泛分布于水生生态系统中[1]。目前,大多数关于周丛生物的研究集中在湖泊、河流等水生生态系统中,或者关注生长在石头、竹子、木材和植物等“硬性”表面的周丛生物,而生长于稻田土壤等“软性”表面的周丛生物鲜有报道[2-3]。事实上,周丛生物在稻田中普遍存在,特别是在稻田土壤表面[4-5]。
周丛生物的形成和生长可能受到稻田生态系统中诸多因素影响,如光照、水分、温度和养分[6]。同时,人为活动(如水肥管理等)、气候和土壤母质等因素也会造成其群落组成、结构和功能的差异[7-8]。然而,目前尚无关于不同稻田生态系统中周丛生物差异的报道。
众所周知,周丛生物在稻田生态系统“水-土”界面之间生长,该界面是物质转化、能量传递和信息交流的中间载体,是物质转移的必经之地[9]。与单一微生物群落相比,周丛生物这一微生物聚集体具有更复杂的结构组成和稳定的生态功能。例如,周丛生物表面有许多微孔结构,它们作为吸附位点,可直接从水体中将氮和磷等营养物质运输至空腔内存储[10-11]。此外,有文献表明,周丛生物既能固定空气中的N2,又能通过分泌酶(如磷酸酶)将有机磷转化为无机形态[12-13]。因此,周丛生物的存在可能会通过影响稻田的养分迁移和运输,从而影响水稻生长。譬如,Lu等[14]研究了周丛生物对土-水界面之间磷迁移转化及有效性的影响,发现周丛生物能够同时从水相和表层土壤富集磷,并且可提高表层土壤中生物有效磷的含量。也有学者发现利用周丛生物中的部分组分能够影响水稻产量和供肥,例如,Whitton和Roger[15]研究发现,在水稻土中掺入蓝藻提高了水稻产量,其效果相当于添加20~30 kg·hm–2氮磷肥。然而,也有研究发现蓝藻在稻田中的含量不稳定,其效益有限[16]。同时,周丛生物由包括生产者、消费者和分解者在内的多种物种组成,其可作为高营养水平的能量和食物来源,稻田中周丛生物本身也需要摄取营养和获取生长空间,其生长繁殖可能与水稻竞争养分和空间[17]。因此,在稻田生态系统中研究周丛生物及其对水稻生长的影响对认识养分的供给路径和高效管理养分具有重要的实践意义。
为此,本研究的目的为:(1)调查不同土壤类型下所培养的周丛生物群落特征;(2)明确周丛生物对水稻种子萌发的影响;(3)明确周丛生物对水稻幼苗生长的影响。本研究旨在阐明不同土壤类型下周丛生物的理化性质、群落组成、多样性及碳代谢功能的差异性,明确周丛生物对水稻生长关键期(萌发和幼苗期)的影响,为稻田养分管理和优化水稻生长提供理论依据。
1 材料与方法 1.1 周丛生物的培养和样品收集本研究从延边(YB)、鹰潭(YT)和镇江(ZJ)的稻田中采集了新鲜土壤(0~20 cm)(土壤类型及理化性质见表 1),并以这三种土壤作为周丛生物附着的固体基质。首先,将5 kg土壤放入塑料桶内(直径25 cm)。然后向每个处理加入蒸馏水至水深2 cm;同时,在每个对照组中加入5.0 g叠氮化钠(NaN3)抑制周丛生物生长。培养2周后,周丛生物富集在水土界面间。为了进行下一步研究,本研究利用上述培养获得的周丛生物设置了6组处理,分别为延边土周丛生物(YBP)、鹰潭土周丛生物(YTP)、镇江土周丛生物(ZJP)和三组对照实验(无周丛生物)。所有处理和对照均设置三个重复,并在25~38℃的温室中培养。同时,用消毒的硅胶刮刀剥离一部分周丛生物,用于测定其群落和理化性质。
|
|
表 1 不同采样点(延边、鹰潭和镇江)稻田土壤理化性质 Table 1 The types and chemical properties of paddy soil in different sampling sites |
为了评估周丛生物对水稻种子萌发的影响,首先用5%(V/V)NaClO对水稻种子(徐稻10号)消毒4 h后,用蒸馏水冲洗种子,然后在蒸馏水中浸泡24 h;前处理后,再将100颗水稻种子均匀置于处理和对照组中培养7 d;7 d后所有处理中均有水稻种子发芽。为了评估周丛生物对水稻幼苗生长的影响,在实验进行第8天时,在每个处理中选择20个具有相似高度的水稻种子继续培养30 d。萌发和生长实验在25~38℃的温室中进行。
1.3 样品处理和分析试验过程中每天对种子萌发状况进行测定和记录(种子根的长度等于或大于种子长度视作萌发)。经过7 d的观测后,计算种子的萌发指数[18]。同时使用GB8275-2009法测定了水稻种子α-淀粉酶活性[19]。试验进行30 d后,统计各处理的水稻幼苗存活率。将收集的幼苗用3 L蒸馏水洗净后,测定幼苗高度(地面植物部分)、根长和生物量(茎叶生物量和根生物量)。同时测定所用土壤和周丛生物的理化性质,具体方法如下:土壤pH采用玻璃电极法测定,水土比2.5︰1;总有机碳(TOC)采用重铬酸钾容量法测定;全氮(TN)采用半微量凯氏法测定;全磷(TP)和全铁(TFe)采用碳酸钠熔融法测定;全锰(TMn)采用火焰和电热原子吸收光谱法测定[20]。
本研究采用Biolog微生物鉴定系统(Hayward,CA,美国)研究不同水稻土培养下周丛生物的碳代谢活性。Biolog-ECO微平板通过分布于96孔中的碳源底物来分析评价周丛生物碳代谢特征,Biolog-ECO微平板含有31种不同的碳源(其中氨基酸6种、糖类10种、羧酸7种、聚合物4种、胺类2种和酚类2种)。具体操作步骤为:将2 g周丛生物悬浮于50 mL蒸馏水中,在25℃的恒温培养箱中200 r·min–1摇动30 min。随后,将1 mL周丛生物溶液稀释至20 mL,并将150 μL稀释后的溶液加入各孔中,在25℃下培养,每24小时测定一次数据,共培养168 h。Biolog-Eco微平板中单一碳源的反应程度,即周丛生物对单一碳源的利用能力,采用平均每孔颜色变化率(Average well color development,AWCD)来描述。AWCD值较大表示土壤微生物具有较高的碳源利用能力。AWCD的计算公式如下:
| $ AWCD=Σ[(C_{i}–R)/31] $ | (1) |
式中,Ci为第i孔的吸光值;R为对照孔的吸光值。对于(Ci−R) < 0的孔,将其标记为0,即(Ci−R)≥0。
1.4 周丛生物DNA提取及16S rRNA基因高通量测序本研究通过Illumina测序16S rRNA来确定周丛生物的多样性和组成。首先,用PowerSoil DNA isolation kit(MoBio,Carlsbad,CA,美国)从采集的周丛生物样品中提取DNA。利用1%琼脂糖凝胶电泳检测DNA的完整性和纯度,同时再利用NanoDrop One超微量分光光度计(NanoDrop™ One,赛默飞,美国)检测DNA的浓度和纯度。扩增序列为细菌16S rRNA基因的V4~V5区片段。PCR扩增采用特异性引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)/907R(5′-CCGTCAATTCMTTTRAGTTT-3′)。PCR扩增条件包括94℃ 5 min,94℃ 60 s,55℃ 60 s,72℃ 75 s,30个循环,之后72℃ 10 min。PCR反应产物采用QIA quick PCR Purification kit(Qiagen)进行纯化。将不同样品的PCR扩增产物等摩尔混合后,采用Illumina公司HiSeq2500平台(美国)完成序列分析(委托广东美吉生物有限公司测定)。
高通量测序所得序列按照以下步骤进行分析[21]:(1)双端序列采用FLASH2进行拼接;(2)使用Cutadapt软件切除引物;(3)采用QIIME(1.91)去除质量分数低于20和短于100 bp的低质量序列;(4)采用RDP数据库去除嵌合体;(5)得到的高质量序列采用UPARSE软件在97%的序列相似度下聚类为操作分类单元(Operation taxonomic unit,OTU)。利用RDP Classifier方法将每个OTU的代表序列与Greengenes数据库进行比对,获得物种注释信息(设定置信度阈值默认为0.5以上),从而达到了解所有序列物种来源的目的。香农(Shannon)指数和Chao1指数在QIIME中计算。
1.5 数据统计与分析所有处理均设置三组重复,其结果以平均值±标准差展示(n=3)。采用单因素方差分析(one-way ANOVA)和皮尔森(Pearson)相关性分析对不同数据进行差异显著性和相关性分析。数据处理和作图使用SPSS 22.0和Excel 2019软件进行。
2 结果 2.1 不同土壤理化性质差异如表 1所示,用于培养周丛生物的土壤理化性质存在差异。鹰潭稻田土壤的pH(5.00)显著低于镇江(6.97)和延边(7.31)(P < 0.05)。鹰潭稻田土壤的全氮、全磷和总有机碳含量均显著低于其他两组处理(P < 0.05)。此外,鹰潭稻田土壤的全铁含量显著高于其他两组处理(P < 0.05),而全锰含量显著低于其他两组处理(P < 0.05)。以上结果表明本研究中所用三种稻田土壤的理化性质存在显著差异。
2.2 不同土壤培养的周丛生物特征差异如表 2所示,不同土壤培养的周丛生物的理化性质存在差异。延边周丛生物的全氮(3.75 g·kg–1)、全磷(1.16 g·kg–1)和总有机碳(34.14 g·kg–1)含量均显著高于其他两组处理(P < 0.05),而全锰含量无显著差异(P > 0.05);镇江周丛生物的全铁含量(32.48 g·kg–1)显著高于延边(28.83 g·kg–1)和鹰潭周丛生物(21.91 g·kg–1)。
|
|
表 2 不同稻田周丛生物的理化性质 Table 2 The physicochemical properties of periphytons in different paddy fields(n=3) |
本研究通过对不同土壤培养的周丛生物进行高通量测序,研究周丛生物的群落组成和多样性差异。如图 1所示,延边、鹰潭和镇江周丛生物的主要细菌群落有:变形菌门(Proteobacteria)(相对丰度分别为39.7%、29.3%和68.9%)、蓝细菌门(Cyanobacteria)(相对丰度分别为20.8%、9.8%和8.4%)和拟杆菌门(Bacteroidetes)(相对丰度分别为17.08%、3.7%和3.3%);但是鹰潭周丛生物厚壁菌门(Firmicutes)的相对丰度(35.6%)显著高于延边(0.4%)和镇江(2.2%)(P < 0.05)。如表 3所示,进一步分析了周丛生物的群落特征(物种数、Chao1和香农多样性指数),发现延边周丛生物(YBP)的物种数和Chao1指数显著高于其他两组处理(P < 0.05);而镇江周丛生物(ZJP)的香农指数(3.42)显著高于鹰潭(3.00)和延边(3.11)(P < 0.05)。
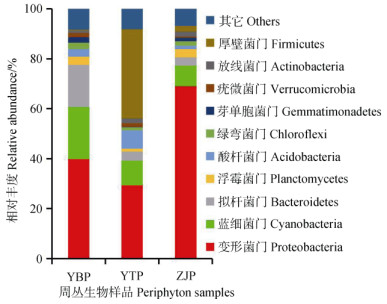
|
图 1 周丛生物的群落组成(门水平) Fig. 1 Microbial community composition of periphyton at phylum level |
|
|
表 3 微生物多样性分析 Table 3 Diversity analysis of microbial community(n=3) |
土壤类型通过影响周丛生物的群落组成和多样性,从而决定其生态功能。如表 4所示,本研究分析了土壤理化性质与周丛生物群落多样性间的相关关系,结果表明周丛生物的群落多样性与土壤pH、全磷、总有机碳和全锰含量呈显著正相关(P < 0.01),表明不同土壤类型可能对稻田周丛生物的群落组成和多样性具有潜在的影响,从而改变其生态功能。
|
|
表 4 土壤理化性质与周丛生物群落多样性的皮尔森相关性 Table 4 Pearson's correlation coefficients for soil chemical properties and periphyton microbial diversity |
如图 2a)所示,三种周丛生物的碳代谢活性存在显著差异(P < 0.05)。其中,延边周丛生物(YBP)在整个培养期内的碳代谢活性最高,在144 h时达到峰值(AWCD为1.49),鹰潭周丛生物(YTP)的碳代谢活性最低,AWCD为0.53,而镇江周丛生物的最大AWCD为1.24。
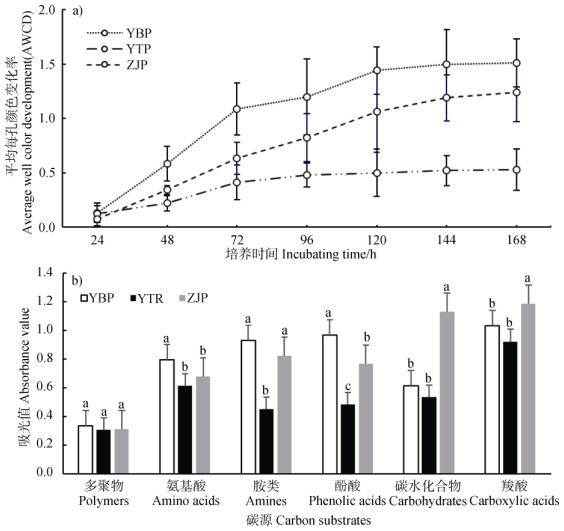
|
图 2 周丛生物AWCD随时间变化(a))及其对六种主要类型碳底物的利用情况(b)) Fig. 2 Temporal variation of AWCD of periphyton(a)) and the metabolic utilization of the six main types of carbon substrates by periphyton(b)) |
进一步分析了周丛生物对Biolog-ECO板提供的6大类碳源(多聚物polymer、氨基酸amino acid、胺类amine、酚酸phenolic acid、碳水化合物carbohydrate和羧酸carboxylic acid)的利用情况。如图 2b)所示,在六种碳底物中,三种周丛生物对羧酸的利用最高,分别为1.0(YBP)、0.9(YTP)和1.2(ZJP),而对多聚物的利用最低。此外,三种周丛生物对不同碳底物的利用存在显著差异。例如,延边周丛生物对氨基酸(0.8)的利用显著高于其他两组处理(P < 0.05),而镇江周丛生物对碳水化合物(1.1)和羧酸(1.2)的利用显著高于其他两组处理(P < 0.05)。
2.3 周丛生物对水稻种子萌发的影响如图 3所示,周丛生物的存在影响了水稻种子萌发率和α-淀粉酶活性。周丛生物存在情况下,延边、鹰潭和镇江处理中水稻种子平均萌发率分别为87%、63%和63%,相比各自对照组分别增加了18%、9%和3%(图 3a))。进一步测定了培养7 d后水稻种子中α-淀粉酶的活性,结果表明:延边、鹰潭和镇江处理中水稻种子的α-淀粉酶活性分别为1.6、1.1和1.6U·g–1,而对照组分别为1.3、1.0和1.2 U·g–1(图 3b))。表明三种周丛生物促进了水稻种子萌发率和α-淀粉酶活性(P < 0.05)。
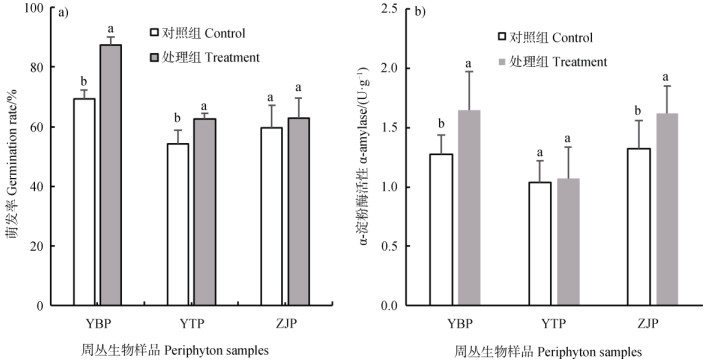
|
图 3 周丛生物对水稻种子萌发率(a))和α-淀粉酶活性(b))的影响 Fig. 3 Effects of periphyton on the germination index(a)) and α-amylase activity(b)) of rice seed |
不同周丛生物物种组成、多样性和理化特性可能对水稻种子萌发产生影响。如表 5所示,本研究分析了周丛生物群落特征与水稻种子萌发的相关关系,结果表明水稻种子萌发率与周丛生物理化性质(全氮、全磷和总有机碳含量)、物种和群落多样性呈显著正相关(P < 0.01),表明周丛生物的群落特征与水稻种子萌发存在潜在的相关关系。
|
|
表 5 周丛生物群落特征与水稻种子萌发率和幼苗存活率的皮尔森相关性 Table 5 Pearson's correlation coefficients (r) of chemical composition and community characteristics of the periphyton with germination rate and survival rate of rice seedlings |
周丛生物的存在除了影响水稻种子的萌发和α-淀粉酶酶活性外,还对幼苗的存活率产生影响。如图 4所示,周丛生物对水稻幼苗存活率有不同的影响。周丛生物存在情况下,鹰潭和镇江的水稻平均幼苗成活率分别为67%和78%,分别较对照高19%和5%;而延边水稻平均幼苗成活率为67%,较对照组降低了1%。统计分析表明:鹰潭周丛生物处理显著增加了水稻幼苗的存活率(P < 0.05),而延边和镇江周丛生物对幼苗存活率无显著影响(P > 0.05)。本研究进一步分析了周丛生物的存在与水稻幼苗存活率之间的关系(表 5),皮尔森相关性分析结果表明,周丛生物的理化性质、物种组成和多样性与水稻幼苗存活率呈显著正相关(P < 0.01),表明周丛生物理化性质、物种组成和多样性的差异可能是导致不同周丛生物对水稻幼苗生长产生不同影响的潜在因素。
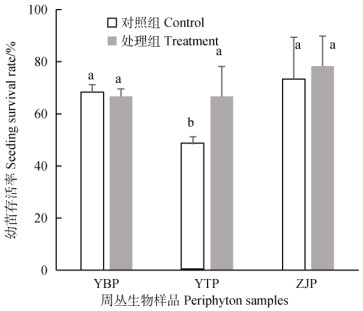
|
图 4 周丛生物对水稻幼苗存活率的影响 Fig. 4 Rice seedling survival rate in the presence of periphytonVs control(The control represents no periphyton |
此外,通过测定水稻幼苗的根生物量、茎生物量、根长和高度,进一步研究了周丛生物对幼苗生长状况的影响。如图 5所示,延边周丛生物的存在显著提高了水稻幼苗的根生物量和根长。延边的平均根生物量为1.7 g,比对照组提高了0.2 g(P < 0.05)。此外,延边周丛生物处理中幼苗根长为14.75 cm,较对照组提高了4.92 cm(P < 0.05)。以上结果表明周丛生物的存在有助于水稻幼苗的生长发育。
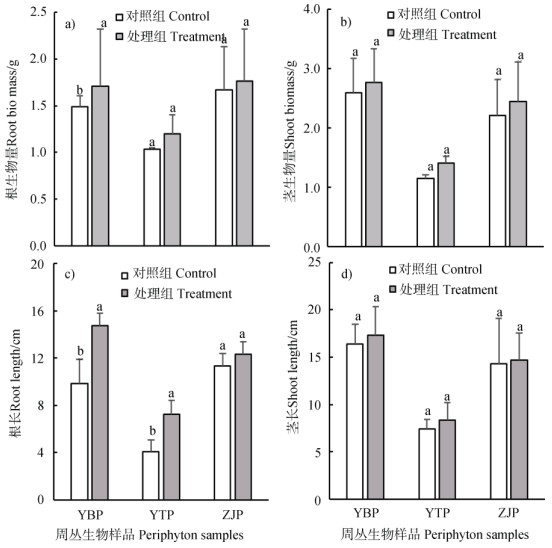
|
图 5 周丛生物对水稻幼苗生长指标的影响 Fig. 5 Rice root length, root biomass, shoot biomass and shoot length in the presence of periphyton vs control |
底物被认为是决定周丛生物群落组成、多样性和功能的关键因素[22]。本研究选取了三种具有代表性的稻田土壤(延边、鹰潭和镇江)作为周丛生物培养的底物。其中,延边黑土是中国东北主要的土壤类型[23];鹰潭红壤稻田土是中国南方最重要的耕作土地类型[24];镇江稻田土代表中国水稻主要产区的太湖流域[25]。三种水稻土的pH存在显著差异(表 1),而pH被认为是决定土壤微生物群落组成和多样性的关键因素[26-27]。以往的研究也证实并解释了土壤pH在微生物群落形成中的主导作用[26]。一种解释是,土壤pH可直接选择具有适应性策略的物种,换言之,那些适应能力不太好的物种可能在竞争中被淘汰[28-29]。第二种可能的解释是,土壤pH与土壤养分的有效性和重金属元素的生物有效性高度相关,这反过来又可能影响周丛生物群落的组成[30-31]。因此,稻田土壤的理化性质可能对周丛生物群落组成和功能产生重要影响。本研究中不同土壤类型培养的周丛生物群落的组成和多样性存在差异(图 1和表 3),这可能是周丛生物群落的适应性过程。在这个过程中周丛生物逐渐形成了新的和稳定的微生态系统[32-33]。本研究中三种周丛生物的碳代谢活性存在显著差异。延边和镇江周丛生物的碳代谢活性显著高于鹰潭。造成这种差异的原因可能是鹰潭土壤有机质含量显著低于其他两组处理(图 2和表 1),而土壤是周丛生物重要的碳源,这可能导致与碳源代谢相关的微生物丰度发生改变,进而影响了周丛生物的碳代谢活性。此外,不同的微生物群落由于其具有竞争机制,或者对底物的适应性不同,表现出对不同碳源的利用强度存在一定的差异[34]。
3.2 周丛生物促进水稻种子萌发水稻种子萌发受到多种因素的影响,如pH、温度和水分等[34-36],而本研究表明周丛生物的存在也影响了水稻种子萌发(图 3)。众所周知,周丛生物普遍存在于稻田“土-水”界面,其广泛参与各种生物过程,从而影响了周围环境的理化性质,特别是pH[37]。此外,周丛生物的存在改变了表土微环境的水热状态。Belnap等[38]研究发现沙漠生态系统中生物结皮使土壤表面温度最高增加14℃,而稻田土壤表面附着的周丛生物可看作是一种土壤生物结皮。相关研究还发现蓝藻可吸收超过自身体积10倍或更多的水分,而蓝藻是周丛生物的主要组成物种[39]。因此,周丛生物可能是通过改变表土和种子周围的微环境(如水热条件和pH等),最终促进了水稻种子的萌发。除上述因素外,周丛生物也可能通过释放化感物质(如吲哚乙酸IAA等)改变种子萌发率[39]。诸多研究表明种子萌发具有化感物浓度依赖性,即低浓度的相关化感物可促进种子萌发,而高浓度则抑制种子萌发[40-41]。但是关于周丛生物如何通过化感作用影响水稻种子萌发尚需进一步的研究。在本研究中周丛生物的存在促进了水稻种子的萌发,这与Lu等[18]的结果一致。
3.3 周丛生物促进水稻幼苗生长以往的研究表明周丛生物的存在极大地促进了水稻的生长和产量提高[15]。本研究得出了类似的结果,周丛生物的存在促进了水稻幼苗的生长,包括幼苗根系长度和生物量(图 5)。这可能是因为周丛生物具有多种特殊的“集体功能”,例如,多种酶促协同作用,活化和转化闭蓄态磷(Fe、Al、Ca结合态磷)和有机态氮磷。通过这些“集体功能”的协同作用,提高了表土养分的有效性和幼苗对养分的利用,进而促进了水稻幼苗的生长。此外,周丛生物所致的水稻种子α-淀粉酶活性提高(图 3b))可能是其促进水稻幼苗生长的另一个原因。
一些研究表明,周丛生物对植物生长有不利的影响[18],这与本研究的结果不同。最可能的原因是,培养周丛生物所使用的载体不同。Lu等[18]以生物秸秆和生物炭材料为载体富集周丛生物,其培养的周丛生物的群落组成、功能多样性和理化特征等与本研究显著不同。而这些因素可能会直接影响水稻种子萌发和生长的微环境,进而影响水稻的生长过程。因此,载体的差异可能是其与本研究结果相反的原因。不同载体培养的周丛生物对水稻生长的影响有待进一步研究。
4 结论土壤类型显著影响了稻田周丛生物的群落组成和生理生化特征,主要表现在:不同类型土壤培养的周丛生物的理化特征、物种组成和多样性存在显著差异,碳代谢活性显著不同。同时,周丛生物间存在的特征差异可能在水稻种子萌发和幼苗生长过程中产生不同影响。总体而言,周丛生物的存在促进了水稻种子萌发,提高了种子内α-淀粉酶的活性。同时,周丛生物还能够促进水稻幼苗的生长,增加幼苗生物量。因此,有效管理田间广泛存在的周丛生物可能是调控作物生长发育的可行途径。
| [1] |
Dickman M. Some effects of lake renewal on phytoplankton productivity and species composition[J]. Limnology and Oceanography, 1969, 14(5): 660-666. DOI:10.4319/lo.1969.14.5.0660
(  0) 0) |
| [2] |
Lamberti G A. The role of periphyton in benthic food webs[M]//Algal Ecology. Amsterdam: Elsevier, 1996: 533-572.
(  0) 0) |
| [3] |
Zang X M, Zhang Y, Lin J N, et al. Variation of periphyton community structure in 2009, 2014 and their relationship with environmental factors in taizi river basin (In Chinese)[J]. Research of Environmental Sciences, 2018, 31(6): 1057-1067. [臧小苗, 张远, 林佳宁, 等. 2009年与2014年太子河流域附石藻群落结构变化及其与水环境的关系[J]. 环境科学研究, 2018, 31(6): 1057-1067.]
(  0) 0) |
| [4] |
Sun R, Xu Y, Wu Y H, et al. Functional sustainability of nutrient accumulation by periphytic biofilm under temperature fluctuations[J]. Environmental Technology, 2019, 1-10.
(  0) 0) |
| [5] |
Wu Y H, Liu J Z, Rene E R. Periphytic biofilms: A promising nutrient utilization regulator in wetlands[J]. Bioresource Technology, 2018, 248: 44-48. DOI:10.1016/j.biortech.2017.07.081
(  0) 0) |
| [6] |
Kasai F. Shifts in herbicide tolerance in paddy field periphyton following herbicide application[J]. Chemosphere, 1999, 38(4): 919-931. DOI:10.1016/S0045-6535(98)00221-5
(  0) 0) |
| [7] |
Cui Z L, Zhang H Y, Chen X P, et al. Pursuing sustainable productivity with millions of smallholder farmers[J]. Nature, 2018, 555(7696): 363-366. DOI:10.1038/nature25785
(  0) 0) |
| [8] |
Yagi K, Tsuruta H, Kanda K, et al. Effect of water management on methane emission from a Japanese rice paddy field: Automated methane monitoring[J]. Global Biogeochemical Cycles, 1996, 10(2): 255-267. DOI:10.1029/96GB00517
(  0) 0) |
| [9] |
Battin T J, Kaplan L A, Denis Newbold J, et al. Contributions of microbial biofilms to ecosystem processes in stream mesocosms[J]. Nature, 2003, 426(6965): 439-442. DOI:10.1038/nature02152
(  0) 0) |
| [10] |
Guzzon A, Bohn A, Diociaiuti M, et al. Cultured phototrophic biofilms for phosphorus removal in wastewater treatment[J]. Water Research, 2008, 42(16): 4357-4367. DOI:10.1016/j.watres.2008.07.029
(  0) 0) |
| [11] |
Sun R, Sun P F, Zhang J H, et al. Microorganisms-based methods for harmful algal blooms control: A review[J]. Bioresource Technology, 2018, 248: 12-20. DOI:10.1016/j.biortech.2017.07.175
(  0) 0) |
| [12] |
Ellwood N T W, Di Pippo F, Albertano P. Phosphatase activities of cultured phototrophic biofilms[J]. Water Research, 2012, 46(2): 378-386. DOI:10.1016/j.watres.2011.10.057
(  0) 0) |
| [13] |
Inglett P W, Reddy K R, McCormick P V. Periphyton chemistry and nitrogenase activity in a northern everglades ecosystem[J]. Biogeochemistry, 2004, 67(2): 213-233. DOI:10.1023/B:BIOG.0000015280.44760.9a
(  0) 0) |
| [14] |
Lu H Y, Wan J J, Li J Y, et al. Periphytic biofilm: A buffer for phosphorus precipitation and release between sediments and water[J]. Chemosphere, 2016, 144: 2058-2064. DOI:10.1016/j.chemosphere.2015.10.129
(  0) 0) |
| [15] |
Whitton B A, Roger P A. Use of blue-green algae and azolla in rice culture[J]. 1989, 25: 89-100
(  0) 0) |
| [16] |
Diazolarte J, Valoyes-Valois V, Guisande C, et al. Periphyton and phytoplankton associated with the tropical carnivorous plant Utricularia foliosa[J]. Aquatic Botany, 2007, 87(4): 285-291. DOI:10.1016/j.aquabot.2007.06.010
(  0) 0) |
| [17] |
Larned S T. A prospectus for periphyton: Recent and future ecological research[J]. Journal of The North American Benthological Society, 2010, 29(1): 182-206. DOI:10.1899/08-063.1
(  0) 0) |
| [18] |
Lu H Y, Liu J Z, Kerr P G, et al. The effect of periphyton on seed germination and seedling growth of rice(Oryza sativa) in paddy area[J]. The Science of the Total Environment, 2017, 578: 74-80. DOI:10.1016/j.scitotenv.2016.07.191
(  0) 0) |
| [19] |
中华人民共和国卫生部. 食品添加剂α-淀粉酶制剂: GB8275-2009[S]. 北京: 中国标准出版社, 2009. Ministry of Health of the People's Republic of China. Food additive-Alpha-amylase preparation: GB8275-2009[S]. Beijing: China Standard Press, 2009. (  0) 0) |
| [20] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.]
(  0) 0) |
| [21] |
Ma L, Guo Z B, Wang D Z, et al. Effect of long-term application of phosphorus fertilizer on soil bacterial community structure and enzymatic activity in lime concretion black soil relative to P application rate (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(6): 1459-1470. [马垒, 郭志彬, 王道中, 等. 长期三水平磷肥施用梯度对砂姜黑土细菌群落结构和酶活性的影响[J]. 土壤学报, 2019, 56(6): 1459-1470.]
(  0) 0) |
| [22] |
Ren C J, Zhang W, Zhong Z K, et al. Differential responses of soil microbial biomass, diversity, and compositions to altitudinal gradients depend on plant and soil characteristics[J]. Science of the Total Environment, 2018, 610/611: 750-758. DOI:10.1016/j.scitotenv.2017.08.110
(  0) 0) |
| [23] |
Zhang X Y, Sui Y Y, Zhang X D, et al. Spatial variability of nutrient properties in black soil of Northeast China[J]. Pedosphere, 2007, 17(1): 19-29. DOI:10.1016/S1002-0160(07)60003-4
(  0) 0) |
| [24] |
Zhong W H, Cai Z. Long-term effects of inorganic fertilizers on microbial biomass and community functional diversity in a paddy soil derived from quaternary red clay[J]. Applied Soil Ecology, 2007, 36(2): 84-91.
(  0) 0) |
| [25] |
Zhang Z J, Zhang J Y, He R, et al. Phosphorus interception in floodwater of paddy field during the rice-growing season in TaiHu Lake Basin[J]. Environmental Pollution, 2007, 145(2): 425-433. DOI:10.1016/j.envpol.2006.05.031
(  0) 0) |
| [26] |
Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. PNAS, 2006, 103(3): 626-631. DOI:10.1073/pnas.0507535103
(  0) 0) |
| [27] |
Griffiths R I, Thomson B C, James P, et al. The bacterial biogeography of British soils[J]. Environmental Microbiology, 2011, 13(6): 1642-1654. DOI:10.1111/j.1462-2920.2011.02480.x
(  0) 0) |
| [28] |
Lauber C L, Hamady M, Knight R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology, 2009, 75(15): 5111-5120. DOI:10.1128/AEM.00335-09
(  0) 0) |
| [29] |
Ramirez K S, Craine J M, Fierer N. Nitrogen fertilization inhibits soil microbial respiration regardless of the form of nitrogen applied[J]. Soil Biology & Biochemistry, 2010, 42(12): 2336-2338.
(  0) 0) |
| [30] |
Wang C, Zheng M M, Song W F, et al. Impact of 25 years of inorganic fertilization on diazotrophic abundance and community structure in an acidic soil in Southern China[J]. Soil Biology and Biochemistry, 2017, 113: 240-249. DOI:10.1016/j.soilbio.2017.06.019
(  0) 0) |
| [31] |
van Nostrand J D, Sowder A G, Bertsch P M, et al. Effect of pH on the toxicity of nickel and other divalent metals to Burkholderia cepacia PR1(301)[J]. Environmental Toxicology and Chemistry, 2005, 24(11): 2742-2750. DOI:10.1897/04-335R.1
(  0) 0) |
| [32] |
Tang J, Zhu N, Zhu Y, et al. Responses of periphyton to Fe2O3 nanoparticles: A physiological and ecological basis for defending nanotoxicity[J]. Environmental Science & Technology, 2017, 51(18): 10797-10805.
(  0) 0) |
| [33] |
Grayston S J, Wang S, Campbell C D, et al. Selective influence of plant species on microbial diversity in the rhizosphere[J]. Soil Biology & Biochemistry, 1998, 30(3): 369-378.
(  0) 0) |
| [34] |
Bradford K J. A water relations analysis of seed germination rates[J]. Plant Physiology, 1990, 94(2): 840-849. DOI:10.1104/pp.94.2.840
(  0) 0) |
| [35] |
Laghmouchi Y, Belmehdi O, Bouyahya A, et al. Effect of temperature, salt stress and pH on seed germination of medicinal plant Origanum compactum[J]. Biocatalysis and Agricultural Biotechnology, 2017, 10: 156-160. DOI:10.1016/j.bcab.2017.03.002
(  0) 0) |
| [36] |
Vieira B, Bicalho E M, Munnebosch S, et al. Abscisic acid regulates seed germination of Vellozia species in response to temperature[J]. Plant Biology, 2017, 19(2): 211-216. DOI:10.1111/plb.12515
(  0) 0) |
| [37] |
MacLeod N A, Barton D R. Effects of light intensity, water velocity, and species composition on carbon and nitrogen stable isotope ratios in periphyton[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1998, 55(8): 1919-1925. DOI:10.1139/f98-075
(  0) 0) |
| [38] |
Belnap J, Prasse R, Harper K T. Influence of biological soil crusts on soil environments and vascular plants[J]. Biological Soil Crusts: Structure, Function, and Management, 2003, 281-300.
(  0) 0) |
| [39] |
Tabatabaei S, Ehsanzadeh P, Etesami H, et al. Indole-3-acetic acid(IAA) producing Pseudomonas isolates inhibit seed germination and α-amylase activity in durum wheat(Triticum turgidum L.)[J]. Spanish Journal of Agricultural Research, 2016, 14(1): 0802.
(  0) 0) |
| [40] |
Fatima Z, Saleemi M K, Zia M, et al. Antifungal activity of plant growth-promoting rhizobacteria isolates against Rhizoctonia solani in wheat[J]. African Journal of Biotechnology, 2009, 8(2): 219-225.
(  0) 0) |
| [41] |
McPhail K L, Armstrong D J, Azevedo M D, et al. 4-Formylaminooxyvinylglycine, an herbicidal germination-arrest factor from Pseudomonas rhizosphere bacteria[J]. Journal of Natural Products, 2010, 73(11): 1853-1857. DOI:10.1021/np1004856
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


