2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
小麦是我国重要的粮食作物,其高产依赖于充足的氮素供应,因此在小麦的生产过程中通常需要投入大量的氮肥。然而,在实际生产中以尿素为代表的速效氮肥的利用效率非常低[1-2]。氮肥在施入土壤后,会经历淋溶、挥发、硝化和反硝化等过程,氮素的损失率高达14%~45%[2]。此外,过量的氮肥施用不仅造成了资源浪费,还导致了水体的富营养化等严重的环境问题[3]。
土壤中的氮水平是土壤微生物多样性和群落结构及其功能变化的主要驱动力之一[4-6]。根际是植物、土壤和微生物连接最为紧密的复杂微环境[7-8]。植物根系从该区域直接获取氮素以维持生长和发育,缺氮将直接影响作物生长、产量和品质。植物在长期进化过程中形成了一系列的氮胁迫适应机制[9]。例如,根系释放酶和有机酸等分泌物影响根际环境中的微生物群落,根系及其周围的根际微生物协同响应来适应缺氮环境,提高植物氮效率[10]。研究发现,随着尿素施用量的增加,小麦根际微生物总量、细菌、放线菌和真菌数量呈先上升后下降的趋势,土壤蛋白酶、脲酶和过氧化氢酶等酶活力也随之变化[11]。然而,长期的氮肥施用则会降低土壤微生物数量以及细菌群落的α多样性[4]。Chen等[10]的研究表明,小麦的生育期和供氮水平均驱动着小麦根区微生物群落结构的变化。Pagé等[12]的研究表明,缺氮条件下,肠杆菌科(Enterobacteriaceae)、噬几丁质杆菌科(Chitinophagaceae)、丛毛单胞菌科(Comamonadaceae)和柄杆菌科(Caulobacteraceae)等细菌在小麦根际富集。上述微生物丰度的增加可能提高作物氮肥吸收和利用效率。研究表明,接种枯草芽孢杆菌(Bacillus subtilis)、荧光假单胞菌(Pseudomonas fluorescens)、巨大芽孢杆菌(Bacillus megaterium)和固氮螺菌(Azospirillum)等植物根际促生菌可提高小麦株高和籽粒产量,保证小麦产量的同时减少氮肥的用量[13-14]。
土壤微生物在土壤氮素循环中发挥着不可替代的作用,广泛参与氮的同化作用、氨化作用、硝化作用、反硝化作用、厌氧氨氧化作用和固氮作用等过程[15-16]。与古菌和真菌相比,土壤中细菌具有数量更多,种类更为丰富的氮代谢基因,具有氮代谢多功能性,广泛参与氮循环的各个步骤[4,17]。对微生物而言,土壤中环境条件变化很大,且极少情况是适合生长的最佳条件,因此,单个微生物的氮循环效率必然很低,而土壤中的微生物群落协同作用可有效提高氮素循环效率[16]。研究发现,长期的氮肥施用会显著增强细菌的反硝化作用、硝酸盐同化作用和有机氮代谢,而古菌的氮代谢过程则会受到抑制[4]。接种固氮微生物等菌剂则是提高氮肥利用率和氮肥减施的有效途径。研究表明,通过种子包衣接种和向叶面或土壤撒施含有固氮螺菌(Azospirillum)等固氮菌剂,可促进小麦根系的生长,提高其抗逆性并减少农田生态系统中氮素的流失[18]。然而,供氮水平对小麦根际(根室)、近根际(距离根室0~30 mm)以及非根际(距离根室30~80 mm)微生物群落的多样性和群落结构的影响尚不明确。因此,本研究以氮素耗竭的陕西关中塿土为材料,通过根箱实验实现根际、近根际和非根际土壤的分离,在两侧正常供氮、一侧正常供氮一侧缺氮和两侧均缺氮的实验设计基础上,采用16S rRNA基因扩增子高通量测序技术,解析缺氮胁迫下小麦根际微生物多样性和群落结构的变化及其与非根际土壤微生物的差异,挖掘其中可能存在的关键氮代谢功能微生物,从而为小麦生产中氮肥的减施增效提供理论依据。
1 材料与方法 1.1 供试材料供试土壤采自陕西省咸阳市长武县王东村(35°14'21.85"N,107°41'24.8"E)的耕作层土壤(0~15 cm),该区域为内陆干旱气候,年平均气温9.1℃,年均降水量584 mm,土壤类型为塿土(土垫旱耕人为土),多年种植小麦,氮素耗竭。供试土壤理化性质:pH7.06,电导率(Electrical conductivity,EC)0.29 dS·m–1,有机质(Organic matter,OM)9.10 g·kg–1,全氮(Total nitrogen,TN)0.67 g·kg–1,全磷(Total phosphorus,TP)9.46 g·kg–1,有效磷(Available phosphorus,AP)19.57 mg·kg–1,硝态氮(NO3–)6.28 mg·kg–1,铵态氮(NH4+)4.59 mg·kg–1,速效钾(Available potassium,AK)261 mg·kg–1。土壤去除石块、植物残体等异物后,风干,过10目筛,搅拌均匀后用于根箱试验。供试小麦(Triticum aestivum)品种为中国春。
1.2 根箱试验设计多区室的根箱设计参考李晓亮等[19]的方法,并做了一些改良(图 1)。该装置由聚氯乙烯(PVC)灰色塑料板制成,大小为220 mm×140 mm×180 mm。根箱正中间的塑料挡板有6个植物种植孔,根系被限制在左右两侧宽20 mm的根系生长室中。根系生长室和距离根室0~30 mm、30~80 mm的区域分别为根际(Rhizosphere,R)、近根际(Near-rhizosphere,N)和非根际(Non-rhizosphere,Non)的土壤取样区域,每一侧不同区室之间用500目的尼龙网隔开,允许土壤养分和微生物自由迁移。每个根箱用4 kg风干土填充。
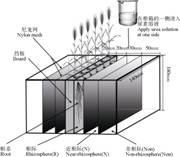
|
图 1 根箱结构示意图 Fig. 1 Schematic diagram of the rhizobox |
2018年11月19日,选择饱满且大小一致的小麦种子在浸湿的滤纸上于室内避光过夜催芽,将露白的种子种植于根箱的种植孔中(每个孔一株小麦)。正中间的挡板将根箱隔成左右两侧,同一株小麦的根系可同时进入左右两侧的根系生长室,但无法进入近根际区和非根际区。根箱两侧设置正常供氮(N150)和缺氮(N0)两种供氮水平。由于左右两侧进行了物理分割,因此根箱设置三种供氮方式:两侧均正常供氮、一侧正常供氮一侧缺氮、两侧均缺氮,每种供氮方法有3个重复,共9个根箱。所有处理两侧均施磷酸二氢钙作为磷肥。根箱每一侧不同区室之间土壤养分和微生物可自由迁移,尽量将尿素溶液均匀地浇至供氮一侧的三个区室中。在小麦二叶期时第一次施肥,氮和磷的施用量均为100 mg·kg–1(以纯氮或纯磷计),孕穗期追肥一次,施氮量为50 mg·kg–1(以纯氮计)。根箱放置于日光温室中,每周随机交换根箱的位置。至小麦灌浆期结束盆栽实验,对三种根箱供氮方式(3个重复)的左右两侧的根际、近根际和非根际土壤分别进行取样,共计54个样品,取样日期为2019年3月13日。土壤样品采集时,小心拆除根箱周围的塑料板,逐层剥离中间的尼龙网。小麦根系遍布整个生长室,因此,将去除小麦根系并充分混匀后的根系生长室中的土壤作为根际土。根箱的近根际和非根际区域的土壤充分混匀后作为近根际土和非根际土。样品一部分用于土壤微生物DNA的提取及土壤硝态氮和铵态氮的测定,–80℃储存,一部分风干后过10目筛用于测定土壤基本理化性质。
1.4 植株和土壤基本性质测定植株和土壤基本理化性质的测定均参考鲁如坤[20]的方法。在小麦灌浆期采用叶绿素仪(SPAD- 502Plus,Konica Minolta,日本)测定叶绿素相对含量(SPAD值),并测量穗长(Spike length,SL)。植株烘干后测定小麦地上部生物量(Biomass),植株样品经研磨仪粉碎混匀后用于营养元素含量的测定。经过H2SO4-H2O2消煮后,植物全氮含量采用靛酚蓝比色法测定;全磷含量采用钼锑抗比色法测定;全钾含量采用火焰光度计(M410 Sherwood,英国)测定。使用pH计(SevenMulti Mettler Toledo,瑞士)测定土壤pH,使用电导仪(SevenMulti Mettler Toledo,瑞士)测定电导率。土壤样品的硝态氮和铵态氮含量采用连续流动分析仪(San++System,SAKLAR,荷兰)测定。土壤有机质含量采用水合热重铬酸钾氧化—比色法测定;全氮含量使用酸溶—靛酚蓝比色法测定;全磷含量采用酸溶—钼锑抗比色法测定;有效磷含量采用碳酸氢钠溶液浸提—钼锑抗比色法测定;速效钾含量采用乙酸铵溶液浸提—火焰光度计法测定。
1.5 16S rRNA基因扩增子高通量测序 1.5.1 土壤微生物DNA的提取准确称取0.5 g鲜土,采用土壤DNA提取试剂盒(FastDNA SPIN Kit for Soil,MP Biomedicals)进行土壤DNA的提取。使用NanoDrop 2000(Thermo Scientific,美国)测定DNA的浓度和纯度,–20℃保存。
1.5.2 高通量测序方法利用通用引物(341F:CCTACGGGRBGCASCAG和806R:GGACTACNN GGGTATCTAAT)对DNA中的细菌基因组16S rRNA基因的Ⅴ3~Ⅴ4区域进行扩增。细菌和古菌的16S rRNA基因同源性很高,因此部分古菌的序列也会被扩增。PCR反应体系为30 μL,包含Phusion Master Mix(2×)15 μL,引物(2 μmol·L–1,3 μL),模板DNA(1 ng·μL–1,10 μL,共10 ng)和超纯水(2 μL)。PCR反应程序为:预变性98℃,1 min;(98℃,10 s;50℃,30 s;72℃,30 s)× 30个循环;72℃,5 min。每一个样本的引物中有对应的Barcode用于数据拆分。为保证样本数据量产出均匀,PCR产物经Qubit仪(Qubit2.0,Thermo Scientific,美国)测定浓度后等质量混样并纯化。最后使用建库试剂盒(TruSeq® DNA PCR-Free Sample Preparation Kit)进行文库构建,构建好的文库经过Qubit和荧光定量PCR定量,文库合格后,使用IonS5TM XL(Thermo Scientific,美国)进行测序,测序服务委托北京诺禾致源科技股份有限公司完成。
1.5.3 高通量测序数据处理首先使用QIIME软件对拼接数据进行过滤,过滤掉低质量碱基较多的序列。具体步骤为:将原始序列从连续低质量值(≤19)碱基数达到设定长度(3)的第一个低质量碱基位点截断,经过截取后,进一步过滤掉其中连续高质量碱基长度小于序列长度75%的序列。使用vsearch(Version 2.13.2)软件将序列文件和物种注释数据库、嵌合体序列数据库进行比对,从而去除嵌合体序列,一共得到3 328 189条有效的DNA序列。根据Barcode拆分不同样品,每个样本序列数在40 491~85 747之间,平均61 633条序列。使用Uparse(Version 7.0.1001)软件按照97 %的序列相似度对序列进行聚类,一共获得5 028个可操作分类单元(Operational taxonomic unit,OTU),选择每个OTU中频数最高的序列作为每个OTU的代表序列。使用Mothur(Version 1.44.1)软件将代表序列和SSUrRNA数据库中的序列以阈值0.8~1为标准进行比对,从而获得每个代表序列在各个分类层级的菌种注释信息。代表序列通过MUSCLE(Version 3.8.31)软件进行序列比对,进而构建所有OTU的系统进化树。最后以测序数据量最小的样本为标准对所有样本的OTU丰度数据进行均一化处理。
1.6 数据处理和统计分析数据分析和可视化在R语言(Version 3.6.0)环境下完成。通过QIIME软件(Version 1.9.1)计算样本的多样性指数。使用psych包(Version 1.8.12)分析多样性指数与土壤理化因子之间的相关性;使用vegan包(Version 2.2.5)进行不同样本物种OTU和环境因子之间基于欧几里德距离的冗余分析(Distance-based redundancy analysis,dbRDA)。使用vegan包进行不同样本OTU丰度数据的主成分分析(Principal component analysis,PCA)和多响应置换过程(Multi response permutation procedure,MRPP)分析。使用lavaan包(Version 0.6.5)整合土壤、植株的理化指标和微生物群落多样性数据建立结构方程模型,并利用visio 2016可视化分析结果。共存网络图中OTU之间的相关性筛选标准为相关系数的绝对值大于0.9且校正后P值小于0.01,使用igraph包(Version 1.2.5)绘制共存网络图,并统计共存网络的相关属性。根据OTU丰度及KEGG数据库,使用Tax4Fun2包(Version 1.1.5)预测不同样本的微生物群落的功能潜力。使用randomForest包(Version 4.6.14)对不同处理下的OTU丰度进行随机森林分析并绘制受试者工作特征曲线(Receiver operating characteristic curve,ROC)。使用ggplot2包(Version 3.3.0)绘制不同微生物种类对随机森林分类结果准确性的影响。
2 结论 2.1 缺氮胁迫对小麦生长和土壤理化性质的影响与正常供氮相比,两侧缺氮的小麦地上部生物量、SPAD、全氮含量以及穗长显著降低(表 1)。但是,除了穗长,其他指标在一侧正常供氮一侧缺氮和两侧正常供氮的处理之间无显著差异。正常供氮条件下,土壤硝态氮含量大大提高,在根际土壤中尤为显著(表 2)。速效钾在不同的根箱区室间差异显著,越靠近根系,含量越低。不同供氮条件对土壤pH、有机质含量、全氮含量和全磷含量的影响不显著。
|
|
表 1 小麦地上部性状和营养元素含量 Table 1 Status and nutrient contents in shoots of wheat |
|
|
表 2 根箱土壤的理化性质 Table 2 Physicochemical properties of the soil in the rhizobox |
土壤微生物群落的α多样性采用基于多度覆盖的物种估计量(Abundance-based coverage estimator,ACE)指数和物种丰富度(Observed species)指数来表征。在正常供氮条件下,根际土壤微生物的ACE多样性显著低于近根际土壤,而在同一供氮水平下其他区室之间的差异不显著(图 2a))。总体而言,缺氮胁迫极显著地提高了土壤微生物的ACE多样性指数(图 2b))。因此,供氮水平对土壤微生物群落α多样性的影响要大于根际效应的影响。

|
注:多组比较使用克鲁斯卡尔-沃利斯(Kruskal-Wallis)检验,成对比较使用Wilcoxon检验。显著性差异在P≤0.05和P≤0.01水平分别用*和**标注,n=9(a)),n=27(b))。 Note:Kruskal-Wallis test was used for multi-group comparison,and wilcoxon test for paired comparison. Significant differences at P≤0.05 and P≤0.01 levels are indicated by * and **,respectively,n=9(a)),n=27(b)). 图 2 不同根箱区室(a))和不同供氮水平(b))的土壤微生物群落的基于多度覆盖的物种估计量(ACE)多样性指数 Fig. 2 ACE-based diversity index of the soil microbial community between different areas in the rhizobox(a))and under different nitrogen levels(b)) |
进一步对物种丰富度(observed species index)和土壤理化因子做相关性分析(图 3)。土壤微生物群落的物种丰富度与硝态氮含量呈极显著的负相关关系(P≤0.001),且相关性最高(R2=0.69)。同时,物种丰富度与铵态氮含量和电导率也呈极显著负相关关系,而与其他土壤化学性质的相关性并不显著。这也验证了土壤可溶性无机氮水平,特别是硝态氮含量对土壤微生物群落α多样性的影响。

|
图 3 土壤微生物群落物种丰富度与土壤理化因子之间的相关性 Fig. 3 Correlation between diversity index of the observed species of soil microbial community and soil physicochemical factors |
不同供氮水平下土壤微生物群落结构和环境因子之间的关系通过dbRDA冗余分析来表征。降维后第一维度和第二维度的解释量分别为10.84%和6.04%。不同氮水平下的微生物群落结构具有显著差异(图 4a)),其95%置信椭圆能够在硝态氮含量、铵态氮含量和土壤电导率向量指示的方向上大致区分开。进一步对土壤理化因子拟合dbRDA分析的结果进行F检验,硝态氮含量、铵态氮含量、土壤电导率和速效钾含量对土壤微生物群落结构具有显著影响。
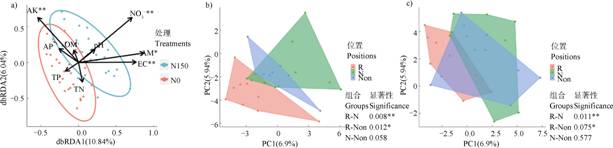
|
注:不同环境因子在基于距离的冗余分析(dbRDA)结果中的显著性通过F检验获得,根际、近根际和非根际微生物群落结构之间的差异用多响应排列程序(MRPP)检验获得,显著的差异性在P≤0.05和P≤0.01的水平分别用*和**标注。 Note:The significance of different environmental factors in the distance-based redundancy analysis(dbRDA)analysis was obtained by F test,the significant differences between soil microbial community in rhizosphere,near-rhizosphere,and non-rhizosphere were test by multi response permutation procedure(MRPP)test. The significant differences obtained by Wilcoxon test at P≤0.05 and P≤0.01 levels are indicated by * and **,respectively.OTU丰度的主成分分析(PCA) 图 4 土壤微生物OTUs丰度和环境因子的dbRDA分析(a))以及正常供氮的(b))和缺氮胁迫下(c)) Fig. 4 dbRDA analysis between OTUs abundances and environmental factors(a))and the PCA analyses based on OTU abundances under normal nitrogen supply(b))and nitrogen deficiency(c)) |
根际、近根际和非根际土壤微生物OTU丰度数据的PCA分析结果表明,降维后前两个主成分维度的解释量分别为6.9%和5.94%(图 4b)和图 4c))。同一供氮水平下,根际和近根际围成的多边形相距较远,而非根际则在前两者中间。基于Bray-Curtis距离的MRPP检验表明,在缺氮胁迫下根际和近根际的土壤微生物群落组成之间具有显著差异,而近根际和非根际之间差异并不显著(图 4b))。小麦的根际效应对土壤微生物群落结构产生的差异仅在同一供氮水平下进行比较才能达到显著水平,因此,土壤可溶性无机氮含量对微生物多样性和群落结构的影响较根际效应的影响更大。
在门水平上对微生物丰度数据与土壤理化因子进行相关性分析(图 5):厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和硝化螺旋菌门(Nitrospirae)在土壤微生物群落中占主导地位,丰度分别为5.45%,4.97%和1.39%。有10个门的微生物丰度与土壤硝态氮含量具有显著的相关性,这表明了硝态氮含量对部分门类的微生物丰度有较大的影响。其中,厚壁菌门和其他丰度相对较低的纤细菌门(Gracilibacteria)、Candidatus Jorgensenbacteria和迷踪菌门(Elusimicrobia)等微生物的丰度与土壤硝态氮含量呈显著的负相关关系,而硝化螺旋菌门则与土壤硝态氮含量呈显著的正相关关系。厚壁菌门和纤细菌门等微生物丰度与土壤EC以及铵态氮含量也呈显著的负相关关系。此外,拟杆菌门和纤维杆菌门(Fibrobacteres)的丰度则与速效钾含量呈显著的负相关关系。
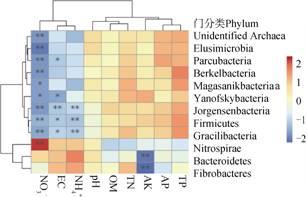
|
注:热图中的红色和蓝色分别表示正相关和负相关关系;显著相关性在P≤0.05和P≤0.01水平上分别用*和**标注。 Note:The red or blue color in the heatmap indicates positive or negative correlation,respectively. The sign of * and ** indicates significant correlation at P≤0.05 and P≤0.01,respectively. 图 5 微生物丰度与土壤理化因子相关性聚类热图(门水平) Fig. 5 Cluster heatmap of correlativity between abundances of microorganisms at the phylum level and soil physicochemical factors |
基于微生物OTU丰度数据构建土壤微生物的共存网络。其中,来源于δ变形菌纲(Deltaproteobacteria)、γ变形菌纲(Gammaproteobacteria)、放线菌纲(Actinobacteria)、α变形菌纲(Alphaproteobacteria)、杆菌纲(Bacilli)和Nitrososphaeria的微生物丰度较高(图 6a))。在共存网络中,正相关边数为1 403条,占98.04%,因此,绝大多数的OTUs丰度之间呈正相关关系。仅有少数OTUs之间呈负相关关系(28条,1.95%)。
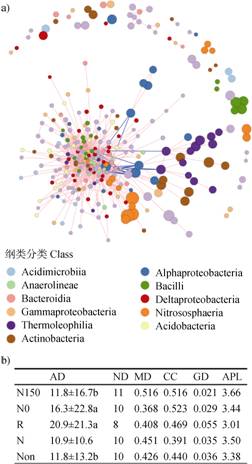
|
注:圆圈大小和OTU丰度呈正比,红色和蓝色线条分别表示正相关和负相关关系。AD表示平均连接度、ND表示网络图直径最大测量长度、MD表示模块化程度、CC表示聚类系数;GD表示网络图密度;APL表示平均路径长度。不同的小写字母表示不同处理下AD有显著性差异(P≤0.05),重复数为网络中节点(OTUs)的数量。 Note:Size of the circle is proportional to the abundance of OTU. The red or blue line indicates positive or negative relationship,respectively. AD stands for average degree,ND for network diameter,MD for modularity,CC for clustering coefficient,GD for graph density,and APL for average path length. Different lowercase letters indicate significant difference of AD(P≤0.05),n= number of nodes(OTUs)in the network. 图 6 土壤微生物OTU的共存网络(a))和属水平共存网络的属性(b)) Fig. 6 Co-occurrence network of soil microbial OTU(a))and the attributes of the co-occurrence network at the genus level(b)) |
属水平的土壤微生物共存网络分析结果表明,与正常供氮相比,缺氮胁迫下微生物共存网络的平均连接度(Average degree,AD)显著增加,但是其模块化程度(Modularity,MD)更低(图 6b))。与近根际和非根际土壤相比,根际土壤中微生物共存网络的平均连接度显著更高,聚类系数(Clustering coefficient,CC)和网络图密度(Graph density,GD)更高,网络图直径最大测量长度(Network diameter,ND)和平均路径长度(Average path length,APL)更低。说明缺氮胁迫和根际效应可能增强了土壤微生物的互作强度。
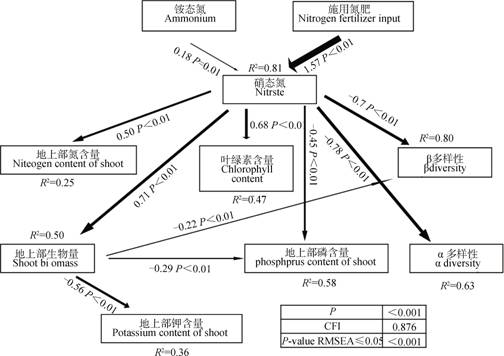
2.4 缺氮胁迫影响小麦和土壤微生物的结构方程模型整合土壤-植物理化指标和微生物群落多样性数据构建结构方程模型,比较拟合指数(Comparison fit index,CFI)为0.876,近似误差均方根(Root mean square error of approximation,RMSEA)为0.300,模型的总体P值小于0.001,模型可靠(图 7)。土壤硝态氮含量处于模型的中心位置。土壤硝态氮含量与供氮水平、土壤铵态氮含量显著正相关,土壤硝态氮含量与小麦地上部生物量、全氮含量、叶片叶绿素含量也呈显著正相关,而与小麦地上部全磷含量、土壤微生物群落的α多样性、β多样性显著负相关。小麦地上部生物量与土壤微生物β多样性、地上部全磷含量、全钾含量显著负相关。缺氮胁迫将抑制小麦地上部的生长和光合作用,引起小麦地上部全磷和全钾含量的提高,并提高土壤微生物的α多样性。土壤硝态氮含量和小麦的地上部生物量共同影响了土壤微生物的群落结构,土壤-植物-微生物群落三者相互影响,相互作用。
|
注:CFI:比较拟合指数,RMSEA:近似误差均方根,箭头粗细与相关系数成正比。 Note:CFI:Comparative fit index,RMSEA:Root mean square error of approximation,arrow weights are proportional to coefficients. 图 7 结构方程模型 Fig. 7 Structural equation model |
通过京都基因与基因组百科全书(KEGG,Kyoto Encyclopedia of Genes and Genomes)数据库的功能注释对微生物群落功能变化进行预测(图 8)。缺氮胁迫可能导致土壤微生物的信使RNA生物起源(messenger RNA biogenesis)、糖酵解或糖异生过程(glycolysis / gluconeogenesis)、过氧化物酶体(peroxisome)和磷酸肌醇代谢(inositol phosphate metabolism)显著增强,而蛋白质输出(protein export)和组氨酸代谢(histidine metabolism)则显著减弱。

|
注:差异的显著性通过t检验获得,显著性差异在P≤0.05和P≤0.01水平分别用*和**标注,n=27。 Note:The significance of differences was obtained through t test. The sign of * and ** indicates significant differences at P≤0.05 and P≤0.01 level,respectively,n = 27. 图 8 不同氮水平下具有显著差异的微生物代谢通路 Fig. 8 Metabolic pathways of the microorganisms with significant differences under different nitrogen levels |
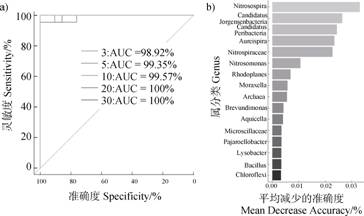
为筛选不同供氮水平影响下的潜在生物标记物(biomarker),本研究进行了两种供氮水平下土壤微生物丰度数据的随机森林分析。不同供氮水平下,仅选择前3个最重要的微生物种类的丰度数据对两种供氮水平进行分类,曲线下面积值(area under the curve,AUC)就达到了98.92%,选用前20个最重要的微生物种类,AUC值达到了100%,这表明随机森林的分类准确度较高,可信度较高(图 9a))。亚硝化螺菌属(Nitrosospira)、Candidatus Jorgensenbacteria、Candidatus Peribacteria、未鉴定的硝化螺旋菌属(unidentified Nitrospiraceae)、亚硝化单胞菌属(Nitrosomonas)等微生物对随机森林分类器准确度的影响最大,可以作为与土壤氮水平相关的生物标记物(图 9b))。上述结果可为后续分离培养微生物提供参考。
|
注:AUC:曲线下面积。 Note:AUC:Area under the curve. 图 9 微生物丰度的随机森林分析 Fig. 9 Random forest analysis of microbial abundance |
土壤氮素是影响小麦生长、产量和品质的主要限制因子之一[21],同时,土壤氮水平也是驱动土壤微生物多样性和群落结构改变的重要因子[4-6]。本研究通过根箱试验综合考察了缺氮胁迫和根际效应对土壤微生物群落结构的影响。研究结果表明,缺氮胁迫显著抑制了小麦生长(表 1),但显著提高了土壤微生物群落的α多样性(图 2)。微生物群落的Observed species多样性指数与土壤硝态氮、铵态氮含量和电导率呈极显著的负相关关系(图 3),这也与前期的一些研究结果一致[22]。Kavamura等[5]的研究表明,不同供氮条件下(有机氮、无添加、中等无机氮、高无机氮),小麦根系细菌群落结构和组成具有显著的差异,高无机氮的添加反而会抑制细菌群落的多样性和稳定性。与长期施氮相比,低氮条件下小麦土壤细菌群落的香农(Shannon)多样性指数更高,而古菌和真菌群落的多样性则相对降低[4-5,23]。高氮供应提高了土壤微生物DNA/RNA复制和蛋白质代谢相关基因的丰度,有利于变形杆菌等富营养微生物的生长和繁殖[24]。而缺氮胁迫会激发更多种类的寡营养型微生物利用难降解碳源的能力,使其相对丰度增加[22]。缺氮胁迫下更多种类的寡营养型微生物相对于富营养微生物的竞争优势可能导致缺氮胁迫下土壤微生物多样性更高。
本研究整体而言,土壤可溶性无机氮含量对微生物多样性和群落结构的影响较根际效应的影响更大(图 2~图 4),这很可能与一些氮代谢活跃的细菌丰度的变化相关。本研究也发现,硝化螺旋菌门(Nitrospirae)的硝化细菌丰度与土壤硝态氮含量呈显著的正相关关系,缺氮胁迫显著抑制了硝化螺旋菌门等氨氧化微生物的繁殖,但显著地促进了厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)等微生物的繁殖(图 5)。随机森林分析结果表明,亚硝化螺菌属(Nitrosospira)、未鉴定的硝化螺旋菌属(unidentified Nitrospiraceae)和亚硝化单胞菌属(Nitrosomonas)是响应缺氮胁迫的土壤微生物标志物(图 9)。前期研究发现,长期缺氮的土壤中,土壤硝化潜势较低,土壤中硝化作用的主要驱动力氨氧化细菌的作用减弱,而氨氧化古菌的作用增强[25-26]。其中,硝化螺旋菌在土壤微生物的氮代谢过程中起主导作用。长期的氮肥施用导致硝化螺旋菌和亚硝化单胞菌等氨氧化细菌的丰度大幅度提高,氮代谢相关基因的表达分析也表明,供氮水平与细菌的反硝化、硝化、硝酸盐同化作用和有机氮的代谢能力显著正相关[4]。缺氮胁迫下,微生物群落中氨氧化微生物丰度的降低可能有利于降低土壤氮素的流失,进而有助于小麦适应短期缺氮环境。
3.2 小麦根际在缺氮胁迫下富集特定的微生物类群不同种类或基因型植物的根系会在土壤中招募大量特定种属的微生物,调节根际微生物群落的多样性和群落结构,以促进自身的生长并增强抗逆性[27]。根系分泌有机酸等物质是植物应对氮素缺乏的一种重要适应性机制[9,28]。植物根系分泌的有机酸、氨基酸、糖类、蛋白质和其他次级代谢物等会显著影响根际土壤微生物群落结构[29]。研究表明,小麦和野燕麦等麦类作物根际富集的杆菌属(Arthrobacter)和芽孢杆菌属(Bacillus)等特定微生物的丰度与根系分泌物中的乙酸、草酸、琥珀酸、烟酸、莽草酸和水杨酸等有机酸含量显著相关[10,30]。缺氮胁迫下,玉米根系分泌的天冬氨酸、酪氨酸、异亮氨酸和赖氨酸等氨基酸含量大大降低,也会引起根际微生物丰度和活性的改变[31]。本研究表明,与正常供氮相比,缺氮胁迫下小麦根际和近根际的土壤微生物多样性和群落结构与非根际中的有一定的差异(图 4),这可能与缺氮胁迫导致小麦根际分泌物的有机酸和氨基酸含量改变有关。根际对特定微生物的富集效应受土壤类型、植物类型以及植物基因型的影响。最近的研究表明,不同氮效率的水稻品种的根系微生物群落存在显著差异,氮高效品种能够在根际富集更多种类的微生物,并且这些微生物具有更强的氮代谢功能,水稻的硝酸盐转运体NRT1.1B参与这些特定微生物类群的富集[32]。细菌在土壤的短期氮素转化过程中占据主导地位,能够快速利用土壤中添加的植物源有机氮[33]。缺氮胁迫下,一些特定种类的细菌在小麦根际土壤中富集可能有利于土壤中氮素的周转并提高小麦应对缺氮胁迫的抗逆性,进而促进小麦的生长。
3.3 缺氮胁迫对小麦根际微生物共存网络和代谢过程的影响本研究的结果表明,与正常供氮水平和非根际土壤相比,缺氮胁迫下和根际土壤中的微生物共存网络的平均连接度显著更高,模块化程度更低(图 6)。这表明缺氮胁迫下,小麦根际土壤中不同种类的微生物互作更加剧烈,且土壤可溶性无机氮浓度变化通过促进或抑制相关微生物的生长调控了这种互作关系。Ma等[34]的研究也表明,土壤微生物共存网络的网络图密度和平均路径长度等属性与土壤可溶性氮含量显著相关。
氨氧化古菌Nitrososphaeria是微生物共存网络的关键节点。据报道,氨氧化古菌是土壤氮循环中极其重要的参与者,催化了氨氧化过程的第一个步骤,而Nitrososphaeria是氨氧化古菌中的一个重要种类[35]。作为一种富营养型古菌,Nitrososphaeria在长期施用有机肥的水稻根际土壤中丰度较高[36]。此外,本研究有关微生物代谢过程的预测结果表明,缺氮胁迫下,土壤微生物的信使RNA生物起源、过氧化物酶活性和磷酸肌醇代谢与抗逆胁迫相关的代谢过程在缺氮胁迫下显著增强,同时组氨酸代谢和蛋白质输出这两种与氮元素相关的代谢过程被显著抑制(图 8)。缺氮胁迫带来的环境压力导致微生物抗逆性增强,使不同种类微生物互作效应增强,从而共同应对不利环境。
4 结论土壤氮素对植物的生长发育和微生物群落结构的变化具有重要作用,土壤-植物-微生物三者相互作用,相互影响。本研究通过根箱试验发现土壤可溶性无机氮含量在小麦土壤微生物多样性和群落结构的改变中起主导作用,同时根际效应也影响了土壤微生物的群落结构。氨氧化古菌Nitrososphaeria是受缺氮胁迫影响的微生物共存网络中的关键节点,土壤可溶性无机氮含量的变化和根际效应能够引起一些特定微生物丰度的显著变化,并改变微生物群落的代谢功能,该改变可能有助于微生物和植物适应缺氮胁迫。上述研究结果可为小麦根际促生微生物的发掘和小麦氮素利用效率的提高提供部分参考依据。
| [1] |
Zhang F S, Wang J Q, Zhang W F, et al. Nutrient use efficiencies of major cereal crops in China and measures for improvement (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(5): 915-924. DOI:10.3321/j.issn:0564-3929.2008.05.018 [张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924.]
(  0) 0) |
| [2] |
Yu S F, Yang L, Zhang M, et al. Effects of controlled-release urea on wheat-corn's yield and soil nitrogen (In Chinese)[J]. Journal of Agro-Environment Science, 2010, 29(9): 1744-1749. [于淑芳, 杨力, 张民, 等. 控释尿素对小麦-玉米产量及土壤氮素的影响[J]. 农业环境科学学报, 2010, 29(9): 1744-1749.]
(  0) 0) |
| [3] |
Conley D J, Paerl H W, Howarth R W, et al. Controlling eutrophication: Nitrogen and phosphorus[J]. Science, 2009, 323(5917): 1014-1015. DOI:10.1126/science.1167755
(  0) 0) |
| [4] |
Li Y L, Tremblay J, Bainard L D, et al. Long-term effects of nitrogen and phosphorus fertilization on soil microbial community structure and function under continuous wheat production[J]. Environmental Microbiology, 2020, 22(3): 1066-1088. DOI:10.1111/1462-2920.14824
(  0) 0) |
| [5] |
Kavamura V N, Hayat R, Clark I, et al. Inorganic nitrogen application affects both taxonomical and predicted functional structure of wheat rhizosphere bacterial communities[J]. Frontiers in Microbiology, 2018, 9: 1074. DOI:10.3389/fmicb.2018.01074
(  0) 0) |
| [6] |
Nivelle E, Verzeaux J, Habbib H, et al. Functional response of soil microbial communities to tillage, cover crops and nitrogen fertilization[J]. Applied Soil Ecology, 2016, 108: 147-155. DOI:10.1016/j.apsoil.2016.08.004
(  0) 0) |
| [7] |
Lagos L M, Maruyama F, Nannipieri P, et al. Current overview on the study of bacteria in the rhizosphere by modern molecular techniques: A mini-review[J]. Journal of Soil Science and Plant Nutrition, 2015, 15(2): 504-523.
(  0) 0) |
| [8] |
Philippot L, Raaijmakers J M, Lemanceau P, et al. Going back to the roots: The microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology, 2013, 11(11): 789-799. DOI:10.1038/nrmicro3109
(  0) 0) |
| [9] |
Kiba T, Krapp A. Plant nitrogen acquisition under low availability: Regulation of uptake and root architecture[J]. Plant and Cell Physiology, 2016, 57(4): 707-714. DOI:10.1093/pcp/pcw052
(  0) 0) |
| [10] |
Chen S M, Waghmode T R, Sun R B, et al. Root-associated microbiomes of wheat under the combined effect of plant development and nitrogen fertilization[J]. Microbiome, 2019, 7(1): Article number 136. DOI:10.1186/s40168-019-0750-2
(  0) 0) |
| [11] |
Ma D Y, Guo T C, Song X, et al. Effects of urea application rate on the quantity of microorganisms and activity of enzymes in wheat rhizosphere (In Chinese)[J]. Acta Ecologica Sinica, 2007, 27(12): 5222-5228. DOI:10.3321/j.issn:1000-0933.2007.12.032 [马冬云, 郭天财, 宋晓, 等. 尿素施用量对小麦根际土壤微生物数量及土壤酶活性的影响[J]. 生态学报, 2007, 27(12): 5222-5228.]
(  0) 0) |
| [12] |
Pagé A P, Tremblay J, Masson L, et al. Nitrogen-and phosphorus-starved Triticum aestivum show distinct belowground microbiome profiles[J]. PLoS One, 2019, 14(2): e0210538. DOI:10.1371/journal.pone.0210538
(  0) 0) |
| [13] |
Saber Z, Pirdashti H, Esmaeili M, et al. Response of wheat growth parameters to co-inoculation of plant growth promoting rhizobacteria(PGPR) and different levels of inorganic nitrogen and phosphorus[J]. World Applied Sciences Journal, 2012, 16(2): 213-219.
(  0) 0) |
| [14] |
Kumar A, Maurya B R, Raghuwanshi R. Isolation and characterization of PGPR and their effect on growth, yield and nutrient content in wheat(Triticum aestivum L.)[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3(4): 121-128. DOI:10.1016/j.bcab.2014.08.003
(  0) 0) |
| [15] |
Zhu Y G, Shen R F, He J Z, et al. China soil microbiome initiative: Progress and perspective (In Chinese)[J]. Bulletin of the Chinese Academy of Sciences, 2017, 32(6): 554-565. [朱永官, 沈仁芳, 贺纪正, 等. 中国土壤微生物组: 进展与展望[J]. 中国科学院院刊, 2017, 32(6): 554-565.]
(  0) 0) |
| [16] |
Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews. Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9
(  0) 0) |
| [17] |
Cabello P, Roldán M D, Moreno-Vivián C. Nitrate reduction and the nitrogen cycle in archaea[J]. Microbiology, 2004, 150(11): 3527-3546. DOI:10.1099/mic.0.27303-0
(  0) 0) |
| [18] |
dal Cortivo C, Barion G, Visioli G, et al. Increased root growth and nitrogen accumulation in common wheat following PGPR inoculation: Assessment of plant-microbe interactions by ESEM[J]. Agriculture, Ecosystems & Environment, 2017, 247: 396-408.
(  0) 0) |
| [19] |
李晓亮, 杜公福, 余小兰, 等. 一种植物分根装置: CN207340617U[P]. [2018-05-11]] Li X L, Du G F, Yu X L, et al. A plant root-splitting device: CN207340617U[P]. [2018-05-11]. [ (  0) 0) |
| [20] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.]
(  0) 0) |
| [21] |
Du P, Zhang J J, Guo W, et al. Effect of nitrogen application on nitrogen nutrition and yield of wheat in fields of different fertility (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(2): 176-186. [杜盼, 张娟娟, 郭伟, 等. 施氮对不同肥力土壤小麦氮营养和产量的影响[J]. 植物营养与肥料学报, 2019, 25(2): 176-186.]
(  0) 0) |
| [22] |
Shen W S, Lin X G, Shi W M, et al. Higher rates of nitrogen fertilization decrease soil enzyme activities, microbial functional diversity and nitrification capacity in a Chinese polytunnel greenhouse vegetable land[J]. Plant and soil, 2010, 337(1-2): 137-50. DOI:10.1007/s11104-010-0511-2
(  0) 0) |
| [23] |
Zeng J, Liu X J, Song L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry, 2016, 92: 41-49. DOI:10.1016/j.soilbio.2015.09.018
(  0) 0) |
| [24] |
Fierer N, Lauber C L, Ramirez K S, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. The ISME Journal, 2012, 6(5): 1007-1017. DOI:10.1038/ismej.2011.159
(  0) 0) |
| [25] |
Chu H Y, Fujii T, Morimoto S, et al. Community structure of ammonia-oxidizing bacteria under long-term application of mineral fertilizer and organic manure in a sandy loam soil[J]. Applied and Environmental Microbiology, 2007, 73(2): 485-491. DOI:10.1128/AEM.01536-06
(  0) 0) |
| [26] |
Sterngren A E, Hallin S, Bengtson P. Archaeal ammonia oxidizers dominate in numbers, but bacteria drive gross nitrification in N-amended grassland soil[J]. Frontiers in Microbiology, 2015, 6: 1350.
(  0) 0) |
| [27] |
Fitzpatrick C R, Copeland J, Wang P W, et al. Assembly and ecological function of the root microbiome across angiosperm plant species[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(6): E1157-E1165. DOI:10.1073/pnas.1717617115
(  0) 0) |
| [28] |
Zhao K, Zhou B H, Ma W Z, et al. The influence of different environmental stresses on root-exuded organic acids: A review (In Chinese)[J]. Soils, 2016, 48(2): 235-240. [赵宽, 周葆华, 马万征, 等. 不同环境胁迫对根系分泌有机酸的影响研究进展[J]. 土壤, 2016, 48(2): 235-240.]
(  0) 0) |
| [29] |
Sasse J, Martinoia E, Northen T. Feed your friends: Do plant exudates shape the root microbiome?[J]. Trends in Plant Science, 2018, 23(1): 25-41. DOI:10.1016/j.tplants.2017.09.003
(  0) 0) |
| [30] |
Zhalnina K, Louie K B, Hao Z, et al. Dynamic root exudate chemistry and microbial substrate preferences drive patterns in rhizosphere microbial community assembly[J]. Nature Microbiology, 2018, 3(4): 470-480. DOI:10.1038/s41564-018-0129-3
(  0) 0) |
| [31] |
Carvalhais L C, Dennis P G, Fedoseyenko D, et al. Root exudation of sugars, amino acids, and organic acids by maize as affected by nitrogen, phosphorus, potassium, and iron deficiency[J]. Journal of Plant Nutrition and Soil Science, 2011, 174(1): 3-11. DOI:10.1002/jpln.201000085
(  0) 0) |
| [32] |
Zhang J Y, Liu Y X, Zhang N, et al. NRT1.1B is associated with root microbiota composition and nitrogen use in field-grown rice[J]. Nature Biotechnology, 2019, 37(6): 676-684. DOI:10.1038/s41587-019-0104-4
(  0) 0) |
| [33] |
Starke R, Kermer R, Ullmann-Zeunert L, et al. Bacteria dominate the short-term assimilation of plant-derived N in soil[J]. Soil Biology & Biochemistry, 2016, 96: 30-38.
(  0) 0) |
| [34] |
Ma B, Wang H, Dsouza M, et al. Geographic patterns of co-occurrence network topological features for soil microbiota at continental scale in Eastern China[J]. The ISME Journal, 2016, 10(8): 1891-1901. DOI:10.1038/ismej.2015.261
(  0) 0) |
| [35] |
Kerou M, Offre P, Valledor L, et al. Proteomics and comparative genomics of Nitrososphaera viennensis reveal the core genome and adaptations of archaeal ammonia oxidizers[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(49): E7937-E7946. DOI:10.1073/pnas.1601212113
(  0) 0) |
| [36] |
Tang H M, Xiao X P, Xu Y L, et al. Utilization of carbon sources in the rice rhizosphere and nonrhizosphere soils with different long-term fertilization management[J]. Journal of Basic Microbiology, 2019, 59(6): 621-631. DOI:10.1002/jobm.201800736
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


