2. 中国科学院大学, 北京 100049;
3. 中国科学院常熟农业生态实验站, 江苏常熟 215555
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Changshu Agro-ecological Experimental Station, Chinese Academy of Sciences, Changshu, Jiangsu 215555, China
硝酸根异化还原成铵(Dissimilatory nitrate reduction to ammonium,DNRA)是微生物在厌氧环境中将硝态氮(NO3–-N)还原为铵态氮(NH4+-N)的过程[1],可将易流失的NO3–-N转化为水稻易利用的NH4+-N,有利于氮素在土壤中的固持。DNRA是除反硝化、厌氧氨氧化以外厌氧状态下氮素转化的重要途径,该过程可以存在于土壤、沉积物和活性污泥中,目前对DNRA研究主要集中在海洋、湖泊、河流等水体沉积物中,对稻田DNRA的研究相对较少[2-3]。长期处于淹水条件的稻田,为DNRA过程的发生提供了适宜的条件,研究显示,在常规施肥的稻田土壤中,DNRA对NO3–还原过程的贡献率最高可达17.63%[4],长期低氮施肥稻田土壤中DNRA发生速率显著高于长期高氮施肥稻田土壤 [5]。铁作为水稻土中重要的氧化还原物质之一,对水稻土中氮的转化具有重要调节作用,以针铁矿和水合氧化铁形式存在的三价铁极易在淹水的水稻土中发生铁解,进而被部分还原为亚铁(Fe2+),而Fe2+可被微生物氧化或被化学氧化,与NO3–还原过程耦合从而影响稻田NO3–还原路径和产物。尽管目前还未分离到能够将NO3–还原成NH4+的Fe2+氧化纯菌株,但NO3–依赖的Fe2+氧化微生物群落可以耦合NO3–还原成NH4+的过程已被证实。如Weber等[6]研究发现湿地环境中的Geobacter和Dechloromonas属在NO3–存在的厌氧体系Fe2+氧化过程中会伴随NH4+的产生。Coby等[7]的研究也发现在含有铁还原微生物的体系中,NO3–的还原和醋酸盐的消耗导致了Fe2+的快速氧化和NH4+的积累。Robertson等[8]在河口底泥沉积物中的研究显示,增加Fe2+浓度可促进NO3–还原成NH4+,并伴随着反硝化速率的降低。陈鹏程等[9]在水稻土的富集培养实验中发现,只有Fe2+和NO3–同时存在的培养体系中,Fe2+才能发生氧化,并伴随着NH4+的生成。Wang等[10]对淹水下水稻土的研究发现NO3–减少过程伴随着亚硝酸根的累积、氧化亚氮(N2O)的排放以及NH4+的生成。李进芳等[11]在水稻土中的研究也发现,土壤Fe2+含量是影响水稻土DNRA过程速率的关键因子之一。因此有理由推测,稻田土壤中存在Fe2+氧化耦合DNRA过程,根据前人对河口沉积物的研究结果,该过程的具体反应方程式[12]如下:
| $ {\rm{8F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + NO}}_{\rm{3}}^ - {\rm{ + 10}}{{\rm{H}}^{\rm{ + }}} \to {\rm{8F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + NH}}_{\rm{4}}^{\rm{ + }}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (1) |
在稻田生态系统,除Fe2+外,微生物还可以利用有机碳为电子供体,为DNRA过程的发生捐赠电子,从而影响DNRA过程的发生速率[13]。研究发现不同种类的碳源对DNRA过程的影响不同,乳酸等发酵型碳源可以直接被部分DNRA功能微生物利用,或经微生物发酵后以醋酸的形式为其他DNRA功能微生物利用[14]。此外,目前对DNRA的研究主要集中在厌氧条件下,一般认为DNRA细菌多为专性厌氧菌和兼性厌氧菌[15],但也有学者发现氧气存在对DNRA具有促进作用[16]。对周期性低氧河口底泥的研究发现,在自然存在Fe2+的环境中,当氧气状态由缺氧转为氧饱和后,NO3–还原过程中DNRA的占比从小于1%上升为18%[12]。目前对有氧下Fe2+氧化耦合DNRA过程的研究较少,而氧气存在和碳源添加对Fe2+氧化耦合DNRA过程的影响还不清楚。
本研究以常熟和桃源水稻土为研究对象,结合15N同位素示踪技术和膜进样质谱仪,研究水稻土中Fe2+氧化耦合DNRA的发生情况,并探究氧气存在和碳源添加对该过程的影响,以期加深对稻田生态系统NO3–还原过程的认识,为提高氮肥利用率和合理制定农田土壤氮素管理措施提供科学依据。
1 材料与方法 1.1 供试材料供试水稻土分别采自江苏常熟(31°55′N,120°70′E)和湖南桃源(28°55′N,111°49′E),其中,常熟水稻土是湖基母质风化发育而成的水稻土,桃源水稻土是第四纪红土母质发育而成的水稻土。采土时用土钻采集表层0~20 cm土壤,置于配有冰袋的保温箱中尽快带回实验室。新鲜土样略风干后过10目筛混匀分成两份,一份置于4℃冰箱短暂保存,随后用于Fe2+氧化耦合DNRA过程实验;另一份自然风干,用于土壤基本理化性质测定。供试水稻土基本理化性质见表 1。
|
|
表 1 两种水稻土的基本理化性质 Table 1 Basic physico-chemical properties of the two tested paddy soils |
采用15N示踪实验测定水稻土中DNRA及Fe2+耦合DNRA过程的速率,具体实验操作参考Yin等[17]的方法。每种水稻土取2.5 g过筛土样于12 mL顶空瓶中,注入冲氦纯水并混匀,保证每个瓶中无气泡存在,将顶空瓶置于8 r·min–1旋转培养器内预培养一周以消耗背景NO3–和O2。预培养结束后将样品分为三组,分别对应0、500、800 µmol·L–1三个Fe2+浓度水平(根据参与DNRA反应中Fe2+与NO3–化学计量比设定),每个浓度水平下分别有四个处理,分别是无添加的对照处理、单一氧气处理(溶解氧为8.47 mg·L–1)、单一乳酸处理(乳酸与NO3–摩尔比为2.97)以及氧气乳酸联合处理,每个处理重复三次;除了上述处理外,为了进一步探究两种水稻土中微生物对Fe2+氧化耦合DNRA过程的贡献,每种土壤也分别增加一组800 µmol·L–1 Fe2+浓度下灭菌实验处理。土壤具体灭菌过程为:将每种土壤放于121℃高压灭菌锅中,灭菌1 h,反复3次。上述所有实验处理中土壤样品的分装及Fe2+的添加操作均在厌氧环境中进行。所有样品在培养前均加入K15NO3(15N丰度99%)进行标记,使得最终样品中15N浓度在100 µmol·L–1左右。在0、3、6 h时间点取样并用微量进样针加入200 µL 7 mol·L–1 ZnCl2溶液终止反应。终止后的样品按不同处理分别倒入100 mL广口瓶中进行充氦半小时以上,排出样品中反硝化、厌氧氨氧化等过程产生的28N2、29N2和30N2后分装至干净的12 mL顶空瓶中,用微量进样针加入200 µL氧化剂次溴酸钠碘溶液,充分摇匀使得样品氧化完全。用离心机以2 000 r·min–1的转速离心5 min后将样品取出置于25℃水浴培养箱待测,利用膜进样质谱仪(Membrane Inlet Mass Spectrometer,MIMS)测定水中15N(29N2+2×30N2)信号强度。DNRA速率计算需要先绘制标准曲线:制备0、0.5、2、4、8、10、20 µmol·L–1的15NH4Cl溶液分装于12 mL顶空瓶中,用微量进样针往每个顶空瓶中加入200 µL氧化剂将15NH4+氧化为N2(29N2和30N2),利用MIMS测定水中15N信号强度,得到15N信号强度与15NH4Cl浓度之间的对应曲线,每个浓度设置三个重复。DNRA速率的计算公式如下:
| $ R = \frac{{slop{e_{{[^{15}}NH_4^ + ]}} \times V}}{W} $ |
式中,R表示DNRA速率,N nmol·g–1·h–1;
采用FastDNA SPIN Kit for soil(MP Biomedicals,美国)试剂盒提取各处理实验终止时刻(即培养6 h后)土壤样本的DNA。称取0.3 g冻干土样,按照试剂盒说明进行土壤DNA提取操作,提取完毕的DNA于–20℃冰箱保存。针对不同的功能基因选择特定的引物进行实时荧光定量PCR(Quantitative real-time PCR,qPCR)操作,narG采用引物narG1960m2f和narG2050m2r;napA采用引物napA-3F和napA-3FR;nrfA采用引物nrfAF2aw和nrfAR1。上述功能基因分别以10倍梯度稀释标准质粒得到各自标准曲线。采用宝生物工程(大连)有限公司的SYBR Premix Ex Taq试剂盒于QuantStudio 3系统上分析。本实验采用20 µL反应体系,包括1 µL DNA样本,10 µL SYBR Premix Ex Taq、0.08 µL ROX Reference DyeⅡ、前后引物各0.5 µL和7.92 µL灭菌水。相关引物序列和循环条件见表 2。
|
|
表 2 qPCR扩增引物及反应条件 Table 2 Primers and qPCR conditions used in this study |
采用独立样本t检验对两种水稻土的土壤性质、功能基因丰度、灭菌前后土样的DNRA速率进行差异比较。利用单因素方差分析(ANOVA)的LSD法,对两种水稻土不同Fe2+浓度下DNRA速率及氧气存在和碳源添加处理下Fe2+氧化耦合DNRA速率进行显著性分析。采用IBM SPSS Statistics 24软件进行数据分析,利用Origin2018软件进行制图。
2 结果 2.1 水稻土Fe2+氧化耦合DNRA的速率在0、500、800 µmol·L–1 Fe2+浓度处理下,常熟和桃源水稻土的DNRA速率变化趋势一致,总体上当Fe2+浓度的增加时,水稻土DNRA速率随之增加(图 1)。两种水稻土的DNRA速率在500 µmol·L–1 Fe2+浓度处理下较对照组略有提高,在800 µmol·L–1 Fe2+浓度处理下与对照组差异显著(P < 0.05)。以上结果表明,两种水稻土均存在Fe2+氧化耦合DNRA过程。此外,尽管两种水稻土对照组DNRA速率相当(常熟0.38 nmol·g–1·h–1;桃源0.36 nmol·g–1·h–1),但是在800 µmol·L–1 Fe2+浓度处理下,常熟水稻土的DNRA速率(2.35 nmol·g–1·h–1)显著高于桃源水稻土(0.81 nmol·g–1·h–1,P < 0.05),是同处理下桃源水稻土的2.90倍,表明常熟水稻土具有较大的Fe2+氧化耦合DNRA潜势。
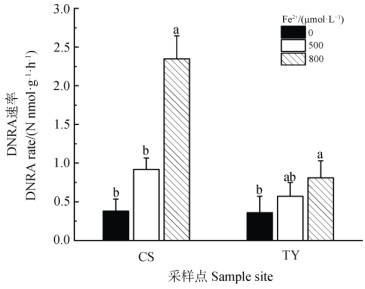
|
注:CS:常熟;TY:桃源。下同。不同小写字母代表不同浓度Fe2+处理之间差异显著,P < 0.05。 Note: S and TY represent Changshu and Taoyuan paddy soils, respectively. In each soil, different lowercase letters above bars indicate significant differences (P < 0.05) among treatment different in Fe2+ concentration. 图 1 不同Fe2+浓度对两种水稻土DNRA速率的影响 Fig. 1 Effects of different Fe2+ concentrations on potential rate of DNRA in two paddy soils |
两种水稻土DNRA相关功能基因丰度结果显示,常熟水稻土中nrfA基因丰度显著高于(P < 0.05)桃源水稻土(图 2),napA基因仅在800 µmol·L–1 Fe2+浓度情况下差异显著(P < 0.05),而两种水稻土narG基因丰度之间无显著差异。在不同浓度Fe2+添加情况下,各功能基因丰度变化趋势与DNRA速率所呈现的趋势并不相同。两种水稻土的DNRA速率随Fe2+浓度的增加而增加,在800 µmol·L–1 Fe2+浓度下达到最大值,而上述趋势与相关功能基因丰度变化趋势并不一致,两种水稻土在不同Fe2+浓度下相关功能基因丰度变化并不显著。
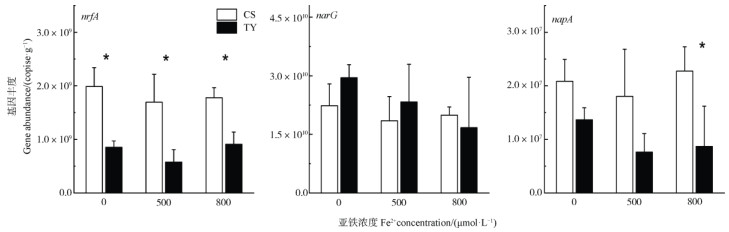
|
注:*表示两种水稻土功能基因丰度差异显著,P <;0.05。 Note: * indicates significant differences(P < 0.05) between the two paddy soils. 图 2 不同Fe2+浓度下两种水稻土中nrfA、narG、napA基因丰度 Fig. 2 Abundance of nrfA, narG and napA genes in the two paddy soils under different Fe2+ concentrations |
在单一氧气处理、单一乳酸处理以及氧气乳酸联合处理下,常熟和桃源两种水稻土DNRA速率均表现为显著的增加(P < 0.05),DNRA速率的最大值均出现在单一乳酸处理组,分别为2.91 nmol·g–1·h–1和5.04 nmol·g–1·h–1,其次为氧气乳酸联合处理组和单一氧气处理组。
在氧气存在和乳酸添加处理下,常熟和桃源两种水稻土Fe2+氧化耦合DNRA速率表现出不同的趋势(图 3),桃源水稻土Fe2+氧化耦合DNRA速率的提升高于常熟水稻土。在常熟水稻土中,当Fe2+浓度为500 µmol·L–1时,单一氧气处理、单一乳酸处理以及氧气乳酸联合处理都能促进Fe2+氧化耦合DNRA的速率,其中单一氧气处理和单一乳酸处理对Fe2+氧化耦合DNRA的促进作用均达到显著水平(P < 0.05)。当Fe2+浓度为800 µmol·L–1时,三个处理下Fe2+氧化耦合DNRA的速率均受到抑制,且单一乳酸处理和氧气乳酸联合处理对Fe2+氧化耦合DNRA过程表现为显著的抑制作用(P < 0.05)。在桃源水稻土中,单一氧气处理、单一乳酸处理以及氧气乳酸联合处理均显著提升了水稻土Fe2+氧化耦合DNRA速率(P < 0.05)。在500 µmol·L–1 Fe2+浓度下,氧气乳酸联合处理对水稻土Fe2+氧化耦合DNRA速率提升效率低于其他两种处理,这一点与常熟水稻土结果一致。在800 µmol·L–1 Fe2+浓度下,单一氧气处理、单一乳酸处理以及氧气乳酸联合处理的水稻土Fe2+氧化耦合DNRA的速率显著高于对照组(P < 0.05),这与常熟水稻土在Fe2+浓度为800 µmol·L–1时Fe2+氧化耦合DNRA速率受到抑制的情况不同。
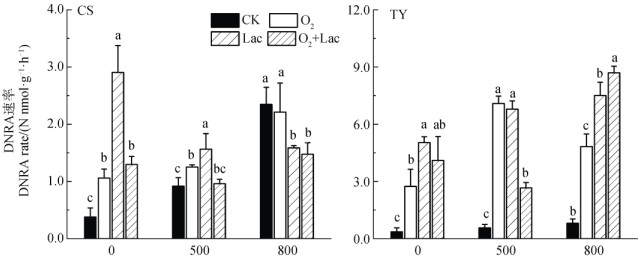
|
注:CK:对照组;O2:单一氧气处理;Lac:单一乳酸处理;O2+Lac:氧气乳酸联合处理。不同小写字母代表不同处理之间差异显著,P < 0.05。 Note: CK: control; O2: single oxygen presence; Lac: single lactic acid addition; O2+Lac: oxygen presence combined with lactic acid addition. Different lowercase letters above the bars indicate significant differences(P < 0.05) among different treatments. 图 3 氧气存在和乳酸添加处理对两种水稻土不同Fe2+浓度下DNRA速率的影响 Fig. 3 Potential rate of DNRA under varying Fe2+ concentrations in the two paddy soils as affected by oxygen presence and lactic acid addition |
本研究中两种水稻土均存在Fe2+氧化耦合DNRA过程,DNRA速率随Fe2+浓度增加而增加,介于0.57~2.35 nmol·g–1·h–1之间。以往研究表明,Fe2+浓度是影响NO3–还原过程的重要因素,且NO3–还原过程的产物很大程度上取决于Fe2+和NO3–的化学计量比。当Fe2+和NO3–化学计量比为5时,NO3–还原过程产物以N2为主[18],当Fe2+和NO3–化学计量比为8时,NO3–还原过程产物以NH4+为主。本实验中,当Fe2+浓度为500 µmol·L–1时,Fe2+和NO3–化学计量比为5,两种水稻土的DNRA速率较对照组略有提高,但不构成显著差异;当Fe2+添加量为800 µmol·L–1时,体系中Fe2+和NO3–的化学计量比为8,反应更倾向于生成NH4+,DNRA速率与对照相比也差异显著(P < 0.05),与上述研究结果一致。
此外,两种水稻土的pH差异也可能是影响两种水稻土Fe2+氧化耦合DNRA速率的重要因素,前人对活性污泥的研究发现,pH=8时Fe2+依赖型NO3–还原过程的速率接近pH=6时的4倍[18],当pH高于9或低于6时反应活性极小。本研究中常熟水稻土pH为6.82±0.02,桃源水稻土pH为5.38±0.01,而800 µmol·L–1 Fe2+浓度下常熟Fe2+氧化耦合DNRA速率显著高于桃源土,与上述研究结果一致。土壤pH还可以通过调控其他土壤氮转化过程(如反硝化、硝化)从而影响DNRA过程。有研究表明反硝化过程在低pH环境下更有利,而提高pH更有利于DNRA过程的进行[19],主要原因在于反硝化过程的关键酶铜依赖型亚硝酸盐还原酶(CuNir)和DNRA过程的关键酶产铵亚硝酸还原酶(NrfA)对环境pH的响应不同[20],CuNir活性在pH小于7.0时较高,pH为5.2时活性最大,当pH大于7.5时活性极低;而NrfA活性的最适pH在7.5以上[21-22]。在有氧情况下,硝化过程也可能为DNRA提供反应所需底物,在适宜pH下可促进DNRA的发生。如Zhang等[23]对不同水稻土氮转化过程的研究发现,DNRA和硝化过程速率均在中性和碱性水稻土中较高,在酸性水稻土中较低,且DNRA随硝化速率的增加呈线性增加。
DNRA是微生物主导的异化还原过程,土壤的电子供应能力很大程度上决定了DNRA的发生潜势[24]。除了微生物驱动的DNRA过程外,在厌氧条件下,涉及表面催化的非生物过程也可以实现Fe2+氧化并产NH4+的过程[25-26]。为区分两者的产NH4+量差别,将两种水稻土灭菌后的土样与正常活性土样进行对比,结果表明,常熟水稻土灭菌前后的DNRA速率差异显著(P < 0.05,图 4),这表明常熟水稻土中DNRA过程主要由微生物主导;同时,800 µmol·L–1 Fe2+处理组灭菌前后水稻土的DNRA速率差异也显著(P < 0.05),这表明常熟水稻土中由Fe2+和NO3–参与的化学反应产NH4+非常有限[27]。然而,在桃源水稻土中,对照组与800 µmol·L–1 Fe2+处理组灭菌前后的DNRA速率差异均不显著,表明桃源土壤中非生物过程对DNRA及Fe2+氧化耦合DNRA的贡献也不可忽视,但具体机制还有待进一步研究。
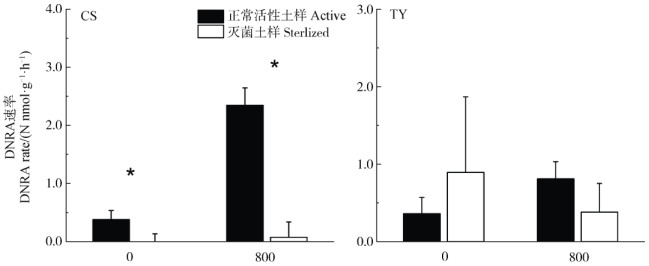
|
注:*表示灭菌土样DNRA速率与正常活性土样相比差异显著,P < 0.05。 Note: * indicates significant differences (P < 0.05)between sterilized and active soils. 图 4 正常活性与灭菌土样中DNRA速率 Fig. 4 Potential rate of DNRA in active or sterilized soils |
土壤氮循环高度依赖于微生物过程,细菌群落对DNRA过程的调控具有重要意义。在不同的Fe2+浓度下,常熟和桃源两种水稻土DNRA速率表现出较大差异,常熟水稻土表现出更强的氮素留存能力,这可能与两种水稻土DNRA相关微生物的群落组成差异有关。DNRA过程中涉及的功能基因有narG、napA和nrfA,narG和napA基因参与编码硝酸根还原酶(NaR)调控NO3–→NO2–过程,间接影响NH4+的形成,而nrfA基因参与编码亚硝酸根还原酶(NiR)调控NO2–→NH4+的反应过程,直接调控NH4+的形成。部分针对河口湿地DNRA过程的研究已证明DNRA速率与nrfA基因数量密切相关[28-29]。此外,也有研究发现Fe2+氧化过程与DNRA过程的NO3–→NO2–和NO2–→NH4+的转化过程均存在联系[8]。本实验中,在不同Fe2+浓度下,常熟水稻土较桃源水稻土展现出较高的DNRA速率,常熟水稻土中nrfA基因丰度(1.69×109~1.78×109 copies·g–1)也高于桃源水稻土(5.76×108~9.08×108 copies·g–1),两种水稻土之间nrfA基因丰度与DNRA速率成正相关。然而,在一种水稻土的不同浓度Fe2+处理之间,Fe2+浓度的增加显著提高了水稻土DNRA的速率,但是水稻土narG、napA、nrfA基因丰度并无显著变化,基因丰度变化与DNRA速率并不呈正相关,其可能原因是短时间(6 h)内环境因子变动不足以改变主要DNRA功能微生物的遗传结构,而是通过调节细胞生理活性来影响反应速率。此外,也有研究显示相较于DNA分子水平的功能基因丰度,基于mRNA水平的功能基因丰度更能反映DNRA活性的变化[30]。
3.3 氧气存在和碳源添加对Fe2+氧化耦合DNRA过程的影响传统观点认为DNRA过程主要发生在厌氧环境中,近来有学者在有氧下亦检测到DNRA过程的发生[31-32],认为就DNRA过程而言,其对氧气分压的敏感性可能低于反硝化过程[33]。本实验中,单一氧气处理显著提升了水稻土DNRA速率,对于Fe2+氧化耦合DNRA过程而言,在500 µmol·L–1 Fe2+浓度,单一氧气处理下,在桃源和常熟水稻土上表现为促进作用。对周期性厌氧的河口DNRA的研究也有类似发现,DNRA仅在同时满足Fe2+和氧气条件的情况下表现较大速率,据此研究人员推测在厌氧下Fe2+与硫化物(S2–)结合形成FeS,降低了环境中游离Fe2+离子浓度,使得Fe2+氧化耦合DNRA过程减缓[12]。在800 µmol·L–1 Fe2+浓度,单一氧气处理下,常熟水稻土中Fe2+氧化耦合DNRA的过程表现为受抑制,与桃源水稻土现象不一致,这可能与两种土壤理化性质有关。推测当两种水稻土外源添加的Fe2+和NO3–的化学计量比为8时,常熟水稻土中DNRA过程的电子需求先于桃源水稻土达到饱和,DNRA过程的限制因素可能由电子供体转为NO3–[34]。此外,在有氧情况下,硝化作用会与NO3–还原过程发生耦合[35-36],硝化作用在有氧下产生的NO3–-N,在厌氧下会成为NO3–还原过程的底物。桃源水稻土NH4+-N(23.73±11.08 mg·kg–1)含量显著高于常熟水稻土(NH4+-N:3.94±3.81 mg·kg–1),这可能是导致单一氧气处理下的Fe2+氧化耦合DNRA速率高于常熟水稻土的原因,有关水稻土电子供应与NO3–还原途径关系的具体机制尚待进一步研究。除此以外,NO3–还原过程也可能会受环境中游离S2–浓度影响,水生生态系统大量研究显示高浓度的游离S2–会抑制反硝化最终产生N2O和N2的过程,进而促进以NH4+为主要产物的NO3–还原过程[37]。Murphy等[38]对盐碱地沉积物的研究发现,高浓度的S2–添加促进DNRA速率并抑制反硝化速率,也证实了以上猜想。但是,本研究并未涉及土样S2–含量的测定,稻田中S2–与NO3–还原过程的影响还有待研究。
碳源是土壤中DNRA过程的能量来源和电子供体,在本研究中,乳酸和NO3–的摩尔比值(Lac/ NO3–)设定为2.97,研究表明,在该比值下DNRA过程较反硝化过程更具优势[13]。结果显示,单一乳酸处理作用与氧气类似,对桃源水稻土都表现为显著的促进作用,对常熟水稻土DNRA过程在500 µmol·L–1 Fe2+添加情况下也表现为促进作用,而在800 µmol·L–1 Fe2+添加情况下表现为显著的抑制作用。其机理可能与单一氧气处理类似,因为电子需求饱和使得DNRA的主要限制因素转为NO3–。
在常熟水稻土中,氧气和乳酸联合处理对Fe2+氧化耦合DNRA过程表现为抑制作用,而桃源水稻土中,氧气乳酸的联合处理对Fe2+氧化耦合DNRA的过程均表现为显著的促进作用。推测产生该现象的原因有两方面。一方面,在高Fe2+浓度下,氧气存在和乳酸添加的处理使常熟水稻土中的电子需求达到饱和,DNRA过程受限因素转为NO3–。另一方面,由于桃源水稻土具有较高的NH4+-N,氧气促进了环境中硝化过程的进行,在硝化细菌的作用下,土壤中的NH4+-N逐渐转为NO3–-N,使得桃源水稻土中NO3–浓度进一步提升,因而表现为较高的电子需求,电子供体仍是桃源水稻土中DNRA过程的主要限制因素。综上所述,Fe2+氧化过程为DNRA过程提供了电子,氧气存在和碳源添加通过提高电子供应的方式促进Fe2+氧化耦合DNRA过程,但是当该过程中电子供应饱和时,氮源(NO3–-N和NH4+-N)仍是调节Fe2+氧化耦合DNRA过程的重要因素。
4 结论常熟和桃源两种水稻土中存在Fe2+氧化耦合DNRA过程。氧气和乳酸的单独、联合处理均起到促进DNRA过程的作用,但对Fe2+氧化耦合DNRA过程的作用在不同水稻土之间不一致。在桃源水稻土中,各处理均促进了Fe2+氧化耦合DNRA过程;而在常熟水稻土中,800 µmol·L–1 Fe2+浓度下,单一乳酸及氧气乳酸联合处理对Fe2+氧化耦合DNRA过程起到显著抑制作用。因此,未来研究水稻土Fe2+氧化耦合DNRA过程时,还应纳入更多土壤样本,综合考察环境因子和土壤性质对该过程的影响。
致谢 感谢中国科学院南京土壤研究所柴延超、陈顺涛等同学在样品测试与分析中给予的帮助!
| [1] |
殷士学. 淹水土壤中硝态氮异化还原成铵过程的研究[D]. 南京: 南京农业大学, 2000. Yin S X. Dissimilatory nitrate reduction to ammonium in submerged soils[D]. Nanjing: Nanjing Agricultural Univercity, 2000. (  0) 0) |
| [2] |
Yin S X, Chen D, Chen L M, et al. Dissimilatory nitrate reduction to ammonium and responsible microorganisms in two Chinese and Australian paddy soils[J]. Soil Biology and Biochemistry, 2002, 34(8): 1131-1137. DOI:10.1016/S0038-0717(02)00049-4
(  0) 0) |
| [3] |
Lu W W, Shi W M. Potential of dissimilatory nitrate reduction to ammonium in paddy soils in paddy soils in the Taihu Lake region as affected by irrigation with tail water from pig rearing (In Chinese)[J]. Acta Pedologica Sinica, 2012, 49(6): 1120-1127. [卢伟伟, 施卫明. 养猪场处理尾水灌溉对太湖地区水稻土硝酸根异化还原为铵的影响[J]. 土壤学报, 2012, 49(6): 1120-1127.]
(  0) 0) |
| [4] |
Shan J, Zhao X, Sheng R, et al. Dissimilatory nitrate reduction processes in typical Chinese paddy soils: Rates, relative contributions, and influencing factors[J]. Environmental Science and Technology, 2016, 50(18): 9972-9980. DOI:10.1021/acs.est.6b01765
(  0) 0) |
| [5] |
Pandey A, Suter H, He J Z, et al. Dissimilatory nitrate reduction to ammonium dominates nitrate reduction in long-term low nitrogen fertilized rice paddies[J]. Soil Biology and Biochemistry, 2019, 131(4): 149-156.
(  0) 0) |
| [6] |
Weber K A, Urrutia M M, Churchill P F, et al. Anaerobic redox cycling of iron by freshwater sediment microorganisms[J]. Environmental Microbiology, 2006, 8(1): 100-113. DOI:10.1111/j.1462-2920.2005.00873.x
(  0) 0) |
| [7] |
Coby A J, Picardal F, Shelobolina E, et al. Repeated anaerobic microbial redox cycling of iron[J]. Applied and Environmental Microbiology, 2011, 77(17): 6036-6042. DOI:10.1128/AEM.00276-11
(  0) 0) |
| [8] |
Robertson E K, Roberts K L, Burdorf L D W, et al. Dissimilatory nitrate reduction to ammonium coupled to Fe(Ⅱ) oxidation in sediments of a periodically hypoxic estuary[J]. Limnology and Oceanography, 2016, 61(1): 365-381. DOI:10.1002/lno.10220
(  0) 0) |
| [9] |
Chen P C, Li X M, Li F B. Shifts of microbial communities during Fe(Ⅱ) oxidation coupled to nitrate reduction in paddy soil (In Chinese)[J]. China Environmental Science, 2017, 37(1): 358-366. [陈鹏程, 李晓敏, 李芳柏. 水稻土Fe(Ⅱ)氧化耦合NO3-还原的微生物变化[J]. 中国环境科学, 2017, 37(1): 358-366.]
(  0) 0) |
| [10] |
Wang M, Hu R, Ruser R, et al. Role of chemodenitrification for N2O emissions from nitrate reduction in rice paddy soils[J]. ACS Earth and Space Chemistry, 2020, 4(1): 122-132. DOI:10.1021/acsearthspacechem.9b00296
(  0) 0) |
| [11] |
Li J F, Chai Y C, Chen S T, et al. Measurement of denitrification, Anammox, DNRA rates, and net N2 flux in paddy soil using a membrane inlet mass spectrometer (In Chinese)[J]. Journal of Agri-Environment Science, 2019, 38(7): 1541-1549. [李进芳, 柴延超, 陈顺涛, 等. 利用膜进样质谱仪测定水稻土几种厌氧氮转化速率[J]. 农业环境科学学报, 2019, 38(7): 1541-1549.]
(  0) 0) |
| [12] |
Roberts K L, Kessler A J, Grace M R, et al. Increased rates of dissimilatory nitrate reduction to ammonium(DNRA) under oxic conditions in a periodically hypoxic estuary[J]. Geochimica et Cosmochimica Acta, 2014, 133(3): 313-324.
(  0) 0) |
| [13] |
Yin G Y, Hou L J, Liu M, et al. DNRA in intertidal sediments of the Yangtze Estuary[J]. Journal of Geophysical Research: Biogeosciences, 2017, 122(8): 1988-1998. DOI:10.1002/2017JG003766
(  0) 0) |
| [14] |
van den Berg E M, Elisrio M P, Kuenen J G, et al. Fermentative bacteria influence the competition between denitrifiers and DNRA bacteria[J]. Frontiers in Microbiology, 2017, 8: 1684. DOI:10.3389/fmicb.2017.01684
(  0) 0) |
| [15] |
Tao Y L, Wen D H. Dissimilatory nitrate reduction to ammonium: the potential and impacts in estuarine regions (In Chinese)[J]. Microbiology China, 2016, 43(1): 172-181. [陶怡乐, 温东辉. 细菌硝酸盐异化还原成铵过程及其在河口生态系统中的潜在地位与影响[J]. 微生物学通报, 2016, 43(1): 172-181.]
(  0) 0) |
| [16] |
Roberts K L, Eate V M, Eyre B D, et al. Hypoxic events stimulate nitrogen recycling in a shallow salt-wedge estuary: The Yarra River Estuary, Australia[J]. Limnology and Oceanography, 2012, 57(5): 1427-1442. DOI:10.4319/lo.2012.57.5.1427
(  0) 0) |
| [17] |
Yin G Y, Hou L J, Liu M, et al. A novel membrane inlet mass spectrometer method to measure 15NH4+ for isotope-enrichment experiments in aquatic ecosystems[J]. Environmental Science and Technology, 2014, 48(16): 9555-9562. DOI:10.1021/es501261s
(  0) 0) |
| [18] |
Nielsen J L, Nielsen P H. Microbial nitrate-dependent oxidation of ferrous iron in activated sludge[J]. Environmental Science and Technology, 1998, 32(22): 3556-3561. DOI:10.1021/es9803299
(  0) 0) |
| [19] |
Yoon S, Cruz-García C, Sanford R, et al. Denitrification versus respiratory ammonification: Environmental controls of two competing dissimilatory NO3-/NO2- reduction pathways in Shewanella loihica strain PV-4[J]. The ISME Journal, 2015, 9(5): 1093-1104. DOI:10.1038/ismej.2014.201
(  0) 0) |
| [20] |
Wilks J, Slonczewski J. pH of the cytoplasm and periplasm of Escherichia coli: Rapid measurement by green fluorescent protein fluorimetry[J]. Journal of Bacteriology, 2007, 189(15): 5601-5607. DOI:10.1128/JB.00615-07
(  0) 0) |
| [21] |
Abraham Z H L, Smith B E, Howes B D, et al. pH-dependence for binding a single nitrite ion to each type-2 copper centre in the copper-containing nitrite reductase of Alcaligenes xylosoxidans[J]. Biochemical Journal, 1997, 324(2): 511-516. DOI:10.1042/bj3240511
(  0) 0) |
| [22] |
Kajie S I, Anraku Y. Purification of a hexaheme cytochrome c552 from Escherichia coli K12 and its properties as a nitrite reductase[J]. European Journal of Biochemistry, 1986, 154(2): 457-463. DOI:10.1111/j.1432-1033.1986.tb09419.x
(  0) 0) |
| [23] |
Zhang J B, Lan T, Muller C, et al. Dissimilatory nitrate reduction to ammonium(DNRA) plays an important role in soil nitrogen conservation in neutral and alkaline but not acidic rice soil[J]. Journal of Soils and Sediments, 2015, 15(3): 523-531. DOI:10.1007/s11368-014-1037-7
(  0) 0) |
| [24] |
Rahman M M, Roberts K L, Grace M R, et al. Role of organic carbon, nitrate and ferrous iron on the partitioning between denitrification and DNRA in constructed stormwater urban wetlands[J]. Science of the Total Environment, 2019, 666(5): 608-617.
(  0) 0) |
| [25] |
Carlson H K, Clark I C, Blazewicz S J, et al. Fe(Ⅱ) oxidation is an innate capability of nitrate-reducing bacteria that involves abiotic and biotic reactions[J]. Journal of Bacteriology, 2013, 195(14): 3260-3268. DOI:10.1128/JB.00058-13
(  0) 0) |
| [26] |
Hansen H C B, Koch C B, NanckeKrogh H, et al. Abiotic nitrate reduction to ammonium: Key role of green rust[J]. Environmental Science and Technology, 1996, 30(6): 2053-2056. DOI:10.1021/es950844w
(  0) 0) |
| [27] |
Weber K A, Picardal F W, Roden E E. Microbially catalyzed nitrate-dependent oxidation of biogenic solid-phase Fe(Ⅱ) compounds[J]. Environmental Science and Technology, 2001, 35(8): 1644-1650. DOI:10.1021/es0016598
(  0) 0) |
| [28] |
Hou L J, Zheng Y L, Liu M, et al. Anaerobic ammonium oxidation and its contribution to nitrogen removal in China's coastal wetlands[J]. Scientific Reports, 2015, 5: 15621. DOI:10.1038/srep15621
(  0) 0) |
| [29] |
Smith C J, Dong L F, Wilson J, et al. Seasonal variation in denitrification and dissimilatory nitrate reduction to ammonia process rates and corresponding key functional genes along an estuarine nitrate gradient[J]. Frontiers in Microbiology, 2015, 6: 542.
(  0) 0) |
| [30] |
Chen Z, Wang C H, Gschwendtner S, et al. Relationships between denitrification gene expression, dissimilatory nitrate reduction to ammonium and nitrous oxide and dinitrogen production in montane grassland soils[J]. Soil Biology and Biochemistry, 2015, 87(8): 67-77.
(  0) 0) |
| [31] |
Silver W L, Thompson A W, Reich A, et al. Nitrogen cycling in tropical plantation forests: Potential controls on nitrogen retention[J]. Ecological Applications, 2005, 15(5): 1604-1614. DOI:10.1890/04-1322
(  0) 0) |
| [32] |
Yang W H, Ryals R A, Cusack D F, et al. Cross-biome assessment of gross soil nitrogen cycling in California ecosystems[J]. Soil Biology and Biochemistry, 2017, 107(4): 144-155.
(  0) 0) |
| [33] |
Fazzolari E, Nicolardot B, Germon J C. Simultaneous effects of increasing levels of glucose and oxygen partial pressures on denitrification and dissimilatory nitrate reduction to ammonium in repacked soil cores[J]. European Journal of Soil Biology, 1998, 34(1): 47-52. DOI:10.1016/S1164-5563(99)80006-5
(  0) 0) |
| [34] |
Dong L F, Sobey M N, Smith C J, et al. Dissimilatory reduction of nitrate to ammonium, not denitrification or anammox, dominates benthic nitrate reduction in tropical estuaries[J]. Limnology and Oceanography, 2011, 56(1): 279-291. DOI:10.4319/lo.2011.56.1.0279
(  0) 0) |
| [35] |
Liu C, Hou L J, Liu M, et al. Coupling of denitrification and anaerobic ammonium oxidation with nitrification in sediments of the Yangtze Estuary: Importance and controlling factors[J]. Estuarine Coastal and Shelf Science, 2019, 220(5): 64-72.
(  0) 0) |
| [36] |
Seitzinger S P. Linkages between organic matter mineralization and denitrification in eight riparian wetlands[J]. Biogeochemistry, 1994, 25(1): 19-39.
(  0) 0) |
| [37] |
Burgin A J, Hamilton S K. Have we overemphasized the role of denitrification in aquatic ecosystems? A review of nitrate removal pathways[J]. Frontiers in Ecology and the Environment, 2007, 5(2): 89-96. DOI:10.1890/1540-9295(2007)5[89:HWOTRO]2.0.CO;2
(  0) 0) |
| [38] |
Murphy A E, Bulseco A N, Ackerman R, et al. Sulphide addition favours respiratory ammonification(DNRA) over complete denitrification and alters the active microbial community in salt marsh sediments[J]. Environmental Microbiology, 2020, 22(6): 2124-2139. DOI:10.1111/1462-2920.14969
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


