2. 中国科学院大学, 北京 100049;
3. 北京大学城市与环境学院, 北京 100871
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of City and Environment, Peking University, Beijing 100871, China
土壤微生物是植物生长过程中养分循环的重要调控者,其种类、数量及空间分布直接或间接反映了生境土壤的特征及转化规律,是评估土壤发育状况和植被演替的重要指标[1]。土壤微生物根据功能可划分为不同的类群。依据在碳、氮、磷循环过程中的作用,土壤微生物可划分为纤维素分解菌、产甲烷菌、甲烷氧化菌,氨化细菌、硝化细菌、反硝化细菌、固氮菌、溶磷菌等生理类群[2]。植被恢复过程与土壤微生物功能群落密切相关,不同功能群在养分循环中生物学功能各异[3]。纤维素是植物组织的主要成分,是一种非常稳定的化合物。土壤中植物残体的分解主要由纤维素分解菌完成,如噬纤维素菌属镰状纤维菌属、包子杆菌、产甲烷纤维芽孢杆菌等,均为分解纤维素能力很强的微生物。它们是碳元素循环中最主要的一类微生物类群,也是自然界生态系统中大气碳元素循环的重要基础。氨化细菌能使得动植物残体中的蛋白质氨化,这类细菌具有蛋白酶和肽酶,能够水解蛋白质为氨基酸和氨,如枯草芽孢杆菌等。氨化作用产生的铵盐本身已适用于作为绿色植物的养料,但绿色植物更适合的养料是硝酸盐,因此,氨化细菌和硝化细菌类群在土壤氮元素循环中发挥重要作用。而芽孢杆菌中的蜡质芽孢杆菌等溶磷菌微生物使土壤中难以被植物吸收利用的磷转变为可被利用的磷酸盐[4]。因此,对土壤微生物以功能为单位进行研究,可更好地掌握生物地球化学循环及生态系统的演替规律,特别是对退化生态系统的恢复及提高其生物学功能均有重要的理论和实践意义[5]。
环境变化直接或间接地影响土壤微生物群落结构和多样性,进而对整个生态系统产生影响。大量研究表明,土壤类型[6]、土壤理化性质[7-8](水分、温度、pH和碳氮磷元素含量等)、植被类型及物种多样性等是影响土壤微生物功能群的重要因素[9],而在干旱区土壤微生物对上述因素的变化更加敏感。此外,植被恢复年限、植物种、生物土壤结皮(BSC)、季节变化等均被证实能显著影响干旱沙区土壤微生物数量[10-11]。已有的研究[11-12]大多从固沙植被建植后土壤微生物整体的恢复情况及结构和功能等方面进行描述。然而,针对不同年代(老固沙区和新固沙区)、植物种(先锋种和稳定种)及微生境(灌丛下和灌丛间),以指示碳、氮、磷元素循环中承担的微生物功能为目标,探索土壤微生物时空变化规律的研究甚少。固沙植被建立后,一方面,物种多样性增加,植物的凋落物及根系分泌物向土壤中输入有机质,能够为微生物的生长和代谢提供基质[13]。另一方面,随着植被恢复年限增加,BSC的繁衍和拓殖,流动沙丘逐渐被固定,植被的建立减少太阳辐射,有效降低地表温度并减少土壤水分蒸发,改善土壤水热状况[14]。那么,不同的恢复年限、植物种及微生境对土壤微生物数量的空间分布、季节变化以及与土壤理化性质的关系是本研究关心的科学问题。基于此,本研究以腾格里沙漠东南缘沙坡头地区不同年代建植的固沙植被区土壤微生物为对象,采用传统培养法研究微生物功能群,是由于该方法在分离具有一定功能的微生物时非常有效,可获得具有特定功能的微生物种类。虽然可培养的微生物种类有限,但可分离培养的才是人类可利用的微生物,也是该方法在国内外相关研究中被长久应用的原因之一[5]。此外,传统培养法同目前的微生物研究新技术相比,如功能基因芯片虽然能够获得更多的微生物多样性和功能群的基因数据,但它们不一定在环境中表达,这是上述新技术的不足之处。本文比较了沙区植被恢复过程中不同土壤微生物功能群的时空动态,分析了不同因素(建植年代、微生境、土层和采样时间)对微生物功能群数量的影响,最后,讨论了土壤理化性质与微生物数量的关系。旨在揭示土壤微生物功能群对环境变化的响应机制。研究结果期望为干旱沙区荒漠化防治和沙化土地恢复实践提供理论依据。
1 材料与方法 1.1 研究区概况研究区位于腾格里沙漠东南缘宁夏回族自治区中卫市境内的中国科学院沙坡头沙漠研究试验站(37°32′N,105°02′E)。沙坡头站自1956年至2010年于不同年代建立的人工固沙植被演替序列为开展沙区恢复生态学的研究提供了理想的试验平台。该区处于草原化荒漠与荒漠化草原过渡带,气候干旱多风,平均海拔1 300 m,年均气温9.6℃,年均降水量180 mm左右,2017年降水总量为186.4 mm,主要集中在5-9月(图 1),年蒸发量3 000 mm,土壤基质为稀疏贫瘠的风沙土。以油蒿(Artemisia ordosica)和柠条(Caragana korshinskii)为主的固沙植被建立后,有利于大量物种的繁殖和定居,使原有的流沙演变成一个复杂的人工-天然复合的荒漠生态系统。
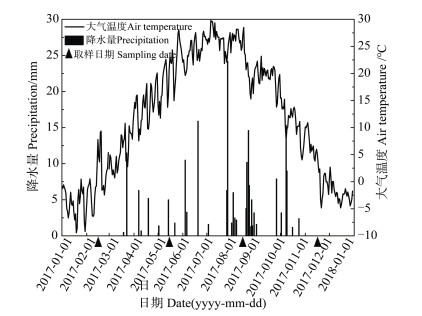
|
图 1 2017年1-12月空气温度和降雨量的日变化 Fig. 1 Daily air temperatures and precipitations from January to December 2017 |
为探究不同恢复年限、不同微生境下的微生物动态特征,分别在沙坡头站2010年和1990年建植的固沙植被区设置样地,在每个样地内选择长势较好、植株大小均匀的柠条和油蒿各3株作为重复,植株间隔5 m。然后分别在柠条和油蒿灌丛下、灌丛间设置1 m×1 m的样方各3个,对每个样方进行编号标记,共24个样方(2个年代×2种植物×2种微生境×3次重复)。样方中的草本植物主要有雾冰藜(Bassia dasyphylla)、小画眉草(Eragrostis poaeoides)、虫实(Corispermum macrocarpum)、刺沙蓬(Salsola ruthenica)、虎尾草(Chlorisvirgata)、沙米(Agriophyllum squarrosum)。沙面形成了BSC,指示土壤碳、氮、磷元素循环为主的微生物得到了较好的发育。
土壤样品于2017年1月15日、4月15日、7月15日、10月15日分四次进行取样。采样时,在样方中按3个方向120°夹角分3层(0~5、5~10和10~20 cm)用土钻采集土样,然后将3个点各土层样品进行混合形成一个复合样品。新鲜土样除去草屑、石头和植物凋落物,过2 mm网筛。所有的土样被分成两部分,一部分分析土壤微生物群落,另一部分分析土壤有机碳(SOC)、全碳(TC)、全氮(TN)、全磷(TP)、碱解氮(AN、NO4+-N与NO3--N之和)、有效磷(AP)、pH和电导率(EC)。
1.3 土壤微生物功能群的测定方法本研究区固沙植被柠条和油蒿样地中的BSC发育较好且具有生物固氮作用,沙区土壤偏碱性,低含水量有利于氨化和硝化作用而不利于反硝化作用[15]。鉴于以上特点,在传统培养法研究土壤微生物中,本研究选择纤维素分解菌、氨化细菌和硝化细菌、溶磷菌分别作为指示碳、氮和磷元素循环的微生物功能群。采用稀释培养计数法测定不同微生物功能群数量,通过各种微生物的生理生化特征及外观形态等进行鉴定。其中,纤维素分解菌使用羧甲基纤维素钠培养基,氨化细菌使用蛋白胨培养基,硝化细菌使用改良的斯蒂芬逊培养基,溶磷菌使用溶磷菌活化培养基[4]。以纤维素分解菌为例,具体实验步骤如下:接种0.05 mL稀释度为10-1 g·mL-1、10-2 g·mL-1、10-3 g·mL-1的土壤悬浊液至冷凝的培养基上,用玻璃涂布棒均匀涂抹于培养基表面。30 ℃倒置恒温培养14 d。分别计算黏液菌、弧菌、真菌和放线菌的数目。最后换算成每克干土中微生物数量。
1.4 土壤理化性质测定TC采用TOC分析仪(Multi N/C 2100,Germany)测定,SOC采用总有机碳分析仪(vario TOC,Elementar,DE)测定,TN采用浓H2SO4消煮-半自动凯氏定氮仪法测定,NO4+-N采用KCl浸提-蒸馏法测定,NO3--N采用饱和CaSO4浸提-酚二磺酸比色法测定,TP采用NaOH熔融-钼锑抗比色法测定,AP采用NaHCO3浸提-钼锑抗比色法测定,土壤pH采用水溶液浸提法(水: 土=5:1)测定[16],EC用电导法测定。
1.5 数据分析土壤微生物功能群分析:采用重复性再裂区三因素方差分析比较土壤微生物功能群时空变化差异的影响因素,采样时间为重复因子,样地、微生境、土层为固定因子。
环境因子分析:将SOC、TN、TC、TP、AN、AP、pH、EC与纤维素分解菌、氨化细菌、硝化细菌和溶磷菌进行冗余分析(RDA),确定土壤微生物功能群和土壤理化性质间的关系,选择影响极显著因子采用拟合函数进行最优拟合,进一步探究理化性质和微生物功能群的关系。
数据预处理方法:利用Excel 2016软件对数据进行预处理;采用SPSS22.0进行统计分析,通过变量的正态性检验(Kolmogorov-Smirnov)和方差的同质性检验(Levenes)满足重复性方差分析;样地、微生境、土层及季节变化的显著差异采用最小显著差异法(LSD)比较;采用多因素方差分析检验不同因素或处理交互作用的差异显著性;采用Origin9.1作图;利用Canoco5.0软件进行RDA分析。本文中所有数据均为样方中三次重复的平均值和标准误差。
2 结果 2.1 土壤微生物功能群数量时空格局取样时间、样地、微生境和土层均显著影响土壤微生物功能群纤维素分解菌、氨化细菌、硝化细菌、溶磷菌的数量。其中,取样时间、样地和土层对其影响极显著,微生境对其影响显著,并且各因素存在明显的交互作用;取样时间和样地、取样时间和土层、样地和土层两两交互作用及取样时间、样地和土层三者交互作用均对微生物功能群数量影响显著,其他交互作用不显著(表 1)。
|
|
表 1 土壤微生物功能群数量三因素方差分析 Table 1 Variance analysis of three factors affecting the number of soil microbial functional groups |
1990年和2010年建植样地0~20 cm土层中纤维素分解菌、氨化细菌、硝化细菌和溶磷菌数量均差异显著(P < 0.05)。1990年油蒿样地中四种菌数量分别为2010年样地中的4.40倍、1.50倍、1.70倍、1.60倍;1990年柠条样地中四种菌数量分别为2010年的4.40倍、1.70倍、1.90倍、1.80倍。此外,油蒿生境中微生物纤维素分解菌和溶磷菌数量显著高于氨化和硝化作用的微生物数量(P < 0.05);而在柠条样地中四种菌数量差异不显著(P > 0.05)(图 2)。
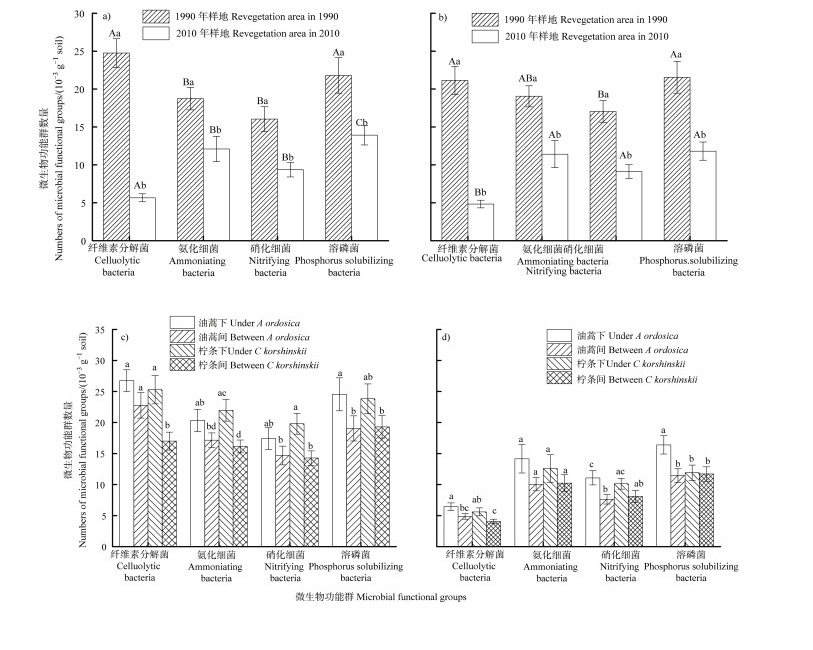
|
注:不同大写字母表示不同微生物功能群间差异显著,P < 0.05;不同小写字母表示不同样地及微生境下差异显著,P < 0.05)。a):油蒿样地;b):柠条样地;c):1990年样地;d):2010年样地。下同。 Note: Different capital letters indicated significant differences among different microbial functional groups(P < 0.05). Different lowercase letters indicate significant(P < 0.05)differences under different sample and microhabitat. a): A. ordosica plot; b): C. korshinskii plot; c): Revegetation area in 1990;d): Revegetation area in 2010. The same below. 图 2 不同样地和微生境0~20 cm土层微生物功能群数量 Fig. 2 Numbers of microbial functional groups of 0-20 cm soil layer in different plots and microhabitats |
不同微生境0~20 cm土层微生物功能群数量不同,油蒿和柠条样地土壤微生物功能群均表现为灌丛下含量高于灌丛间,1990年油蒿和柠条地均表现为:从纤维素分解菌、溶磷菌、硝化细菌到氨化细菌依次递减;但2010年油蒿地微生物功能群数量表现为:从溶磷菌、硝化细菌、氨化细菌到纤维素分解菌依次递减(图 2)。
随着土壤深度的增加各微生物功能群数量呈减少趋势。除1990年油蒿样地5~10和10~20 cm土层氨化细菌数量及2010年柠条样地0~5和5~10 cm土层硝化细菌数量外,其他微生境中各土层微生物功能群数量均差异显著(P < 0.05);尤其固沙植被建立后,0~5 cm土层不同微生境各土层微生物功能群数量变化最显著(图 3)。

|
注:a):1990年油蒿样地;b):2010年油蒿样地;c):1990年柠条样地;d):2010年柠条样地。 Note: a): A. ordosica plot in 1990;b): A. ordosica plot in 2010;c): C. korshinskii plot in 1990;d): C. korshinskii plot in 2010. 图 3 不同土层微生物功能群数量 Fig. 3 Numbers of microbial functional groups of different soil layers |
不同样地(1990油蒿、1990柠条、2010油蒿、2010柠条)土壤微生物功能群季节变化规律表现一致,本研究仅以1990年油蒿样地为例对微生物功能群季节变化展示,发现土壤微生物功能群数量具有明显的季节变化规律。不同土层(0~5、5~10和10~20 cm)土壤纤维素分解菌季节变化均表现为春低、夏高、秋冬持平,呈现出“V”字型变化特征(图 4a));氨化细菌和硝化细菌微生物量从冬、春到秋季逐渐上升(图 4b)和图 4c));溶磷菌含量则表现为从冬季、秋季到春夏季依次递减(图 4d))。
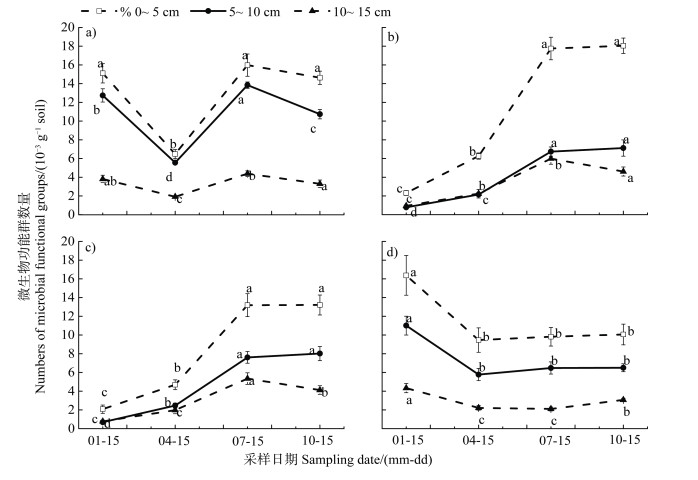
|
注a):纤维素分解菌;b):氨化细菌;c):硝化细菌;d):溶磷菌。 Note: a): Cellulolytic bacteria; b): Ammoniating bacteria; c): Nitrifying bacteria; d): Phosphorus solubilizing bacteria. 图 4 土壤微生物功能群数量季节变化(以1990年建植油蒿样地为例) Fig. 4 Seasonal variation of the numbers of soil microbial functional groups(taking the planting A. ordosica plot in 1990 as an example) |
对土壤理化性质和微生物功能群数量的冗余分析(RDA)表明,土壤理化性质对微生物功能群数量总变异解释率为75.7%,其中TN解释率最高,高达66.1%(P < 0.01),AP解释率为3.6%(P < 0.01)。轴Ⅰ和轴II的解释率为73.4%和1.84%,分别占拟合变异累积解释率的97.0%和99.5%。前两个轴解释了土壤微生物功能群的主要变异来源,能较好地反映土壤微生物与理化性质间的关系。此外,纤维素分解菌、氨化细菌、硝化细菌、溶磷菌与土壤SOC、TN、TC、TP、AN、AP、EC均呈正相关,而与pH显著负相关(图 5)。将TN和AP两个极显著因素与微生物功能群数量函数拟合发现,TN与纤维素分解菌和溶磷菌呈线性变化,与氨化细菌和硝化细菌变化对数函数拟合最优;AP与四种菌均呈对数函数变化(图 6)。

|
图 5 土壤微生功能群数量和土壤理化性质的冗余分析排序图(RDA排序图确定了土壤微生物功能群(虚线)和土壤理化性质(实线)之间的关系) Fig. 5 Redundancy analysis ordination diagram of soil microbial functional groups and physicochemical properties(Ordination plots of the results from the RDA identify the relationships among the soil microbial functional groups(dashed lines)and soil physicochemical characters(solid lines) |
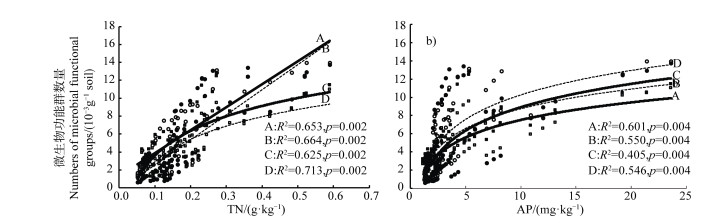
|
注A:纤维素分解菌;B:氨化细菌;C:硝化细菌;D:溶磷菌。 Note: A: Cellulolytic bacteria; B: Ammoniating bacteria; C: Nitrifying bacteria; D: Phosphorus solubilizing bacteria. 图 6 土壤微生物功能群数量与全氮(TN)和有效磷(AP)的关系 Fig. 6 The relationships between the number of soil microbial functional groups with TN and AP |
土壤微生物动态变化近年来倍受学者关注,人工植被恢复过程中土壤微生物动态变化的研究主要集中在热带、亚热带和温带地区的阔叶林以及部分地区的针叶林[17-18],而干旱沙区开展的研究相对较少。本研究通过对干旱沙区人工固沙植被演替过程中与碳、氮、磷元素循环密切相关的功能群微生物时空变化规律及土壤恢复特征的研究,发现随固沙年限增加,各微生物功能群数量显著增加,这与其他学者研究结果[19]一致。原因是流动沙丘土壤贫瘠、生产力低,限制了微生物的发育,而在固沙植被建立后,随着植被恢复年限增长,归还土壤的凋落物增加、植物根系的分泌物增多、土壤细粒物质含量增多、土壤养分增加,共同促使微生物量逐渐增加[20]。此外,本研究还表明表层土壤(0~5 cm)较亚表层(5~10和10~20 cm)具有较高的微生物数量(图 3)。这可能由多种原因引起的,与土壤质地及土地利用方式有关。本研究中,土层间氧气浓度的差异是非常重要的原因,表层氧气充足,有利于微生物活动[14]。其次,由于本研究区处于干旱沙区,土壤以流沙为主,且0~30 cm深度土壤含水率极低,植被分布稀疏,地下生物量极其匮乏,土壤中腐殖质含量远远不够,人工植被建立后,小画眉草等草本及隐花植物的定居,改变了表层地下生物量和凋落物质量的输入[18]。此外,深层土壤较低的含水量和孔隙率,不利于土壤中的离子交换,阻碍了养分的扩散,进而影响土壤微生物的生长和分布。因此,养分资源匮乏及腐殖质的分解受限是造成不同土层微生物数量差异的主要原因。这一结果与其他研究者在干旱沙区的研究结果一致[21]。
植被作为土壤微生物营养物质与能量的重要来源,对微生物群落有重要影响。本研究发现,柠条和油蒿灌丛下微生物功能群落含量均高于灌丛间(图 2c)和图 2d))。一方面,灌丛下凋落物的输入量高于灌丛间;另一方面,植被灌丛下较灌丛间根系发达[12]。此外,本研究还发现固沙植物种影响微生物功能群数量,即以油蒿和柠条为优势种的群落微生物功能群数量存在差异。相同恢复年限,多年生灌木柠条和寿命较短的半灌木油蒿微生物功能群变化规律不同。本研究表明:在植被恢复前期(7年左右)油蒿更利于氮元素循环的微生物(氨化细菌和硝化细菌数量)的恢复,而植被恢复后期(27年左右)柠条更有利于对碳元素循环的微生物纤维素分解菌的改善(图 2a)和图 2b))。这可能是由于多年生柠条的形态结构、根系质量和地上生物量特征(如木质素与纤维素的比例更高)相对于寿命较短的半灌木油蒿不同,即植被的形态及更新周期对土壤恢复状况影响不同[22]。综上,植被类型、生理特性及人为管理均对土壤微生物群落和土壤恢复有重要影响[23]。因此,在干旱沙区土壤恢复过程中必须考虑物种选择和配置方式,做到灌木和半灌木搭配,利于土壤生境的恢复。
3.2 土壤微生物功能群季节变化规律土壤微生物对土壤温度、湿度、理化性质等环境因素波动较敏感。因此,土壤微生物功能群数量季节变化与植被类型、气候、土壤理化性质等因子密切相关[24]。本研究表明,碳循环微生物功能群落纤维素分解菌春季含量显著低于其他季节(图 4),这与王贵[25]的研究结果一致。季节性温度及土壤含水量的差异能够使土壤中微生物代谢活动受限。参与氮素循环的氨化和硝化作用的微生物数量的季节变化较碳素循环中纤维素分解菌的数量季节变化更强。氨化和硝化作用从冬、春、夏到秋季表现为逐渐增强的趋势,这与人工卷柏林[26]参与土壤氮循环微生物的季节变化规律一致。冬季较低温度限制了氨化和硝化作用的发生,随着温度升高,氮循环过程活跃。而溶磷菌季节变化规律与草地和森林土壤中磷酸酯酶和磷酸二酯酶活性的较为一致,均表现为冬季最高,秋季到春夏季呈上升趋势。这可能由于溶磷菌和磷酸酯酶具有相似的生物过程或影响因素,生长季植物需要土壤中的有机磷元素,故溶磷菌和磷酸酶作用均是促进土壤中无机磷的矿化[27]。但也有研究表明,在森林土壤中全磷的含量多年来保持相对稳定,根系凋落物的输入对磷元素含量的影响是有限的[28]。因此,对于土壤中指示磷循环微生物功能群的动态变化暂无确定性结论。
3.3 环境因素对土壤微生物功能群的影响土壤微生物群落对环境变化敏感,土壤TN、pH等理化性质是影响土壤微生物多样性及分布的主要因素[29-30]。本研究表明,TN是引起土壤微生物功能群数量变化的关键因子[31],即随TN含量增大,纤维素分解菌和溶磷菌数量逐渐增加,但氨化细菌和硝化细菌数量前期快速繁殖,后期繁殖速度逐渐趋于平稳(图 5),说明植被恢复后期,土壤微生物数量可能受氮素含量的限制。这一发现支持了土壤养分(如TN和SOC含量)是影响土壤细菌等微生物群落的最重要土壤变量的假设[32]。本研究结果也进一步说明,在干旱沙区,随着人工固沙植被的恢复演替,氮元素相对碳元素依旧比较匮乏,而植物的生长和土壤微生物对氮元素的需求更大,说明固沙植被演替后期植物生长和土壤微生物繁衍有可能主要受氮素的限制[19, 33]。但本研究结果与干旱地区森林土壤细菌群落相对丰度的研究结果不同,Zeng等[34]的研究表明,随TN和铵态氮含量的增加细菌相对丰度显著降低,即氮素含量对微生物群落表现出抑制作用,这可能是由于研究区土壤类型及地理跨度的差异造成的。此外,Liu等[35]研究发现年龄较老的森林土壤中,AP含量是影响土壤微生物种群的一个重要环境因子;Cleveland等[36]在热带雨林里也发现AP含量是影响土壤微生物群落结构的主要因子。这与本研究结果一致,土壤AP是微生物功能群数量的极显著因子,且随其呈对数函数变化(图 6a)和图 6b))。综上,由于荒漠沙区氮和磷元素的匮乏,微生物功能群对其变化更加敏感,微生物功能群数量表现为先快速繁殖,后期受氮和磷含量的限制逐渐趋于平稳。
4 结论本研究表明,从长时间尺度上分析指示土壤碳、氮、磷元素循环的微生物功能群数量分布主要受固沙植被建植年代、微生境、土层影响,而短期波动则受季节控制。在恢复初期半灌木油蒿的氮元素循环微生物恢复较快,而后期灌木柠条则对碳元素循环微生物的改善较好。由于沙区土壤中养分匮乏,固沙植被的建植要注重物种合理搭配。因此,固沙植物的物种选取和配置方式对沙区土壤恢复极其重要。此外,土壤理化性质与土壤微生物功能群变化密切相关,其中,TN和AP含量是决定土壤微生物功能群数量的关键因素。由此可以看出,在该生态系统中,氮和磷较碳对土壤微生物功能群数量限制更大,即在干旱沙区植物生长季,固沙植被演替后期植物生长和土壤微生物繁衍有可能主要受氮素的限制。本研究结果为更好地理解干旱沙区植被恢复中微生物与土壤特性的相互作用奠定了基础,并加强了对沙漠化地区土壤碳、氮、磷元素循环的理解。
| [1] |
Matsumoto L S, Martines A M, Avanzi M A, et al. Interactions among functional groups in the cycling of, carbon, nitrogen and phosphorus in the rhizosphere of three successional species of tropical woody trees[J]. Applied Soil Ecology, 2005, 28(1): 57-65. DOI:10.1016/j.apsoil.2004.06.008
(  0) 0) |
| [2] |
Ding L L, Qi B, Shang Z H, et al. Dynamics of different soil microbial physiological groups and their relationship to soil conditions under sub-alpine grasslands vegetation in the eastern-Qilian mountain (In Chinese)[J]. Acta Prataculturae Sinica, 2007, 16(2): 9-18. DOI:10.3321/j.issn:1004-5759.2007.02.002 [丁玲玲, 祁彪, 尚占环, 等. 东祁连山亚高山草地土壤微生物功能群数量动态及其与土壤环境关系[J]. 草业学报, 2007, 16(2): 9-18.]
(  0) 0) |
| [3] |
Zhu Y G, Duan G L, Chen B D, et al. Mineral weathering and element cycling in soil-microorganism-plant system (In Chinese)[J]. Scientia Sinica Terrae, 2014, 44(6): 1107-1116. [朱永官, 段桂兰, 陈保冬, 等. 土壤-微生物-植物系统中矿物风化与元素循环[J]. 中国科学: 地球科学, 2014, 44(6): 1107-1116.]
(  0) 0) |
| [4] |
Xu G H, Zheng H Y. Analytical methods for soil microbiology (In Chinese). Beijing: Agriculture Press, 1986. [许光辉, 郑洪元. 土壤微生物分析方法手册[M]. 北京: 农业出版社, 1986.]
(  0) 0) |
| [5] |
Yang C D, Long R J, Chen X R, et al. Advanced research in soil microbial functional groups (In Chinese)[J]. Chinese Journal of Soil Science, 2008, 39(2): 421-425. DOI:10.3321/j.issn:0564-3945.2008.02.043 [杨成德, 龙瑞军, 陈秀蓉, 等. 土壤微生物功能群及其研究进展[J]. 土壤通报, 2008, 39(2): 421-425.]
(  0) 0) |
| [6] |
Plassart P, Vinceslas M A, Gangneux C, et al. Molecular and functional responses of soil microbial communities under grassland restoration[J]. Agriculture Ecosystems & Environment, 2008, 127: 286-293.
(  0) 0) |
| [7] |
Liu J, Sui Y, Yu Z, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology & Biochemistry, 2014, 70: 113-122.
(  0) 0) |
| [8] |
Wang X B, van Nostrand J D, Deng Y, et al. Scale-dependent effects of climate and geographic distance on bacterial diversity patterns across Northern China's grasslands[J]. FEMS Microbiology Ecology, 2015, 91(12): fiv133.
(  0) 0) |
| [9] |
Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil, 1995, 170(1): 75-86. DOI:10.1007/BF02183056
(  0) 0) |
| [10] |
Yubing L, Lina Z, Zengru W, et al. Changes in functional gene structure and metabolic potential of the microbial community in biological soil crusts along a revegetation chronosequence in the Tengger Desert[J]. Soil Biology & Biochemistry, 2018, 126: 40-48.
(  0) 0) |
| [11] |
Lü X Y, Zhang Z S. Recovery of soil microbe quantities dependent on fine particle contents after establishment of sand-fixing revegetation in desert region (In Chinese)[J]. Journal of Desert Research, 2019, 39(5): 71-79. [吕星宇, 张志山. 固沙植被区土壤质地与土壤微生物数量的关系[J]. 中国沙漠, 2019, 39(5): 71-79.]
(  0) 0) |
| [12] |
Yan X, An H, Liu R T. Effects of desertification on soil physiochemical properties of desert grassland (In Chinese)[J]. Soils, 2019, 51(5): 1006-1012. [阎欣, 安慧, 刘任涛. 荒漠草原沙漠化对土壤物理和化学特性的影响[J]. 土壤, 2019, 51(5): 1006-1012.]
(  0) 0) |
| [13] |
Li J, Tong X, Awasthi M K, et al. Dynamics of soil microbial biomass and enzyme activities along a chronosequence of desertified land revegetation[J]. Ecological Engineering, 2018, 111: 22-30. DOI:10.1016/j.ecoleng.2017.11.006
(  0) 0) |
| [14] |
Li X J, Yang H T, Shi W L, et al. Afforestation with xerophytic shrubs accelerates soil net nitrogen nitrification and mineralization in the Tengger Desert, northern China[J]. Catena, 2018, 169: 11-20. DOI:10.1016/j.catena.2018.05.026
(  0) 0) |
| [15] |
吕星宇. 固沙植被演替进程中土壤微生物功能群和酶活性的生态化学计量研究[D]. 北京: 中国科学院大学, 2019. Lü X Y. Studies on ecological stoichiometry of soil microbial functional community and enzymatic activity during the succession of sand-fixed revegetation in the arid desert[D]. Beijing: University of Chinese Academy of Sciences, 2019. (  0) 0) |
| [16] |
Zhang Y L, Chen L J, Chen X H, et al. Response of soil enzyme activity to long-term restoration of desertified land[J]. Catena, 2015, 133: 64-70. DOI:10.1016/j.catena.2015.04.012
(  0) 0) |
| [17] |
Yang K, Zhu J J, Zhang M, et al. Soil microbial biomass carbon and nitrogen in forest ecosystems of Northeast China: A comparison between natural secondary forest and larch plantation[J]. Journal of Plant Ecology, 2010, 3(3): 175-182. DOI:10.1093/jpe/rtq022
(  0) 0) |
| [18] |
Patel K, Kumar J I N, Kumar R N, et al. Seasonal and temporal variation in soil microbial biomass C, N and P in different types land uses of dry deciduous forest ecosystem of Udaipur, Rajasthan, Western India[J]. Applied Ecology and Environmental Research, 2010, 8(4): 377-390. DOI:10.15666/aeer/0804_377390
(  0) 0) |
| [19] |
Chen H, Zhao X, Chen X, et al. Seasonal changes of soil microbial C, N, P and associated nutrient dynamics in a semiarid grassland of north China[J]. Applied Soil Ecology, 2018, 128: 139-148.
(  0) 0) |
| [20] |
Wang Y W, Luo L, Zhang F, et al. Soil conservation effect of Haloxylon ammodendron bushes in Hexi oasis-desert ecotone (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(3): 749-762. [王彦武, 罗玲, 张峰, 等. 河西绿洲荒漠过渡带梭梭林土壤保育效应[J]. 土壤学报, 2019, 56(3): 749-762.]
(  0) 0) |
| [21] |
Fterich A, Mahdhi M, Mars M. Impact of grazing on soil microbial communities along a chronosequence of Acacia tortilis subsp. raddiana in arid soils in Tunisia[J]. European Journal of Soil Biology, 2012, 50: 56-63. DOI:10.1016/j.ejsobi.2011.12.002
(  0) 0) |
| [22] |
Wang S K, Zuo X A, Zhao X Y, et al. Responses of soil fungal community to the sandy grassland restoration in Horqin Sandy Land, northern China[J]. Environmental Monitoring & Assessment, 2016, 188(1): 21.
(  0) 0) |
| [23] |
Berg G, Smalla K. Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere[J]. FEMS Microbiology Ecology, 2009, 68(1): 1-13. DOI:10.1111/j.1574-6941.2009.00654.x
(  0) 0) |
| [24] |
Wakelin S A, Colloff M J, Harvey P R, et al. The effects of stubble retention and nitrogen application on soil microbial community structure and functional gene abundance under irrigated maize[J]. FEMS Microbiology Ecology, 2007, 59(3): 661-670. DOI:10.1111/j.1574-6941.2006.00235.x
(  0) 0) |
| [25] |
王贵. 植被类型与土壤生化性质及功能细菌的相互关系--以石梅湾海岸青皮林为例[D]. 海口: 海南师范大学, 2013. Wang G. Relationship of vegetation types with soil biochemical properties and functional bacteria in coastal Vatica mangachapoi forest in Shimei bay[D]. Haikou: Hainan Normal University. 2013. (  0) 0) |
| [26] |
Wang Y, Liu X S, Chen F F, et al. Seasonal dynamics of soil microbial biomass C and N of Keteleeria fortunei var. cyclolepis forests with different ages[J]. Journal of Forestry Research, 2020, 31(6): 2377-2384. DOI:10.1007/s11676-019-01058-w
(  0) 0) |
| [27] |
Tate K R, Speir T W, Ross D J, et al. Temporal variations in some plant and soil P pools in two pasture soils of widely different P fertility status[J]. Plant and Soil, 1991, 132(2): 219-232. DOI:10.1007/BF00010403
(  0) 0) |
| [28] |
Chen C R, Condron L M, Davis M R, et al. Seasonal changes in soil phosphorus and associated microbial properties under adjacent grassland and forest in New Zealand[J]. Forest Ecology & Management, 2003, 177(1/3): 539-557.
(  0) 0) |
| [29] |
Zhalnina K, Dias R, de Quadros P D, et al. Soil pH determines microbial diversity and composition in the park grass experiment[J]. Microbial Ecology, 2015, 69(2): 395-406. DOI:10.1007/s00248-014-0530-2
(  0) 0) |
| [30] |
Zhang B B, Wan X H, Yang J Q, et al. Effects of litters different in quality on soil microbial community structure in Cunninghamia lanceolata plantation (In Chinese)[J]. Acta Pedologica Sinica. DOI:10.11766/trxb201912260562 [张冰冰, 万晓华, 杨军钱, 等. 不同凋落物质量对杉木人工林土壤微生物群落结构的影响[J]. 土壤学报.]
(  0) 0) |
| [31] |
Zhu G D, Guo N, Lü G Y, et al. Effects of enclosure on soil physiochemical properties and stable carbon and nitrogen isotopes in Inner Mongolia Desert Steppe (In Chinese)[J]. Soils, 2020, 52(4): 840-845. [朱国栋, 郭娜, 吕广一, 等. 围封对内蒙古荒漠草原土壤理化性质及稳定碳氮同位素的影响[J]. 土壤, 2020, 52(4): 840-845.]
(  0) 0) |
| [32] |
Zeng Q, An S, Liu Y. Soil bacterial community response to vegetation succession after fencing in the grassland of China[J]. Science of the Total Environment, 2017, 609: 2-10. DOI:10.1016/j.scitotenv.2017.07.102
(  0) 0) |
| [33] |
Yang X X, Li M Q, He X D, et al. Relationship between vegetation C, N, P stoichiometry and species diversity in sand land (In Chinese)[J]. Chinese Journal of Applied Ecology, 2018, 29(9): 2819-2824. [杨祥祥, 李梦琦, 何兴东, 等. 沙地植被碳氮磷化学计量特征与物种多样性的关系[J]. 应用生态学报, 2018, 29(9): 2819-2824.]
(  0) 0) |
| [34] |
Zeng Q, An S, Liu Y, et al. Biogeography and the driving factors affecting forest soil bacteria in an arid area[J]. The Science of the Total Environment, 2019, 680: 124-131. DOI:10.1016/j.scitotenv.2019.04.184
(  0) 0) |
| [35] |
Liu L, Gundersen P, Zhang T, et al. Effects of phosphorus addition on soil microbial biomass and community composition in three forest types in tropical China[J]. Soil Biology and Biochemistry, 2012, 44(1): 31-38. DOI:10.1016/j.soilbio.2011.08.017
(  0) 0) |
| [36] |
Cleveland C C, Townsend A R, Schmidt S K. Phosphorus limitation of microbial processes in moist tropical forests: Evidence from short-term laboratory incubations and field studies[J]. Ecosystems, 2002, 5(7): 680-691. DOI:10.1007/s10021-002-0202-9
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


