2. 湖北省农业科学院植保土肥研究所, 武汉 430064
2. Institute of Plant Protection and Soil Fertilizer, Hubei Academy of Agricultural Sciences, Wuhan 430064, China
在经济作物种植区,由于化肥农药的长期过量投入和经济作物单一连作,导致土传病害频发,造成重大的经济损失。土传病害是高强度利用下土壤生物功能退化的重要表现之一[1]。以土传青枯病为例,全国大部分地区均能检测到该病害的致病菌(Ralstonia solanacearum,简称青枯菌),且能够侵害200多种重要的作物[2],被视为最严重的细菌性土传病害[3]。根际是土传病原菌入侵植物的关键位点,病原菌通常利用寄主植物根际丰富的资源大量增殖,进而入侵作物根系[4]。大量研究[4-6]表明,土壤中丰富的微生物,如细菌、真菌、病毒以及一些小型的原生生物等能够有效抑制病害的发生,它们通过竞争、寄生、捕食等多种方式构筑了抵御病原菌入侵植物根系的防线。有益菌芽孢杆菌因其较强的拮抗能力被广泛应用于土传青枯病的防治[7]。但土壤环境复杂多变,温度、湿度、养分等均能够影响有益菌的生防效果,生产上施用单一有益菌的防控效果通常不稳定。有益菌在植物根际稳定定殖是其发挥生防作用的关键,为提高有益菌的生防效率,本研究提出为有益菌提供载体,提高其在根际的定殖能力。
生物质炭作为一种具有吸附性能的多孔性材料,在改善土壤结构、肥力[8]的同时,可为微生物的生长提供营养,是有益菌载体的良好选择。富含碳的生物质在无氧或缺氧条件下经过高温裂解生产出一种高度芳香化、富含碳素的多孔固体颗粒物质,其具有巨大的表面积和多孔结构,能够吸附根系分泌物[9-10]。研究[11-12]表明,生物质炭能够吸附或转移植物根系分泌物中低分子量物质,限制病原菌入侵。另一方面,生物质炭多孔结构能够为细菌的生长和增殖提供合适的栖息地和资源,有利于微生物在生物质炭孔径表面形成生物膜[13],生物质炭还能够显著改变土壤微生物群落的结构和功能[14]。有研究[15]表明,生物质炭能够一定程度上去除连作土壤中的化感物质残留,降低芦苇根腐病的发生;桉树树木和温室有机废料制成的生物质炭能够有效降低黄瓜猝倒病的发生[16]。但以生物质炭作为有益菌载体的研究相对较少,其中的机制也有待进一步研究。本试验以番茄土传青枯病为病理模型,研究玉米秸秆、木块和稻壳3种不同原料制备的生物质炭为载体,对有益菌--解淀粉芽孢杆菌Bacillus amyloliquefaciens T-5防控土传青枯病效果的影响,并从“空间”和“资源”转移的角度,探究生物质炭与有益菌联合抑菌的潜在机制。
1 材料与方法 1.1 供试材料供试菌株:青枯菌,分离自南京市麒麟镇发病番茄根际强致病力的青枯菌QL-Rs1115(简称RS)[17],以及QL-Rs1115的红色荧光蛋白(RFP)标记菌株QL-RFP(简称RS-RFP)[18]。有益菌,分离自发病区的健康番茄根际,具有较强抑菌能力的解淀粉芽孢杆菌Bacillus amyloliquefaciensT-5[19]。
供试生物质炭:裂解温度为400℃,分别为南京勤丰秸秆科技有限公司的玉米秸秆生物质炭(maize straw)、南京林业大学生物与环境学院环境工程系的木块(松木)生物质炭(wood)和稻壳生物质炭(rice husk)。
1.2 生物质炭基础特性检测利用pH计(Sartorius PB-10,Goettingen,德国)对炭水比为1:20(w: v)的生物质炭悬液测定pH。利用比表面积及孔径分析仪(V-Sorb 2008P,金埃谱,北京)测定生物质炭的比表面积。利用亚甲基蓝吸附试验测定生物质炭物理吸附能力[20]。
1.3 盆栽试验方法Micro-Tom番茄种子经表面消毒后,30 ℃催芽两天后播种至育苗盘中。三至四叶期番茄苗移栽至6孔大育苗盘中,每孔大约600 g土,试验设置8个处理:(1)仅接种青枯菌RS;(2)接种青枯菌和有益菌T-5;(3)~(5)接种青枯菌和三种生物质炭;(6)~(8)接种青枯菌和有益菌及三种生物质炭。青枯菌和有益菌接种悬液的制备方法:利用牛肉膏蛋白胨(NA)培养基活化青枯菌RS和有益菌T-5,获得单菌落转接至NA液体培养基,30 ℃,170 r·min-1培养24 h。将新鲜菌液6 000 r·min-1常温离心5 min,收集菌体,利用生理盐水(9.5 g·kg-1 NaCl)重悬并调节OD600=1.0。有益菌与生物质炭混合悬液的制备方法:生物质炭与有益菌菌液混合,30 ℃、170 r·min-1震荡2 h,使二者充分混匀吸附。移栽一周后,按照不同处理以灌根方式接种有益菌、生物质炭及其混合悬液,其中有益菌的接种量为107 CFU·g-1土,生物质炭的接种量为10 g·kg-1(w: w,生物质炭:土壤)。接种有益菌和生物质炭一周后接种青枯菌RS菌液(108 CFU·g-1土)。每个处理3个6孔育苗盘(3个重复),共18株番茄。所有的盆钵定期随机移动位置,减少误差。温室的温度白天22~32 ℃,夜间20~25 ℃。5周后番茄发病率趋于稳定,统计植株的发病情况。从各处理的每个重复中随机取一株健康植株,保存根际土壤样品,一部分用来提取土壤DNA,定量青枯菌的数量;一部分土壤样品通过稀释涂布检测有益菌定殖的数量。
根际病原菌和拮抗菌数量的测定:利用MO BIO的强力土壤DNA提取试剂盒(PowerSoil® DNA Isolation Kit)提取根际土壤的DNA,检测DNA浓度和纯度。病原菌数量的测定采用荧光定量PCR的方法,使用SYBR® Premix Ex TaqTM(Takara,宝生物工程有限公司)试剂盒。扩增引物为青枯菌的特异性引物,FliC F:5’-GAACGCCAACGGTGCGAA CT-3’,FliC R:5’-GAACGCCAA CGGTGCGAACT- 3’ [21],浓度为10 pmol·μL−1;定量PCR反应体系为20 μL:SYBR® Premix Ex Taq(2×)10 μL,ROX reference Dye II(50×)0.4 μL,前端引物0.8 μL,末端引物0.8 μL,DNA模板2.0 μL,ddH2O 6 μL;反应步骤为:95℃ 30 s,95℃ 5 s,60℃ 34 s,返回第二步,40个循环;95℃ 30 s。扩增产物特异性表现为单一的熔融峰,且2%凝胶电泳检测仅为一条条带。有益菌数量的测定采用选择性平板稀释涂布法:称取根际土3 g,加27 mL无菌ddH2O,37 ℃、170 r·min-1摇床中震荡2 h,梯度稀释涂布于通用的芽孢杆菌选择性培养基(V8培养基:V8果蔬汁326 mL·L-1,氯化钠33.0 g·L-1,葡萄糖0.8 g·L-1,调节pH至6.0。倒平板前加入放线菌酮45 mg·L-1,多黏菌素22.5 mg·L-1)[22]。37 ℃培养48 h后,统计平板上的菌落数。以不接种有益菌T-5的处理为对照,接种有益菌后根际增加的芽孢杆菌来表征有益菌的定殖数量。
1.4 室内试验方法生物质炭对青枯菌的吸附试验:采用Rivera-Utrilla等[23]报道的方法检测生物质炭对细菌吸附能力。将活化的RS菌液用生理盐水洗涤重悬,调节OD600为0.5(~108 CFU·mL-1)。将0.1 g生物质炭和10 mL RS菌液混合,放置于30 ℃、170 r·min-1摇床中震荡2 h,取出静置15 min,吸取上清液进行稀释,涂布于SMSA培养基(semiselective medium for South Africa,半选择性培养基)[24],以未经生物质炭处理的菌液为对照,30 ℃培养48 h后计数。与对照相比,生物质炭处理后青枯菌的相对减少量用来表征生物质炭吸附青枯菌的能力。
生物质炭对青枯菌的固持作用试验:利用青枯菌对根系分泌物的趋化试验来检验青枯菌逃离生物质炭的能力,从而评估生物质炭固持青枯菌的能力。采用Rudrappa等[25]毛细管实验方法测定青枯菌的趋化能力:将生物质炭和青枯菌菌液按照1:100(w: v,g: mL)比例混合,30 ℃、170 r·min-1震荡2 h。1 mL注射器吸取100 μL模拟根系分泌物培养基(RE培养基)[26],排净气泡;用无菌枪头吸取生物质炭与青枯菌混合悬浊液100 μL,将装有RE培养基的注射器针头从枪头尖端插入,使两者中的液体形成连通,以未经生物质炭处理的青枯菌菌液处理为对照,30 ℃恒温静置2 h后,对注射器内的液体进行稀释涂布,30 ℃培养48 h后统计菌落数量。
生物质炭对根系分泌物的吸附试验:将生物质炭和根系分泌物(RE培养基)按照1:100(w: v)混合,30 ℃、170 r·min-1摇床中震荡2 h,悬液经无菌的0.22 μm水系滤膜过滤获得无菌悬液,作为培养基接种至96孔细胞培养板中(200 μL体系)用于培养青枯菌RS(~106 CFU·mL-1),以未经生物质炭处理的RE培养基为对照,测定36 h群落的OD600值,以各处理中青枯菌的生长间接表征生物质炭对根系分泌物的吸附能力。
有益菌利用根系分泌物对青枯菌的抑制作用试验:含196 μL根系分泌物(RE培养基)的96孔细胞培养板中接种2 μL RS-RFP(~108 CFU·mL-1),2 μL有益菌T-5(~107 CFU·mL-1),30 ℃,170 r·min-1震荡培养,每隔6 h用酶标仪(SpectraMax M5,Molecular Devices,美国)测定群落的荧光值,表征青枯菌的生长情况。30 μL有益菌T-5悬液(~107 CFU·mL-1)接种至含3 mL RE培养基中,30 ℃,170 r·min-1震荡培养,分别在12、24、36和48 h取培养物,12 000 r·min-1常温离心5 min,离心过滤得到无菌发酵液。利用平板对峙法检测该发酵液的抑菌能力。具体做法如下:10 mL RS悬液(~108 CFU·mL-1)与100 mL冷却至50 ℃的NA半固体培养基混合均匀,制备平板,待平板冷却凝固后在中央打孔,添加50 μL有益菌发酵物至孔中,30 ℃培养基培养24 h,测定抑菌圈的大小。
1.5 数据处理试验数据处理使用IBM SPSS Statistics 22统计分析,采用SigmaPlot 12.5作图,并使用邓肯(Duncan’s)新复极差法检验差异显著性(P < 0.05)。
2 结果 2.1 生物质炭的基础特性3种不同来源的生物质炭的pH均大于8,且差异显著(P < 0.001,表 1),其中木块生物质炭(wood)的pH最低,为8.69。比表面积是影响生物质炭吸附能力的重要物理指标之一。3种生物质炭的比表面积存在较大的差异(P < 0.001,表 1),其中木块生物质炭的比表面积显著高于其他2种生物质炭,达到395.9 m2·g-1,玉米秸秆生物质炭的比表面积最低。不同生物质炭对亚甲基蓝溶液的吸附能力存在较大的差异,木块生物质炭在24 h的吸附总量达到116.4 mg·g-1,显著高于其他两种原料的生物质炭(P < 0.001,表 1)。
|
|
表 1 不同生物质炭的理化特性 Table 1 Physiochemical properties of biochar relative to sources |
与对照相比,有益菌或生物质炭单独处理均能够降低青枯病的病情指数(有益菌单独:P=0.004;生物质炭单独:P < 0.001,图 1a))。有益菌与生物质炭配合能够进一步提高有益菌防控青枯病效果,与有益菌单独处理相比平均提高了89.34%。不同生物质炭单独施用时对青枯病病情指数的影响差异显著(P= 0.047),但与有益菌联合后处理间差异不显著。木块生物质炭与有益菌组合表现出协同效应,显著提高了青枯病的防控效率,与木块生物质炭单独处理相比提升了18.61%。

|
注:图a) 和图b)中的虚线表示仅接种青枯菌的病情指数和根际病原菌数量;图a)和图b)中*:P < 0.05;图c)中不同字母表示差异显著(P < 0.05);图例中T:接种有益菌,B:接种生物质炭,BT:接种生物质炭和有益菌。下同。 Note: In Fig. a) and b), dashed lines represent disease index and pathogen density in the control treatment inoculated with Ralstonia solanacearum only, and * denotes P < 0.05;and in Fig c), different letters denote significant difference(P < 0.05);T stands for inoculation of probiotic T-5, B for application biochar and BT for application of biochar and inoculation of probiotic T-5 together. The same below. 图 1 不同生物质炭联合生防细菌处理对青枯病病情指数(a))、根际青枯菌(b))和有益菌(c))定殖的影响 Fig. 1 Effect of combined application of biochar and probiotics on disease index(a)) and population of pathogens(b)) and probiotic colonization(c)) in rhizosphere soil relative to kind of the biochar |
进一步检测番茄根际青枯菌的数量,结果表明,与仅接种青枯菌的对照处理相比,添加有益菌或3种不同来源生物质炭均能降低根际病原菌数量(有益菌单独:P < 0.001;生物质炭单独:P < 0.001,图 1b))。不同生物质炭与有益菌联合时对根际病原菌数量的影响差异显著(P < 0.001,图 1b))。其中木块生物质炭与有益菌联合效果最佳,降低了97.42%的病原菌入侵根际。
生物质炭作为有益菌载体同时添加时,能够显著提高有益菌在根际的定殖(P < 0.001,图 1c))。与直接接种有益菌的处理相比,玉米秸秆和木块生物质炭处理下有益菌定殖量分别提高了5.73倍和5.71倍。
2.3 生物质炭载体与有益菌联合抑制青枯菌的机制利用室内模拟试验探究生物质炭联合有益菌防控青枯病的潜在机制。首先检测不同生物质炭对青枯菌的直接吸附作用,涂布计数结果表明,不同生物质炭对青枯菌的吸附效率平均达到80.42%,处理之间差异显著(P < 0.001,图 2a))。其中,木块生物质炭的效果显著优于玉米秸秆和稻壳生物质炭,对青枯菌的吸附效果最佳,能够吸附88.45 %的青枯菌(图 2a))。
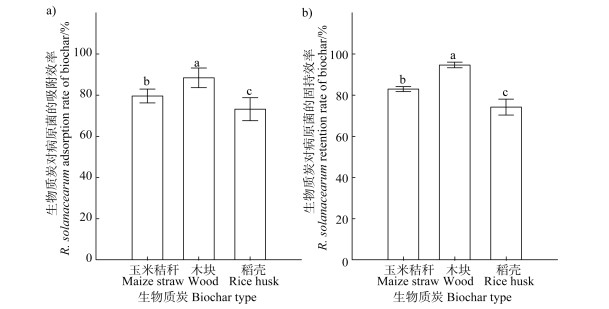
|
图 2 不同生物质炭对青枯菌的吸附(a))和固持(b))能力 Fig. 2 Biochar's R. solanacearum adsorption(a)) and the retention(b)) capacities relative to kind of the biochar |
利用趋化试验检测不同生物质炭对青枯菌的固持作用。不同生物质炭的固持效果差异明显,由高到低依次为:木块生物质炭、玉米秸秆生物质炭、稻壳生物质炭(P < 0.001,图 2b))。木块生物质炭的固持效果显著高于其他两种生物质炭,阻止94.66%的青枯菌逃离生物质炭。
利用不同生物质炭吸附根系分泌物,然后检测青枯菌利用这些根系分泌物的能力,以青枯菌的生长情况间接表征生物质炭对根系分泌物的吸附能力。青枯菌在经生物质炭吸附后的根系分泌物中的生长明显受到抑制,说明根系分泌物中部分有效营养物质被生物质炭吸附,营养供应不足导致青枯菌生长受阻。3种生物质炭中,木块生物质炭和玉米秸秆生物质炭对根系分泌物的吸附显著高于稻壳生物质炭(P < 0.001,图 3a))。

|
注:图b)中R:仅接种青枯菌,RT:接种青枯菌和有益菌;图b)共培养,图c)对峙培养。 Note: In Fig. b) R means inoculation of R. solanacearum only; and RT, inoculation of both R. solanacearum and probiotic T-5;Fig. b) for co-culture and Fig. c) for confrontation culture. 图 3 不同生物质炭对根系分泌物的吸附能力(a))及有益菌利用根系分泌物对青枯菌的抑制作用(b),c)) Fig. 3 Biochar's root exudate adsorption rate(a)) and effect of probiotics utilizing root exudates and inhibiting R. solanacearum(b), c)) |
以上研究说明生物质炭能够有效吸附根系分泌物,进一步分别利用共培养体系和平板对峙的方法,评估有益菌利用根系分泌物对青枯菌的营养和拮抗竞争作用。青枯菌单独培养时生长随时间呈现“S”形,当与有益菌T-5共培养时,青枯菌的生长受到明显抑制(图 3b))且抑菌效果稳定。拮抗竞争的结果表明有益菌以根系分泌物为营养时,能够显著抑制青枯菌的生长,且抑菌效果随着时间逐渐增强,在36 h有益菌产生的抑菌物质活性最高,抑菌圈最大(图 3c))。
3 讨论 3.1 生物质炭载体与有益菌联合能够有效抑制病原青枯菌入侵生物质炭是集肥料、改良剂和吸附剂于一体的多孔性材料,在土传病害的防控中表现出巨大的潜力。本研究提出以生物质炭作为有益菌的载体,充分发挥生物质炭的物理吸附作用和有益菌高效抑菌的优势,减少根际病原菌可利用的资源,增强有益菌根际定殖能力,最终提高有益菌的防控效果。以3种不同原料制备的生物质炭为载体,利用盆栽试验探究生物质炭对有益菌防控番茄土传青枯病效果的影响。结果发现,生物质炭载体与有益菌联合能有效降低青枯病的发病指数和根际病原菌数量(图 1a)和图 1b))。不同生物质炭作为载体对有益菌生防效果的增强作用存在差异,其中木块生物质炭的效果最好。这可能与木块生物质炭具有较大的比表面积和物理吸附能力有关。三种生物质炭中,木块生物质炭的比表面积达到396.9 mm2,吸附能力达到了116.4 mg·g-1,显著优于其他两种生物质炭(表 1)。研究[27-28]表明,生物质炭的物理性质(表面面积和孔结构)和化学性质(表面化学性质)共同决定生物质炭的吸附能力,而生物质炭的吸附能力是其发挥作用的关键。所以,木块生物质炭的大比表面积和强吸附性能一定程度解释木块生物质炭载体联合有益菌对土传青枯病的防控效果最佳。与单独接种有益菌相比,本研究发现,以不同生物质炭为有益菌的接种载体,能够显著提高有益菌在根际的定殖能力(图 1c))。生物质炭的施用可增加土壤的碳储量[8]、土壤的肥力和质量。大量研究[29-30]表明,生物质炭能够通过改变土壤微生物的生境或直接影响微生物的代谢调控根际微生物群落的结构和功能。生物质炭丰富的孔隙结构和巨大的表面积能够为土壤微生物提供庇护所[31];生物质炭颗粒上附着的营养物质可为微生物的生长提供养分[32];生物质炭通过改善微生物生长的土壤特性(包括通气条件、水含量和pH)来改变微生物栖息地[31]等。
3.2 生物质炭载体与有益菌联合抑制病原青枯菌可能的机制本研究发现,生物质炭能够直接吸附青枯菌,吸附效率达到88.45%(图 2a))。但青枯菌处于动态过程,一旦生物质炭内部的营养物质消耗殆尽或外界出现信号物质的诱导,青枯菌随时会逃逸出生物质炭。所以生物质炭不仅需要有效吸附青枯菌,还需有较强的固持能力。前人研究很少同时评估生物质炭的吸附和固持能力,本试验利用离体的趋化性试验,模拟了生物质炭对青枯菌的固持作用,结果发现生物质炭能够有效阻止青枯菌的逃逸,其中生物质炭的固持效果达到94.66%(图 2b))。生物质炭对病原青枯菌的吸附作用除了与其强吸附能力有关,还可能与生物质炭吸附根系分泌物资源、诱导青枯菌进入生物质炭有关。有研究[33]表明,生物炭能够通过吸附根系分泌物而驱动病原菌的趋化作用。植物根系分泌的糖、氨基酸和有机酸等物质是有益菌和病原青枯菌根际营养竞争的核心[9]。除了直接吸附、固持病原菌,本研究还发现3种生物质炭对根系分泌物也有一定的吸附作用(图 3a))。通常,青枯菌和有益菌之间争夺资源的“战场”在根际,但随着生物质炭对根系分泌物、青枯菌和有益菌的吸附作用,“主战场”随之转移至生物质炭内部。前期研究[34]也发现多种不同资源存在时,能够同时促进有益菌T-5的生长和产拮抗物质的能力。共培养和对峙试验均发现,在模拟根系分泌物中,有益菌能够有效利用根系分泌物,抑制青枯菌的生长(图 3b),图 3c))。说明有益菌以生物质炭为载体,能够高效利用根系分泌物资源,产生拮抗物质抑制病原青枯菌的生长。
基于现有的结果,本研究提出生物质炭作为有益菌载体,增强有益菌抵御病原青枯菌入侵番茄根际的潜在机制,如图 4所示:首先,生物质炭吸附根系分泌物和青枯菌,诱导青枯菌离开根表,进入生物质炭孔隙中(过程1);然后,生物质炭内部青枯菌因生物质炭的强吸附能力,固持了青枯菌,降低其逃逸(过程2);最后,生物质炭吸附的有益菌通过竞争根系分泌物资源,减少病原菌资源的可利用性,同时产生大量的抑菌物质,抑制病原菌的生长(过程3)。因为青枯菌与有益菌的互作“战场”转移至生物质炭内部,极大减少直接侵害植物的病原菌数量。本研究中生物质炭虽然不能去除根际土壤中的病原青枯菌,但结合有益菌的抑菌作用,能够有效降低青枯病的发生。下阶段将会进一步从植物根际原位探究生物质炭载体与有益菌联合抑制青枯菌的机制。

|
图 4 有益菌-生物质炭复合抑制青枯菌入侵番茄根系的作用机制 Fig. 4 Mechanism of probiotics- biochar on inhibiting R. solanacearum from invading tomato roots |
不同原料制备的生物质炭作为有益菌的载体,能够有效提高有益菌对番茄土传青枯病的防控效果,青枯病的发病率和根际病原菌数量均有不同程度的下降,其中比表面积大、吸附能力强的木块生物质炭的增效作用最强。进一步研究其中的机制,发现生物质炭作为有益菌的载体能够有效提高有益菌在根际的定殖,同时能够有效吸附和固持病原菌,对根系分泌物也有一定的吸附作用。说明生物质炭可能通过“营养”和“空间”转移作用提高有益菌的生防效率。
| [1] |
Cai Z C, Huang X Q. Soil-borne pathogens should not be ignored by soil science (In Chinese)[J]. Acta Pedologica Sinica, 2016, 53(2): 305-310. [蔡祖聪, 黄新琦. 土壤学不应忽视对作物土传病原微生物的研究[J]. 土壤学报, 2016, 53(2): 305-310.]
(  0) 0) |
| [2] |
Jiang G, Wei Z, Xu J, et al. Bacterial wilt in China: History, current status, and future perspectives[J]. Frontiers in Plant Science, 2017, 8: 1549. DOI:10.3389/fpls.2017.01549
(  0) 0) |
| [3] |
Mansfield J, Genin S, Magori S, et al. Top 10 plant pathogenic bacteria in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(6): 614-629. DOI:10.1111/j.1364-3703.2012.00804.x
(  0) 0) |
| [4] |
Berendsen R L, Pieterse C M J, Bakker P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486. DOI:10.1016/j.tplants.2012.04.001
(  0) 0) |
| [5] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100. DOI:10.1126/science.1203980
(  0) 0) |
| [6] |
Wang X F, Wei Z, Li M, et al. Parasites and competitors suppress bacterial pathogen synergistically due to evolutionary trade-offs[J]. Evolution, 2017, 71(3): 733-746. DOI:10.1111/evo.13143
(  0) 0) |
| [7] |
Ongena M, Jacques P. Bacillus lipopeptides: Versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2008, 16(3): 115-125. DOI:10.1016/j.tim.2007.12.009
(  0) 0) |
| [8] |
Bao J P, Yuan G S, Dong F Y, et al. Effects of biochar application and straw returning on organic carbon fractionations and microbial activities in a red soil (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 721-729. [包建平, 袁根生, 董方圆, 等. 生物质炭与秸秆施用对红壤有机碳组分和微生物活性的影响[J]. 土壤学报, 2020, 57(3): 721-729.]
(  0) 0) |
| [9] |
Bais H P, Prithiviraj B, Jha A K, et al. Mediation of pathogen resistance by exudation of antimicrobials from roots[J]. Nature, 2005, 434(7030): 217-221. DOI:10.1038/nature03356
(  0) 0) |
| [10] |
Callaway R M, Aschehoug E T. Invasive plants versus their new and old neighbors: A mechanism for exotic invasion[J]. Science, 2000, 290(5491): 521-523. DOI:10.1126/science.290.5491.521
(  0) 0) |
| [11] |
Gu Y, Hou Y G, Huang D P, et al. Application of biochar reduces Ralstonia solanacearum infection via effects on pathogen chemotaxis, swarming motility, and root exudate adsorption[J]. Plant and Soil, 2017, 415(1-2): 269-281. DOI:10.1007/s11104-016-3159-8
(  0) 0) |
| [12] |
Masiello C A, Chen Y, Gao X D, et al. Biochar and microbial signaling: Production conditions determine effects on microbial communication[J]. Environmental Science & Technology, 2013, 47(20): 11496-11503.
(  0) 0) |
| [13] |
Gibert O, Lefevre B, Fernández M, et al. Characterising biofilm development on granular activated carbon used for drinking water production[J]. Water Research, 2013, 47(3): 1101-1110. DOI:10.1016/j.watres.2012.11.026
(  0) 0) |
| [14] |
Kolton M, Graber E R, Tsehansky L, et al. Biochar-stimulated plant performance is strongly linked to microbial diversity and metabolic potential in the rhizosphere[J]. New Phytologist, 2017, 213(3): 1393-1404. DOI:10.1111/nph.14253
(  0) 0) |
| [15] |
Elmer W H, Pignatello J J. Effect of biochar amendments on mycorrhizal associations and Fusarium crown and root rot of Asparagus in replant soils[J]. Plant Disease, 2011, 95(8): 960-966. DOI:10.1094/PDIS-10-10-0741
(  0) 0) |
| [16] |
Jaiswal A K, Elad Y, Graber E R, et al. Rhizoctonia solani suppression and plant growth promotion in cucumber as affected by biochar pyrolysis temperature, feedstock and concentration[J]. Soil Biology & Biochemistry, 2014, 69: 110-118.
(  0) 0) |
| [17] |
Wei Z, Yang X M, Yin S X, et al. Efficacy of Bacillus-fortified organic fertiliser in controlling bacterial wilt of tomato in the field[J]. Applied Soil Ecology, 2011, 48(2): 152-159. DOI:10.1016/j.apsoil.2011.03.013
(  0) 0) |
| [18] |
Tan S Y, Gu Y, Yang C L, et al. Bacillus amyloliquefaciens t-5 may prevent Ralstonia solanacearum infection through competitive exclusion[J]. Biology and Fertility of Soils, 2016, 52(3): 341-351. DOI:10.1007/s00374-015-1079-z
(  0) 0) |
| [19] |
Tan S, Jiang Y, Song S, et al. Two Bacillus amyloliquefaciens strains isolated using the competitive tomato root enrichment method and their effects on suppressing Ralstonia solanacearum and promoting tomato plant growth[J]. Crop Protection, 2013, 43: 134-140. DOI:10.1016/j.cropro.2012.08.003
(  0) 0) |
| [20] |
Xu R K, Zhao A Z, Xiao S C, et al. Adsorption of methylene blue from water by the biochars generated from crop residues (In Chinese)[J]. Chinese Journal of Environmental Science, 2012, 33(1): 142-146. DOI:10.3969/j.issn.1000-6923.2012.01.023 [徐仁扣, 赵安珍, 肖双成, 等. 农作物残体制备的生物质炭对水中亚甲基蓝的吸附作用[J]. 环境科学, 2012, 33(1): 142-146.]
(  0) 0) |
| [21] |
Schönfeld J, Heuer H, van Elsas J D, et al. Specific and sensitive detection of Ralstonia solanacearum in soil on the basis of PCR amplification of flic fragments[J]. Applied and Environmental Microbiology, 2003, 69(12): 7248-7256. DOI:10.1128/AEM.69.12.7248-7256.2003
(  0) 0) |
| [22] |
Kinsella K, Schulthess C P, Morris T F, et al. Rapid quantification of Bacillus subtilis antibiotics in the rhizosphere[J]. Soil Biology & Biochemistry, 2009, 41(2): 374-379.
(  0) 0) |
| [23] |
Rivera-Utrilla J, Bautista-Toledo I, Ferro-García M A, et al. Activated carbon surface modifications by adsorption of bacteria and their effect on aqueous lead adsorption[J]. Journal of Chemical Technology and Biotechnology, 2001, 76(12): 1209-1215. DOI:10.1002/jctb.506
(  0) 0) |
| [24] |
Elphinstone J, Hennessy J, Wilson J, et al. Sensitivity of different methods for the detection of Ralstonia solanacearum in potato tuber extracts[J]. EPPO Bulletin, 1996, 26(3/4): 663-678.
(  0) 0) |
| [25] |
Rudrappa T, Czymmek K J, Paré P W, et al. Root-secreted malic acid recruits beneficial soil bacteria[J]. Plant Physiology, 2008, 148(3): 1547-1556. DOI:10.1104/pp.108.127613
(  0) 0) |
| [26] |
Yao J, Allen C. Chemotaxis is required for virulence and competitive fitness of the bacterial wilt pathogen Ralstonia solanacearum[J]. Journal of Bacteriology, 2006, 188(10): 3697-3708. DOI:10.1128/JB.188.10.3697-3708.2006
(  0) 0) |
| [27] |
Fan Y Z, Wang B Z. Surface chemistry of activated carbon (In Chinese)[J]. Coal Conversion, 2000, 23(4): 26-30. DOI:10.3969/j.issn.1004-4248.2000.04.007 [范延臻, 王宝贞. 活性炭表面化学[J]. 煤炭转化, 2000, 23(4): 26-30.]
(  0) 0) |
| [28] |
Meng G H, Li A M, Zhang Q X. Studies on the oxygen-containing groups of activated carbon and their effects on the adsorption character (In Chinese)[J]. Ion Exchange and Adsorption, 2007, 23(1): 88-94. DOI:10.3321/j.issn:1001-5493.2007.01.013 [孟冠华, 李爱民, 张全兴. 活性炭的表面含氧官能团及其对吸附影响的研究进展[J]. 离子交换与吸附, 2007, 23(1): 88-94.]
(  0) 0) |
| [29] |
Zhu X M, Chen B L, Zhu L Z, et al. Effects and mechanisms of biochar-microbe interactions in soil improvement and pollution remediation: A review[J]. Environmental Pollution, 2017, 227: 98-115. DOI:10.1016/j.envpol.2017.04.032
(  0) 0) |
| [30] |
Ma B B, Huang R L, Zhang N, et al. Effect of straw-derived biochar on molecular ecological network between bacterial and fungal communities in rhizosphere soil (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(4): 964-974. [马泊泊, 黄瑞林, 张娜, 等. 秸秆生物质炭对根际土壤细菌-真菌群落分子生态网络的影响[J]. 土壤学报, 2019, 56(4): 964-974.]
(  0) 0) |
| [31] |
Quilliam R S, Glanville H C, Wade S C, et al. Life in the 'charosphere' - Does biochar in agricultural soil provide a significant habitat for microorganisms[J]. Soil Biology & Biochemistry, 2013, 65: 287-293.
(  0) 0) |
| [32] |
Joseph S, Graber E R, Chia C, et al. Shifting paradigms: Development of high-efficiency biochar fertilizers based on nano-structures and soluble components[J]. Carbon Management, 2013, 4(3): 323-343. DOI:10.4155/cmt.13.23
(  0) 0) |
| [33] |
Gu Y, Hou Y, Huang D, et al. Application of biochar reduces Ralstonia solanacearum infection via effects on pathogen chemotaxis, swarming motility, and root exudate adsorption[J]. Plant and Soil, 2017, 415(1/2): 269-281.
(  0) 0) |
| [34] |
Yang C L, Dong Y, Friman V P, et al. Carbon resource richness shapes bacterial competitive interactions by alleviating growth-antibiosis trade-off[J]. Functional Ecology, 2019, 33(5): 868-875. DOI:10.1111/1365-2435.13292
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


