2. 山东省沂南县第三中学,山东临沂 276300
2. The Third Middle School of Yinan, Linyi, Shandong 276300, China
六六六(Hexachlorocyclohexane,HCH;化学式为C6H6Cl6)化学名为六氯环己烷,是一种持久性有机氯杀虫剂(OCPs),1825年由Michael Faladay首先合成,因其廉价、广谱、长效和出色杀虫效果等优点,20世纪后半叶被广泛用作商业杀虫剂,在防治病虫害、发展农业生产中发挥了重要作用[1-3]。商品化六六六产品中α、β、γ、δ-HCH异构体为主要成分,分别占60%~70%、5%~12%、10%~12%、6%~10%[4]。γ-HCH又称为林丹,仅有林丹具有杀虫效力,因此HCH生物活性主要取决于γ-HCH的含量[5]。HCH在高温、日光、酸性条件下均较稳定,碱性条件下容易脱氯,其中β-HCH降解最慢、半衰期长,加上各异构体之间生物转化,导致HCH持久积累,在环境中长期存留[6]。虽然我国在20世纪80年代已禁用HCH,但由于其在我国有长期生产和使用历史,其残留时间长且毒性高,目前一些土壤环境中仍有较高HCH残留[7-8]。2014年《全国土壤污染状况调查公报》[9]中指出,我国土壤中HCH点位超标率为0.5%。
进入土壤中的HCH对土壤细菌群落数量和多样性产生影响,从而间接地影响土壤中各种生物化学过程[10]。不同细菌群落对HCH耐受性不同,一些敏感性菌群会受到不同程度抑制[11]。有研究显示,γ-HCH对土壤中淀粉分解菌具有抑制作用[12]。在γ-HCH污染的芦苇根际土壤中,发现α、β和γ变形杆菌数量较多,而Arcicella、Hevizibacter(肝杆菌)和Flavobacterium(黄杆菌属)则对γ-HCH较敏感[13]。即使在推荐剂量下,HCH还是会抑制甲烷氧化作用[14]。借助甲烷氧化测定法和PCR-DGGE(变性梯度凝胶电泳)技术评估HCH对土壤中甲烷营养菌群落的影响,发现I型甲烷营养菌群落分布不均匀,且仅有γ和δ异构体对其有抑制作用[15]。有研究发现,向土壤中加入HCH异构体混合物后,土壤微生物生物量增加[16]。Viñas等[17]证明,施加了OCPs的土壤中参与OCPs降解的细菌丰度升高。HCH本身也能为土壤细菌提供碳源,刺激Sphingomonas(鞘氨醇单胞菌)等细菌群落生长。这表明有机氯农药能够影响微生物菌群,反之菌群也能够加速农药降解。然而,以往研究中仅考虑了HCH自身对细菌群落的影响,大多忽略了土壤理化性质等因素的作用。在各种环境变量中,土壤类型也影响细菌群落的多样性及组成,不同理化性质土壤的细菌群落对农药响应应该存在差异[18-20]。
为了研究不同类型土壤中HCH对细菌群落的影响,本文采用小麦盆栽试验,结合高通量测序技术,探讨了红壤和紫色土细菌群落对HCH污染的响应,试图明确HCH对土壤微生态系统的影响,并为土壤环境安全评价提供参考。
1 材料与方法 1.1 供试材料供试红壤采集于江西鹰潭市中国科学院红壤生态试验站周围农田,紫色土采自四川盐亭县中国科学院盐亭紫色土生态试验站,红壤和紫色土的基本理化性质见表 1。
|
|
表 1 供试土壤的基本理化性质 Table 1 Some physicochemical properties of the test soils |
小麦(徐麦856)种子购于江苏省农业科学院,HCH混合异构体标准品(纯度99%)购于Dr. Ehrensorfer公司,异构体α-HCH、β-HCH、γ-HCH、δ-HCH、ε-HCH含量分别为70 g·kg-1、7 g·kg-1、14 g·kg-1、7 g·kg-1、1 g·kg-1。
1.2 盆栽试验设计在温室中进行盆栽试验。将采集的新鲜红壤和紫色土去除石块等杂物后,装入直径和高度分别为20 cm和30 cm的陶瓷花盆中,每盆装土8 kg,同时一次性施入10 g氮磷钾复合肥作为基肥。一周后,将小麦种子播种于盆中,进行正常水肥管理,待小麦生长至分蘖期时施药,用喷壶将HCH溶液均匀喷洒于土壤表层。本试验设置了3个HCH浓度处理,分别为不施加HCH对照(C)、600 g·hm-2 HCH处理(M)、1 500 g·hm-2 HCH处理(H),每个处理3次重复。采用五点采样法,分别在施药后第1、7、42天采集各盆中表层土壤,将每盆中采集的土壤剔除植物残体和石块后混合,作为一个样品。将所有采集的土壤鲜样放置-80℃冰箱保存。
1.3 土壤DNA提取与测序土壤样品全基因组的提取采用MOBIO公司的PowerSoil DNA Isolation Kit试剂盒。通过1%琼脂糖凝胶电泳检测DNA质量,按表 2进行PCR扩增,检查样品的提取效果。引物选取341F(5’-CCTACGG GAGGCAGCAG-3’)、518R(5’-ATTACCGCGGCTG CTGG-3’)。
|
|
表 2 16S rDNA PCR反应条件 Table 2 16S rDNA PCR reaction conditions |
对DNA样品进行高通量测序,对细菌16S V3~V4区域进行扩增,引物选取341F(5’-CCTACGGGA GGCAGCAG-3’)和805R(5’-GACTACHVGGGT ATCTAATCC-3’)。
对所有样品的有效序列进行聚类,将这些序列按照97%相似性聚类为OTUs(操作分类单元,operational taxonomic units)。采用Excel 2013和SPSS 22.0、Origin 2017和测序数据处理平台进行数据处理及相关图表绘制,其他部分则采用单因素方差分析进行显著性分析,显著性水平为P < 0.05。
2 结果 2.1 土壤细菌群落Alpha多样性通过16S rRNA测序数据计算出Chao1和香农(Shannon)指数,以此进行群落结构Alpha多样性分析[21]。Chao1指数用于估计样品中物种丰富度,数值越大表示细菌群落丰富度越高。香农指数综合反映样品物种多样性,数值越大表示细菌群落多样性越高。覆盖率(Coverage)主要反映测序结果对某些低丰度OTUs的覆盖。本次测序样本覆盖率均在99%以上,表明测序结果反映了各个处理土壤细菌群落真实情况。
红壤和紫色土细菌群落的Chao1和香农指数见表 3。添加HCH后,红壤中两种指数显著增加,表明其细菌群落多样性升高,且HCH施用浓度越高,变化越大。HCH对紫色土细菌群落多样性的影响不显著。高通量测序发现紫色土Chao1指数均大于红壤,表明紫色土中细菌群落丰富度高于红壤。细菌群落丰富度越高,抵抗微生态环境变化能力越强,这可能是HCH对紫色土细菌群落多样性影响较小的主要原因。
|
|
表 3 六六六处理下土壤中细菌群落丰富度及多样性指数 Table 3 Richness and diversity indices of the bacterial communities in the soils spiked with HCH |
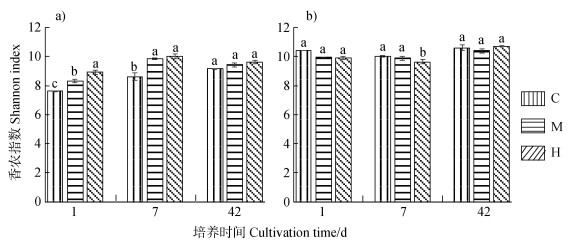
HCH对红壤细菌群落多样性的影响与残留时间密切相关。由图 1a)看出,处理前期HCH作用下红壤细菌群落多样性指数显著提高。第1天时,对照组香农指数为7.62,600和1 500 g·hm-2 HCH处理组则分别为8.31和8.93,不同处理组间差异显著,表明高浓度HCH促使红壤细菌群落多样性提高。推测某些细菌群落会利用该农药为碳源,从而刺激生长。第7天时,各处理组细菌群落多样性最高,1 500 g·hm-2处理组香农指数为10.03。随着培养时间延长,HCH对细菌群落的影响逐渐减弱,第42天时,各处理组基本恢复至对照水平。红壤样品Chao1指数为1 088~2 146,且随HCH处理浓度增大而提高,表明HCH可提高红壤细菌群落丰富度。
|
注:C:对照组,M:600 g·hm-2六六六处理,H:1500 g·hm-2六六六处理。图中不同小字母表示同一时间不同处理间显著性差异(P < 0.05)。下同。 C: control, M: 600 g·hm-2, H: 1500 g·hm-2. Different letters meant significant differences at 0.05 level between different treatments. The same below. 图 1 六六六处理下土壤细菌香农指数变化(a)红壤,b)紫色土) Fig. 1 Changes in Shannon index of the bacteria in the soils spiked with HCH, (a)Red soil and b)Purple soil) |
与红壤相比,紫色土中细菌群落多样性受HCH影响不显著(图 1b))。第1天时,CK处理、600 g·hm-2处理、1 500 g·hm-2处理的土壤香农指数分别为10.41、9.98和9.89,之间差异不显著。仅在第7天时,1 500 g·hm-2处理组细菌群落多样性受到显著抑制,香农指数为9.64。然而第42天时其细菌群落多样性又完全恢复至CK水平。紫色土样品Chao1指数为2 377~3 052,远大于红壤,表明其细菌群落丰富度高于红壤。丰富度越大,土壤细菌群落自身的调节能力越强,这可能也是HCH对紫色土细菌群落影响较小的主要原因。
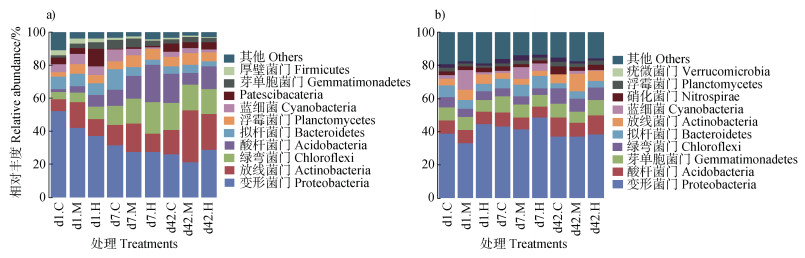
2.2 土壤细菌群落结构组成土壤细菌群落结构分析结果如图 2所示。HCH对红壤细菌群落组成结构的影响大于紫色土。HCH降低了红壤中变形菌门(Proteobacteria)相对丰度,显著提高了绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)的相对丰度和放线菌门(Actinobacteria)、酸杆菌门的多样性。处理前期,高浓度HCH处理组显著提高了紫色土中变形菌门的相对丰度,但降低了酸杆菌门、拟杆菌门、绿弯菌门的相对丰度。
|
图 2 六六六处理下土壤细菌群落组成(a)红壤,b)紫色土) Fig. 2 Community composition of the bacteria in the soils spiked with HCH(a)Red soil and b)Purple soil) |
第1天时,与对照相比,600 g·hm-2和1 500 g·hm-2 HCH处理的土壤中变形菌门相对丰度分别下降了13.88%和19.63%,呈现出随HCH处理浓度增大相对丰度降低的趋势。随着培养时间延长,这种差异逐渐减小;第42天时,1 500 g·hm-2处理组的相对丰度已超过对照水平。由图 3可见,HCH对红壤酸杆菌门、绿弯菌门的相对丰度有显著影响。第7天时,与对照相比,600和1 500 g·hm-2处理组红壤放线菌门相对丰度增加了3.69%和10.98%,绿弯菌门相对丰度增加了2.78%和6.23%。第1天时,对照、600和1 500 g·hm-2处理组中放线菌门的OTUs数目分别为106、190和179,酸杆菌门OTUs数目分别为37、40和90,表明HCH提高了放线菌门、酸杆菌门的多样性,这可能是红壤中细菌群落多样性提高的主要原因。

|
图 3 第7天时红壤优势菌门相对丰度随处理浓度的变化 Fig. 3 Changes in abundance of the dominant bacteria in the red soil spiked with HCH at Day 7 |
与红壤不同,高浓度HCH促使紫色土变形菌门相对丰度升高。由图 4可见,第7天时,与对照相比,1 500 g·hm-2处理组变形菌门相对丰度显著增大了5.53%;第42天时,两个HCH处理组基本恢复至对照水平。处理前期,HCH降低了紫色土酸杆菌门、绿弯菌门、拟杆菌门的相对丰度。第1天时,600和1 500 g·hm-2处理组酸杆菌门相对丰度较对照下降了0.25%和0.47%,绿弯菌门相对丰度下降0.98%和0.71%,拟杆菌门下降1.84%和2.69%;但第7天时均有所恢复。

|
图 4 第7天时紫色土优势菌门相对丰度随处理浓度的变化 Fig. 4 Changes in abundance of the dominant bacteria in the purple soil spiked with HCH at Day 7 |
HCH处理下两种土壤中变形菌门丰度最高。红壤优势菌门为变形菌门和放线菌门,HCH提高了放线菌门、酸杆菌门的多样性。紫色土优势菌门为变形菌门、酸杆菌门,与红壤相比,处理前期HCH降低了紫色土酸杆菌门、拟杆菌门、绿弯菌门的相对丰度。
两种土壤中细菌前100优势菌属的相对丰度与HCH浓度间存在相关性。红壤中来自绿弯菌门的KD4-96_unclassified、变形菌门的Elsterales_ unclassified相对丰度与HCH浓度呈极显著正相关(P < 0.01),HCH加强了菌属所在生态位中同其他菌株的竞争,推测这两种菌属对HCH具有耐受性。紫色土中Steroidobacteraceae_unclassified、Defluviicoccus相对丰度与HCH浓度呈显著负相关,拟杆菌门的Flavihumibacter相对丰度与HCH浓度呈显著性正相关。
2.3 土壤中固氮菌丰度变化红壤中,高浓度HCH处理的土壤中慢生根瘤菌属(Bradyrhizbium)相对丰度显著增加。紫色土中固氮菌种类和相对丰度大于红壤,厌氧杆菌(Anaeromyxobacter)、地杆菌属(Geobacter)、脱硫球菌菌属(Desulfuromonas)受到HCH抑制,相对丰度均下降,且施药浓度越高,抑制作用越大。
红壤中检测到3种丰度较高的固氮菌。结果显示,HCH可提高Geobacter、Bradyrhizbium的相对丰度。由图 5看出,Geobacter、Bradyrhizbium相对丰度随施药浓度增大而提高;第7天时,1 500 g·hm-2处理组的Geobacter相对丰度较对照上升了0.05%,600和1 500 g·hm-2处理组中Bradyrhizbium相对丰度较对照提高0.15%和0.18%。表明HCH能促进这两种固氮菌的生长。第42天时,固氮菌总相对丰度有所下降,但总体水平仍高于对照组。

|
图 5 六六六处理下土壤中固氮菌丰度图(a)红壤,b)紫色土) Fig. 5 Abundance map of nitrogen-fixing bacteria in the soils spiked with HCH(a)Red soil and b)Purple soil) |
|
|
表 4 六六六浓度与土壤优势菌属间的相关性 Table 4 Correlation between HCH concentration and dominant genera of bacteria in the soils |
供试污染强度下,HCH降低了紫色土中Anaeromyxobacter、Geobacter、Desulfuromonas的相对丰度。紫色土中检测到6种丰度较高的固氮菌,分别为Anaeromyxobacter、Geobacter、Desulfuromonas、固氮菌属(Azotobacter)、Sideroxydans、Bradyrhizobium。培养第7天,1 500 g·hm-2 HCH处理下Anaeromyxobacter相对丰度较对照下降0.21%,Geobacter相对丰度下降0.28%,Desulfuromonas相对丰度下降0.03%;施药浓度越大,抑制作用越强。培养至第42天,各处理组固氮菌丰度较第7天时均有所恢复。
3 讨论 3.1 六六六对红壤细菌群落的影响土壤细菌群落多样性是指菌群在数量和相对丰富度方面的复杂变异程度,是土壤生态机制和土壤胁迫影响细菌群落的内在表现[22-23]。农药对微生物生长的影响大致分为两种情况:一是抑制微生物生长,二是作为碳源被微生物利用。本试验中,HCH对红壤细菌群落多样性有促进作用。据报道,放线菌在红壤中丰度高,作为土壤优势菌群,可产生胞外水解酶,降解各种不溶性有机物质从而获得代谢所需营养,对有机物矿化起重要作用[24]。已有研究证实,放线菌可利用难降解有机物生长,如链霉菌(Streptomyces)是有机氯农药的主要降解菌,能利用林丹作为碳源并促进自身生长,使其在污染土壤中成为优势种群[25]。汪小勇[26]发现,HCH可促进土壤中放线菌数量增长。因此,农药污染可促使细菌群落向着降解或耐受农药的方向转化,减少了与敏感菌群的空间竞争,导致本研究中可降解HCH的菌群优势度增加。此外,在HCH作用下,优势菌绿弯菌门和酸杆菌门的相对丰度显著增加。张红等[27]研究发现,在施加少量HCH(0.5~1.5 mg·kg-1)的土壤中,菌群利用碳源的能力高于空白土样,细菌群落代谢加强、数量增加。郑丽萍等[28]分析了有机氯农药污染土壤的细菌群落结构,证实低负荷有机氯农药污染对土壤菌群生理活性有促进作用,高水平的(451.5 mg·kg-1)有机氯农药污染能显著抑制土壤微生物活性,抑制微生物对碳源的利用。因此,较低负荷HCH等农药污染可刺激土壤细菌群落生长,增加土壤微生物的整体活性。
固氮主要依靠土壤中固氮微生物群落来完成[29]。受HCH影响最大的是慢生根瘤菌,其相对丰度提高了一倍多,这可加快土壤氮素转化,促进作物生长。丁柳屹[30]在研究γ-HCH对土壤中固氮菌影响时也发现,γ-HCH可导致慢生根瘤菌丰度升高。
3.2 六六六对紫色土细菌群落的影响培养前期,紫色土中变形菌门相对丰度显著提高。据报道,变形菌门是五氯苯酚(PCP)降解过程的主要细菌门类,参与土壤中PCP降解,主要降解菌属有黄单胞菌属(Xanthomonadaceae)和伯克氏菌属(Burkholderiaceae)等[31]。华健等[32]研究表明,与对照组相比,添加一定浓度PCP在4~17 d可提高土壤中Proteobacteria(变形菌)的相对丰度。因此,细菌结构的动态变化伴随着农药生物降解过程,大量参与降解的微生物丰度得以提高。
土壤理化性质与细菌群落的变化具有相关性。本试验中,紫色土细菌群落变化不明显(图 2),推测可能原因是紫色土呈微碱性,细菌群落多样性高于红壤,群落关系复杂,抵抗环境变化的能力较强。此外,拟杆菌门的Flavihumibacter相对丰度与HCH浓度呈显著正相关,可能受农药刺激后,菌株变异、耐受力增强,但是否为HCH耐受菌或降解菌,仍有待验证。本研究发现,紫色土中硝化螺旋菌门(Nitrospirae)相对丰度高于红壤(图 2),主要与土壤pH有关。微碱性的紫色土中Nitrospirae百分比高于酸性土,随pH升高,紫色土中硝化作用增强[33-34]。硝化作用增强会使土壤中硝酸盐含量增加,对植物生长提供氮素养料有重要意义。此外,紫色土中厌氧杆菌属(Anaeromyxobacter)、地杆菌属(Geobacter)、脱硫球菌属(Desulfuromonas)对HCH较为敏感,而固氮菌属(Azotobacter)受HCH影响不明显,其耐受性较强。有报道表明,浓度在2.0~15.0 kg·hm-2时,γ-HCH对固氮菌属数量并无显著影响,浓度为3.5~15.0 kg·hm-2时,γ-HCH能显著降低硝化细菌数量,影响土壤氮循环[35]。HCH浓度为250 mg·kg-1时,共生固氮菌根瘤菌(Rhizobium)数量下降约40%,影响固氮效果[36]。HCH会降低联合固氮菌Azospirillum(固氮螺菌)的固氮酶和吸氢酶活性,这可能与HCH含氯有关[37]。HCH对土壤中不同固氮细菌的影响存在差异。大多数农药在田间推荐施用剂量下,不会影响细菌固氮作用;超过田间推荐用量,则会降低固氮菌活性和数量,影响土壤氮素转化,进而影响作物生长,给农业生产带来负面影响。
总体而言,HCH对红壤微生态环境的影响相对较大。本文研究结果为明确HCH污染土壤的微生态效应提供了理论依据。但本文仅借助高通量测序手段明确了HCH对细菌群落的影响,而HCH改变关键菌群的机制仍不清楚,因此土壤HCH污染水平及环境因子对菌群的调控机理仍待进一步研究。
4 结论六六六(HCH)能够影响土壤细菌群落多样性及结构,总体表现为对红壤细菌群落的影响要强于紫色土。HCH作用下,红壤细菌群落多样性提高,引起细菌群落结构组成变化,且HCH浓度越高,红壤细菌群落结构与不施加HCH对照组差异越大。在盆栽实验后期,随着HCH降解,这种影响逐渐消失。紫色土细菌群落丰富度远大于红壤,HCH胁迫下紫色土细菌群落多样性和组成结构较为稳定。HCH对红壤和紫色土中固氮细菌的影响也不同,HCH污染导致红壤中固氮细菌丰度上升,而紫色土中则呈现下降趋势。
| [1] |
Bai Q Y. The isomerization of hexachlorocyclohexane in the environment (In Chinese)[J]. Journal of Agro-Environment Science, 1983, 3(2): 20-22. [白清云. 六六六在环境中的异构化作用[J]. 农业环境科学学报, 1983, 3(2): 20-22.]
(  0) 0) |
| [2] |
Phillips T M, Seech A G, Lee H, et al. Biodegradation of hexachlorocyclohexane (HCH) by microorganisms[J]. Biodegradation, 2005, 16(4): 363-392. DOI:10.1007/s10532-004-2413-6
(  0) 0) |
| [3] |
Quintero J C, Moreira M T, Feijoo G, et al. Screening of white rot fungal species for their capacity to degrade lindane and other isomers of hexachlorocyclohexane (HCH)[J]. Ciencia e Investigación Agraria, 2008, 35(2): 159-167. DOI:10.4067/s0718-16202008000200005
(  0) 0) |
| [4] |
Lal R, Pandey G, Sharma P, et al. Biochemistry of microbial degradation of hexachlorocyclohexane and prospects for bioremediation[J]. Microbiology and Molecular Biology Reviews, 2010, 74(1): 58-80. DOI:10.1128/MMBR.00029-09
(  0) 0) |
| [5] |
Byzov B A, Tretyakova E B, Zvyagintsev D G, et al. Effects of soil invertebrates on the survival of some genetically engineered bacteria in leaf litter and soil[J]. Biology and Fertility of Soils, 1996, 23(3): 221-228. DOI:10.1007/BF00335948
(  0) 0) |
| [6] |
于军强. 花生及土壤中丁酰肼、六六六、乙草胺及其代谢产物的测定与研究[D]. 济南: 山东大学, 2008. Yu J Q. Determination and research on daminozide, hexachlorocyclohexane, acetochlor and their metabolites in peanuts and soil[D]. Jinan: Shandong University, 2008. (  0) 0) |
| [7] |
Zhao L, Teng Y, Luo Y M. Status of organochlorine pesticide contaminated sites in China and advances in site remediation (In Chinese)[J]. Soils, 2018, 50(3): 435-445. [赵玲, 滕应, 骆永明. 我国有机氯农药场地污染现状与修复技术研究进展[J]. 土壤, 2018, 50(3): 435-445.]
(  0) 0) |
| [8] |
Vijgen J, Abhilash P C, Li Y F, et al. Hexachlorocyclohexane (HCH) as new Stockholm Convention POPs-A global perspective on the management of Lindane and its waste isomers[J]. Environmental Science and Pollution Research, 2011, 18(2): 152-162. DOI:10.1007/s11356-010-0417-9
(  0) 0) |
| [9] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[R]. 2014-04-17]. http://www.mee.gov.cn/gkml/sthjbgw/qt/201404/t20140417_270670.htm. Ministry of Environmental Protection, Ministry of Land and Resources of the People's Republic of China. Report on the national general survey of soil contamination[R]. 2014-04-17]. http://www.mee.gov.cn/gkml/sthjbgw/qt/201404/t20140417_270670.htm. (  0) 0) |
| [10] |
Johnsen K, Jacobsen C S, Torsvik V, et al. Pesticide effects on bacterial diversity in agricultural soils-A review[J]. Biology and Fertility of Soils, 2001, 33(6): 443-453. DOI:10.1007/s003740100351
(  0) 0) |
| [11] |
Dadhwal M, Singh A, Prakash O, et al. Proposal of biostimulation for hexachlorocyclohexane (HCH)-decontamination and characterization of culturable bacterial community from high-dose point HCH-contaminated soils[J]. Journal of Applied Microbiology, 2009, 106(2): 381-392. DOI:10.1111/j.1365-2672.2008.03982.x
(  0) 0) |
| [12] |
Zargar M Y, Johri B N. Effect of Gamma-hexachiorocyclohexane on amylolytic microorganisms of soil and amylase activity[J]. Bulletin of Environmental Contamination and Toxicology, 1995, 55(3): 426-430.
(  0) 0) |
| [13] |
San Miguel A, Roy J, Gury J, et al. Effects of organochlorines on microbial diversity and community structure in Phragmites australis rhizosphere[J]. Applied Microbiology and Biotechnology, 2014, 98(9): 4257-4266. DOI:10.1007/s00253-014-5545-6
(  0) 0) |
| [14] |
Kumaraswamy S, Rath A K, Bharati K, et al. Influence of pesticides on methane oxidation in a flooded tropical rice soil[J]. Bulletin of Environmental Contamination and Toxicology, 1997, 59(2): 222-229. DOI:10.1007/s001289900468
(  0) 0) |
| [15] |
Mertens B, Boon N, Verstraete W. Stereospecific effect of hexachlorocyclohexane on activity and structure of soil methanotrophic communities[J]. Environmental Microbiology, 2005, 7(5): 660-669. DOI:10.1111/j.1462-2920.2005.00735.x
(  0) 0) |
| [16] |
Rath A K, Ramakrishnan B, Rath A K, et al. Effect of pesticides on microbial biomass of flooded soil[J]. Chemosphere, 1998, 37(4): 661-671. DOI:10.1016/S0045-6535(98)00082-4
(  0) 0) |
| [17] |
Viñas M, Sabaté J, Espuny M J, et al. Bacterial community dynamics and polycyclic aromatic hydrocarbon degradation during bioremediation of heavily creosote-contaminated soil[J]. Applied and Environmental Microbiology, 2005, 71(11): 7008-7018. DOI:10.1128/AEM.71.11.7008-7018.2005
(  0) 0) |
| [18] |
Delmont T O, Francioli D, Jacquesson S, et al. Microbial community development and unseen diversity recovery in inoculated sterile soil[J]. Biology and Fertility of Soils, 2014, 50(7): 1069-1076. DOI:10.1007/s00374-014-0925-8
(  0) 0) |
| [19] |
Tian Y H, Feng Y L. Application of microbial research in evaluation of soil quality (In Chinese)[J]. Chinese Journal of Applied & Environmental Biology, 2008, 14(1): 132-137. [田耀华, 冯玉龙. 微生物研究在土壤质量评估中的应用[J]. 应用与环境生物学报, 2008, 14(1): 132-137.]
(  0) 0) |
| [20] |
Bossio D A, Scow K M, Gunapala N, et al. Determinants of soil microbial communities: Effects of agricultural management, season, and soil type on phospholipid fatty acid profiles[J]. Microbial Ecology, 1998, 36(1): 1-12. DOI:10.1007/s002489900087
(  0) 0) |
| [21] |
Chen M Q, Ma L, Zhao B Z, et al. Effects of woody peat on quick improvement of soil organic matter and bacterial community composition in newly reclaimed red-yellow paddy soils (In Chinese)[J]. Soils, 2020, 52(2): 279-286. [陈美淇, 马垒, 赵炳梓, 等. 木本泥炭对红黄壤性水田土壤有机质提升和细菌群落组成的影响[J]. 土壤, 2020, 52(2): 279-286.]
(  0) 0) |
| [22] |
Donnison L M, Griffith G S, Hedger J N, et al. Management influences on soil microbial communities and their function in botanically diverse haymeadows of northern England and Wales[J]. Soil Biology & Biochemistry, 2000, 32(2): 253-263.
(  0) 0) |
| [23] |
Xia W J, Liu K L, Zhang L F, et al. Effect of long-term fertilization on soil microbial biomass and enzyme activities in reddish paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2021. DOI:10.11766/trxb201912050570 [夏文建, 柳开楼, 张丽芳, 等. 长期施肥对红壤稻田土壤微生物生物量和酶活性的影响[J]. 土壤学报, 2021.]
(  0) 0) |
| [24] |
Wang W L, Li J, Zhao X. Effects of biological organic fertilizer on rhisosphere soil bacteria community and root rot diseases of continuous cropping Angelica sinensis (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(8): 2813-2821. [王文丽, 李娟, 赵旭. 生物有机肥对连作当归根际土壤细菌群落结构和根腐病的影响[J]. 应用生态学报, 2019, 30(8): 2813-2821.]
(  0) 0) |
| [25] |
Kieser T, Bibb M J, Buttner M J, et al. Practical Streptomyces genetics . The John Innes Foundation, United Kingdom: Norwich, 2000.
(  0) 0) |
| [26] |
汪小勇. 有机氯农药(六六六)污染土壤植物修复技术研究[D]. 南宁: 广西大学, 2006. Wang X Y. Research on phytoremediation technology of organochlorine pesticides (hexachlorocyclohexane) contaminated soil[D]. Nanning: Guangxi University, 2006. (  0) 0) |
| [27] |
Zhang H, Lü Y L, Xin X Y, et al. Effects of organochlorine pesticides on soil microbial community functional diversity (In Chinese)[J]. Acta Ecologica Sinica, 2005, 25(4): 937-942. DOI:10.3321/j.issn:1000-0933.2005.04.041 [张红, 吕永龙, 辛晓云, 等. 杀虫剂类POPs对土壤中微生物群落多样性的影响[J]. 生态学报, 2005, 25(4): 937-942.]
(  0) 0) |
| [28] |
Zheng L P, Long T, Lin Y S, et al. Biolog-ECO analysis of microbial community functional diversity in organochlorine contaminated soil (In Chinese)[J]. Chinese Journal of Applied & Environmental Biology, 2013, 19(5): 759-765. [郑丽萍, 龙涛, 林玉锁, 等. Biolog-ECO解析有机氯农药污染场地土壤微生物群落功能多样性特征[J]. 应用与环境生物学报, 2013, 19(5): 759-765.]
(  0) 0) |
| [29] |
Han B, Kong J J, Zou X M, et al. The evolvement and expectation of biological nitrogen fixation (In Chinese)[J]. Journal of Shanxi Agricultural Sciences, 2009, 37(10): 86-89. [韩斌, 孔继君, 邹晓明, 等. 生物固氮研究现状及展望[J]. 山西农业科学, 2009, 37(10): 86-89.]
(  0) 0) |
| [30] |
丁柳屹. γ-HCH对覆膜苜蓿根际土壤细菌群落结构的影响[D]. 西安: 西北大学, 2019. Ding L Y. Effect of γ-HCH on bacterial community structure in rhizosphere soil of covered alfalfa[D]. Xi'an: Northwest University, 2019. (  0) 0) |
| [31] |
Cea M, Jorquera M, Rubilar O, et al. Bioremediation of soil contaminated with pentachlorophenol by Anthracophyllum discolor and its effect on soil microbial community[J]. Journal of Hazardous Materials, 2010, 181(1/2/3): 315-323.
(  0) 0) |
| [32] |
Hua J, Chen M J, Li F B, et al. Transformation dynamic of pentachlorophenol and its effects on microbial communities in a paddy soil (In Chinese)[J]. Earth and Environment, 2018, 46(3): 225-230. [华健, 陈曼佳, 李芳柏, 等. 水稻土中五氯酚的降解转化动态及其对微生物群落的影响[J]. 地球与环境, 2018, 46(3): 225-230.]
(  0) 0) |
| [33] |
Cao Y Q, Yan X J, Luo H Y, et al. Nitrification activity and microbial community structure in purple soils with different pH (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(1): 194-202. [曹彦强, 闫小娟, 罗红燕, 等. 不同酸碱性紫色土的硝化活性及微生物群落组成[J]. 土壤学报, 2018, 55(1): 194-202.]
(  0) 0) |
| [34] |
Jiang X J, Hou X Y, Zhou X, et al. pH regulates key players of nitrification in paddy soils[J]. Soil Biology & Biochemistry, 2015, 81: 9-16.
(  0) 0) |
| [35] |
Martinez-Toledo M V, Salmeron V, Rodelas B, et al. Studies on the effects of a chlorinated hydrocarbon insecticide, lindane, on soil microorganisms[J]. Chemosphere, 1993, 27(11): 2261-2270.
(  0) 0) |
| [36] |
Lu J Z, Luo Q X, Cheng F Q, et al. The effect of hexachlorocyclohexane on nitrogen-fixing microorganisms (In Chinese)[J]. Environmental Science, 1984, 9(3): 35-38. [陆娟子, 罗清修, 成放晴, 等. 有机氯农药六六六对固氮微生物的影响[J]. 环境科学, 1984, 9(3): 35-38.]
(  0) 0) |
| [37] |
Zeng K R, Wang Z F. Effects of six pesticides on the activities of nitrogenase and hydrogenase of Azospirillum brasilense (In Chinese)[J]. Acta Scientiae Circumstantiae, 1986, 6(3): 353-357. [曾宽容, 王子芳. 六种农药对固氮螺菌(Azospirillum brasilense)固氮酶和吸氢酶活性的影响[J]. 环境科学学报, 1986, 6(3): 353-357.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


