2. 湖南师范大学资源与环境科学学院,长沙 410081;
3. 湖南省水利水电科学研究院,长沙 410007
2. College of Resources and Environmental Science, Hunan Normal University, Changsha 410081, China;
3. Hunan Institute of Water Resources and Hydropower Research, Changsha 410007, China
我国南方红壤区马尾松林土壤侵蚀严重、生物多样性差,以工程措施和生物措施为主的水土流失防治措施可减少林下土壤侵蚀、恢复林地植被、提高土壤质量[1]。土壤微生物是生态系统恢复的重要驱动力,土壤的生物学特性可以对土壤内外环境的变化作出快速响应[2-3]。土壤细菌、真菌数量以及微生物量均受到土壤性质,特别是养分的影响[4]。Wang等[5]研究表明,苹果林中,不同覆盖措施下的土壤环境异质性决定了微生物群落结构和优势种群,覆盖措施增加了微生物的多样性与优势菌群的相对丰度。在中国北方旱地,保护性耕作通过改变土壤质地,改善水分和养分水平,提高了土壤细菌的多样性[6]。有研究表明,在草原土壤中,水平条沟虽然能有效提高土壤养分,但对土壤微生物特性的改善并不显著[7],但王海荣[8]的研究表明,在森林土壤中,实施水平沟和鱼鳞坑整地后土壤微生物数量上升。宋贤冲等[9]使用Biolog-Eco微平板技术分析了微生物群落多样性,证明在退化人工林恢复过程中,土壤微生物的多样性指数与植被物种丰度显著正相关。
尽管已有研究探讨了微生物群落多样性、结构组成对农业管理措施引起的土壤性质及外部环境的响应,但对水土流失防治措施下微生物相互作用的变化仍知之甚少。在生态系统中,微生物并不是简单地以单个种群的形式积累,而是形成复杂的相互作用网络,这对维持生态系统的功能和服务至关重要[10]。生态网络分析法(Ecological network analysis)是基于随机矩阵原理研究微生物间交互作用机制及微生物系统稳定性的一种方法,可用于预测土壤生态系统功能[11-12]。李冰等[13]比较了不同利用类型土地的细菌分子生态网络,发现旱田细菌网络规模更大,物种互作关系更为复杂,而天然林地土壤细菌之间的竞争关系最强烈。Tao等[14]使用生态网络分析方法研究了微生物的相互作用对玉米生长的影响,证明了生态网络复杂度驱动了玉米产量的增长。Wang等[5]发现覆盖措施增强了土壤微生物之间的相互作用关系,有利于提升土壤质量。Zhou等[15]在研究废弃尾矿土地的恢复过程中发现,植被重建驱动了废弃地土壤微生物网络的变化,提高了网络的连通性,使废弃土壤向附近森林土壤的状态发展。
有研究表明,农业工程措施及林下植被变化均会对土壤理化性质及微生物群落结构造成影响[16-17]。多种环境因素均能驱动土壤微生物分子生态网络的变化,同时微生物群落结构的变化也会影响微生物群落个体与其他物种的相互作用关系。因此,本研究假设,水土流失防治措施会改变土壤微生物分子生态网络。本研究以湖南省邵阳市莲荷小流域马尾松林坡面土壤为实验对象,建设试验小区,布设2种典型水土流失防治措施(挖设鱼鳞坑并种植草本,挖设鱼鳞坑并种植草本与灌木)以及1个对照组(不设置任何措施)。采集3种处理下0~5 cm深度的土壤,进行16S rRNA和18S rRNA高通量测序,测定土壤微生物群落结构,结合分子生态网络的研究方法,构建3种处理下土壤的微生物网络,分析了水土流失防治措施下土壤微生物网络特征、微生物互作关系的变化以及土壤理化性质对微生物群落结构的影响,以期为退化林地生态系统土壤养分调控研究及制定科学有效的水土流失防治措施提供参考。
1 材料与方法 1.1 试验区概况与设计试验区位于湖南省邵阳市水土保持研究站内(27°03′ N,111°22′ E),属于长江流域资江水系,海拔231~276 m。该区域为典型亚热带季风气候区,年均温为17.1 ℃,年均降水量为1 327 mm。区域内的土壤主要为第四纪红黏土发育的地带性红壤、黄壤。研究区的马尾松为1984年种植的人工林。本试验前,马尾松林土壤本底值见表 1。
|
|
表 1 马尾松林土壤基本理化性质 Table 1 Physical and chemical properties of the soil in Pinus massoniana forests |
2018年10月,选择了一处坡度为8°~10°的马尾松林坡面,设置了3种处理的试验小区:T1,挖设鱼鳞坑+种植草本;T2,挖设鱼鳞坑+种植草本+种植灌木;T3,对照(图 1)。每种处理设置3个重复,共9个小区。鱼鳞坑的横截面为半径50 cm的半圆形,深20 cm,圆形凸向朝坡下设置。每个小区长10 m,宽5 m,小区的长沿坡向设置。试验中所种植的草本为黑麦草,灌木为胡枝子,这两种植被均是研究区域的乡土物种,且具有较强的抗逆性。

|
图 1 实验小区设置及采样点位置示意图(圆点为采样点位置) Fig. 1 Set up of experimental plots and soil sample points(the dots represent soil sampling positions) |
2019年10月,在各试验小区内采集土样。在每个试验小区选取6个采样点(样点位置见图 1),用土钻采集0~5 cm土样,移除样品中的石块、凋落物及植被根系后,将每列中的3个土样均匀混合成一个样品,每个小区获得2个混合样品,每种措施共计6个混合样品,共计18个混合样品。混合样品带回实验室后,一部分于-70 ℃条件下冷冻保存,用于DNA提取与高通量测序,另一部分在室温下自然风干,用于测定土壤pH、有机质及全氮含量。此外,在每个采样点用环刀(直径50.46 mm×高50 mm)采集一个环刀样品,用于测定土壤含水量及容重。
1.3 土壤理化性质测定土壤含水量使用烘干法测定。土壤容重使用环刀法测定。土壤pH采用pH计测定(土壤土水比为1:2.5)。土壤有机质含量采用重铬酸钾-外加热法测定[18],土壤全氮含量采用重铬酸钾-硫酸消化法测定[19]。
1.4 DNA提取及高通量测序使用土壤DNA试剂盒(Omega Bio-tek,Norcross,GA,U.S.),在说明书的指导下从0.5 g混合土壤中提取基因组DNA。用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度。细菌16SrRNA的扩增引物序列为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),对16S rRNA基因V3-V4可变区进行PCR扩增,PCR扩增的条件为95℃变性30 s,55℃退火30 s,72℃延伸30 s,然后72℃稳定延伸10 min,最后在4℃进行保存。真菌18s rRNA的扩增引物序列为SSU0817F(5′-TTAGCATGGAATAATRRAATAGGA- 3′)和1196R(5′-TCTGGACCTGGTGAGTTTCC- 3′),PCR扩增条件为95℃变性30 s,55℃退火30 s,72℃延伸30 s,然后72℃稳定延伸10 min,最后在4℃进行保存。
将同一样本的PCR产物混合后采用2%琼脂糖凝胶回收PCR产物,采用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer(Promega,USA)对回收产物进行检测定量,利用Illumina公司的Miseq PE300平台进行测序。
1.5 微生物网络构建与分析高通量测序得到的细菌、真菌的OTU数据,在Molecular Ecological Network Analyses Pipeline(MENA)网站(http://ieg4.rccc.ou.edu/mena)上传数据后,进行lg标准化处理,构建Pearson相关性矩阵。基于随机矩阵理论(random matrix theory,RMT),设置合适的阈值,构建了3种处理下的土壤微生物分子生态网络(phylogenetic molecular ecological network,pMEN),获得网络拓扑参数文件。Deng等[12]的研究详细介绍了网络构建的步骤。利用Gephi 0.9.2软件对微生物网络进行可视化处理。
描述网络的特征参数包括:节点数即群落中的物种数;连通度即某个节点与其他连接节点的连接数之和;路径距离即两个节点之间的最短距离;聚类系数即一个节点与其他节点间连通度的好坏;网络模块性即分子生态网络模块化特性,一个生态网络被分成多个模块,每个模块均是生态系统中的一个功能单元。模块内的连通度(Zi)与模块间的连通度(Pi)用以表征节点的作用。
1.6 统计分析利用SPSS25软件(SPSS Inc,Chicago,IL,USA)进行土壤理化性质的单因素方差分析,采用ANOVA的最小显著差异(LSD)选项来检验差异显著性。利用Origin 2019软件(OriginLab,Northampton,MA,USA)绘制3种处理下的土壤微生物群落结构、微生物网络的拓扑角色分布及节点分布韦恩图。
2 结果 2.1 土壤基本理化特征马尾松林3种处理下的土壤理化性质如表 2所示,T1、T2处理下土壤含水量较T3处理高24.95%、21.58%,差异显著(P < 0.05);T1、T2处理下土壤容重较T3处理低,差异显著(P < 0.05);与T1、T2相比,T3处理下的土壤pH较低,但各处理的土壤pH无显著差异;T1、T2处理下土壤有机质含量较T3处理高103.17%、84.48%,差异显著(P < 0.05);T1、T2处理下土壤全氮含量较T3处理高49.28%,43.48%,差异显著(P < 0.05)。T1、T2处理下的土壤碳氮比值较T3处理高36.24%,29.92%,差异显著(P < 0.05)。
|
|
表 2 不同处理下的土壤基本理化特征 Table 2 Variation of the physical and chemical properties of the soil with treatment |
如图 2a所示,从门水平上分析,马尾松林3种处理下的土壤中共有的优势细菌群(相对丰度 > 5%)有:绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)。其中绿弯菌门在T1处理(29.19%)、T2处理(27.21%)中的相对丰度显著低于T3处理(51.36%)(P < 0.05);变形菌门在T1处理(25.00%)、T2处理(25.59%)中的相对丰度显著高于T3处理(13.56%)(P < 0.05);放线菌门在各处理中的相对丰度差异不显著;酸杆菌门在T1处理(12.56%)、T2处理(11.82%)中的相对丰度显著高于T3处理(6.92%)(P < 0.05)。此外,门水平上的其他主要细菌群有:WPS-2(4.42%~6.32%)、浮霉菌门(Planctomycetes)(2.04%~2.72%)、杆菌门(Patescibacteria)(0.73%~1.63%),其中杆菌门在T1处理(1.63%)与T2处理(1.46%)中的土壤显著高于T3处理(0.73%)(P < 0.05)。在目水平上,3种处理下的土壤中共有的优势细菌群有纤线杆菌目(Ktedonobacterales)(16.34%~28.75%)、norank_c__AD3(5.03%~13.99%)、Frankiales(5.63%~9.54%)、Solirubrobacterales(5.85%~7.46%)(图 3a)。其中纤线杆菌目在T1处理(16.34%)、T2处理(16.78%)中的相对丰度显著低于T3处理(28.75%)(P < 0.05);norank_c__AD3在T1处理(7.14%)、T2处理(5.04%)中也显著低于T3处理(13.99%)(P < 0.05);Frankiales和Solirubrobacterales的相对丰度在各处理土壤中无显著差异。在属水平上,3种处理下的土壤中共有的优势细菌群有:norank_f__norank_o__norank_c__AD3(5.04%~13.99%)、酸热菌属(Acidothermus)(5.20%~8.42%)、锥形菌属(Conexibacter)(5.39%~6.72%)(图 4a)。其中norank_f__norank_o__norank_ c__AD3的相对丰度在T1处理(7.14%)、T2处理(5.04%)中显著低于T3处理(13.99%)(P < 0.05);酸热菌属和锥形菌属的相对丰度在各处理土壤中无显著差异。
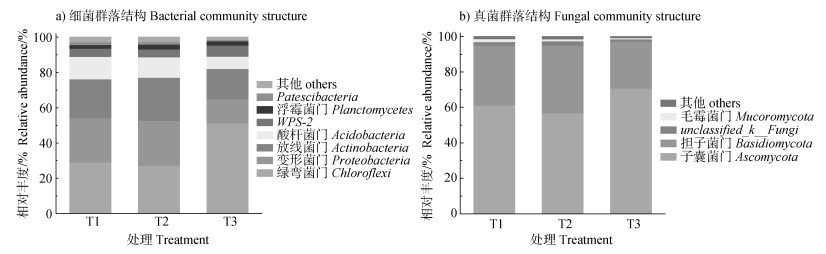
|
注:相对丰度 < 1%的微生物群落合并为其他,下同。 Note: Microbial communities with relative abundance less than 1 % were merged into others, the same bellow. 图 2 土壤细菌、真菌在门水平上的群落结构 Fig. 2 Bacterial and fungal community structure of soil samples at the phylum level |

|
图 3 土壤细菌、真菌在目水平上的群落结构 Fig. 3 Bacterial and fungal community structure of soil samples at the order level |

|
图 4 土壤细菌、真菌在属水平上的群落结构 Fig. 4 Bacterial and fungal community structure of soil samples at the genus level |
如图 2b所示,马尾松林3种处理下的土壤中共有的优势真菌群(相对丰度 > 5%)有子囊菌门(Ascomycota)(57.01%~70.74%)和担子菌门(Basidiomycota)(26.42%~38.16%)。子囊菌门和担子菌门在各处理下的土壤中相对丰度差异均不显著。此外,土壤中的其他主要菌群有:unclassified_k__ Fungi(1.07%~2.01%)、毛霉菌门(Mucoromycota)(0.64%~1.65%)。在目水平上,3种处理下的土壤共有的优势真菌群有散囊菌目(Eurotiales)(22.20%~31.44%)、银耳目(Tremellales)(6.86%~12.30%)、刺盾炱目(Chaetothyriales)(5.36%~12.80%)、unclassified_c__Leotiomycetes(6.82%~9.17%)(图 3b),各优势真菌群的相对丰度在不同处理下的土壤中不存在显著差异。在属水平上,3种处理下的土壤共有的优势真菌群有unclassified_f__Aspergillaceae(11.36%~15.42%)、Saitozyma(6.25%~11.27%)、unclassified_c__Leotiomycetes(6.82%~9.17%)(图 4b),同样地,属水平上各优势真菌群的相对丰度在不同处理下的土壤中也不存在显著差异。
2.3 土壤微生物分子网络的特性根据3种处理下的土壤微生物测序的结果,采用基于RMT的网络分析方法,识别群落中的微生物相互作用。数据分析之后,分别保留894、947、868个OTU节点,构建微生物群落分子生态网络,并计算主要的特征参数来描述网络的总体结构(表 3)。3个网络拓扑分布的R2为0.877、0.837和0.868,符合幂定律(Power law),表明各网络的无尺度行为,可以进一步分析。自动确定的阈值非常相似,分别为0.980、0.980和0.970。
|
|
表 3 土壤微生物分子生态网络特征参数 Table 3 Characteristic parameters of the molecular ecological network of soil microbe |
网络特征参数的分析表明,T1处理、T2处理中土壤微生物网络的总节点数、总连接数、平均连通度以及模块性较T3处理更高,表明T1处理与T2处理下的土壤微生物网络规模更大,相互作用的关系更为复杂;微生物网络路径距离代表物种间传递物质、能量及信息的效率[20],相比较于T1处理与T2处理,T3处理下的网络平均群聚系数较高,而网络平均路径距离较短,表明T3处理中土壤微生物间响应速度快,易受外界环境的干扰,群落结构稳定性差;而T1处理与T2处理中土壤微生物间的响应速度更慢,当外界环境发生变化时群落结构可以保持相对稳定。
微生物网络中,节点之间的作用分为正互相作用和负互相作用。本研究中构建的3个土壤微生物互相作用网络(图 5)中,大多数微生物间均为负互相作用。这表明在3种处理下的土壤中微生物是以竞争关系为主导,共生关系较弱,其中T2处理(67.49%)下的土壤微生物竞争关系比例最高,T1处理(65.75%),次之,T3处理(60.59%)最低。总体来看,在3个微生物网络中,T2处理的微生物网络连接最紧密,结构最复杂。此外,从图 2中可以看出,3个微生物网络中各模块的大小也存在着差异,相比于T3处理,T1处理和T2处理的微生物网络中形成了更大的节点模块,用以维持网络的结构和功能。

|
注:图中每个节点代表一个OTU,每个节点的大小与其连接数成正比。节点间存在连线表示各节点有显著的相关性(P < 0.05)。网络的不同模块以不同的颜色显示,小于20个节点的模块中的节点为灰色。 Note: Each node represents an OTU, and the size of each node is proportional to the number of connections. The links between the nodes indicate a significant correlation(P < 0.05). Different modules are presented with different colors, and nodes in modules with less than 20 nodes are colored gray. 图 5 土壤微生物互相作用网络 Fig. 5 Soil microbial interaction network |
通过计算土壤微生物群落分子生态网络节点的模块内连通度(Zi)和模块间连通度(Pi),分析3种处理下微生物网络各节点的拓扑学角色分布差异(图 3)。网络节点分为四类:①外围节点(Zi ≤2.5,Pi ≤ 0.62),连接数少,基本是与模块内部节点相连接;②模块枢纽(Zi > 2.5,Pi ≤0.62),与模块内部的节点高度连接;③连接器(Zi ≤2.5,Pi > 0.62),与其他模块的节点高度连接;④网络枢纽(Zi > 2.5,Pi > 0.62),既与其他模块的节点高度连接,又与模块内部的节点高度连接[21]。通常认为,Zi > 2.5或者Pi > 0.62的节点是关键节点,在与模块内或模块间的节点连接中发挥重要作用。
在所构建的3个微生物网络中,共有1 376个不重复的节点。T1处理(97.99%)、T2处理(98.42%)和T3处理(97.35%)中的大部分节点均是外围节点(图 6)。此外,只有61.6%的节点出现在1个以上的网络中(图 7),说明各微生物网络的节点组成存在一定的差异性。T1处理中共有14个模块枢纽,T2处理中共有13个模块枢纽,T3处理中共有15个模块枢纽;T1处理中共有4个连接器,T2处理中共有2个连接器,T3处理中共有8个连接器;3种处理中均没有网络枢纽节点。在3个不同的微生物网络中,几乎没有模块枢纽节点与连接器节点重叠。

|
图 6 土壤微生物网络节点的拓扑角色分布 Fig. 6 Role distribution of soil microbial network nodes |
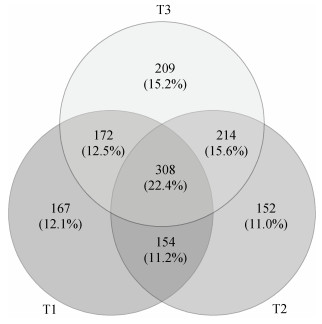
|
图 7 节点分布韦恩图 Fig. 7 Venn diagram of node distribution |
根据各关键节点所对应的菌群,分析3种处理的土壤微生物关键菌群在门水平上的分布情况(表 4)。T1处理的土壤中关键菌群分别属于7个菌门,其中放线菌门所占的比例最大,为27.78%;T2处理的土壤中关键菌群分别属于10个菌门,其中变形菌门所占的比例最大,为26.67%;T3处理的土壤中关键菌群分别属于10个菌门,其中绿弯菌门所占的比例最大,达到了34.78%。同时,在三个处理的土壤中,细菌类关键菌群均多于真菌类关键菌群。此外,在各处理的土壤出现的关键菌群中,厚壁菌门、纤毛菌门、装甲菌门、拟杆菌门、GAL15、芽单胞菌门、疣微菌门、WPS-2以及壶菌门,均不属于本研究区优势或主要菌群。
|
|
表 4 关键微生物菌群的分布情况 Table 4 Distribution of key microbial flora |
利用冗余分析(Redundancy analysis)解析土壤理化性质对微生物群落结构的影响(图 8)。结果显示,土壤理化性质对细菌群落结构变化的总解释量为41.41%,其中第一轴的解释量为32.87%,第二轴的解释量为8.54%,T1处理与T2处理的土壤细菌群落主要受土壤含水量、pH、有机质以及全氮含量的影响,而T3处理的土壤细菌群落主要受土壤容重和土壤碳氮比的影响。其中,土壤容重(R2=0.465,P < 0.05,n = 18)、pH(R2 = 0.377,P < 0.05,n = 18)、有机质(R2 = 0.383,P < 0.05,n = 18)、全氮(R2 = 0.545,P < 0.01,n = 18)、对土壤细菌群落结构影响显著。研究表明,土壤理化性质对真菌群落结构变化的总解释量为46.29%,其中第一轴的解释量为38.72%,第二轴的解释量为7.57%,T1处理的土壤真菌群落主要受土壤含水量与pH的影响,T2处理的土壤真菌群落主要受土壤有机质及全氮的影响,T3处理的土壤真菌群落主要受土壤容重的影响。其中,土壤含水量(R2 = 0.4845,P < 0.05,n = 18)对土壤真菌群落结构影响显著。

|
a)细菌群落与土壤理化性质的冗余分析Redundancy analysis of bacterial community and soil physicochemical properties. b)真菌群落与土壤理化性质的冗余分析Redundancy analysis of fungal community and soil physicochemical properties. 图 8 不同处理的土壤微生物群落与土壤理化性质的冗余分析 Fig. 8 Redundancy analysis of soil microbial community and soil physicochemical properties in different treatments |
分析微生物群落分子生态网络的相互作用及其影响因素,是研究水土流失防治措施下微生物生态系统响应的关键。微生物网络的各种参数,如拓扑结构、模块性、网络组成等,更能反映微生物群落与其相关生态位功能之间的关系[22]。结果表明,本研究中所实施的水土流失防治措施改变了土壤微生物生态网络的特征参数,较对照组(T3),实施了水土流失防治措施的土壤中微生物网络规模更大,相互作用更为复杂,有助于微生物菌群更有效地利用土壤养分[23],同时连接度更高的复杂网络对环境扰动有更强的抵抗性[24]。其中,鱼鳞坑加种植草本与灌木(T2)处理下土壤微生物网络复杂性大于鱼鳞坑加种植草本(T1)处理。鱼鳞坑可拦蓄雨期产生的径流泥沙,积累水分与养分[25],有研究表明,泥沙沉积物中的碳含量是田间土壤的5倍~32倍[26]。本研究中,较对照组,2种措施处理均显著提高了土壤的水分含量,而土壤含水量对微生物群落结构有重要的影响[27]。同时,2种措施处理也显著提高了土壤的有机质与全氮的含量,为微生物的生长提供了养分来源。本研究中,虽然鱼鳞坑加种植草本与灌木(T2)处理提高土壤含水量及养分的效果不如鱼鳞坑加种植草本(T1)处理,可能是因为本实验所种植的灌木处于生长初期,需要吸收较多的水分及养分,而较短的实验周期导致灌木生物量未能被完全分解而归还土壤,但T2处理下的土壤微生物网络却较T1处理更复杂,这是因为马尾松林下植被多样性差,同时种植草本与灌木提高了植被物种多样性,可为土壤微生物间发生多种功能的互相作用提供机会[10]。此外,相比于对照组,2种措施处理下的土壤微生物网络平均路径距离较长,微生物作用的响应速度变慢,外界环境变化不会快速影响到整个微生物网络,群落结构稳定性提高[28]。
土壤微生物互相作用也受到养分的驱动,有研究指出,向土壤中添加丰富营养物质后,微生物网络的竞争作用减少[29]。本研究中,马尾松林土壤养分较低,微生物间的互相作用以竞争关系为主,尽管水土流失防治措施在一定程度上提高了土壤碳、氮养分含量,但微生物间的竞争作用却加强。这可能因为,实施措施后土壤养分并未达到极高水平[30],在资源相对短缺时,微生物需要通过更强的竞争作用来满足自身的需求[31]。土壤C/N是衡量土壤碳、氮养分平衡的重要指标[32],本研究措施实施后土壤C/N升高,而较高的土壤C/N能够促进部分固氮微生物(如变形菌、放线菌、厚壁菌等)发挥作用[33]。土壤pH不仅对微生物多群落结构产生影响[34-35],而且与土壤微生物的活性、有机质的合成与分解均有密切关系[36]。马尾松林木会分泌有机酸,使得土壤酸化[37],过低的土壤pH会限制多种微生物酶活性[38-39]。Pietri和Brookes [40]的研究表明,土壤中微生物活性与pH之间存在显著的正相关,本研究中措施下土壤pH略微上升,有利于提高微生物活性,促进微生物作用。
绿弯菌门是马尾松林土壤中普遍存在的细菌,是对照组(T3)土壤中相对丰度最高的细菌,也是微生物网络中占比最高(34.78%)的关键菌群。通常认为绿弯菌是贫营养型细菌,在养分较低的土壤中占主导地位[41],而所属绿弯菌门的关键菌群在T1处理和T2处理的土壤中所占比例分别下降至22.22%和20.00%(T2),说明在土壤养分提升后,绿弯菌与其他菌群的相互作用减弱。放线菌门和变形菌门分别是T1处理和T2处理的土壤中占比最高的关键菌群。变形菌通常被认为是富营养型细菌,措施实施后土壤中积累了更多的养分,为其生存提供资源[42]。放线菌在植被凋落物的分解过程中起着重要的作用[43-44],措施实施后林下植被增多,凋落物增多,促进了放线菌的分解作用。措施下,酸杆菌门的相对丰度虽然提高,但是在对照组中酸杆菌门有3个关键菌群,而措施下却不再含有关键菌群。这可能是因为酸杆菌主要聚集在植被根系[45],措施中种植的草本灌木可以为其提供良好的生存环境,但是酸杆菌又属于嗜酸贫营养型细菌[46],本研究措施下土壤pH及养分的上升可能减弱了酸杆菌的作用。同一类型微生物在相对丰度与互作网络中关键菌群数量上所表现出来的的变化差异性,在未来需要进一步探索。子囊菌是马尾松林土壤中相对丰度最高的真菌,同时在3种处理的土壤中均作为关键菌群出现,说明子囊菌在微生物网络中与其他菌群的连接关系较强。此外,相比于对照组,措施实施后壶菌门和毛霉菌门不再作为微生物网络的关键菌群。壶菌门是木质纤维素和难降解有机碳的主要分解者,对照组的地表植被枯落物主要为马尾松针叶,含有较多难分解物质(如木质素和纤维素等)。措施中所种植的黑麦草和胡枝子可以向土壤输送多种类型的凋落物,混合枯落物因其自身基质产生变化而更易在多种微生物共同作用下而分解[47],壶菌门更偏向于利用难降解的有机质,因此其在微生物网络中的作用减弱。有研究表明,毛霉菌更适于在通风不良、高湿高热的环境下生长[48],而措施下毛霉菌门作用减弱,说明水土流失防治措施可能增强了土壤透气性。此外,在3个微生物网络中的部分关键菌群相对丰度较低(< 1%),并不是本研究区的主要菌群,却在微生物网络的构建中发挥重要作用。本研究探索了典型水土流失防治措施实施对土壤微生物网络的影响,有利于揭示水土流失防治措施的作用机制,为退化林地的治理提供理论依据。在此基础上,探究微生物群落相互作用变化及关键菌群转变对土壤物质循环产生了怎样的影响,是未来研究的方向。
4 结论实施水土流失防治措施后,马尾松林土壤微生物群落结构组成发生变化,绿弯菌门相对丰度显著降低,变形菌门与酸杆菌门的相对丰度显著升高。此外,水土流失防治措施也使土壤微生物网络的规模增大,物种间相互作用更加复杂。林区土壤微生物间以竞争作用为主,水土流失防治措施实施下这种竞争关系进一步加强。措施实施后,微生物间的响应速度变缓,微生物网络的稳定性和抗干扰能力提高,其中挖设鱼鳞坑并种植草本与灌木的措施比较挖设鱼鳞坑并只种植草本措施的表现更加突出。绿弯菌门、放线菌门和变形菌门中的部分菌群在本研究区的微生物网络中起着重要的连接作用,此外,一些低丰度的菌群对于构建微生物网络也具有关键作用。土壤容重、pH、有机质含量、全氮含量对细菌群落有显著影响,土壤含水量对土壤真菌群落影响显著。本研究表明,水土流失防治措施实施后土壤微生物群落结构发生明显变化,网络规模增大,物种间互作关系增强且竞争关系比例提高,微生物群落结构的稳定性提升。但本研究仅为措施实施后较短期的监测,长期的研究有待进一步开展。
| [1] |
Yuan Z J, Ma D F, Nie X D, et al. Progress in research on prevention and control of soil erosion under forest in red soil hilly region of South China (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 12-21. [袁再健, 马东方, 聂小东, 等. 南方红壤丘陵区林下水土流失防治研究进展[J]. 土壤学报, 2020, 57(1): 12-21.]
(  0) 0) |
| [2] |
Qin Q, Zhu S S, Xia B, et al. Temporal and spatial dynamics of soil microbial biomass carbon and its influencing factors on an eroded slope in the hilly Loess Plateau region (In Chinese)[J]. Environmental Science, 2019, 40(4): 1973-1980. [覃乾, 朱世硕, 夏彬, 等. 黄土丘陵区侵蚀坡面土壤微生物量碳时空动态及影响因素[J]. 环境科学, 2019, 40(4): 1973-1980.]
(  0) 0) |
| [3] |
Harris J. Soil microbial communities and restoration ecology: Facilitators or followers?[J]. Science, 2009, 325(5940): 573-574. DOI:10.1126/science.1172975
(  0) 0) |
| [4] |
Arunachalam K, Arunachalam A, Melkania N P. Influence of soil properties on microbial populations, activity and biomass in humid subtropical mountainous ecosystems of India[J]. Biology and Fertility of Soils, 1999, 30(3): 217-223. DOI:10.1007/s003740050611
(  0) 0) |
| [5] |
Wang Y J, Liu L, Luo Y, et al. Mulching practices alter the bacterial-fungal community and network in favor of soil quality in a semiarid orchard system[J]. Science of the Total Environment, 2020, 725: 138527. DOI:10.1016/j.scitotenv.2020.138527
(  0) 0) |
| [6] |
Wang Z T, Liu L, Chen Q, et al. Conservation tillage increases soil bacterial diversity in the dryland of Northern China[J]. Agronomy for Sustainable Development, 2016, 36(2): 1-9.
(  0) 0) |
| [7] |
Shen Y, Ma H B, Xie Y Z, et al. Responses of soil microbial prosperities to different management modes in typical steppe, Ningxia (In Chinese)[J]. Pratacultural Science, 2012, 29(6): 863-868. [沈艳, 马红彬, 谢应忠, 等. 宁夏典型草原土壤微生物特征对不同管理方式的响应[J]. 草业科学, 2012, 29(6): 863-868.]
(  0) 0) |
| [8] |
王海荣. 大青山森林培育技术与根际土壤微生物数量关系的研究[D]. 呼和浩特: 内蒙古农业大学, 2009. Wang H R. The study of the relationship between the forest cultivation techniques and the number of rhizoshere soil microorganism in Daqing moutain[D]. Hohhot: Inner Mongolia Agricultural University, 2009. (  0) 0) |
| [9] |
Song X C, Wang H L, Qin W D, et al. Effects of stand type of artificial forests on soil microbial functional diversity (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(3): 841-848. [宋贤冲, 王会利, 秦文弟, 等. 退化人工林不同恢复类型对土壤微生物群落功能多样性的影响[J]. 应用生态学报, 2019, 30(3): 841-848.]
(  0) 0) |
| [10] |
Tu Q C, Yan Q Y, Deng Y, et al. Biogeographic patterns of microbial co-occurrence ecological networks in six American forests[J]. Soil Biology & Biochemistry, 2020, 148: 107897.
(  0) 0) |
| [11] |
Fuhrman J A. Microbial community structure and its functional implications[J]. Nature, 2009, 459(7244): 193-199. DOI:10.1038/nature08058
(  0) 0) |
| [12] |
Deng Y, Jiang Y H, Yang Y F, et al. Molecular ecological network analyses[J]. BMC Bioinformatics, 2012, 13: 113. DOI:10.1186/1471-2105-13-113
(  0) 0) |
| [13] |
Li B, Li Y S, Wei J B, et al. Effects of different land use typess on the molecular ecological network of soil bacteria (In Chinese)[J]. Environmental Science, 2020, 41(3): 1456-1465. [李冰, 李玉双, 魏建兵, 等. 不同土地利用方式对土壤细菌分子生态网络的影响[J]. 环境科学, 2020, 41(3): 1456-1465.]
(  0) 0) |
| [14] |
Tao J M, Meng D L, Qin C, et al. Integrated network analysis reveals the importance of microbial interactions for maize growth[J]. Applied Microbiology and Biotechnology, 2018, 102(8): 3805-3818. DOI:10.1007/s00253-018-8837-4
(  0) 0) |
| [15] |
Zhou W H, Wang Y T, Lian Z H, et al. Revegetation approach and plant identity unequally affect structure, ecological network and function of soil microbial community in a highly acidified mine tailings pond[J]. Science of the Total Environment, 2020, 744: 140793. DOI:10.1016/j.scitotenv.2020.140793
(  0) 0) |
| [16] |
Zhang K, Bao W K, Yang B, et al. The effects of understory vegetation on soil microbial community composition and structure (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(6): 1178-1184. [张坤, 包维楷, 杨兵, 等. 林下植被对土壤微生物群落组成与结构的影响[J]. 应用与环境生物学报, 2017, 23(6): 1178-1184.]
(  0) 0) |
| [17] |
Zhou Y, Ma H B, Jia X Y, et al. Effects of enclosure and level trench engineering ecological restoration on soil biological characteristics of typical steppe in loess hilly area in Ningxia (In Chinese)[J]. Journal of Soil and Water Conservation, 2017, 31(3): 263-270. [周瑶, 马红彬, 贾希洋, 等. 封育和水平沟生态恢复措施对宁夏黄土丘陵区典型草原土壤生物学特性的影响[J]. 水土保持学报, 2017, 31(3): 263-270.]
(  0) 0) |
| [18] |
Nelson D W, Sommers L E. Total carbon, organic carbon, and organic matter[M]//SSSA Book Series. Madison, WI, USA: Soil Science Society of America, American Society of Agronomy, 2018: 961-1010.
(  0) 0) |
| [19] |
Tsiknia M, Tzanakakis V A, Oikonomidis D, et al. Effects of olive mill wastewater on soil carbon and nitrogen cycling[J]. Applied Microbiology and Biotechnology, 2014, 98(6): 2739-2749. DOI:10.1007/s00253-013-5272-4
(  0) 0) |
| [20] |
Zhou J Z, Deng Y, Luo F, et al. Phylogenetic molecular ecological network of soil microbial communities in response to elevated CO2[J]. mBio, 2011, 2(4): e00122-11. DOI:10.1128/mBio.00122-11
(  0) 0) |
| [21] |
Olesen J M, Bascompte J, Dupont Y L, et al. The modularity of pollination networks[J]. Proceedings of the National Academy of the Sciences of the United States of America, 2007, 104(50): 19891-19896.
(  0) 0) |
| [22] |
Hahn A S, Konwar K M, Louca S, et al. The information science of microbial ecology[J]. Current Opinion in Microbiology, 2016, 31: 209-216. DOI:10.1016/j.mib.2016.04.014
(  0) 0) |
| [23] |
Ma L, Zhang J B, Li Z Q, et al. Long-term phosphorus deficiency decreased bacterial-fungal network complexity and efficiency across three soil types in China as revealed by network analysis[J]. Applied Soil Ecology, 2020, 148: 103506. DOI:10.1016/j.apsoil.2020.103506
(  0) 0) |
| [24] |
Sheng M, Chen X D, Zhang X L, et al. Changes in arbuscular mycorrhizal fungal attributes along a chronosequence of black locust (Robinia pseudoacacia) plantations can be attributed to the plantation-induced variation in soil properties[J]. Science of the Total Environment, 2017, 599/600: 273-283. DOI:10.1016/j.scitotenv.2017.04.199
(  0) 0) |
| [25] |
Mengistu D, Bewket W, Lal R. Conservation effects on soil quality and climate change adaptability of Ethiopian watersheds[J]. Land Degradation & Development, 2016, 27(6): 1603-1621.
(  0) 0) |
| [26] |
Xu Q X, Wang T W, Cai C F, et al. Effects of soil conservation on soil properties of Citrus orchards in the Three-Gorges Area, China[J]. Land Degradation & Development, 2012, 23(1): 34-42.
(  0) 0) |
| [27] |
Brockett B F T, Prescott C E, Grayston S J. Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in western Canada[J]. Soil Biology & Biochemistry, 2012, 44(1): 9-20.
(  0) 0) |
| [28] |
Wang Y, Zhang R, Zheng Q, et al. Bacterioplankton community resilience to ocean acidification: Evidence from microbial network analysis[J]. ICES Journal of Marine Science, 2016, 73(3): 865-875. DOI:10.1093/icesjms/fsv187
(  0) 0) |
| [29] |
Gu Y F, Wang Y Y, Lu S E, et al. Long-term fertilization structures bacterial and archaeal communities along soil depth gradient in a paddy soil[J]. Frontiers in Microbiology, 2017, 8: 1516. DOI:10.3389/fmicb.2017.01516
(  0) 0) |
| [30] |
National Soil Survey Office. Chinese Soil (In Chinese). Beijing: Chinese Agriculture Press, 1998. [全国土壤普查办公室. 中国土壤[M]. 北京: 中国农业出版社, 1998.]
(  0) 0) |
| [31] |
Menezes A B, Richardson A E, Thrall P H. Linking fungal-bacterial co-occurrences to soil ecosystem function[J]. Current Opinion in Microbiology, 2017, 37: 135-141. DOI:10.1016/j.mib.2017.06.006
(  0) 0) |
| [32] |
Six J, Frey S D, Thiet R K, et al. Bacterial and fungal contributions to carbon sequestration in agroecosystems[J]. Soil Science Society of America Journal, 2006, 70(2): 555-569. DOI:10.2136/sssaj2004.0347
(  0) 0) |
| [33] |
Yang W H, Zhang Y, Wang Z C, et al. Community characteristics of nitrogen-fixing microorganisms in lake sediment-Taking Nanhaihu lake as example (In Chinese)[J]. China Environmental Science, 2020, 40(6): 2674-2682. DOI:10.3969/j.issn.1000-6923.2020.06.038 [杨文焕, 张元, 王志超, 等. 寒旱区湖泊沉积物中固氮微生物群落特征——以包头南海湖为例[J]. 中国环境科学, 2020, 40(6): 2674-2682.]
(  0) 0) |
| [34] |
Griffiths R I, Thomson B C, James P, et al. The bacterial biogeography of British soils[J]. Environmental Microbiology, 2011, 13(6): 1642-1654. DOI:10.1111/j.1462-2920.2011.02480.x
(  0) 0) |
| [35] |
Mukherjee S, Juottonen H, Siivonen P, et al. Spatial patterns of microbial diversity and activity in an aged creosote-contaminated site[J]. The ISME Journal, 2014, 8(10): 2131-2142. DOI:10.1038/ismej.2014.151
(  0) 0) |
| [36] |
Xiong X, Xiong Q H, Guo X, et al. Spatial variation characteristics of total nitrogen, organic carbon and ratio of carbon to nitrogen of cultivated land in typical hilly areas in South China and its influencing factors (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2020, 26(9): 1656-1668. [熊杏, 熊清华, 郭熙, 等. 南方典型丘陵区耕地土壤全氮、有机碳和碳氮比空间变异特征及其影响因素[J]. 植物营养与肥料学报, 2020, 26(9): 1656-1668.]
(  0) 0) |
| [37] |
Wang B W, Duan J, Wang L Y, et al. Relationship between vegetation and soil erosion under Pinus massoniana forest in eroded red soil region of Southern China (In Chinese)[J]. Science of Soil and Water Conservation, 2014, 12(5): 9-16. DOI:10.3969/j.issn.1672-3007.2014.05.002 [汪邦稳, 段剑, 王凌云, 等. 红壤侵蚀区马尾松林下植被特征与土壤侵蚀的关系[J]. 中国水土保持科学, 2014, 12(5): 9-16.]
(  0) 0) |
| [38] |
Che J, Zhao X Q, Zhou X, et al. High pH-enhanced soil nitrification was associated with ammonia-oxidizing bacteria rather than Archaea in acidic soils[J]. Applied Soil Ecology, 2015, 85: 21-29. DOI:10.1016/j.apsoil.2014.09.003
(  0) 0) |
| [39] |
Wang A S, Angle J S, Chaney R L, et al. Changes in soil biological activities under reduced soil pH during Thlaspi caerulescens phytoextraction[J]. Soil Biology & Biochemistry, 2006, 38(6): 1451-1461.
(  0) 0) |
| [40] |
Aciego Pietri J C, Brookes P C. Relationships between soil pH and microbial properties in a UK arable soil[J]. Soil Biology & Biochemistry, 2008, 40(7): 1856-1861.
(  0) 0) |
| [41] |
Wang C, Liu S Y, Zhang Y, et al. Bacterial communities and their predicted functions explain the sediment nitrogen changes along with submerged macrophyte restoration[J]. Microbial Ecology, 2018, 76(3): 625-636. DOI:10.1007/s00248-018-1166-4
(  0) 0) |
| [42] |
Jenkins S N, Rushton S P, Lanyon C V, et al. Taxon-specific responses of soil bacteria to the addition of low level C inputs[J]. Soil Biology & Biochemistry, 2010, 42(9): 1624-1631.
(  0) 0) |
| [43] |
Kramer C, Gleixner G. Soil organic matter in soil depth profiles: Distinct carbon preferences of microbial groups during carbon transformation[J]. Soil Biology & Biochemistry, 2008, 40(2): 425-433.
(  0) 0) |
| [44] |
Taha M, Foda M, Shahsavari E, et al. Commercial feasibility of lignocellulose biodegradation: Possibilities and challenges[J]. Current Opinion in Biotechnology, 2016, 38: 190-197. DOI:10.1016/j.copbio.2016.02.012
(  0) 0) |
| [45] |
Kielak A, Pijl A S, Van Veen J A, et al. Phylogenetic diversity of Acidobacteria in a former agricultural soil[J]. The ISME Journal, 2009, 3(3): 378-382. DOI:10.1038/ismej.2008.113
(  0) 0) |
| [46] |
Liu J J, Sui Y Y, Yu Z H, et al. Diversity and distribution patterns of acidobacterial communities in the black soil zone of northeast China[J]. Soil Biology & Biochemistry, 2016, 95: 212-222.
(  0) 0) |
| [47] |
Wang Y K, Fang S Z, Qu H H, et al. Factors influencing decomposition of forest litter (In Chinese)[J]. China Forestry Science and Technology, 2012, 26(1): 5-9. DOI:10.3969/j.issn.1000-8101.2012.01.002 [王意锟, 方升佐, 曲宏辉, 等. 森林凋落物分解的影响因素[J]. 林业科技开发, 2012, 26(1): 5-9.]
(  0) 0) |
| [48] |
Sui X, Zhang R T, Xu N, et al. Fungal community structure of different degeneration Deyeuxia angustifolia wetlands in Sanjiang plain (In Chinese)[J]. Environmental Science, 2016, 37(9): 3598-3605. [隋心, 张荣涛, 许楠, 等. 三江平原不同退化阶段小叶章湿地土壤真菌群落结构组成变化[J]. 环境科学, 2016, 37(9): 3598-3605.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


