钨(W)是位于元素周期表中VIB族的一种过渡元素,原子序数74,原子量183.85,与同族元素钼(Mo)有许多相似的性质。由于其硬度大、熔点高、化学性质稳定等特点,在冶金、化工、电子、光源、机械和军事等领域得到广泛应用,例如灯泡丝、喷气发动机涡轮、武器弹药等[1]。钨的天然化合物有20多种,其中黑钨矿[(FeMn)WO4]和白钨矿(CaWO4)是两种最常见也是开采量最多的天然钨矿[2]。我国钨矿开采和使用历史悠久,储量和产量均居世界首位[3]。钨与稀土元素一样,也是国家重要的战略金属资源,其开采量受到严格控制,2020年国家总开采量控制在52 500吨[4]。近200多年来,随着钨矿的开采冶炼和钨制品在各行业的应用,钨及其化合物进入土壤的途径增加,对土壤环境、动植物和人类的潜在危害日益凸显[2, 5-8],已有研究[9]报道,儿童患白血病可能与高浓度钨暴露相关。美国环境保护署(EPA)已将钨认定为一种新兴污染物。但与镉(Cd)、铅(Pb)、铜(Cu)、锌(Zn)、砷(As)等重金属以及同族元素Mo相比,人类对钨的认识,特别是在土壤中的生物地球化学过程,对微生物、动植物和人类健康的影响很缺乏,在国内相关研究尚为空白,亟需尽快开展这方面的数据积累与研究工作。本文就土壤钨的来源和含量水平、钨的土壤界面行为以及钨在生物中的富集特征和潜在健康风险做了梳理,在总结国内外研究的基础上,结合本课题组部分研究工作,剖析目前土壤钨研究的不足,提出未来研究的几点方向,目的是希望更多国内学者重视该新兴污染物。
1 土壤钨来源及含量水平 1.1 土壤中钨的来源土壤重金属污染的来源和途径非常广泛,主要通过大气沉降、污水、固体废弃物、农用物资等进入土壤[10-11]。土壤中钨的来源可分为天然源与人为源,但以人为源为主。例如,未经妥善处理的废钨矿石和冶炼矿渣,在自然力作用下持续释放出钨和伴生重金属,并通过地下水输送、大气颗粒沉降、动植物富集等途径不断在土壤中累积[2, 6, 12-13]。在军事领域,钨及其聚合物常用来代替铅作为弹药弹芯[14],因此,在打靶场遗弃地也存在高浓度钨。
1.2 土壤中钨的天然含量水平钨在地壳中的丰度约为1.3 mg·kg-1[15-16],与同族元素钼的丰度接近。目前,尚未全面评估全球土壤钨含量背景值,仅有少部分工作关注了局部范围内土壤钨浓度水平。在欧盟地区,研究[17-18]显示土壤表层钨含量约为0.68~2.7 mg·kg-1;在美国爱荷华州,农田土壤钨含量为0~2 mg·kg-1[19];在我国,对863个土壤样品分析表明,土壤表层钨含量均值为2.22 mg·kg-1[20]。从上述已有的调查数据可大致推测,自然土壤表层钨含量与地壳中的丰度接近或略高。
1.3 典型区域土壤钨含量水平在钨矿采冶和军事活动等区域,土壤钨含量大大超过环境背景值。调查[21]显示,江西大余钨矿周边农田土壤钨含量可达43.7 mg·kg-1;澳大利亚昆士兰北部的采矿和冶炼区域,表层土壤钨含量达到56 mg·kg-1[22];在英国废弃的Carrock Fell矿区周边,土壤表层钨含量高达944~1 637 mg·kg-1[23];而美国马萨诸塞州一个军事训练场,土壤钨含量甚至达到惊人的2 080 mg·kg-1[12]。由此可见,粗放的采冶和军事活动使土壤中钨含量达到环境背景值的上百甚至上千倍,其潜在的生态环境风险不容忽视。
我国有钨矿200多处,主要分布于湖南、江西、广西、福建、广东等南部省份。目前,国内学者对钨矿区重金属污染研究尚较少,且几乎所有研究均关注钨矿采冶过程中产生的Cd、As、铬(Cr)、汞(Hg)、锰(Mn)、Pb、Cu、Zn等伴生元素,唯有少数几个研究关注钨[21, 24],目前的研究也缺乏对采冶矿区土壤钨空间分布的调查。湖南省钨资源储量居全国第一位,占全国查明总量的32%,为此,本课题组调查了湖南省某钨矿区(黑钨矿床)钨浓度空间分布,结果如图 1和表 1所示。在冶炼厂遗留地(5~7号样点),土壤表层钨含量最高达到约3 191 mg·kg-1;在冶炼厂小流域下游(8~12号样点),土壤表层钨含量介于54~1 333 mg·kg-1;在非冶炼厂小流域(1~4号样点),土壤表层钨含量也很高,约57~376 mg·kg-1。河流中钨浓度相对较低(A~H样点),介于0.11~0.34 mg·L-1,这可能由于该钨矿已停工停产数十年,冶炼废水通过地表径流的输入很低,但此值也远远大于自然水体钨浓度(10.3 ng·L-1~2.05 μg·L-1)[25]。上述调查数据表明,我国南方典型钨矿采冶区域土壤钨含量高于环境背景值几十甚至上千倍,且空间分布不随污染源水平距离增加而降低。该地区居民长期种植和食用大米等作物,潜在的健康风险将在下文进一步分析。

|
图 1 湖南省某钨矿采冶区土壤和水采样点分布 Fig. 1 Sampling point distributions in soils and waters around a tungsten mining-smelting area in Hunan Province, China |
2 钨在土壤中的环境界面行为 2.1 土壤钨的赋存形态和迁移转化
钨的赋存形态对其在土壤中的迁移、生物有效性和毒性尤为重要。长期以来,土壤中的外源金属钨(化合物)被认为非常稳定,这也是该元素被关注较少的主要原因。但近十几年来,学者不断发现,金属钨在自然条件下可被氧化成钨酸盐(WO42-)[6, 12, 26],这些可溶性阴离子具有较高的移动性,使钨在土壤中的环境行为变得复杂。最近Clausen等[27]提出了靶场弹壳残留金属钨在土壤中的转化途径:金属钨→氧化钨→钨酸盐→多钨酸盐→多金属钨酸盐(如W12SiW4O4-),且迁移性由高到低依次为:钨酸盐、多钨酸盐、多金属钨酸盐、金属钨。
厘清土壤钨形态的另一个难点是钨酸盐的聚合作用。钨酸盐与钼酸盐相似,两个或多个钨酸盐单体(WO42-)在一定条件下形成多聚物(H2W12O406-、HW6O203-、W6O20(OH)5-),这种多聚物的形成在酸性pH(低于4.5)和较高钨浓度时更显著[28-30],此外,多聚钨酸盐的稳定性要高于单钨酸盐,可长期存在于表层土壤中[27]。研究[6]发现,碱性土壤中钨多以钨酸根单体存在(WO42-),而在酸性土壤中以多聚钨酸盐形式存在,这也造成碱性土壤中钨的迁移性更高[31-33]。聚合态钨的毒性远大于钨酸盐单体[34],因此在酸性土壤中,钨对植物的毒害可能更高。
一些传统的化学提取方法如Tessier和Community Bureau of Reference(BCR)也被用来研究土壤钨形态。陈明等[24]利用BCR四步法提取赣南钨矿周边土壤中的钨,结果表明,钨主要以残渣态和可氧化态存在,可还原态和酸溶态极少。Li等[35]利用Tessier五步法提取土壤钨,结果显示残渣态和可氧化态占主导,这与陈明等[24]的研究结果一致。Hobson等[31]利用改进的Tessier六步法测定钨形态,结果表明硫化物结合态、残渣态和有机质结合态是美国内华达州法隆Churchill县土壤中钨的主要形态。目前,大部分学者利用传统强酸(HF-HNO3-HClO4)提取土壤中的钨[24, 35],再利用电感耦合等离子体发射光谱仪(ICP-OES)、电感耦合等离子体质谱(ICP-MS)以及电感耦合等离子体原子发射光谱法(ICP-AES)等仪器检测溶液态钨含量[2]。但必须指出,该方法存在很大缺陷,主要因为钨酸盐在酸性条件下易形成聚合物,溶解度低,利用强酸提取造成回收率不高,将大大低估土壤钨含量。因此,已有学者利用硝酸+弱酸(如磷酸)作为土壤钨提取剂,发现钨回收率远远大于传统强酸提取[36],这也是上文1.3中土壤钨提取用到的方法。此外高效液相色谱-电感耦合等离子体质谱法(HPLC-ICP-MS)也可对土壤提取液中的钨氧阴离子进行定量测定[37]。El-Shahawi和Al Khateeb[38]建立了一种高选择性、低成本的萃取荧光光谱法测定水中痕量钨,与ICP-MS结果对比,准确率高达95%以上。最近,Mohammed等[39]利用槲皮素建立一种高选择性荧光光谱法测定水中痕量钨酸盐(WO42-)的方法,原理主要是通过检测钨酸盐和槲皮素形成络合物的信号强度,该方法的准确性也得到ICP-OES的进一步验证。
在微观尺度,研究钨与土壤组分的作用机制对于理解钨在土壤中的形态、迁移转化和生物有效性有重要意义。同步辐射X-射线吸收技术(XANES、EXAFS)能确定元素价态,并能在原子水平获得元素配位结构如配位原子、配位数和键长,被广泛用来研究重金属微观化学结构[40-41],而有关钨与土壤组分互作的同步辐射研究为数不多[27, 30, 32, 42],钨与氧(O)、碳(C)、硫(S)、铁(Fe)、Mn、硅(Si)、铝(Al)等元素之间的配位信息也不完备,值得学者对此进一步探究。此外,衰减全反射原位红外光谱(ATR-FTIR)也可作为辅助手段丰富钨的微观配位信息,虽然分辨率不及EXAFS精细,但此技术在区分钨(酸盐)聚合状态有无可比拟的优势[29, 43-47]。复杂土壤界面钨的微观分布可借助基于同步辐射的微区X-射线荧光光谱(SR-XRF)和扫描透射X射线显微技术(SR-STXM)在微米和亚微米尺度进行测定。近几年发展起来的纳米二次离子质谱(NanoSIMS),可在更精细的分辨率对钨的分布特征进行表征。而钨的稳定同位素分馏技术,因其较低的检测限和灵敏度,也有助于进一步理解钨在土壤系统中的环境行为[48]。
2.2 钨在土壤界面的吸附及影响因素当金属钨氧化为钨酸盐,这些含氧阴离子势必会在土壤颗粒表面发生吸附解吸反应[49],进一步影响其迁移和归宿。土壤活性颗粒主要包括矿物、微生物和有机物等,它们在粒径大小、带电性和官能团等方面有很大区别,因此对钨的亲和力和吸附机制可能有较大差异。钨(酸根)是带负电含氧阴离子,因此,在土壤胶体上的吸附行为可能与砷、锑、钼和磷酸根等有相似性[50-52],但有关钨在土壤胶体颗粒上吸附的研究不多,目前的研究主要集中在矿物体系。Iwai和Hashimoto[53]发现,钨酸盐(WO42-)在几种土壤黏土矿物上的亲和力由大到小依次为:三水铝矿、水铁矿、水钠锰矿、蒙脱石,且吸附量在低pH时较高。Cao等[54]发现,纳米水氯铁镁石是一种对钨酸盐吸附很强的矿物,最高吸附量可达71.9 mg·g-1。钨酸盐在矿物表面的吸附也受众多环境配体的影响,如磷酸根、硅酸根和钼酸根[30, 43, 55];此外,钨酸盐的聚合作用也显著降低钨在矿物表面的吸附[30]。关于钨的界面吸附机理,学者利用ATR-FTIR和XAFS等技术发现,钨酸盐在金属氧化物表面主要通过形成单层或多层内圈络合物[43-47],既有单齿也有多齿形态(图 2)。此外,内圈络合物的形成会进一步造成钨在矿物表面发生同位素分馏(Δ186/183W)[48, 56],使较轻的组分结合在矿物表面。

|
注:数据来源于Kashiwabara等[48]。 Note: Data are reproduced from Kashiwabara et al. [48]. 图 2 钨在铁氧化物表面几种可能的络合物形态 Fig. 2 Optimized structures of W adsorbed on Fe(oxyhydr)oxides |
目前,土壤有机组分如微生物、腐殖酸、溶解性有机物(DOM)等如何吸附、络合钨(酸根)尚不明确。最近,本课题组研究了腐殖酸(HA)如何影响钨酸根在水铁矿表面的吸附过程[29],结果表明,钨酸根的吸附量随腐殖酸浓度增加而减少,此外吸附态W(Ⅵ)会部分还原成W(Ⅴ),表明土壤有机物不仅影响钨在矿物表面的吸附还影响其价态,进一步可能影响其迁移和生物有效性。少量研究[57-58]发现,微生物如大肠杆菌(Escherichia coli)是比较好的钨吸附剂,但在分子水平,有机物、微生物络合钨的机理尚不清楚,钨在有机组分上发生氧化还原反应,以及可能存在的同位素分馏过程和机制尚未明晰,上述均为未来的研究重点。
3 钨在生物中的富集特征及潜在健康风险 3.1 钨在植物中的富集、生理作用和危害植物可通过根系摄取土壤中的钨,且不同植物对钨的吸收积累有很大差异。James和Wang[59]的研究显示,几种植物可食部位对钨的富集系数由大到小依次为:萝卜(28.01)、菠菜(11.35)、土豆(1.36)、莲藕(0.77)、玉米(0.32)。植物的不同器官对钨的累积也有很大区别,Wilson和Pyatt[23]在研究帚石楠体时发现,根部钨含量(655 mg·kg-1)要远远高于茎(48.9 mg·kg-1)和叶(124 mg·kg-1)。Lin等[21]调查了江西大余钨矿周边农田水稻中钨含量,水稻不同部位钨含量由高到低依次为根、叶、茎、籽粒。本课题组的水稻盆栽试验结果(表 2)表明,当土壤(钨背景值约为0.5 mg·kg-1)添加5 mg·kg-1钨酸钠时,水稻根、茎、叶和籽粒中钨浓度分别约38.2、4.9、12.4和3.2 mg·kg-1;当土壤添加50 mg·kg-1钨酸钠时,水稻根、茎、叶和籽粒中钨浓度增加至106、15.4、23.5和4.3 mg·kg-1。低浓度钨添加时,水稻根的富集系数约为7,而高浓度钨添加时,根富集系数为2,由此可见,水稻是一种对钨吸收富集较强的作物,但根的富集与土壤钨含量不是正相关关系。在Lin等[21]的研究中,钨矿区周边土壤中水稻根对钨的富集系数约为0.2~0.6,远小于盆栽添加Na2WO4的值,主要原因可能是盆栽添加的Na2WO4是可溶态,生物可利用度高,而自然土壤中大部分钨是不活泼态(残渣态)[31, 35],因此仅有少部分钨可被植物吸收利用。除此之外,学者发现钨在植物中的富集也受土壤性质,如质地、pH和有机质含量的影响[34, 60]。
|
|
表 2 盆栽土壤中添加不同浓度钨酸钠(Na2WO4)后水稻器官中钨含量 Table 2 Wcontent in different organs of rice after amendment with different amounts of Na2WO4 |
长期以来,学者认为钨在植物生长发育中的作用可能与同族元素钼相似。Davies和Stockdill[61]报道,施用低浓度钨酸盐促进牧草生长,但效果低于同浓度钼;Kumar和Aery[62]研究显示,低浓度钨(9 mg·kg-1)施用促进小麦根和茎的增长;相似的效应也被Tyagi[63]发现。与其他重金属类似,高浓度钨对植物生长则有显著阻碍作用,据Adamakis等[64]报道,添加200和500 mg·kg-1钨酸钠显著抑制豌豆和棉花幼苗生长和根伸长;Kumar和Aery[62, 65]发现,高浓度钨酸盐(27~243 mg·kg-1)抑制小麦和豇豆的生长;甘蓝的生长在436 mg·kg-1钨时受到显著抑制[66];而超高钨浓度(10 000 mg·kg-1)甚至会引起黑麦死亡[67]。高浓度钨的毒性作用可能主要因为其替代了硝酸盐还原酶中的钼,从而抑制了氮素的同化作用[68],此外,酚类和过氧化氢酶的活性增加也是可能的原因之一[62]。钨对不同植物的毒性效应存在显著差异,但目前相关机制尚不明确。
3.2 钨在微生物、动物和人体内的富集和潜在健康风险 3.2.1 钨对土壤微生物的毒性众所周知,钼是生物固氮酶的重要组成元素[69]。由于钨和钼的相似性,固氮酶中的钼可被钨替代,进一步影响固氮类微生物生长。Wichard等[70]报道,维氏固氮菌的生长速度随钨浓度增加而降低,在0.1 mmol·L-1浓度时,生长速率降低约80%;此外该研究发现,固氮菌生成的邻苯二酚铁载体在缓解钨毒害方面发挥重要作用。Strigul等[67]利用枯草芽孢杆菌(Bacillus subtilis)和荧光假单胞菌(Pseudomonas fluorescens)作为模式细菌研究钨的毒性,钨浓度在10-5~25 mg·L-1时,细菌生物量降低8%~15%,当钨浓度升高至89 mg·L-1时,则减少38%。Dermatas等[26]的研究也证实,当土壤中添加3%的钨时,大量低耐性微生物会死亡并释放CO2。与上述研究相反,Ringelberg等[28]利用磷脂脂肪酸(PLFA)分析了钨酸盐添加对土壤微生物生物量的影响,结果表明添加钨(< 2 600 mg·kg-1)会增加土壤微生物生物量,而高于2 600 mg·kg-1浓度时则下降;此外,土壤中革兰氏阳性菌的相对含量随钨浓度增加而升高,而革兰氏阴性菌会受到抑制。钨对微生物的影响可能主要通过调控某些应激基因的表达而实现[71],而不同微生物种类、土壤性质以及钨形态均可能使钨的毒性产生较大差异。
3.2.2 钨在动物体内累积与毒性钨可通过多种途径向动物体内转移和累积,对动物的生长发育造成潜在危害。在土壤体系中,Lindsay等[7]利用蜗牛作为模式动物探讨了钨的迁移路径和累积特点,结果表明,蜗牛通过摄取植物(卷心菜)对钨的生物富集系数为0.36,远远大于直接从土壤中吸收钨的富集系数(0.05),表明摄取食物(植物)是土壤动物体内钨富集的主要途径;此外,该研究发现蜗牛体内胰脏中钨浓度最高,进一步证明了食用受污染食物是钨由植物向动物迁移的最重要途径。Inouye等[72]对比了钨和铅对蚯蚓存活、生长和繁殖的影响,钨对蚯蚓存活的毒性影响小于铅,而对蚯蚓繁殖(产卵)的毒害作用强于铅,这一结果暗示钨是一种生殖毒物。Kennedy等[66]发现当蚯蚓直接暴露于859 mg·kg-1钨时,会受到显著毒害。一些学者也利用小白鼠作为模式动物研究钨的潜在毒性,结果发现小白鼠口试钨酸钠后,钨主要在骨骼和脾脏中富集,而结肠、肾、肝脏和大脑中钨的含量很少[73]。在免疫水平,Kelly等[74]发现钨主要通过诱导小白鼠B淋巴细胞的发育,进而对骨骼内的DNA造成损伤。此外,不同形态钨的毒性也存在差异,据Strigul等[75]报道,多聚钨酸盐(3Na2WO4·9WO3)对孔雀鱼的毒性远大于钨酸盐(Na2WO4)。
3.2.3 钨对人体健康的潜在危害在美国内华达法隆镇,儿童白血病可能与长期钨暴露有关[2, 8, 76-77]。普通人尿液中钨浓度为0.08~0.7 μg·L-1,而在当地总人口68%的测试样本中,有95%比例超出正常值,儿童尿液中钨平均浓度高达2.31 μg·L-1[78]。但至今,有关当地白血病病因尚无定论,与钨相伴的其他高浓度污染物(钴(Co)、Pb、Cd、Cu)是否引发白血病尚需进一步明确。最近,研究人员发现钨会造成与人类肺癌相关的S100A4基因紊乱,表现出潜在的致癌性[79],但这也仅仅是在细胞水平。除了癌症,过量钨摄入也会引起其他人体疾病,Menke等[80]研究发现尿液钨和糖尿病之间有很高的相关性,心血管疾病、甲状腺疾病也可能与高浓度钨有关联[81-82],由此推测,钨可在人体不同器官之间进行迁移。此外,在一项针对乳腺癌患者的治疗中[83],研究人员发现当患者采用钨-基靶体治疗20个月,在尿液中仍能检测到钨(约1.76 μg·L-1),表明钨在人体内可长期赋存。就目前的研究而言,尚无法证明过量钨摄入与人体的一些疾病如乳腺癌、白血病、肺癌等有直接联系,已有研究还停留在基因和分子水平,钨对人体毒理研究尚需进一步深入。
3.2.4 钨采冶区食用稻米的潜在健康风险前文1.3部分的数据显示,矿区土壤钨浓度远远大于环境背景值,因此采冶矿区周边居民有高浓度钨暴露风险。重金属可通过皮肤吸收、呼吸、摄入污染饮用水和农产品等途径进入人体内。以湖南省某钨矿区为例,该钨矿已停工停产,流域水中钨含量相对较低,因此,当地居民摄入钨的途径可能主要通过食用含钨农产品。以稻米为例,本课题组测定了该区域大米以及湖南省本地市场大米钨含量,结果如图 3所示。湖南省本地市场大米钨含量均值为1.12 mg·kg-1,该值与钨在地壳中的含量[84]接近。此外,该值与普通稻米钼含量[85]相当,表明两种同族元素的累积特性相似。在钨矿采冶区,大部分稻米钨含量与市场大米值接近,少部分钨含量远高于此均值,最高达到7.54 mg·kg-1,为市场大米平均值的6.7倍。前人[86]也有报道,在钼污染区稻米钼含量可达0.58~12.04 mg·kg-1。以成年人日均食用389 g大米计算,采冶区成人每天通过膳食摄入的钨可达2.9 mg·d-1。目前,国内外尚无关于钨的食品安全限量标准,因此难以直接评估此摄入量对人体的健康风险。已有研究[87]报道高钼摄入(10~20 mg·d-1)会引起人体痛风症,但关于高钨摄入对人体潜在毒害亟需学者开展初始数据积累工作。
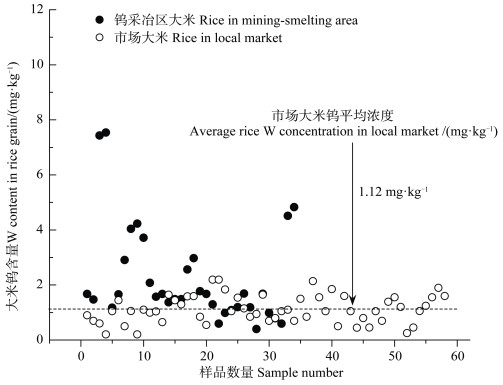
|
图 3 湖南省某钨矿采冶区稻米和湖南省本地市场稻米钨含量 Fig. 3 Rice W content in a tungsten mining-smelting area and a local market in Hunan Province, China |
近年来,国内外学者在土壤钨生物地球化学循环以及在生物系统中的作用、生态风险与健康效应等方面做出了一定的努力,但目前人类对土壤系统中钨的认识尚有限。对于这一新兴污染物,需要尽快全面理解其在土壤和生物系统中的过程、作用和影响,才能防患于未然。针对已有的工作,未来的研究应着眼于以下几个方面:
(1) 钨的生态环境健康风险评估与环境基准/标准建立。优化土壤、水、植物和生物样品中钨的形态提取和检测方法;明确钨在相关生态受体(植物、微生物、动物以及人类)的暴露途径,尤其应重点关注钨从土壤到植物(农作物)的迁移分配规律和累积特点;阐明钨在生物体内分布、代谢和蓄积特性,建立生物免疫、神经、生殖/发育和致癌等方面的毒理数据,评估危害等级并解释毒性作用机制;综合多种模型方法评估钨的生态风险、农产品安全风险和人体健康风险。在此基础上,尽快确定土壤钨的筛选值和管控值,从生态安全、人体健康和农产品安全综合角度制定相关土壤、地下水环境基准,尤其应优先制定常见粮食作物和蔬菜中的限量标准。
(2) 典型区域土壤钨时空分布特征与源汇关系。结合大数据和3S等技术探明区域尺度土壤钨空间分布特征、时空变化趋势和驱动因子;将传统分析方法与同位素示踪和多种数学模型相结合,开展相关源解析工作,量化自然和人为源贡献,厘清钨从水、固、气等介质进入土壤的途径和贡献;揭示土壤钨累积和跨介质的源汇动态平衡机制。为制定相应的源头消减和阻控措施提供决策支撑。
(3) 钨的土壤微界面过程与机制。利用先进光谱学技术、同位素分馏和模型揭示钨在土壤活性颗粒(矿物、有机物、微生物)上的吸附络合、沉淀溶解、氧化还原过程和机理;阐明土壤地球化学因子如何影响钨形态和有效性;研究钨在土壤多相界面的迁移特点,建立和发展钨在土壤多介质、多界面、多过程的动力学和热力学模型。
(4) 土壤钨的生态修复与安全利用。土壤钨在酸性土壤中的迁移性较低,多以残渣态存在,因此在考虑修复技术时,应重点以低成本的原位稳定化技术为主,通过调控土壤pH以及施加稳定化材料达到原位稳定化目标;钨是一种战略物资,资源化利用显得尤为关键,目前在稀土污染治理中,已采用超富集植物来修复污染土壤、恢复植被,并同时实现稀土资源化再利用(植物采矿)[88],这对于土壤钨的资源化利用有较好的指导意义。
| [1] |
Li C Y. Properties and applications of nonferrous metals-Tungsten(Ⅰ) (In Chinese)[J]. Nonferrous Metals Science and Engineering, 1987, 1(1): 65-67. [李承元. 有色金属的性质和用途(一)钨[J]. 有色金属科学与工程, 1987, 1(1): 65-67.]
(  0) 0) |
| [2] |
Koutsospyros A, Braida W, Christodoulatos C, et al. A review of tungsten: From environmental obscurity to scrutiny[J]. Journal of Hazardous Materials, 2006, 136(1): 1-19. DOI:10.1016/j.jhazmat.2005.11.007
(  0) 0) |
| [3] |
Zhu H L, Zhang L P, Du L, et al. The geochemical behavior of tungsten and the genesis of tungsten deposits in South China (In Chinese)[J]. Acta Petrologica Sinica, 2020, 36(1): 13-22. [祝红丽, 张丽鹏, 杜龙, 等. 钨的地球化学性质与华南地区钨矿成因[J]. 岩石学报, 2020, 36(1): 13-22.]
(  0) 0) |
| [4] |
中华人民共和国自然资源部. 自然资源部工业和信息化部关于下达2020年度稀土矿钨矿开采总量控制指标(第一批)的通知[OL]. 2020. http://gi.mnr.gov.cn/202002/t20200219_2499345.html. Ministry of Natural Resources of the People's Republic of China. Ministry of Natural Resources and Ministry of Industry and Information Technology release the 2020 total production control index of rare earth and tungsten ore(the first batch)[OL]. 2020. http://gi.mnr.gov.cn/202002/t20200219_2499345.html. (  0) 0) |
| [5] |
Bednar A J, Jones W T, Boyd R E, et al. Geochemical parameters influencing tungsten mobility in soils[J]. Journal of Environmental Quality, 2008, 37(1): 229-233. DOI:10.2134/jeq2007.0305
(  0) 0) |
| [6] |
Datta S, Vero S E, Hettiarachchi G M, et al. Tungsten contamination of soils and sediments: Current state of science[J]. Current Pollution Reports, 2017, 3(1): 55-64. DOI:10.1007/s40726-016-0046-0
(  0) 0) |
| [7] |
Lindsay J H, Kennedy A J, Seiter-Moser J M, et al. Uptake kinetics and trophic transfer of tungsten from cabbage to a herbivorous animal model[J]. Environmental Science & Technology, 2017, 51(23): 13755-13762.
(  0) 0) |
| [8] |
Sheppard P R, Speakman R J, Ridenour G, et al. Temporal variability of tungsten and cobalt in fallon, Nevada[J]. Environmental Health Perspectives, 2007, 115(5): 715-719. DOI:10.1289/ehp.9451
(  0) 0) |
| [9] |
Rubin C S, Holmes A K, Belson M G, et al. Investigating childhood leukemia in Churchill County, Nevada[J]. Environmental Health Perspectives, 2007, 115(1): 151-157. DOI:10.1289/ehp.9022
(  0) 0) |
| [10] |
Zhao F J, Ma Y B, Zhu Y G, et al. Soil contamination in China: Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759.
(  0) 0) |
| [11] |
Zhao F J, Xie W Y, Wang P. Soil and human health (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 1-11. [赵方杰, 谢婉滢, 汪鹏. 土壤与人体健康[J]. 土壤学报, 2020, 57(1): 1-11.]
(  0) 0) |
| [12] |
Clausen J L, Korte N. Environmental fate of tungsten from military use[J]. The Science of the Total Environment, 2009, 407(8): 2887-2893. DOI:10.1016/j.scitotenv.2009.01.029
(  0) 0) |
| [13] |
Hällström L P B, Alakangas L, Martinsson O. Scheelite weathering and tungsten(W)mobility in historical oxidic-sulfidic skarn tailings at Yxsjöberg, Sweden[J]. Environmental Science and Pollution Research, 2020, 27(6): 6180-6192. DOI:10.1007/s11356-019-07305-1
(  0) 0) |
| [14] |
She J F. Applications of tungsten-From electronic materials to military munitions (In Chinese)[J]. China Tungsten Industry, 2001, 16(2): 39-41. [佘建芳. 钨的应用-从电子材料到军事弹药[J]. 中国钨业, 2001, 16(2): 39-41.]
(  0) 0) |
| [15] |
Kabata-Pendias A, Mukherjee A B. Trace elements from soil to human . Berlin, Heidelberg: Springer Berlin Heidelberg, 2007.
(  0) 0) |
| [16] |
Li T. Chemical element abundances in the earth and it's major shells (In Chinese)[J]. Geochimica, 1976, 5(3): 167-174. DOI:10.3321/j.issn:0379-1726.1976.03.004 [黎彤. 化学元素的地球丰度[J]. 地球化学, 1976, 5(3): 167-174.]
(  0) 0) |
| [17] |
Senesi N, Padovano G, Brunetti G. Scandium, titanium, tungsten and zirconium content in commercial inorganic fertilizers and their contribution to soil[J]. Environmental Technology Letters, 1988, 9(9): 1011-1020. DOI:10.1080/09593338809384663
(  0) 0) |
| [18] |
Senesi G S, Baldassarre G, Senesi N, et al. Trace element inputs into soils by anthropogenic activities and implications for human health[J]. Chemosphere, 1999, 39(2): 343-377. DOI:10.1016/S0045-6535(99)00115-0
(  0) 0) |
| [19] |
Fu M H, Tabatabai M A. Tungsten content of soils, plants, and sewage sludges in Iowa[J]. Journal of Environmental Quality, 1988, 17(1): 146-148.
(  0) 0) |
| [20] |
Wang S F, He M. Environmental background value and distribution rule of molybdenum and tungsten in soil of China (In Chinese)[J]. Chinese Journal of Soil Science, 1991, 22(6): 252-253. [王素芳, 贺铭. 我国土壤中钼、钨的环境背景值及分布规律[J]. 土壤通报, 1991, 22(6): 252-253.]
(  0) 0) |
| [21] |
Lin C Y, Li R P, Cheng H G, et al. Tungsten distribution in soil and rice in the vicinity of the world's largest and longest-operating tungsten mine in China[J]. PLoS One, 2014, 9(3): e91981. DOI:10.1371/journal.pone.0091981
(  0) 0) |
| [22] |
Pyatt F B, Pyatt A J, Lane C. The bioaccumulation of tungsten and copper by organisms inhabiting metalliferous areas in North Queensland, Australia: An evaluation of potential health implications[J]. Journal of Health and Environmental Research, 2004, 3(1): 13-18.
(  0) 0) |
| [23] |
Wilson B, Pyatt F B. Bio-availability of tungsten in the vicinity of an abandoned mine in the English Lake District and some potential health implications[J]. The Science of the Total Environment, 2006, 370(2/3): 401-408.
(  0) 0) |
| [24] |
Chen M, Li F G, Hu L W, et al. Occurrence and release of tungsten from river depositions in typical mining areas of southern Jiangxi Province (In Chinese)[J]. Chemical Industry and Engineering Progress, 2019, 38(9): 4320-4326. [陈明, 李凤果, 胡兰文, 等. 赣南典型矿区河流沉积物钨的赋存特征及释放规律[J]. 化工进展, 2019, 38(9): 4320-4326.]
(  0) 0) |
| [25] |
Steenstra P, Strigul N, Harrison J. Tungsten in Washington State surface waters[J]. Chemosphere, 2020, 242: 125151. DOI:10.1016/j.chemosphere.2019.125151
(  0) 0) |
| [26] |
Dermatas D, Braida W, Christodoulatos C, et al. Solubility, sorption, and soil respiration effects of tungsten and tungsten alloys[J]. Environmental Forensics, 2004, 5(1): 5-13. DOI:10.1080/15275920490423980
(  0) 0) |
| [27] |
Clausen J L, Bostick B C, Bednar A, et al. Tungsten Speciation in Firing Range Soils[R]. Engineer Research and Development Center TR-11-1, 2011: 1-69.
(  0) 0) |
| [28] |
Ringelberg D B, Reynolds C M, Winfield L E, et al. Tungsten effects on microbial community structure and activity in a soil[J]. Journal of Environmental Quality, 2009, 38(1): 103-110. DOI:10.2134/jeq2008.0022
(  0) 0) |
| [29] |
Du H H, Xu Z L, Hu M, et al. Natural organic matter decreases uptake of W(Ⅵ), and reduces W(Ⅵ)to W(Ⅴ), during adsorption to ferrihydrite[J]. Chemical Geology, 2020, 540: 119567. DOI:10.1016/j.chemgeo.2020.119567
(  0) 0) |
| [30] |
Sun J, Bostick B C. Effects of tungstate polymerization on tungsten(Ⅵ)adsorption on ferrihydrite[J]. Chemical Geology, 2015, 417: 21-31. DOI:10.1016/j.chemgeo.2015.09.015
(  0) 0) |
| [31] |
Hobson C, Kulkarni H V, Johannesson K H, et al. Origin of tungsten and geochemical controls on its occurrence and mobilization in shallow sediments from Fallon, Nevada, USA[J]. Chemosphere, 2020, 260: 127577. DOI:10.1016/j.chemosphere.2020.127577
(  0) 0) |
| [32] |
Bostick B C, Sun J, Landis J D, et al. Tungsten speciation and solubility in munitions-impacted soils[J]. Environmental Science & Technology, 2018, 52(3): 1045-1053.
(  0) 0) |
| [33] |
Oburger E, Vergara Cid C, Schwertberger D, et al. Response of tungsten (W) solubility and chemical fractionation to changes in soil pH and soil aging[J]. The Science of the Total Environment, 2020, 731: 139224. DOI:10.1016/j.scitotenv.2020.139224
(  0) 0) |
| [34] |
Oburger E, Vergara Cid C, Preiner J, et al. pH-dependent bioavailability, speciation, and phytotoxicity of tungsten(W)in soil affect growth and molybdoenzyme activity of nodulated soybeans[J]. Environmental Science & Technology, 2018, 52(11): 6146-6156.
(  0) 0) |
| [35] |
Li R P, Wang W J, Wang S L, et al. Comparison of two sequential extraction procedures for tungsten fractionation in the tungsten mining soils[J]. RSC Advances, 2019, 9(61): 35456-35462. DOI:10.1039/C9RA07158J
(  0) 0) |
| [36] |
Bednar A J, Jones W T, Chappell M A, et al. A modified acid digestion procedure for extraction of tungsten from soil[J]. Talanta, 2010, 80(3): 1257-1263. DOI:10.1016/j.talanta.2009.09.017
(  0) 0) |
| [37] |
Bednar A J, Mirecki J E, Inouye L S, et al. The determination of tungsten, molybdenum, and phosphorus oxyanions by high performance liquid chromatography inductively coupled plasma mass spectrometery[J]. Talanta, 2007, 72(5): 1828-1832. DOI:10.1016/j.talanta.2007.02.016
(  0) 0) |
| [38] |
El-Shahawi M S, Al Khateeb L A. Spectrofluorometric determination and chemical speciation of trace concentrations of tungsten species in water using the ion pairing reagent procaine hydrochloride[J]. Talanta, 2012, 88: 587-592. DOI:10.1016/j.talanta.2011.11.039
(  0) 0) |
| [39] |
Mohammed G I, Ahmad W, Alwael H, et al. A quercetin based fluorescent chemical sensor for ultra-sensitive determination and speciation of tungsten species in water[J]. Spectrochimica Acta Part A, Molecular and Biomolecular Spectroscopy, 2020, 229: 117929. DOI:10.1016/j.saa.2019.117929
(  0) 0) |
| [40] |
Li F B, Xu R K, Tan W F, et al. The frontier and perspectives of soil chemistry in the new era (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1088-1104. [李芳柏, 徐仁扣, 谭文峰, 等. 新时代土壤化学前沿进展与展望[J]. 土壤学报, 2020, 57(5): 1088-1104.]
(  0) 0) |
| [41] |
Yang J J, Wang Y H, Wang J, et al. Microscale soil chemistry of heavy metals: Research process and perspective (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 530-539. [杨建军, 王艺皓, Wang Jian, 等. 微尺度重金属土壤化学研究进展与展望[J]. 土壤学报, 2020, 57(3): 530-539.]
(  0) 0) |
| [42] |
Hur H, Reeder R J. Tungstate sorption mechanisms on boehmite: Systematic uptake studies and X-ray absorption spectroscopy analysis[J]. Journal of Colloid and Interface Science, 2016, 461: 249-260. DOI:10.1016/j.jcis.2015.09.011
(  0) 0) |
| [43] |
Sallman B, Rakshit S, Lefèvre G. Influence of phosphate on tungstate sorption on hematite: A macroscopic and spectroscopic evaluation of the mechanism[J]. Chemosphere, 2018, 213: 596-601. DOI:10.1016/j.chemosphere.2018.09.157
(  0) 0) |
| [44] |
Davantès A, Costa D, Lefèvre G. Infrared study of(poly)tungstate ions in solution and sorbed into layered double hydroxides: Vibrational calculations and in situ analysis[J]. The Journal of Physical Chemistry C, 2015, 119(22): 12356-12364. DOI:10.1021/acs.jpcc.5b01578
(  0) 0) |
| [45] |
Davantès A, Costa D, Sallman B, et al. Surface polymerization of Mo(Ⅵ)and W(Ⅵ)anions on hematite revealed by in situ infrared spectroscopy and DFT+U theoretical study[J]. The Journal of Physical Chemistry C, 2017, 121(1): 324-332. DOI:10.1021/acs.jpcc.6b09721
(  0) 0) |
| [46] |
Davantès A, Lefèvre G. In situ characterization of(poly)molybdate and(poly)tungstate ions sorbed onto iron(hydr)oxides by ATR-FTIR spectroscopy[J]. The European Physical Journal Special Topics, 2015, 224(9): 1977-1983. DOI:10.1140/epjst/e2015-02514-8
(  0) 0) |
| [47] |
Rakshit S, Sallman B, Davantés A, et al. Tungstate(Ⅵ)sorption on hematite: An in situ ATR-FTIR probe on the mechanism[J]. Chemosphere, 2017, 168: 685-691. DOI:10.1016/j.chemosphere.2016.11.007
(  0) 0) |
| [48] |
Kashiwabara T, Kubo S, Tanaka M, et al. Stable isotope fractionation of tungsten during adsorption on Fe and Mn(oxyhydr)oxides[J]. Geochimica et Cosmochimica Acta, 2017, 204: 52-67. DOI:10.1016/j.gca.2017.01.031
(  0) 0) |
| [49] |
Johannesson K H, Dave H B, Mohajerin T J, et al. Controls on tungsten concentrations in groundwater flow systems: The role of adsorption, aquifer sediment Fe(Ⅲ)oxide/oxyhydroxide content, and thiotungstate formation[J]. Chemical Geology, 2013, 351: 76-94. DOI:10.1016/j.chemgeo.2013.05.002
(  0) 0) |
| [50] |
Du H H, Tao J, Nie N, et al. Adsorption of antimony by α-Al2O3–bacteria binary composite colloid (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(3). DOI:10.11766/trxb201911080492 [杜辉辉, 陶洁, 聂宁, 等. α-氧化铝–细菌二元复合胶体对锑的吸附研究[J]. 土壤学报, 2021, 58(3).]
(  0) 0) |
| [51] |
安礼航, 刘敏超, 张建强, 等. 土壤中砷的来源及迁移释放影响因素研究进展[J]. 土壤, 2020, 52(2): 234-246. An L H, Liu M C, Zhang J Q, et al. Sources of arsenic in soil and affecting factors of migration and release: A review[J]. 2020, 52(2): 234-246. (  0) 0) |
| [52] |
Li Y, Zhou L, Du H H, et al. Co-adsorption of Cd(Ⅱ)and As(Ⅴ)to soil bacterium Delftia sp. (In Chinese)[J]. Soils, 2020, 52(5): 935-940. [李杨, 周丽, 杜辉辉, 等. Cd(Ⅱ)与As(Ⅴ)在一株土壤细菌Delftia sp.上的共吸附研究[J]. 土壤, 2020, 52(5): 935-940.]
(  0) 0) |
| [53] |
Iwai T, Hashimoto Y. Adsorption of tungstate(WO4)on birnessite, ferrihydrite, gibbsite, goethite and montmorillonite as affected by pH and competitive phosphate(PO4)and molybdate(MoO4))oxyanions[J]. Applied Clay Science, 2017, 143: 372-377. DOI:10.1016/j.clay.2017.04.009
(  0) 0) |
| [54] |
Cao Y, Guo Q, Shu Z, et al. Tungstate removal from aqueous solution by nanocrystalline iowaite: An iron-bearing layered double hydroxide[J]. Environmental Pollution, 2019, 247: 118-127. DOI:10.1016/j.envpol.2019.01.021
(  0) 0) |
| [55] |
Gustafsson J P. Modelling molybdate and tungstate adsorption to ferrihydrite[J]. Chemical Geology, 2003, 200(1/2): 105-115.
(  0) 0) |
| [56] |
Wasylenki L E, Schaefer A T, Chanda P, et al. Differential behavior of tungsten stable isotopes during sorption to Fe versus Mn oxyhydroxides at low ionic strength[J]. Chemical Geology, 2020, 558: 119836. DOI:10.1016/j.chemgeo.2020.119836
(  0) 0) |
| [57] |
Ogi T, Makino T, Iskandar F, et al. Heat-treated Escherichia coli as a high-capacity biosorbent for tungsten anions[J]. Bioresource Technology, 2016, 218: 140-145. DOI:10.1016/j.biortech.2016.06.076
(  0) 0) |
| [58] |
Ogi T, Makino T, Okuyama K, et al. Selective biosorption and recovery of tungsten from an urban mine and feasibility evaluation[J]. Industrial & Engineering Chemistry Research, 2016, 55(10): 2903-2910. DOI:10.1021/acs.iecr.5b04843
(  0) 0) |
| [59] |
James B, Wang G. Accumulation characteristics of tungsten(W)and its potential health risk assessment in the soil-vegetable system under field conditions[J]. Journal of Soils and Sediments, 2020, 20(2): 599-608. DOI:10.1007/s11368-019-02411-6
(  0) 0) |
| [60] |
Petruzzelli G, Pedron F. Influence of increasing tungsten concentrations and soil characteristics on plant uptake: Greenhouse experiments with Zea mays[J]. Applied Sciences, 2019, 9(19): 3998. DOI:10.3390/app9193998
(  0) 0) |
| [61] |
Davies E B, Stockdill S M J. A pasture response to sodium tungstate on a new Zealand soil[J]. Nature, 1956, 178(4538): 866. DOI:10.1038/178866a0
(  0) 0) |
| [62] |
Kumar A, Aery N C. Effect of tungsten on growth, biochemical constituents, molybdenum and tungsten contents in wheat[J]. Plant, Soil and Environment, 2011, 57(11): 519-525. DOI:10.17221/345/2011-PSE
(  0) 0) |
| [63] |
Tyagi V V S. Stimulatory effects of sodium tungstate on the growth of the blue-green alga, Anabaena Doliolum[J]. Annals of Botany, 1974, 38(2): 485-491. DOI:10.1093/oxfordjournals.aob.a084833
(  0) 0) |
| [64] |
Adamakis I D S, Eleftheriou E P, Rost T L. Effects of sodium tungstate on the ultrastructure and growth of pea(Pisum sativum)and cotton(Gossypium hirsutum)seedlings[J]. Environmental and Experimental Botany, 2008, 63(1/2/3): 416-425.
(  0) 0) |
| [65] |
Kumar A, Aery N C. Effect of tungsten on the growth, dry-matter production, and biochemical constituents of cowpea[J]. Communications in Soil Science and Plant Analysis, 2012, 43(7): 1098-1107. DOI:10.1080/00103624.2012.656171
(  0) 0) |
| [66] |
Kennedy A J, Johnson D R, Seiter J M, et al. Tungsten toxicity, bioaccumulation, and compartmentalization into organisms representing two trophic levels[J]. Environmental Science & Technology, 2012, 46(17): 9646-9652.
(  0) 0) |
| [67] |
Strigul N, Koutsospyros A, Arienti P, et al. Effects of tungsten on environmental systems[J]. Chemosphere, 2005, 61(2): 248-258. DOI:10.1016/j.chemosphere.2005.01.083
(  0) 0) |
| [68] |
Hale K L, Tufan H A, Pickering I J, et al. Anthocyanins facilitate tungsten accumulation in Brassica[J]. Physiologia Plantarum, 2002, 116(3): 351-358. DOI:10.1034/j.1399-3054.2002.1160310.x
(  0) 0) |
| [69] |
Burgess B K, Lowe D J. Mechanism of molybdenum nitrogenase[J]. Chemical Reviews, 1996, 96(7): 2983-3012. DOI:10.1021/cr950055x
(  0) 0) |
| [70] |
Wichard T, Bellenger J P, Loison A, et al. Catechol siderophores control tungsten uptake and toxicity in the nitrogen-fixing bacterium Azotobacter vinelandii[J]. Environmental Science & Technology, 2008, 42(7): 2408-2413.
(  0) 0) |
| [71] |
Tajima Y. The effects of tungstophosphate and tungstosilicate on various stress promoters transformed in Escherichia coli[J]. Journal of Inorganic Biochemistry, 2003, 94(1/2): 155-160.
(  0) 0) |
| [72] |
Inouye L S, Jones R P, Bednar A J. Tungsten effects on survival, growth, and reproduction in the earthworm, Eisenia fetida[J]. Environmental Toxicology and Chemistry, 2006, 25(3): 763-768. DOI:10.1897/04-578R.1
(  0) 0) |
| [73] |
Guandalini G S, Zhang L S, Fornero E, et al. Tissue distribution of tungsten in mice following oral exposure to sodium tungstate[J]. Chemical Research in Toxicology, 2011, 24(4): 488-493. DOI:10.1021/tx200011k
(  0) 0) |
| [74] |
Kelly A D R, Lemaire M, Young Y K, et al. In vivo tungsten exposure alters B-cell development and increases DNA damage in murine bone marrow[J]. Toxicological Sciences, 2013, 131(2): 434-446. DOI:10.1093/toxsci/kfs324
(  0) 0) |
| [75] |
Strigul N, Koutsospyros A, Christodoulatos C. Tungsten speciation and toxicity: Acute toxicity of mono- and poly-tungstates to fish[J]. Ecotoxicology and Environmental Safety, 2010, 73(2): 164-171. DOI:10.1016/j.ecoenv.2009.08.016
(  0) 0) |
| [76] |
Seiler R L, Stollenwerk K G, Garbarino J R. Factors controlling tungsten concentrations in ground water, Carson Desert, Nevada[J]. Applied Geochemistry, 2005, 20(2): 423-441. DOI:10.1016/j.apgeochem.2004.09.002
(  0) 0) |
| [77] |
Sheppard P R, Ridenour G, Speakman R J, et al. Elevated tungsten and cobalt in airborne particulates in Fallon, Nevada: Possible implications for the childhood leukemia cluster[J]. Applied Geochemistry, 2006, 21(1): 152-165. DOI:10.1016/j.apgeochem.2005.09.012
(  0) 0) |
| [78] |
Bolt A M, Sabourin V, Molina M F, et al. Tungsten targets the tumor microenvironment to enhance breast cancer metastasis[J]. Toxicological Sciences, 2015, 143(1): 165-177. DOI:10.1093/toxsci/kfu219
(  0) 0) |
| [79] |
Laulicht F, Brocato J, Cartularo L, et al. Tungsten-induced carcinogenesis in human bronchial epithelial cells[J]. Toxicology and Applied Pharmacology, 2015, 288(1): 33-39. DOI:10.1016/j.taap.2015.07.003
(  0) 0) |
| [80] |
Menke A, Guallar E, Cowie C C. Metals in urine and diabetes in United States adults[J]. Diabetes, 2015, 65(1): 164-171.
(  0) 0) |
| [81] |
Navas-Acien A, Silbergeld E K, Pastor-Barriuso R, et al. Arsenic exposure and prevalence of type 2 diabetes in US adults[J]. The Journal of the American Medical Association, 2008, 300(7): 814-822. DOI:10.1001/jama.300.7.814
(  0) 0) |
| [82] |
Yorita Christensen K L. Metals in blood and urine, and thyroid function among adults in the United States 2007-2008[J]. International Journal of Hygiene and Environmental Health, 2013, 216(6): 624-632. DOI:10.1016/j.ijheh.2012.08.005
(  0) 0) |
| [83] |
United States Center for Disease Control. A cross-sectional exposure assessment of environmental exposures in Churchill County, Nevada, US Centers for Disease Control and Prevention, Atlanta[OL]. 2003. http://www.cdc.gov/nceh/clusters/fallon
(  0) 0) |
| [84] |
Norton G J, Douglas A, Lahner B, et al. Genome wide association mapping of grain arsenic, copper, molybdenum and zinc in rice(Oryza sativa L.)grown at four international field sites[J]. PLoS One, 2014, 9(2): e89685. DOI:10.1371/journal.pone.0089685
(  0) 0) |
| [85] |
Huang X Y, Liu H, Zhu Y F, et al. Natural variation in a molybdate transporter controls grain molybdenum concentration in rice[J]. The New Phytologist, 2019, 221(4): 1983-1997. DOI:10.1111/nph.15546
(  0) 0) |
| [86] |
Jia T, Jia Y Y, Yu S J, et al. Pollution of molybdenum and heavy metals of the soils and rice near a molybdenum mining site in eastern Fujian (In Chinese)[J]. Environmental Monitoring in China, 2015, 31(1): 45-49. DOI:10.3969/j.issn.1002-6002.2015.01.009 [贾婷, 贾洋洋, 余淑娟, 等. 闽东某钼矿周边农田土壤钼和重金属的污染状况[J]. 中国环境监测, 2015, 31(1): 45-49.]
(  0) 0) |
| [87] |
Liu M. The effect of Mo on human health (In Chinese)[J]. China Molybdenum Industry, 2001, 25(5): 43-45. DOI:10.3969/j.issn.1006-2602.2001.05.012 [刘牧. 钼对人体健康的影响[J]. 中国钼业, 2001, 25(5): 43-45.]
(  0) 0) |
| [88] |
Chen Y Y, Liu W S, Yuan M, et al. Advancement in researches on the absorption, translocation, detoxification and fractionation of rare earth elements in hyperaccumulators (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(4): 785-795. [陈莺燕, 刘文深, 袁鸣, 等. 超富集植物对稀土元素吸收转运解毒与分异的研究进展[J]. 土壤学报, 2019, 56(4): 785-795.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59

