生物质炭是在无氧或缺氧条件下以生物质为原料经过高温裂解生成的一种高度芳香化的多孔固体物质。与新鲜植物残体返还土壤相比,生物质炭能够减少CO2的大气排放,具有“碳负效应”,因而被认为是土壤固碳的潜在有效措施之一[1-3]。水稻是我国种植面积最大的农作物之一,每年水稻秸秆产量约为8×108 t[4]。利用水稻秸秆制备生物质炭不仅容易获取原料,也是利用生物质生产能源的途径之一。
生物质炭的分解包括生物和非生物过程,前者包括生物同化和呼吸作用,后者包括化学氧化、光化学氧化和溶解作用[5-6]。Zimmermann等[7]使用新鲜和老化生物质炭分别在30 ℃、40 ℃、50 ℃和60 ℃下进行室内培养,除高温(50 ℃和60 ℃)条件下老化生物质炭的分解由非生物过程主导外,新鲜生物质炭的分解以及低温条件下老化生物质炭的分解都是生物过程占主导。生物质炭包含易分解碳和难分解碳。众多研究者利用双一级动力学模型对生物质炭分解过程进行拟合,研究了生物质炭的2个碳库的分解速率和平均停留时间(mean residence time,MRT)。其中,难分解碳库的MRT的变化范围较大,从数十年、数百年至数千年[8-10]。Wang等[11]利用24项研究中生物质炭来源的CO2排放进行元分析(meta-analysis),通过双指数模型计算得到的生物质炭的快速碳库和慢速碳库的MRT分别为108 d和556 a。然而,目前关于生物质炭分解的报道主要是室内实验的结果,野外原位试验相对缺乏。
制备温度是影响生物质炭理化性质的重要因素之一。随制备温度的升高,生物质炭的芳香化程度、比表面积、C/N、pH等主要理化性质均提高[12-14]。一般而言,高温制备生物质炭的稳定性高于低温制备生物质炭[9]。前人对亚马逊富含黑炭的人为土的研究表明,生物质炭的化学组成是影响其稳定性的重要因素[15-16]。而且,非芳香碳的比例和芳香碳的缩合程度可以用来预测生物质炭在土壤中的稳定性[9]。但是,野外条件下土壤温度、水分等环境条件对生物质炭稳定性的影响还缺乏报道。
中国的森林碳汇主要来自人工林的贡献[17]。在气候变化的背景下增强人工林土壤碳累积可能是弥补CO2排放的一种有效措施,对于保障我国在世界碳贸易谈判中的发言权、维持全球及区域气候稳定、以及实现我国提出的“碳达峰”和“碳中和”目标具有重要意义。榉树作为一种常见的景观树种,在我国北亚热带地区具有较大的栽培面积。本研究依托于南京林业大学下蜀林场,以水稻为原料在300 ℃和500 ℃下制备两种生物质炭,利用13C稳定同位素示踪技术开展野外原位试验,旨在研究不同温度制备水稻生物质炭在榉树人工林土壤的稳定性,探究生物质炭的稳定性与自身理化性质以及土壤温度、水分的关系。研究结果可以为深入探讨生物质炭稳定性的理论研究提供基础,并为合理施用生物质炭的实践提供依据。
1 材料与方法 1.1 研究区概况研究区位于江苏省句容市下蜀镇南京林业大学下蜀林场(31°59′N,119°14′E)。该区地处北亚热带季风气候区,四季分明,降水充沛,日照充足,日平均温度高于10 ℃的植物生长期为226 d,总积温4 860 ℃,年均日照时间2 157 h,年均降水量为1 056 mm。林场位于呈东西走向的宁镇山脉东段的武岐山、空青山南侧。林场内的土壤以黄棕壤和山地黄棕壤为主[18]。
1.2 供试材料供试生物质炭以13C标记水稻秸秆为原料。2016年5月,在南京林业大学下蜀林场开展水稻盆栽试验。9月份水稻进入灌浆期后,利用13C脉冲标记法对水稻进行13C标记[19]。标记完成后收获水稻,70 ℃烘至恒重。剪成3~5 cm长,使用专业炭化炉(专利批号200920232191.9)在300 ℃和500 ℃制备生物质炭,制备方法详见Lu等[20]。
采用CHNS/O元素分析仪(PE 2400系列Ⅱ,铂金埃尔默公司,美国)测定生物质炭的全碳(TC)和全氮(TN),采用滴定法测生物质炭无机碳(IC)[21],通过生物质炭全碳(TC)和无机碳(IC)的差值计算有机碳含量,采用靛酚蓝比色法和紫外分光光度法测定铵态氮(
试验共设2个处理,分别为向榉树人工林土壤中添加300 ℃和500 ℃制备的生物质炭,记为B300和B500。每个处理设置3个重复。2016年11月,在林场内选取长势均一的榉树人工林。该榉树林的株行距是2.5 m×2.5 m,总面积约为640 m2,立地条件均一。在林中选取1个9.5 m×9.5 m的区域作为样地。样地土壤pH 6.37,全碳8.6 g·kg-1,全氮0.7 g·kg-1。随机将样地分为6个2.5 m×2.5 m的小样方,在其中心位置,钻取直径9 cm、高20 cm的土壤,剔除植物根系并过4 mm筛,混合均匀。
取1 100 g(以烘干土计)已过筛土壤回填至1个底部带有纱布(200目)且上部带有凹槽的PVC柱(内径8 cm、外径9 cm、高20 cm)。每个PVC柱的生物质炭添加量为11.0 g(过60目筛,土壤质量的1%),相当于22 t·hm-2的田间施用量(20 cm深,土壤容重1.10 g·cm-3计)。样地内共布置6个PVC柱,稳定一周后开始气体样品采集。第1次采样时间为2016年11月12日,记为0 d。此后基本每周采集1次气体样品,共采集26次(因天气原因第2、3次采气的时间间隔为13 d),最后1次采集样品的时间为2017年5月13日,即182 d。
1.4 样品采集与分析采用静态箱法采集土壤所排放的气体样品。静态箱由PVC材料制成,分为顶箱(外径11.0 cm、高15.0 cm)和上部带凹槽(外径12.3 cm)的底座(即PVC柱)两部分。在顶箱的顶部有一开孔,用螺丝固定一块有机玻璃(聚甲基丙烯酸甲酯)材料制作的圆片进行覆盖,圆片上有一个黄色硅胶垫密封的采气孔。为了避免顶箱受太阳照射后升温,顶箱外包裹一层隔热石棉,最外层再用铝箔包裹。顶箱内安装有一直径50 mm的直流风扇,采样期间由一块电池驱动用于混合箱内气体。每次采集样品前,先向底座凹槽中注入适量蒸馏水,再将顶箱放置在凹槽中确保不漏气,接通风扇电源,接着用30 mL注射器将静态箱内气体混匀3次,然后采集25 mL箱内气体并注入预先抽真空的气体样品瓶中。之后向静态箱内注入同等体积(25 mL)的高纯氮气以免产生负压。每次采样固定在上午的10:00至11:30进行,每个PVC柱采集4针,每针间隔0.5 h,即分别在静态箱密闭0、0.5、1和1.5 h后采集气体[25]。每次采集气体时使用AZS-100土壤温湿度测定仪(澳作公司,北京)测定5 cm深度处的土壤温度和水分含量。气体样品采完后将其带回实验室进行分析,CO2浓度和CO2-δ13C分别使用气相色谱仪(7890B,安捷伦公司,美国)和稳定同位素比质谱仪(Delta V Advantage,赛默飞世尔,美国)进行测定。
1.5 数据处理土壤CO2通量的计算公式如下[26]:
| $ F = \rho \frac{V}{A} \times \frac{P}{{{P_0}}} \times \frac{{{T_0}}}{T} \times \frac{{d{C_t}}}{{dt}} $ | (1) |
式中,F为被测气体的CO2-C排放通量(mg·m-2·h-1),ρ为标准状态下CO2-C的密度(0.54 kg·m-3),A为箱体底面积(m2),V为箱体体积(m3),
土壤CO2累积排放量的计算公式如下:
| $ T = \sum\nolimits_{i = 1}^n {({F_{i + 1}} + {F_i})} /2 \times ({t_{i + 1}} - {t_i}) \times 24 \times 0.001 $ | (2) |
式中,T为CO2-C累积排放量(g·m-2),F为土壤CO2-C排放通量(mg·m-2·h-1),t为采样时间(d),i为采样次数,n为总采样次数,ti+1 - ti为相邻两次采样的间隔天数(d)。
生物质炭来源的CO2-C通量(Fsoil,mg·m-2·h-1)的计算公式如下:
| $ {F_{{\text{soil}}}} = F \times {f_{\text{b}}} $ | (3) |
式中,F为添加生物质炭的土壤CO2-C通量(mg·m-2·h-1),fb为来自生物质炭的CO2通量占总CO2通量的比例,其通过以下公式计算[27]:
| $ {f_{\text{b}}} = (\delta - {\delta _{\text{s}}})/({\delta _{\text{b}}} - {\delta _{\text{s}}}) $ | (4) |
式中,δb为生物质炭OC-δ13C(‰),δs为土壤本身OC-δ13C(‰),δ为添加生物质炭的土壤所排放的CO2-δ13C(‰),其是根据Keeling Plot原理通过线性拟合而得出:
| $ {\delta ^{13}}{{\text{C}}_{{\text{air}}}} = M(1/c) + \delta $ | (5) |
式中,δ13Cair为箱内气体CO2-δ13C(‰),c为箱内气体CO2浓度(10-6),M为响应系数,即线性拟合的斜率。
利用双指数模型对生物质炭的累积分解量进行拟合[28],公式如下:
| $ {C_{{\text{B}}t}} = C \times (1 - {e^{ - {K_{1t}}}}) + (100 - C)(1 - {e^{ - {K_{2t}}}}) $ | (6) |
式中,CBt为t时刻生物质炭累积分解的百分比(%),C和(100-C)分别为易分解组分和难分解组分的含量(%),K1t(d-1)和K2t(a-1)分别为易分解组分和难分解组分的分解速率常数。K1t和K2t的倒数即为生物质炭中易分解组分和难分解组分的MRT。
采用独立样本t检验的方法对2种制备温度生物质炭的分解速率、MRT、累积分解量进行差异性比较,显著性水平设为P < 0.05。采用Pearson相关分析检验生物质炭的分解速率与土壤温度、水分之间的相关性。采用SPSS 22.0进行统计分析,采用Origin 2017绘制图表。
2 结果 2.1 制备温度对生物质炭理化性质的影响300 ℃生物质炭的pH、OC:ON、灰分含量均低于500 ℃生物质炭,而TN、
|
|
表 1 两种温度制备生物质炭的基本性质 Table 1 Basic properties of biochars pyrolyzed at 300 ℃ and 500 ℃ |
试验经历秋季、冬季和春季的季节交替,土壤温度呈现明显的前期下降后期上升趋势,最高值(25.0 ℃)和最低值(7.3 ℃)分别出现在182 d和103 d,平均温度为14.7 ℃(图 1)。土壤体积含水量的变化范围为9.3%~14.0%(图 1),变异系数为9.9%。
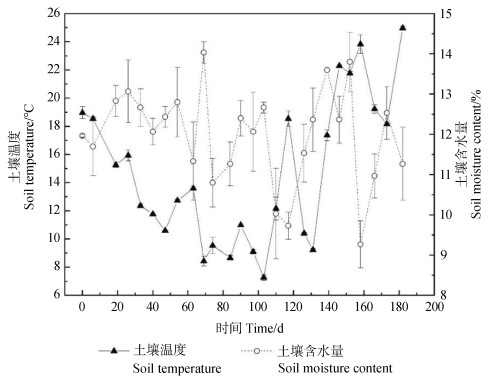
|
图 1 土壤温度和含水量随培养时间的变化 Fig. 1 Dynamics of soil temperature and moisture during the in situ experiment |
以生物质炭来源的CO2释放通量表征生物质炭的分解速率,300 ℃和500 ℃生物质炭的分解速率均呈现前期快速降低,之后相对稳定,而后期又有所升高的趋势(图 2a)。300 ℃生物质炭在0~19 d分解速率快速下降而500 ℃生物质炭在0~6 d分解速率快速下降(图 2a)。除19 d和54 d外,300 ℃生物质炭的分解速率始终大于500 ℃生物质炭(图 2a)。整个培养期间,300 ℃生物质炭的分解速率的最大值出现在0 d(18.5 mg·m-2·h-1),最小值出现在54 d(0.017 mg·m-2·h-1),平均值为2.80 mg·m-2·h-1。500 ℃生物质炭的分解速率的最大值出现在0 d(5.24 mg·m-2·h-1),最小值出现在139 d(0.019 mg·m-2·h-1),平均值为0.927 mg·m-2·h-1。相关性分析表明,300 ℃生物质炭的分解速率与土壤温度显著相关(r = 0.417,P = 0.034,n = 26),与土壤含水量的相关性不显著(r = -0.035,P = 0.866,n = 26);500 ℃生物质炭的分解速率与土壤温度(r = 0.123,P = 0.549,n = 26)和土壤含水量(r = 0.108,P = 0.598,n = 26)的相关性均不显著。整个野外试验期间,300 ℃生物质炭的累积分解量低于500 ℃生物质炭,分别为10.5和3.65 g·m-2(图 2b),分别占添加的生物质炭OC总量的0.82%和0.27%。
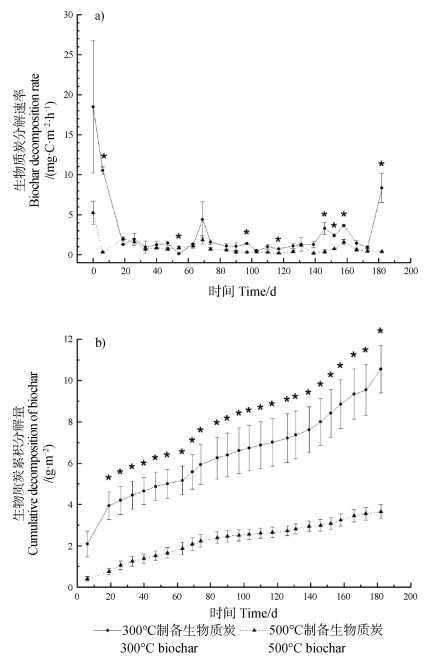
|
注:相同培养时间,标有“*”的差异显著。 Note: * denotes a significant difference between treatments on the same day at P < 0.05. 图 2 两种温度制备生物质炭在榉树人工林土壤的分解速率(a)和累积分解量(b)动态 Fig. 2 Dynamics of decomposition rate(a)and cumulative decomposition(b)of biochars pyrolyzed at 300 ℃ and 500 ℃ during 182 d in situ experiment in a Zelkova serrata plantation soil |
双指数模型拟合的结果表明,与500 ℃生物质炭相比,300 ℃生物质炭拥有较高的易分解碳和较低的难分解碳(表 2),这与300 ℃生物质炭含有较高的热水提取DOC含量以及更高的烷氧碳和羰基碳含量是一致的。300 ℃生物质炭的易分解碳库和难分解碳库的MRT分别低于500 ℃生物质炭的相应碳库的MRT(表 2),表明300 ℃生物质炭的分解速率更快。难分解碳库占生物质炭OC库的99%以上,300 ℃和500 ℃生物质炭的难分解碳库的MRT分别是99.8 a和302 a(表 2)。
|
|
表 2 300 ℃和500 ℃生物质炭在榉树人工林土壤分解的双指数模型拟合 Table 2 Double exponential fitting of the decomposition of biochars pyrolyzed at 300 ℃ and 500 ℃ during 182 d in situ experiment in a Zelkova serrata plantation soil |
生物质炭的分解速率呈现前期迅速下降,之后保持相对较低水平的动态(图 2a),这表明生物质炭的分解遵循双阶段模式,与大部分的研究结果相一致[9-11, 29]。试验前期,生物质炭中一些不稳定形态的碳可能会优先被土壤微生物作为碳源利用,这部分不稳定形态的碳在生物质炭中的含量较低,会在较短时间内被分解[30]。生物质炭中含量高的烷基碳和芳香碳,具有较高的化学和生物学稳定性,这使得生物质炭在后期的分解缓慢[31]。目前对生物质炭分解的研究主要是室内培养实验,得到的生物质炭MRT跨度非常大,从几十年到几万年[8, 32-35]。仅有几项有关生物质炭分解的原位研究[32, 36-38](表 3),其中Ventura等[36]得出气化生物质炭的MRT很低,只有24.3 a。本研究中300 ℃生物质炭的难分解碳库的MRT为99.8 a,略低于Rasse等[37]报道的芒草生物质炭(600~700 ℃)在温带农田土壤125 a的MRT,这可能是因为本研究中生物质炭制备温度较低而引起的。本研究中500 ℃生物质炭的难分解碳库的MRT为302 a,高于Maestrini等[38]报道的松木生物质炭(450 ℃)在温带森林土壤191 a的MRT,而低于Major等[32]报道的芒果树生物质炭(400~600 ℃)在热带稀树草原土壤600 a的MRT,这可能主要是由研究地点、土壤类型等的差异而引起。
|
|
表 3 已报道的生物质炭在野外原位条件下的稳定性 Table 3 The reported stability of biochars through in situ experiments |
500 ℃生物质炭的MRT高于300 ℃生物质炭(表 2)。低温制备的生物质炭含有更多的易分解组分,含有较多无定型形态的碳,更易被土壤微生物利用[38]。生物质炭的芳香化结构是其能够长期保持相对稳定的重要基础[31, 39]。一些研究认为,H:C可以表征生物炭的芳香性。生物质炭的H:C比值越小,芳香性越强,结构越稳定[14, 40]。300 ℃和500 ℃的H:C分别为0.060和0.011(表 1),证实生物质炭自身的化学组成对其稳定性影响显著。除生物质炭自身的性质外,生物质炭与土壤的交互作用也可能对其稳定性产生影响。高温制备生物质炭的pH较高,对土壤pH的提高可能会更大,从而改变土壤微生物的群落组成和结构[41],最终影响生物质炭分解的生物过程。此外,生物质炭添加至土壤后可能与土壤中的矿物形成有机-无机复合体[42],降低其被土壤微生物利用的可能性,从而延长其在土壤中的停留时间。
环境温度对生物质炭分解的影响尚未达成一致。部分研究认为,温度条件会影响生物质炭的分解[43-44]。与之相反,也有研究认为环境温度对生物质炭的分解影响较小,而生物质炭本身的理化性质的影响更大[16, 45]。本研究发现,300 ℃生物质炭的分解速率与土壤温度正相关,而对于500 ℃生物质炭则不存在相关性。生物质炭的分解主要是由土壤微生物所介导的过程。微生物对生物质炭的分解是在胞外酶作用下的酶促反应。一般而言,酶促反应的速率随土壤温度的升高而升高,这可能是300 ℃生物质炭分解速率随土壤温度升高的原因。易分解性不同的有机碳温度敏感性不同。一些研究认为,易分解碳的温度敏感性高于[46]或类似于[47]难分解碳。然而,大部分研究支持难分解碳的温度敏感性高于易分解碳[48-51],这是与化学反应的动力学理论相一致的。不同稳定性的生物质炭的温度敏感性由其碳结构所决定[52]。因此,有机碳组成可能是导致2种生物质炭的稳定性与土壤温度的关系不一致的原因。
4 结论通过182 d的野外原位试验,发现以水稻秸秆为原料在300 ℃和500 ℃制备的生物质炭的累积分解量均不到其有机碳含量的1%。双指数模型拟合表明,500 ℃和300 ℃生物质炭的难分解碳库的平均停留时间MRT分别为302 a和99.8 a,这与前者具有更高的芳香性相一致,从而证明了生物质炭的稳定性主要由其自身有机碳组成和结构而决定。生物质炭的稳定性与土壤温度的关系与生物质炭制备温度有关,300 ℃生物质炭与土壤温度的关系更密切。
| [1] |
Lehmann J. A handful of carbon[J]. Nature, 2007, 447(7141): 143-144. DOI:10.1038/447143a
(  0) 0) |
| [2] |
Zhang H, Voroney R P, Price G W. Effects of temperature and processing conditions on biochar chemical properties and their influence on soil C and N transformations[J]. Soil Biology & Biochemistry, 2015, 83: 19-28.
(  0) 0) |
| [3] |
Lu W W, Zhang Y R, Yao Y X, et al. Biochar-induced priming effects in young and old poplar plantation soils[J]. Phyton-International Journal of Experimental Botany, 2020, 89(1): 13-26.
(  0) 0) |
| [4] |
Wang Y J, Bi Y Y, Gao C Y. The assessment and utilization of straw resources in China[J]. Agricultural Sciences in China, 2010, 9(12): 1807-1815. DOI:10.1016/S1671-2927(09)60279-0
(  0) 0) |
| [5] |
Wu M X, Yang M, Sun X, et al. Research progress in the biotic and abiotic oxidation of biochar (In Chinese)[J]. Acta Ecologica Sinica, 2015, 35(9): 2810-2818. [伍孟雄, 杨敏, 孙雪, 等. 生物质炭生物与非生物氧化特性研究进展[J]. 生态学报, 2015, 35(9): 2810-2818.]
(  0) 0) |
| [6] |
Liu Y X, Liu W, Wu W X, et al. Environmental behavior and effect of biomass-derived black carbon in soil: A review (In Chinese)[J]. Chinese Journal of Applied Ecology, 2009, 20(4): 977-982. [刘玉学, 刘微, 吴伟祥, 等. 土壤生物质炭环境行为与环境效应[J]. 应用生态学报, 2009, 20(4): 977-982.]
(  0) 0) |
| [7] |
Zimmermann M, Bird M I, Wurster C, et al. Rapid degradation of pyrogenic carbon[J]. Global Change Biology, 2012, 18(11): 3306-3316. DOI:10.1111/j.1365-2486.2012.02796.x
(  0) 0) |
| [8] |
Fang Y, Singh B, Singh B P, et al. Biochar carbon stability in four contrasting soils[J]. European Journal of Soil Science, 2014, 65(1): 60-71. DOI:10.1111/ejss.12094
(  0) 0) |
| [9] |
Singh B P, Cowie A L, Smernik R J. Biochar carbon stability in a clayey soil as a function of feedstock and pyrolysis temperature[J]. Environmental Science & Technology, 2012, 46(21): 11770-11778.
(  0) 0) |
| [10] |
Nguyen B T, Koide R T, Dell C, et al. Turnover of soil carbon following addition of switchgrass-derived biochar to four soils[J]. Soil Science Society of America Journal, 2014, 78(2): 531-537. DOI:10.2136/sssaj2013.07.0258
(  0) 0) |
| [11] |
Wang J Y, Xiong Z Q, Kuzyakov Y. Biochar stability in soil: Meta-analysis of decomposition and priming effects[J]. Global Change Biology Bioenergy, 2016, 8(3): 512-523. DOI:10.1111/gcbb.12266
(  0) 0) |
| [12] |
Cai Z H, Chu C J, Zheng H, et al. Effect of pyrolytic temperature and time on characteristics of Typha angustifolia derived biochar and preliminary assessment of the ecological risk (In Chinese)[J]. Environmental Science, 2020, 41(6): 2963-2971. [蔡朝卉, 楚沉静, 郑浩, 等. 热解温度和时间对香蒲生物炭性质的影响及生态风险评估[J]. 环境科学, 2020, 41(6): 2963-2971.]
(  0) 0) |
| [13] |
Zhao S X, Yu X L, Li Z H, et al. Effects of biochar pyrolyzed at varying temperatures on soil organic carbon and its components: Influence on the soil active organic carbon (In Chinese)[J]. Environmental Science, 2017, 38(1): 333-342. [赵世翔, 于小玲, 李忠徽, 等. 不同温度制备的生物质炭对土壤有机碳及其组分的影响: 对土壤活性有机碳的影响[J]. 环境科学, 2017, 38(1): 333-342.]
(  0) 0) |
| [14] |
Jian M F, Gao K F, Yu H P. Effects of different pyrolysis temperatures on the preparation and characteristics of bio-char from rice straw (In Chinese)[J]. Acta Scientiae Circumstantiae, 2016, 36(5): 1757-1765. [简敏菲, 高凯芳, 余厚平. 不同裂解温度对水稻秸秆制备生物炭及其特性的影响[J]. 环境科学学报, 2016, 36(5): 1757-1765.]
(  0) 0) |
| [15] |
Liang B Q, Lehmann J, Solomon D, et al. Stability of biomass-derived black carbon in soils[J]. Geochimica et Cosmochimica Acta, 2008, 72(24): 6069-6078. DOI:10.1016/j.gca.2008.09.028
(  0) 0) |
| [16] |
Cheng C H, Lehmann J, Thies J E, et al. Stability of black carbon in soils across a climatic gradient[J]. Journal of Geophysical Research: Biogeosciences, 2008, 113(G2): G02027.
(  0) 0) |
| [17] |
Fang J Y, Chen A P. Dynamic forest biomass carbon pools in China and their significance (In Chinese)[J]. Acta Botanica Sinica, 2001, 43(9): 967-973. DOI:10.3321/j.issn:1672-9072.2001.09.014 [方精云, 陈安平. 中国森林植被碳库的动态变化及其意义[J]. 植物学报, 2001, 43(9): 967-973.]
(  0) 0) |
| [18] |
李文勤. 水源涵养林生态系统管理模式研究[D]. 南京: 南京林业大学, 2009. Li W Q. Study on ecosystem management mode of water conservation forest[D]. Nanjing: Nanjing Forestry University, 2009. (  0) 0) |
| [19] |
Liu P, Jiang C Y, Li Z P. Quantitative research on effects of nitrogen application rate on distribution of photosynthetic carbon in rice-soil system using 13C pulse labeling technique (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(3): 567-575. [刘萍, 江春玉, 李忠佩. 13C脉冲标记定量研究施氮量对光合碳在水稻-土壤系统中分布的影响[J]. 土壤学报, 2015, 52(3): 567-575.]
(  0) 0) |
| [20] |
Lu W W, Ding W X, Zhang J H, et al. Biochar suppressed the decomposition of organic carbon in a cultivated sandy loam soil: A negative priming effect[J]. Soil Biology & Biochemistry, 2014, 76: 12-21.
(  0) 0) |
| [21] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [22] |
Novak J M, Busscher W J, Laird D L, et al. Impact of biochar amendment on fertility of a southeastern coastal plain soil[J]. Soil Science, 2009, 174(2): 105-112. DOI:10.1097/SS.0b013e3181981d9a
(  0) 0) |
| [23] |
Suliman W, Harsh J B, Abu-Lail N I, et al. Modification of biochar surface by air oxidation: Role of pyrolysis temperature[J]. Biomass and Bioenergy, 2016, 85: 1-11. DOI:10.1016/j.biombioe.2015.11.030
(  0) 0) |
| [24] |
Solum M S, Pugmire R J, Grant D M. Carbon-13 solid-state NMR of Argonne-premium coals[J]. Energy & Fuels, 1989, 3(2): 187-193.
(  0) 0) |
| [25] |
Sackett T E, Basiliko N, Noyce G L, et al. Soil and greenhouse gas responses to biochar additions in a temperate hardwood forest[J]. Global Change Biology Bioenergy, 2015, 7(5): 1062-1074. DOI:10.1111/gcbb.12211
(  0) 0) |
| [26] |
Stavi I, Lal R. Agroforestry and biochar to offset climate change: A review[J]. Agronomy for Sustainable Development, 2013, 33(1): 81-96. DOI:10.1007/s13593-012-0081-1
(  0) 0) |
| [27] |
Amelung W, Brodowski S, Sandhage-Hofmann A, et al. Combining biomarker with stable isotope analyses for assessing the transformation and turnover of soil organic matter[J]. Advances in Agronomy, 2008, 100: 155-250.
(  0) 0) |
| [28] |
Keith A, Singh B, Singh B P. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil[J]. Environmental Science & Technology, 2011, 45(22): 9611-9618.
(  0) 0) |
| [29] |
Kuzyakov Y, Bogomolova I, Glaser B. Biochar stability in soil: Decomposition during eight years and transformation as assessed by compound-specific 14C analysis[J]. Soil Biology & Biochemistry, 2014, 70: 229-236.
(  0) 0) |
| [30] |
Cross A, Sohi S P. The priming potential of biochar products in relation to labile carbon contents and soil organic matter status[J]. Soil Biology & Biochemistry, 2011, 43(10): 2127-2134.
(  0) 0) |
| [31] |
Zhou D D, Wu W W, Wu M. Stability of biochar and its evaluating methods (In Chinese)[J]. Journal of Chongqing University, 2015, 38(3): 116-122. [周丹丹, 吴文卫, 吴敏. 生物炭的稳定性及其评价方法[J]. 重庆大学学报, 2015, 38(3): 116-122.]
(  0) 0) |
| [32] |
Major J, Lehmann J, Rondon M, et al. Fate of soil-applied black carbon: Downward migration, leaching and soil respiration[J]. Global Change Biology, 2010, 16(4): 1366-1379. DOI:10.1111/j.1365-2486.2009.02044.x
(  0) 0) |
| [33] |
Zimmerman A R. Abiotic and microbial oxidation of laboratory-produced black carbon (biochar)[J]. Environmental Science & Technology, 2010, 44(4): 1295-1301.
(  0) 0) |
| [34] |
Wu M X, Han X G, Zhong T, et al. Soil organic carbon content affects the stability of biochar in paddy soil[J]. Agriculture, Ecosystems & Environment, 2016, 223: 59-66.
(  0) 0) |
| [35] |
Ye L L, Wang C H, Zhou H, et al. Effects of rice straw-derived biochar addition on soil structure stability of an ultisol (In Chinese)[J]. Soils, 2012, 44(1): 62-66. [叶丽丽, 王翠红, 周虎, 等. 添加生物质黑炭对红壤结构稳定性的影响[J]. 土壤, 2012, 44(1): 62-66.]
(  0) 0) |
| [36] |
Ventura M, Alberti G, Panzacchi P, et al. Biochar mineralization and priming effect in a poplar short rotation coppice from a 3-year field experiment[J]. Biology and Fertility of Soils, 2019, 55(1): 67-78. DOI:10.1007/s00374-018-1329-y
(  0) 0) |
| [37] |
Rasse D P, Budai A, O'Toole A, et al. Persistence in soil of Miscanthus biochar in laboratory and field conditions[J]. PLoS One, 2017, 12(9): e0184383. DOI:10.1371/journal.pone.0184383
(  0) 0) |
| [38] |
Maestrini B, Abiven S, Singh N, et al. Carbon losses from pyrolysed and original wood in a forest soil under natural and increased N deposition[J]. Biogeosciences, 2014, 11(18): 5199-5213. DOI:10.5194/bg-11-5199-2014
(  0) 0) |
| [39] |
Yuan J H, Xu R K. Progress of the research on the properties of biochars and their influence on soil environmental functions (In Chinese)[J]. Ecology and Environmental Sciences, 2011, 20(4): 779-785. DOI:10.3969/j.issn.1674-5906.2011.04.034 [袁金华, 徐仁扣. 生物质炭的性质及其对土壤环境功能影响的研究进展[J]. 生态环境学报, 2011, 20(4): 779-785.]
(  0) 0) |
| [40] |
Sun K J, Zhang H R, Tang J C. Properties of hydrochars from different sources of biomass feedstock (In Chinese)[J]. Journal of Agro-Environment Science, 2014, 33(11): 2260-2265. DOI:10.11654/jaes.2014.11.027 [孙克静, 张海荣, 唐景春. 不同生物质原料水热生物炭特性的研究[J]. 农业环境科学学报, 2014, 33(11): 2260-2265.]
(  0) 0) |
| [41] |
Lu W W, Geng H L, Zhang Y R, et al. Effects of biochars pyrolyzed at different temperatures on soil microbial community in a poplar plantation in coastal Eastern China (In Chinese)[J]. Journal of Nanjing Forestry University: Natural Sciences Edition, 2020, 44(4): 143-150. [卢伟伟, 耿慧丽, 张伊蕊, 等. 生物质炭对杨树人工林土壤微生物群落的影响[J]. 南京林业大学学报: 自然科学版, 2020, 44(4): 143-150.]
(  0) 0) |
| [42] |
Shang J, Geng Z C, Zhao J, et al. Effects of biochar on water thermal properties and aggregate stability of Lou soil (In Chinese)[J]. Chinese Journal of Applied Ecology, 2015, 26(7): 1969-1976. [尚杰, 耿增超, 赵军, 等. 生物炭对塿土水热特性及团聚体稳定性的影响[J]. 应用生态学报, 2015, 26(7): 1969-1976.]
(  0) 0) |
| [43] |
Preston C M, Schmidt M W I. Black (pyrogenic) carbon: A synthesis of current knowledge and uncertainties with special consideration of boreal regions[J]. Biogeosciences, 2006, 3(4): 397-420. DOI:10.5194/bg-3-397-2006
(  0) 0) |
| [44] |
Fang Y Y, Singh B P, Singh B. Temperature sensitivity of biochar and native carbon mineralisation in biochar-amended soils[J]. Agriculture, Ecosystems & Environment, 2014, 191: 158-167.
(  0) 0) |
| [45] |
Nguyen B T, Lehmann J, Hockaday W C, et al. Temperature sensitivity of black carbon decomposition and oxidation[J]. Environmental Science & Technology, 2010, 44(9): 3324-3331.
(  0) 0) |
| [46] |
Reichstein M, Subke J A, Angeli A C, et al. Does the temperature sensitivity of decomposition of soil organic matter depend upon water content, soil horizon, or incubation time?[J]. Global Change Biology, 2005, 11(10): 1754-1767.
(  0) 0) |
| [47] |
Fang C M, Smith P, Moncrieff J B, et al. Similar response of labile and resistant soil organic matter pools to changes in temperature[J]. Nature, 2005, 433(7021): 57-59.
(  0) 0) |
| [48] |
Conant R T, Steinweg J M, Haddix M L, et al. Experimental warming shows that decomposition temperature sensitivity increases with soil organic matter recalcitrance[J]. Ecology, 2008, 89(9): 2384-2391.
(  0) 0) |
| [49] |
Wetterstedt J Å M, Persson T, Ågren G I. Temperature sensitivity and substrate quality in soil organic matter decomposition: Results of an incubation study with three substrates[J]. Global Change Biology, 2010, 16(6): 1806-1819.
(  0) 0) |
| [50] |
Xu X, Niu S L, Sherry R A, et al. Interannual variability in responses of belowground net primary productivity (NPP) and NPP partitioning to long-term warming and clipping in a tallgrass prairie[J]. Global Change Biology, 2012, 18(5): 1648-1656.
(  0) 0) |
| [51] |
Wang G B, Zhou Y, Xu X, et al. Temperature sensitivity of soil organic carbon mineralization along an elevation gradient in the Wuyi Mountains, China[J]. PLoS One, 2013, 8(1): e53914.
(  0) 0) |
| [52] |
Chen G H, Wang X J, Zhang R D. Decomposition temperature sensitivity of biochars with different stabilities affected by organic carbon fractions and soil microbes[J]. Soil & Tillage Research, 2019, 186: 322-332.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


