2. 江苏省地理环境演化国家重点实验室培育建设点,南京 210023;
3. 江苏省地理信息资源开发与利用协同创新中心,南京 210023;
4. 虚拟地理环境教育部重点实验室(南京师范大学),南京 210023
2. State Key Laboratory Cultivation Base of Geographical Environment Evolution (Jiangsu Province), Nanjing 210023, China;
3. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China;
4. Key Laboratory of Virtual Geographic Environment (Nanjing Normal University), Ministry of Education, Nanjing 210023, China
15N稳定同位素技术已广泛应用于不同类型土壤或水体的氮迁移、转化特点研究中[1-3],主要以不同氮库(尤其是NH4+、NO3-)的氮含量和15N丰度等数据为基础,阐明土壤氮供应和保持能力,揭示土壤或水体中的氮动态特征,最终实现减氮增效、控制污染的目的。因此,准确测定土壤或水体中不同氮库的氮含量和15N丰度是开展此类研究的基础。N2O是氮转化过程的主要气体产物,作为三大温室气体之一[4],N2O源汇特征、影响因素及其减排措施一直是研究的热点,15N稳定同位素技术是N2O源解析的重要手段。由于气态样品中N2O的浓度通常很低,准确测定N2O的15N丰度并不容易。
土壤或水体中样品氮含量和15N丰度的准确测定,受采集过程、实验操作、储存条件、仪器设备等因素影响。实际研究工作中,由于样品常无法立即测定,需在一定条件下储存,不当的储存条件可能造成样品的氮含量和15N丰度发生变化,但储存条件的影响被研究人员忽略。对于气体样品,气袋和玻璃气瓶是常见的储存容器。气袋因方便携带、操作简单,被广泛用于气体样品的储存,但气袋储存时间通常较短,气袋材料、阀门密封性均可能造成气体样品损失、污染。常见用于储存N2O气体的气袋材质有尼龙、聚酯、含氟聚合物、聚乙烯、镀铝等[5-8],但Austin等[7]发现用尼龙气袋储存N2O 90 min,回收率为96.3%,储存120 h后,回收率降至62.9%;郝志鹏等[9]发现铝箔气袋对N2O吸附性弱,适用于储存N2O,但储存初期N2O浓度上下波动;Tedlar和Fluode等聚氟化物材料的气袋也可储存N2O,但成本较高。气瓶机械强度高,较气袋更适合储存气体样品,其气密性主要与气瓶塞的材质、形状、封盖方式有关[10-12]。Glatzel和Well[13]发现丁基塞对气体的吸附作用弱且密封效果明显优于橡胶塞,钳口和螺口两种封盖方式均适用于12 mL玻璃气瓶储存N2O气体;Laughlin和Stevens[11]用丁基塞密封的12 mL螺口玻璃气瓶储存N2O 50周,虽然N2O浓度降低了35%,但并未影响15N丰度。综上,现有的研究大都表明气袋和气瓶是会造成N2O气体的浓度变化,但对其15N丰度的影响认识有限,也未能明确不同气袋和气瓶对N2O气体的适宜储存时间。
与气体样品不同,液体样品中NH4+、NO3-等无机氮易受生物转化、挥发、沉淀、吸附等生物、化学和物理过程作用而发生变化,多采取冷冻和冷藏方式低温储存,以减缓无机氮变化速度,延长样品储存时间[14]。但是液体样品中无机氮的变化趋势尚无一致结论,推测因样品性质、储存条件不同,变化过程可能有所不同,对无机氮的15N丰度测定会有何种影响尚不明确。此外,液体样品中氮的潜在变化还取决于样品的氮素组成和样品自身生物和理化性质[15]。为减少微生物对样品的影响,医学、水处理、食品等领域经常采用滤膜过滤微生物[16-19],但在15N稳定同位素的样品储存中少见关于使用滤膜的报道。
因此,本研究以N2O气体样品、土壤浸提液和河水的无机氮样品为研究对象,研究储存容器、密封塞、温度、滤膜、时间等因素对样品15N丰度的影响,以期阐明储存条件对气态和液态样品15N丰度的影响,为15N稳定同位素研究中的样品储存提供科学依据。
1 材料与方法 1.1 供试材料以N2O、土壤浸提液和河水无机氮样品为供试材料,其中N2O和土壤浸提液无机氮分别设置自然丰度和15N富集样品,开展储存条件对样品15N丰度的影响研究。自然丰度N2O气体采自9.824 mg·m-3的N2O标准气体钢瓶(Air Liquid Ltd.);15N富集的N2O样品经2 atom%的15NH4NO3通过化学转化法制备,产生的N2O的15N理论丰度是1 atom%[20-21]。土壤浸提液以采自江苏宜兴的水稻土为供试土壤,用2 mol·L-1 KCl溶液提取获得。河水样品采自江苏省南京市三通河(32°06′N,118°54′E)。
1.2 试验设计自然丰度N2O储存试验共设置4个储存处理:1)50 mL铝箔采样袋(中国,大连海德科技有限公司),简称CQD;2)20 mL螺口顶空瓶(日本,Maruemu Corporation)+丁基塞(日本,Maruemu Corporation),简称LDB;3)120 mL钳口顶空瓶(中国,上海安谱实验科技股份有限公司)+丁基塞(日本,Maruemu Corporation),简称QDB;4)120 mL钳口顶空瓶(中国,上海安谱实验科技股份有限公司)+ PTFE/硅胶隔垫(中国,上海安谱实验科技股份有限公司),简称QPB。其中螺口顶空瓶与旋口塑料盖配合使用,钳口顶空瓶与钳口铝盖配合使用(图 1)。

|
注:a)铝箔采样袋Aluminum foil air bag;b)20 mL螺口顶空瓶20 mL screw top vacuum vial;c)120 mL钳口顶空瓶120 mL clamp headspace vial;d)丁基塞Butyl septa;e)PTFE/硅胶隔垫PTFE/ silicone septa;f)旋口塑料盖Screw plastic cover;g)钳口铝盖Clamp aluminum cover. 图 1 N2O储存容器 Fig. 1 Containers for storing N2O |
铝箔采样袋使用前将气袋隔垫换为岛津201-35584隔垫(日本,岛津公司),用高纯N2(99.999%)冲洗气袋后抽真空,重复3次;气瓶先抽真空到瓶内气压小于-98 kPa。为保证不同储气容器中N2O的进样量相当,120 mL钳口顶空瓶需事先注入100 mL高纯N2以平衡气压,再注入20 mL自然丰度的N2O样品(δ15N为0.07‰,原子百分比0.366 atom%,浓度9.824 mg·m-3(对应的m/z 44峰面积为7.33±0.19 mV·min));螺口顶空瓶和气袋则直接充满该N2O气体。四种容器中的气体于2019年9月7日至2020年7月19日在实验室中储存,储存期间的温度变化范围为10~28 ℃。铝箔气袋、螺口顶空瓶+丁基塞、钳口顶空瓶+丁基塞处理采样时间为0、10、20、30、60、90、120、255、270 d,钳口顶空瓶+ PTFE/硅胶隔垫处理的采样时间为0、10、20、80、90、235、270 d,每次均为破坏性取样,每个处理5个重复。气袋样品取样时,需用注射器从中抽取20 mL气体转移至抽真空的20 mL螺口顶空瓶(丁基塞)中,于Precon-IRMS上分析N2O的15N丰度,其他处理组则直接分析,所有样品均在采气当天完成测定。
15N富集的N2O储存试验共设置3个储存处理:1)50 mL铝箔采样袋,简称CQD;2)20 mL螺口顶空瓶+丁基塞,简称LDB;3)120 mL钳口顶空瓶+丁基塞,简称QDB。气袋和气瓶的预处理同自然丰度N2O的储存实验。用注射器分别注入15 mL、115 mL高纯N2至20 mL、120 mL预抽真空的顶空瓶中平衡气压,再分别注入5 mL高丰度N2O样品(15N丰度为1.023 atom%,浓度(对应的m/z 44峰面积为4.96±0.16 mV·min))至气瓶中。气袋则直接充满N2O样品。每个处理的采样时间均为0、10、20、30、60、90、200、270 d,每次均为破坏性取样,每个处理5个重复。气袋样品取样时,用注射器从中抽取5 mL气体转入预抽真空的20 mL螺口顶空瓶(事先注入15 mL高纯N2)中,在Precon- IRMS上分析N2O丰度,其他处理则直接分析,所有样品均在采气当天完成测定。
自然丰度液体储存试验中,用2 mol·L-1 KCl浸提土壤,经定性滤纸过滤后,浸提液分装入100 mL聚乙烯塑料瓶,设置4个处理:1)0.22 μm滤膜过滤后4 ℃冷藏,2)不过滤4 ℃冷藏,3)0.22 μm滤膜过滤后-20 ℃冷冻,4)不过滤-20 ℃冷冻。河水样品经定性滤纸过滤后,也设置同样的四个处理。在储存0、10、30、60、180 d测定土壤浸提液和河水样品中的NH4+、NO3-浓度和15N丰度,为避免液体样品的反复冻融,每次均为破坏性采样,每个处理5次重复。
15N富集的液体储存试验中,将风干的水稻土补充水分至40%土壤持水量(WHC),预培养24 h后,加入丰度为1 atom %的15NH4NO3(N 40 mg·kg-1 soil)。培养4 h后,用2 mol·L-1 KCl溶液浸提土壤,浸提液分装入100 mL聚乙烯塑料瓶,设置2个处理:1)4 ℃冷藏,2)-20 ℃冷冻。在储存0、10、30、60、160 d测定土壤浸提液中NH4+、NO3-的浓度和15N丰度,每个处理5次重复,为避免液体样品的反复冻融,每次均为破坏性采样。
1.3 分析方法气态和液态样品产生的自然丰度N2O在稳定同位素比值质谱仪(Thermo Fisher Scientific Delta V plus)上测定15N丰度,富集15N2O在稳定同位素比值质谱仪(Thermo Fisher Scientific Delta V advantage)上测定。
使用连续流动分析仪(SKALAR SAN++)测定NH4+、NO3-浓度。自然丰度的液体样品中NH4+先用次溴酸钠氧化为NO2-,再用盐酸羟胺还原为N2O,在Precon-IRMS上测定N2O丰度[20-21];NO3-使用致金色假单胞菌(P. aureofaciens ATCC 13985)转化为N2O,再测定15N丰度[22-23]。15N富集液体样品的NH4+、NO3-均采用扩散法测定15N丰度[24]。
1.4 数据处理采用Excel 2019进行数据处理,使用方差分析(SPSS 23)检验各处理的差异显著性,采用Origin 2018绘图。
2 结果 2.1 自然丰度N2O气体丰度和浓度变化研究结果表明,N2O样品储存到四种容器后,立即测定(0时刻)的N2O的δ15N值无显著差异,均值为0.09‰±0.06‰。随着储存时间的延长,不同储存容器中N2O的δ15N值变化趋势存在明显的差异(图 2a)。在270 d内,螺口顶空瓶+丁基塞(LDB)和钳口顶空瓶+丁基塞(QDB)储存样品的δ15N值基本保持稳定。在储存20 d时,铝箔气袋(CQD)储存样品的δ15N值已明显增加(P < 0.05),且随着储存时间的延长,其δ15N值继续显著增大,在90 d时(δ15N=7.60‰±4.72‰)接近所处大气环境中N2O的δ15N值。钳口顶空瓶+ PTFE/硅胶隔垫(QPB)稳定储存时间更短,在第10天时,δ15N值已经与初始值差异显著(P < 0.05),整个观测期间都在剧烈上下波动。
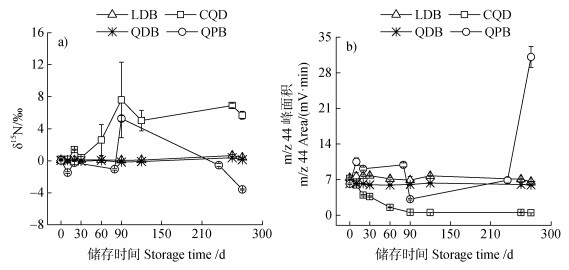
|
注:LDB:螺口顶空瓶+丁基塞;CQD:铝箔气袋;QDB:钳口顶空瓶+丁基塞;QPB:钳口顶空瓶+PTFE/硅胶隔垫。 Note: LDB: Screw top vacuum vial + butyl septa; CQD: Aluminum foil air bag; QDB: Clamp headspace vial + butyl septa; QPB: Clamp headspace vial + PTFE/ silicone septa. 图 2 不同储存条件下自然丰度N2O的δ15N值(a)和m/z 44峰面积(b)的变化 Fig. 2 Changes of δ15N values(a)and m/z 44 peak areas(b)of natural abundance N2O samples under different storage conditions |
不同储存容器中的N2O浓度(用m/z 44峰面积表示)变化也存在显著差异(图 2b)。在0时刻,螺口/钳口顶空瓶+丁基塞(LDB和QDB)和铝箔气袋(CQD)N2O浓度值无显著差异,峰面积均值为(7.29±0.21)mV·min;但是钳口顶空瓶+PTFE/硅胶隔垫(QPB)的N2O浓度值显著低于二者(P < 0.05),峰面积均值为(6.17±0.15)mV·min。随着时间的延长,不同储存容器中N2O峰面积的变化存在显著差别。在270 d的观测期内,螺口顶空瓶+丁基塞和钳口顶空瓶+丁基塞(LDB和QDB)储存样品的N2O峰面积基本保持稳定,仅在270 d时略有下降。铝箔气袋(CQD)中N2O峰面积在储存10 d时已开始显著下降(P < 0.05),并持续下降到90 d后基本稳定(< 0.6 mV·min)。整个观测期间,钳口顶空瓶+PTFE/硅胶隔垫(QPB)储存样品的N2O峰面积都在剧烈波动。
2.2 15N富集的N2O气体丰度和浓度变化15N富集的N2O气体样品储存到三种容器后,马上测定(0时刻)的N2O的15N丰度差异较小,螺口顶空瓶+丁基塞(LDB)、铝箔气袋(CQD)和钳口顶空瓶+丁基塞处理(QDB)的平均值为1.023 atom%±0.002 atom%。随着储存时间的延长,不同容器中样品的15N丰度存在明显的差异(图 3a)。在270 d的观测期间,螺口顶空瓶+丁基塞(LDB)和钳口顶空瓶+丁基塞(QDB)储存N2O样品的15N丰度基本保持稳定。相比之下,铝箔气袋(CQD)在储存仅10 d时,样品的15N丰度已经显著降低(P < 0.05),在第30天时样品15N丰度已下降至0.369 atom%,接近空气中N2O的15N丰度值(0.3663 atom%)。
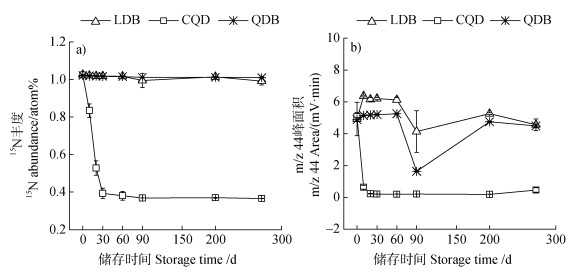
|
注:LDB:螺口顶空瓶+丁基塞;CQD:铝箔气袋;QDB:钳口顶空瓶+丁基塞。 Note: LDB: screw top vacuum vial + butyl septa; CQD: aluminum foil air bag; QDB: clamp headspace vial + butyl septa. 图 3 不同储存条件下15N富集的N2O的15N丰度(a)和m/z 44峰面积(b)的变化 Fig. 3 Changes of 15N abundance(a)and m/z 44 peak areas(b)of 15N enriched N2O samples under different storage conditions |
如图 3b所示,储存开始时,三种容器中N2O浓度无显著差异,峰面积均值为4.96±0.01 mV·min。随着储存时间的延长,不同容器中样品的N2O峰面积变化趋势存在明显的差异。在储存第10天时,铝箔气袋(CQD)N2O峰面积急剧降低,降至0.63±0.12 mV·min,之后基本变化不大。相比之下,第10天时螺口顶空瓶+丁基塞(LDB)和钳口顶空瓶+丁基塞(QDB)这两个处理的N2O峰面积仍保持在4.9 mV·min以上,且螺口顶空瓶+丁基塞的峰面积略大于钳口顶空瓶+丁基塞;在90 d时由于临时更换了测定仪器,这两个处理的N2O浓度(峰面积)有明显下降,但在第270天恢复使用原来的测定仪器后,二者的N2O浓度无明显差别,仅略低于试验初始值,峰面积约为4.52±0.05 mV·min。
2.3 自然丰度液体样品丰度和浓度变化四种不同的储存条件下,土壤浸提液样品的NO3-和NH4+的δ15N值均发生变化,总体变化趋势类似。如图 4a所示,滤膜过滤对土壤浸提液中NO3-的δ15N初始值无显著影响,均值为37.53‰±0.18‰;0~30 d内NO3-的δ15N值均明显上升(P < 0.05),在30 d时达到最大值,显著高于初始值(P < 0.05),之后δ15N值快速下降,60 d时下降到35.504‰,显著低于初始值(P < 0.05),四种储存方式间的变化趋势差异不大。如图 4b所示,滤膜过滤对NH4+的δ15N初始值无显著影响,均值为-4.27‰±0.39‰,NH4+的δ15N值随储存时间的延长呈下降趋势,且四种储存方式间的变化幅度存在明显的差异。在储存30 d以内,其δ15N值有一些波动,但是除过滤膜4℃储存的样品外,各处理δ15N值与初始值差异不显著;在储存180 d时,所有处理δ15N-NH4+均显著低于初始值(P < 0.001),其中4℃储存的样品下降幅度更大,过滤对δ15N值的影响并不显著。
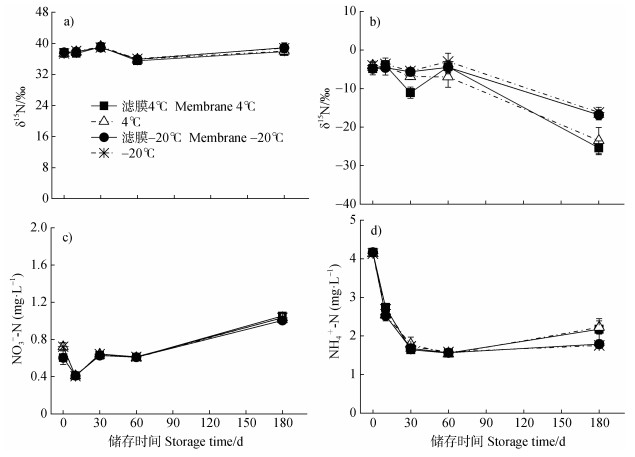
|
图 4 不同储存条件下土壤浸提液NO3-的δ15N值(a)、NH4+的δ15N值(b)、NO3--N浓度(c)、NH4+-N浓度(d)变化 Fig. 4 Changes of δ15N values of NO3-(a), δ15N values of NH4+(b), concentrations of NO3--N(c), and concentrations of NH4+-N(d)in soil extracts samples under different storage conditions |
如图 4c所示,四种储存方式间NO3-浓度初始值存在显著差异(P < 0.05),滤膜过滤后土壤浸提液NO3-浓度显著小于未用滤膜的处理。随着储存时间的延长,四种储存方式下NO3-浓度表现出相同的变化趋势。在储存10 d时,NO3-浓度显著降低,之后快速增加。滤膜过滤对NH4+浓度影响不大,随着储存时间的延长,NH4+浓度迅速降低,60 d后趋于稳定(图 4d)。不同处理间的变化趋势相同,同一储存时间的NH4+浓度没有显著差异(P < 0.05),仅在第180天4 ℃储存的NH4+浓度略高。
四种不同的储存条件下,河水样品的NO3-和NH4+的δ15N值均发生变化,总体变化趋势类似。滤膜过滤对河水NO3-的δ15N初始值无显著影响,均值为17.54‰±0.04‰。随着储存时间的延长,不同储存方式下河水NO3-的δ15N值有变化,但变化趋势相似(图 5a)。0~10 d时NO3-的δ15N值略有上升;第30天时所有处理NO3-的δ15N值均明显降低,持续下降至60 d时,已显著低于初始值(P < 0.05);但储存180 d时,各处理NO3-的δ15N值较第60天有明显增加(P < 0.05)。如图 5b,滤膜过滤对河水NH4+的δ15N初始值也无显著差异,均值为24.27‰±0.27‰。在储存10 d时,所有处理NH4+的δ15N值已经均显著低于初始值(P < 0.05);在储存60 d内,随着时间延长,不同储存方式下NH4+的δ15N值均明显下降。但是,与60 d相比,储存至180 d时-20 ℃储存和不过滤膜4 ℃储存,这三组中NH4+的δ15N值有明显增加(P < 0.05),而4 ℃储存并过滤膜的处理中NH4+的δ15N值进一步降低。

|
图 5 不同储存条件下河水NO3-的δ15N值(a)、NH4+的δ15N值(b)、NO3-N浓度(c)、NH4+-N浓度(d)变化 Fig. 5 Changes of δ15N values of NO3-(a), δ15N values of NH4+(b), concentrations of NO3-N(c), and concentrations of NH4+-N(d)in river samples under different storage conditions |
与土壤提取液类似,滤膜过滤也影响河水NO3-浓度,滤膜处理的河水NO3-浓度显著小于不过滤膜的处理,但对NH4+浓度影响不大(图 5c、图 5d)。四种储存方式下,在第10天时,河水NO3-和NH4+浓度已经明显低于初始值(P < 0.05),随着储存时间的延长,二者继续降低,其中NO3-浓度在储存30 d时基本稳定,NH4+浓度持续降低,至储存180 d时略有增加。
2.4 15N富集的土壤浸提液丰度和浓度变化如图 6a所示,在160 d的储存期间,4 ℃和-20 ℃两种处理对15N富集的土壤浸提液NO3-的15N丰度均没有显著的影响。随着储存时间的延长,两种储存温度下NH4+的15N丰度有明显的降低趋势(图 5b)。在储存30 d时,4 ℃储存样品NH4+的15N丰度开始显著低于初始值(P < 0.05);-20 ℃储存的样品则在160 d显著低于初始值(P < 0.05)。

|
图 6 15N富集的土壤浸提液NO3-的15N丰度(a)、NH4+的15N丰度(b)、NO3--N的浓度(c)、NH4+-N的浓度(d)随时间的变化 Fig. 6 Changes of 15N abundance of NO3-(a), 15N abundance of NH4+(b), concentrations of NO3-(c), and concentrations of NH4+(d)in 15N enriched soil extracts samples under different storage conditions |
与自然丰度土壤浸提液相似,15N富集的土壤浸提液中NO3-浓度也有先减小后增加的趋势。在储存10 d时,两种储存温度的NO3-浓度均显著低于初始值(P < 0.05),之后明显增加。NH4+浓度则随着储存时间的延长呈降低趋势。
3 讨论本研究结果表明,储存条件对N2O的浓度及其15N丰度均会产生明显影响,这是储存容器和储存时间的差异造成的。使用铝箔气袋储存N2O时,自然丰度N2O的15N丰度随时间延长有增大的趋势,15N富集的N2O的15N丰度则迅速减小,但两者均趋于实验室大气环境中N2O的15N丰度(δ15N-N2O为5‰~8‰,原子百分比约为0.368 atom%),这是因为铝箔气袋的密封性差,储存过程中外界大气的N2O与气袋内的样品发生扩散交换,导致气袋中气体15N丰度变化。此外,铝箔气袋中N2O浓度随着储存时间延长而急剧减小,储存自然丰度的N2O气体的气袋在90 d后浓度由初始9.824 mg·m-3减小至接近实验室环境空气的N2O浓度,储存15N富集N2O的气袋则在30 d后就接近环境大气的N2O浓度,这也证明气袋中所储气体会扩散并与空气交换,造成所储N2O气体的损失与其15N丰度的变化。前人也有研究发现气袋不能长时间储存N2O,采集气体之后要及时对其进行分析[7, 25-26]。
对于气瓶,密封塞的材质和形状对N2O气体储存有显著影响,但螺口和钳口两种封盖方式的影响并不明显。在本次试验中,钳口顶空瓶+丁基塞对自然丰度N2O的储存效果优于钳口顶空瓶+PTFE/硅胶隔垫,这与丁基塞的密封性能较好有关,已有研究表明使用丁基塞对N2O吸附性小,密封性好,能有效防止N2O扩散[27-29]。PTFE/硅胶隔垫的密封性不如丁基塞,储存N2O气体与外界环境气体有交换,其浓度和15N丰度均发生了明显的变化。这两类塞子除材质不同外,形状也有差异,有支脚的丁基塞更有利于储存气体;而平盖的PTFE/硅胶隔垫在储存过程中更容易造成气体的交换和污染,这可能是由于隔垫无支脚支撑,转移气体过程中,针头穿刺隔垫时易发生形变,密封效果下降。本试验中钳口顶空瓶+PTFE/硅胶隔垫所储N2O气体的浓度和丰度在270 d内波动明显,这是因为储存期间气瓶曾放置在两个不同地点,其中200 d内的储存地点的环境空气中N2O浓度与大气的N2O浓度和15N丰度接近,而200 d后的储存地点的N2O浓度远高于大气浓度,其15N丰度约为-3.00‰±0.05‰。因为该储存方式的密封效果不佳,易与所处环境发生气体交换,导致N2O气体的浓度和丰度不断发生剧烈变化。但是,也有研究发现平盖丁基塞是可以适配12 mL的Labco气瓶,长期稳定储存N2O气体[11, 14]。本研究中虽未对平盖和带支脚两种不同形状的丁基塞进行对比,但前期试验中有发现对于120 mL的顶空瓶,PTFE/硅胶和丁基塞两种材质的平盖隔垫,在密封性上差异不大,抽真空后第二天瓶内真空度均明显下降,推测平盖隔垫在大体积顶空瓶上储存效果不佳,但可用于小体积顶空瓶的气体储存。在气瓶的封盖方式上,无论是自然丰度还是15N富集N2O气体,螺口顶空瓶+丁基塞和钳口顶空瓶+丁基塞的储存效果差别不大,N2O的15N丰度和浓度能在较长时间内保持稳定,且明显优于其他储存方式。Glatzel和Well[13]在使用12 mL Labco管储存N2O气体时,也发现螺口和钳口两种封盖方式,均可配合丁基塞隔垫稳定长期储存N2O气体。本试验中虽然螺口顶空瓶+丁基塞(20 mL)所储存N2O的浓度略高于(120 mL)钳口顶空瓶+丁基塞,这可能是因为不同体积的气瓶在质谱仪上随He气流进样的方式有所差异。所以,对于带支脚的丁基塞,螺口或钳口两种封盖方式均可保证不同体积的顶空瓶稳定储存N2O气体。
对于土壤浸提液和河水这两类液体样品,无论是自然丰度还是15N富集的样品,4 ℃和-20 ℃储存都会影响NH4+和NO3-的浓度及其15N丰度。随着储存时间的延长,NO3-的15N丰度都有先增加后减小的变化趋势,而NH4+的15N丰度则明显降低,且4 ℃条件下15N下降幅度要大于-20 ℃储存。温度造成的差异可能与储存过程或冻融过程中溶解有机氮矿化、硝化、微生物同化、氨吸收、反硝化以及氮化学反应等多种转化过程引发的同位素稀释、分馏等有关[30-32]。该结果与Thayer[33]和Clough等[15]的研究结果一致,他们也认为储存过程中,NH4+库发生了稀释。-20 ℃冷冻储存时,NH4+的15N丰度变化程度小于4 ℃冷藏,可能是低温降低了微生物活性,减弱了氮的转化速率[34]。尽管如此,-20 ℃冷冻储存仍然会对不同样品造成不同程度的无机氮转化,影响NH4+、NO3-甚至NO2-的浓度及其15N丰度。Clough等[15]发现冷冻储存中性土壤提取液10 d就会造成不同形态氮相互转化和气态氮损失,NO2-的化学反硝化作用明显加剧,NO3-和NH4+浓度显著升高。朱强等[35]发现无论是黄棕壤、潮土还是棕壤,其浸提液冷冻储存10 d后NO3-含量提高9%~68%,NH4+含量变化随不同土壤有所差异,大部分明显降低20%~54%;冷冻储存70 d后NO3-、NH4+含量变化更显著,变化趋势因土壤类型有差异。Kotlash[14]发现冷冻储存适用于富营养程度高的河流水体样品,但对贫营养的水体影响较大;Dore等[36]却发现冷冻储存适用于贫营养的海洋水体样品。因此,-20 ℃冷冻储存方式对不同形态无机氮的浓度及其15N丰度的影响,因样品自身的物理、化学和生物性质有很大差异,要保证样品测定结果的准确性,应在样品采集后尽快完成测定。
此外,土壤浸提液中NH4+的15N丰度变化程度小于河水,河水样品无论4 ℃或-20 ℃储存其NH4+、NO3-的浓度及其15N丰度均在10 d后发生变化,明显较土壤浸提液更不易储存,这可能与高浓度的KCl溶液有关,高浓度盐溶液可以影响微生物的渗透压,导致细菌等微生物的活性降低甚至死亡,从而减弱了微生物氮转化过程[18]。通常认为,滤膜过滤也能够降低液体中微生物的数量,有利于样品储存[19]。但是,本研究结果表明滤膜过滤后,样品NH4+和NO3-的15N丰度并未较过滤膜更稳定,并且液体样品尤其是淡水样品的NO3-的初始浓度,在滤膜过滤后显著低于未使用滤膜的处理。这是因为在液体样品中往往存在大量胶体颗粒(1 nm~1 μm),其中部分胶体是NO3-等可溶性营养盐吸附在矿物上形成的,使用0.22 μm过滤器会造成部分营养盐损失,而且胶体在过滤时易堵塞滤孔,在大体积液体过滤时,滤孔堵塞更为明显,滤液中的营养盐浓度也会相应减少[19]。诚然,在不同的土壤和水体中,因其氮素组成、氮转化过程、生物和理化性质不同,NH4+和NO3-的浓度和15N丰度变化趋势也会有所差异,但本研究结果阐明,对于土壤浸提液和淡水样品,冷藏、冷冻和滤膜处理几种储存方式下无机氮的浓度和丰度均会发生变化,最好在10 d内及时进行测定,以保证数据的准确性。
4 结论容器、温度、时间等储存条件显著影响气体N2O、土壤或河水中NH4+、NO3-的浓度和15N丰度。对于气体N2O样品,推荐使用螺口/钳口顶空瓶+丁基塞储存N2O样品,其15N丰度可以在200 d左右不发生明显变化;气袋只能短期储存,需尽快完成样品测定;带支脚的丁基塞有助于保证气瓶(尤其是大体积顶空瓶)的密封性。对于土壤提取液或河水样品,4 ℃冷藏或-20 ℃冷冻下,其NH4+、NO3-的浓度和15N丰度在储存10 d后均会发生变化,虽然有些变化并未达到显著水平,-20 ℃冷冻储存可略减缓变化幅度,滤膜过滤未能促进储存效果,反而降低NO3-浓度,因此液体样品应在采样后尽快完成测定,储存时间不超过10 d。
| [1] |
Solomon S D, Qin D, Manning M, et al. Climate change 2007: The physical science basis[M]//Working group I contribution to the fourth assessment report of the IPCC. Cambridge and New York: Cambridge University Press, 2007.
(  0) 0) |
| [2] |
Müller C, Rütting T, Kattge J, et al. Estimation of parameters in complex 15N tracing models by Monte Carlo sampling[J]. Soil Biology & Biochemistry, 2007, 39(3): 715-726.
(  0) 0) |
| [3] |
Cheng Y, Zhang J B, Cai Z C. Key Role of Matching of crop-specific N preference, soil N transformation and climate conditions in soil N nutrient management (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(3): 507-515. [程谊, 张金波, 蔡祖聪. 气候-土壤-作物之间氮形态契合在氮肥管理中的关键作用[J]. 土壤学报, 2019, 56(3): 507-515.]
(  0) 0) |
| [4] |
Kirkham D, Bartholomew W V. Equations for following nutrient transformations in soil, utilizing tracer data[J]. Soil Science Society of America Journal, 1954, 18(1): 33-34. DOI:10.2136/sssaj1954.03615995001800010009x
(  0) 0) |
| [5] |
Wilson K W, Buchberg H. Evaluation of materials for controlled air reaction chambers[J]. Industrial & Engineering Chemistry, 1958, 50(11): 1705-1708.
(  0) 0) |
| [6] |
Baker R A, Doerr R C. Methods of sampling and storage of air containing vapors and gases[J]. International Journal of Air Pollution, 1959, 2: 142-158.
(  0) 0) |
| [7] |
Austin J C, Shaw R, Crichton R, et al. Comparison of sampling techniques for studies of nitrous oxide pollution[J]. British Journal of Anaesthesia, 1978, 50(11): 1109-1112. DOI:10.1093/bja/50.11.1109
(  0) 0) |
| [8] |
Schuette F J. Plastic bags for collection of gas samples[J]. Atmospheric Environment, 1967, 1(4): 515-519. DOI:10.1016/0004-6981(67)90067-4
(  0) 0) |
| [9] |
Hao Z P, Dong H M, Tao X P, et al. Experimental study on the absorbability of greenhouse gases by gas-bags made of Aluminum foil composite film (In Chinese)[J]. Transactions of the Chinese Society of Agricultural Engineering, 2005, 21(11): 138-140. [郝志鹏, 董红敏, 陶秀萍, 等. 铝箔复合膜气袋对温室气体吸附性的试验研究[J]. 农业工程学报, 2005, 21(11): 138-140.]
(  0) 0) |
| [10] |
Nelson S T. Sample vial influences on the accuracy and precision of carbon and oxygen isotope ratio analysis in continuous flow mass spectrometric applications[J]. Rapid Communications in Mass Spectrometry, 2000, 14(4): 293-297. DOI:10.1002/(SICI)1097-0231(20000229)14:4<293::AID-RCM869>3.0.CO;2-L
(  0) 0) |
| [11] |
Laughlin R J, Stevens R J. Changes in composition of nitrogen-15-labeled gases during storage in septum-capped vials[J]. Soil Science Society of America Journal, 2003, 67(2): 540-543. DOI:10.2136/sssaj2003.5400
(  0) 0) |
| [12] |
Knohl A, Werner R A, Geilmann H, et al. Kel-FTM discs improve storage time of canopy air samples in 10-mL vials for CO2-δ13C analysis[J]. Rapid Communications in Mass Spectrometry, 2004, 18(14): 1663-1665. DOI:10.1002/rcm.1528
(  0) 0) |
| [13] |
Glatzel S, Well R. Evaluation of septum-capped vials for storage of gas samples during air transport[J]. Environmental Monitoring and Assessment, 2008, 136(1/2/3): 307-311.
(  0) 0) |
| [14] |
Kotlash A R, Chessman B C. Effects of water sample preservation and storage on nitrogen and phosphorus determinations: Implications for the use of automated sampling equipment[J]. Water Research, 1998, 32(12): 3731-3737. DOI:10.1016/S0043-1354(98)00145-6
(  0) 0) |
| [15] |
Clough T J, Stevens R J, Laughlin R J, et al. Transformations of inorganic-N in soil leachate under differing storage conditions[J]. Soil Biology & Biochemistry, 2001, 33(11): 1473-1480.
(  0) 0) |
| [16] |
Saini P, Bulasara V K, Reddy A S. Performance of a new ceramic microfiltration membrane based on kaolin in textile industry wastewater treatment[J]. Chemical Engineering Communications, 2019, 206(2): 227-236. DOI:10.1080/00986445.2018.1482281
(  0) 0) |
| [17] |
Brown A I, Levison P, Titchener-Hooker N J, et al. Membrane pleating effects in 0.2μm rated microfiltration cartridges[J]. Journal of Membrane Science, 2009, 34(1/2): 76-83.
(  0) 0) |
| [18] |
Mouiya M, Abourriche A, Bouazizi A, et al. Flat ceramic microfiltration membrane based on natural clay and Moroccan phosphate for desalination and industrial wastewater treatment[J]. Desalination, 2018, 427: 42-50. DOI:10.1016/j.desal.2017.11.005
(  0) 0) |
| [19] |
Kalbitz K, Solinger S, Park J H, et al. Controls on the dynamics of dissolved organic matter in soils: A review[J]. Soil Science, 2000, 165(4): 277-304. DOI:10.1097/00010694-200004000-00001
(  0) 0) |
| [20] |
Zhang L, Altabet M A, Wu T X, et al. Sensitive measurement of NH4+ 15N/14N (δ15NH4+) at natural abundance levels in fresh and saltwaters[J]. Analytical Chemistry, 2007, 79(14): 5297-5303. DOI:10.1021/ac070106d
(  0) 0) |
| [21] |
Liu D W, Fang Y T, Tu Y, et al. Chemical method for nitrogen isotopic analysis of ammonium at natural abundance[J]. Analytical Chemistry, 2014, 86(8): 3787-3792. DOI:10.1021/ac403756u
(  0) 0) |
| [22] |
Casciotti K L, Sigman D M, Hastings M G, et al. Measurement of the oxygen isotopic composition of nitrate in seawater and freshwater using the denitrifier method[J]. Analytical Chemistry, 2002, 74(19): 4905-4912. DOI:10.1021/ac020113w
(  0) 0) |
| [23] |
Sigman D M, Casciotti K L, Andreani M, et al. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater[J]. Analytical Chemistry, 2001, 73(17): 4145-4153. DOI:10.1021/ac010088e
(  0) 0) |
| [24] |
Wen T, Cao Y C, Zhang P Y, et al. On Progress in use of micro-diffusion method in δ15N-NH4+ and δ15N-NO3- measurements (In Chinese)[J]. Soils, 2016, 48(4): 634-640. [温腾, 曹亚澄, 张珮仪, 等. 微扩散法测定铵态氮、硝态氮的15N稳定同位素研究综述[J]. 土壤, 2016, 48(4): 634-640.]
(  0) 0) |
| [25] |
Fan Z H, Zhang J F, Fan C W, et al. The MMT bag for emission source sampling: Design and evaluation[J]. Journal of the Air & Waste Management Association, 2001, 51(1): 60-68.
(  0) 0) |
| [26] |
Akdeniz N, Janni K A, Jacobson L D, et al. Comparison of gas sampling bags to temporarily store hydrogen sulfide, ammonia, and greenhouse gases[C]. International Symposium on Air Quality & Manuer Management for Agriculture Conference, 2011.
(  0) 0) |
| [27] |
Mosier A R, Klemedtsson L. Measuring denitrification in the field[M]//Methods of soil analysis. Madison, WI: Omnipress, 1994.
(  0) 0) |
| [28] |
Covert J A, Tenuta M, Beauchamp E G. Automated analysis of gases stored in Vacutainer vials[J]. Communications in Soil Science and Plant Analysis, 1995, 26(17/18): 2995-3003.
(  0) 0) |
| [29] |
Scott A, Crichton I, Ball B C. Long-term monitoring of soil gas fluxes with closed chambers using automated and manual systems[J]. Journal of Environmental Quality, 1999, 28(5): 1637-1643.
(  0) 0) |
| [30] |
Di H J, Cameron K C, Mclaren R G. Isotopic dilution methods to determine the gross transformation rates of nitrogen, phosphorus, and sulfur in soil: A review of the theory, methodologies, and limitations[J]. Australian Journal of Soil Research, 2000, 38(1): 213-230. DOI:10.1071/SR99005
(  0) 0) |
| [31] |
Gilmartin M. Changes in inorganic phosphate concentration occurring during seawater sample storage[J]. Limnology and Oceanography, 1967, 12(2): 325-328. DOI:10.4319/lo.1967.12.2.0325
(  0) 0) |
| [32] |
Klingaman E D, Nelson D W. Evaluation of methods for preserving the levels of soluble inorganic phosphorus and nitrogen in unfiltered water samples[J]. Journal of Environmental Quality, 1976, 5(1): 42-46.
(  0) 0) |
| [33] |
Thayer G W. Comparison of two storage methods for the analysis of nitrogen and phosphorus fractions in estuarine water[J]. Chesapeake Science, 1970, 11(3): 155-158. DOI:10.2307/1351238
(  0) 0) |
| [34] |
Zaidi B R, Imam S H. Biodegradability[J]. Encyclopedia of Ecology, 2008, 357-366.
(  0) 0) |
| [35] |
Zhu Q, Ma L, Ma Q, et al. Content of soil mineral nitrogen as influenced by sample extraction and preservation (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2012, 20(2): 138-143. [朱强, 马丽, 马强, 等. 不同浸提剂以及保存方法对土壤矿质氮测定的影响[J]. 中国生态农业学报, 2012, 20(2): 138-143.]
(  0) 0) |
| [36] |
Dore J E, Houlihan T, Hebel D V, et al. Freezing as a method of sample preservation for the analysis of dissolved inorganic nutrients in seawater[J]. Marine Chemistry, 1996, 53(3/4): 173-185.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


