2. 农业农村部岳阳农业环境科学实验站, 湖南岳阳 414000
2. Yueyang Agro-Environmental Sciences Station of Chinses Agriculture Ministry and Rural Affairs, Yueyang, Hunan 414000, China
红壤是我国亚热带地区的地带性土壤,第四纪红色黏土发育的红壤在我国南方丘陵地区分布十分广泛[1-2]。由于亚热带地区高温多雨,岩石和矿物风化速度快,易发生脱硅富铝及淋溶作用,盐基饱和度低,因此红壤大多呈酸性,养分状况较为贫瘠[3-4]。红壤作为我国主要的耕地土壤类型之一,常年受高强度耕作模式、不合理施肥以及自然侵蚀等作用的影响,土壤的物理结构、保水保肥性、养分供应能力等逐年变差,铝离子和重金属离子的活性增加,酸化进程加速,土壤微生物群落结构稳定性和功能性降低,土壤质量下降明显[5]。随着我国经济飞速发展,人口数量日益增多,耕地及粮食资源紧张问题日益凸显,改善贫瘠红壤酸化状况,提高土壤肥力成为亟待解决的问题。
已有研究表明,撒施石灰、添加生物有机肥和秸秆还田等措施均可作为改良贫瘠红壤的有效措施,可显著提升红壤pH及肥力状况[6-7]。秸秆还田可以提高土壤中有机质含量,活化土壤中氮磷钾养分,从而有助于土壤肥力的提升[8];生物有机肥可以改善土壤中的微生物结构,活化土壤中被固定的养分从而提高土壤中有效态养分含量[9];而施用石灰改良酸性土的效果在国内外也广泛得到认可,石灰可以与环境中的酸形成钙盐降低酸的胁迫,还可以竞争性的与植株的Ca结合位点结合,从而抑制铝离子的毒害作用[10]。但针对这些改良措施的研究多集中在土壤物理结构和养分状况的变化,对土壤微生物活性和功能变化的研究相对较少。
土壤酶作为一种具有生物催化能力的高分子蛋白质活性物质[11],一般被认为由土壤微生物代谢过程产生,参与土壤中碳、氮、磷、硫生物地球化学过程,对有机物的分解转化也至关重要[12-14]。如β-1,4-葡糖苷酶参与纤维素的降解,β-1,4-N-乙酰基氨基葡萄糖酐酶参与几丁质和肽聚糖的降解,亮氨酸氨肽酶参与蛋白质水解,酸性磷酸酶可从磷酰脂和磷脂中水解磷酸盐[15]。土壤酶活性的大小可以反映出土壤微生物活性和功能的变化,也可作为表征土壤肥力水平和养分转化的重要指标[16-17]。已有部分研究证明了土壤改良措施可以显著影响参与土壤碳、氮、磷循环的酶活性。黄尚书等[18]研究发现秸秆覆盖可显著增强红壤β-葡糖苷酶和多酚氧化酶活性;向酸性黄红壤中施加石灰可显著提高磷酸酶的活性[19]。可知,通过监测土壤酶活性的变化可以反映出不同改良措施对土壤养分状况的影响。还有一些研究表明,改良年限的长短也可造成土壤酶活性变化程度的差异[20]。但目前系统分析不同改良措施影响下贫瘠红壤酶活性与土壤养分的变化及其相互关系的研究还较少,且随改良时间的逐年增加,土壤酶活性的变化特征也不清楚。
本研究选取农业部岳阳农业环境科学观测试验站第四纪红黏土发育的红壤为研究对象,设置不同改良措施处理的长期定位试验,连续两年采样,开展以下四方面研究:(1)分析不同改良措施对红壤旱地pH及土壤养分状况的影响;(2)明确土壤酶活性对改良措施的响应;(3)探究土壤酶活性与养分之间的关系;(4)分析连续两年改良土壤中酶活性的变化规律。通过以上研究,以期从土壤酶活性角度揭示红壤改良措施影响地力提升的关键作用,筛选出用于红壤可持续利用的有效改良措施,为我国中低产田旱地地力提升研究提供理论依据。
1 材料与方法 1.1 试验地概况本试验依托于农业部岳阳农业环境科学观测试验站,位于湖南省岳阳市麻塘镇(29º23'N,113º06'E),该地区属湿润的大陆性季风气候,年均气温为17 ℃,年降雨量为1 400 mm。本研究基于试验站中的低产红壤旱地改良长期定位试验,建于2012年,2016年开始种植作物。种植作物前施用肥料及改良剂,种植模式为玉米(5-8月)-休闲(8-10月)-油菜(10-5月)轮作。试验共设置7个处理:(1)F(休闲,不施肥不种作物,每年定期将杂草移除);(2)CK(不施肥,种植作物);(3)NPK(施NPK肥);(4)NPKA(施NPK肥及骨粉有机肥);(5)NPKL(施NPK肥及生石灰);(6)NPKS(施NPK肥及小区内上季作物秸秆直接还田);(7)NPKC(施NPK肥及九业生物有机肥),具体施用量如表 1所示。其中,氮肥为尿素,磷肥为钙镁磷肥,钾肥为氯化钾。每个处理设3个重复小区,长8 m,宽3.5 m,面积为28 m2,随机区组排列,具体分布如图 1所示。
|
|
表 1 改良剂施用量及参考标准 Table 1 Dosage of improver applied and reference standard |

|
图 1 小区分布示意图 Fig. 1 Diagram of the experimental plot |
分别于2019年5月和2020年5月油菜收获后取土,分析改良措施影响下连续两年土壤养分及酶活性变化,比较改良年限对酶活性的影响。利用五点取样法采集7种处理小区内0~20 cm、20~40 cm的土样,混匀后四分法取1 kg左右土样,去除动植物残体、石块及其他废弃物。一部分土壤样品过2 mm筛,置于4 ℃冰箱保存,一周内完成土壤酶活性、硝态氮和铵态氮含量的测定。另一部分土壤风干、过筛用于土壤基本理化性质的测定。
1.3 测定方法将风干土过2 mm尼龙筛后测定土壤pH、阳离子交换量,过1 mm尼龙筛后测定碱解氮、速效钾,过0.85 mm尼龙筛后测定有效磷,过0.15 mm尼龙筛后测定土壤有机质、全氮、全磷和全钾等理化性质,所有指标的测定方法均参考《土壤农化分析》[23]。用25 mL 2 mol·L–1 KCl溶液在25 ℃下以200 r·min–1的转速浸提5.0 g土壤中的硝态氮和铵态氮,浸提液在流动分析仪上检测。
对研究土壤中碳氮磷循环有关的α-1,4-葡糖苷酶(αG)、β-1,4-葡糖苷酶(βG)、β-1,4-木糖苷酶(βX)、纤维二糖水解酶(CBH)、亮氨酸氨态酶(LAP)、β-1,4-N-乙酰基氨基葡萄糖酐酶(NAG)和酸性磷酸酶(ACP)以及参与氧化还原过程的多酚氧化酶(POX)和过氧化物酶(PER)活性进行测定,表 2为本研究测定酶种类及底物列表[24]。其中,水解酶活性的测定采用改进的微孔板荧光法[25-26],方法为:称相当于1.000 g干土的鲜土于100 mL洁净的离心管中,向离心管中加入50 mL超纯水,涡旋仪上充分混匀后置于摇床中,在180 r·min–1的转速下震荡30 min。震荡结束,将所有溶液转移至500 mL烧杯中,并用50 mL超纯水冲洗离心管及管盖,在磁力搅拌器的搅拌下向微孔板中加样。每个样品孔、空白孔及淬火标准孔中均加入200 μL土壤悬浮液,阴性对照孔及参考标准孔中则加入200 μL超纯水。然后,样品孔和阴性对照孔中分别加入50 μL底物,参考标准孔和淬火标准孔中加入50 μL标准物质(10 μM的7-amino-4-methylcoumarin(AMC)或4-methylumbelliferone(MUB)),空白孔中加入50 μl超纯水,每个孔均设8个重复。将加好样的微孔板封口后在25 ℃下避光孵育4 h。测定前,向每个孔中加入10 mL 1.0 mol·L–1的NaOH终止反应,在激发光波长为365 nm、发射光波长为450 nm的条件下测定。氧化还原酶采用无色透明酶标板在分光光度计下测定[27],转移悬浮液的方法步骤同上,但不需要添加参考标准孔和淬火标准孔,每个孔仍为8个重复。微孔板封口后在25 ℃下避光孵育24 h,在450 nm波长下测定。土壤酶活性[nmol(g·h)–1]以单位时间内每克土样转化底物的nmol数表示。
|
|
表 2 所测土壤酶列表 Table 2 List of soil enzymes tested |
微孔板荧光法测定土壤酶活性计算公式如下。
水解酶活性计算公式:
| $ 酶活性(\text{nmol}\cdot {\text{h}}^{-1}\cdot {\text{g}}^{-1})=\frac{净荧光值\times 100\text{mL}}{激发系数\times 0.2\text{mL}\times 时间(\text{h})\times 土重(\text{g})} $ | (1) |
| $ \text { 净苂光值(flour) }=\left(\frac{\text { 样品苂光 }-\text { 样品对照 }}{\text { 猝灭系数 }}\right)-\text { 底物对照 } $ | (2) |
| $ \text { 激发系数(flour} \left.\cdot \mathrm{nmol}^{-1}\right)=\frac{\text { 标准苂光 }}{0.5 \mathrm{nmol}} $ | (3) |
| $ \text { 猝灭系数 }=\frac{\text { 标准对照-样品对照 }}{\text { 标准苂光 }}$ | (4) |
氧化还原酶活性计算公式:
| $ \text { 酶活性 }\left(\mathrm{nmol} \cdot \mathrm{h}^{-1} \cdot \mathrm{g}^{-1}\right)=\frac{\text { 冷吸光值 } \times 100 \mathrm{~mL}}{7.9 \mathtt{μ} \mathrm{mol} \times 0.2 \mathrm{~mL} \times \text { 时间 }(\mathrm{h}) \times \text { 土重 }(\mathrm{g})} \times 100 $ | (5) |
| $ \text { 净吸光值 }=\text { 样品吸光值-底物对照-样品对照 } $ | (6) |
土壤酶化学计量的向量长度(Vecctor Length)和向量角度(Vector Angle)计算公式:
| $ \text { 向量长度 }(\text { Vector Length })=\left\{\left[\frac{\mathrm{LN}(\mathtt{β} \mathrm{G})}{\mathrm{LN}(\mathrm{NAG}+\mathrm{LAP})}\right]-\left[\frac{\mathrm{LN}(\mathtt{β} \mathrm{G})}{\mathrm{LN}(\mathrm{ACP})}\right]^{2}\right\} 0.5 $ | (6) |
| $ \text { 向量长度 }(\text { Vector Angle })=\text { Degrees }\left\{\operatorname{ATAN2}\left[\frac{\mathrm{LN}(\mathtt{β} \mathrm{G})}{\mathrm{LN}(\mathrm{ACP})}, \frac{\mathrm{LN}(\mathtt{β} \mathrm{L})}{\mathrm{LN}(\mathrm{NAG}+\mathrm{LAP})}\right]\right\} $ | (7) |
式中,向量长度(Vector Length)越长,代表土壤养分循环受碳限制越强。向量角度(Vector Angle) < 45º和向量角度(Vector Angle) > 45º分别表示土壤养分循环有较强的氮限制和磷限制[28],向量角度(Vector Angle)= 45º表示土壤养分循环受氮磷养分的限制效果相同[29]。
利用SPSS 24.0单因素方差分析(one-way ANOVA)分析比较不同处理pH及养分含量差异,多元方差分析比较处理、年际和土层及其交互作用对酶活性的影响,独立样本T检验比较2019年和2020年酶活性的差异,Pearson相关分析确定土壤酶活性与pH、养分含量之间的联系性,显著性水平均设为P < 0.05。土壤酶活性变化柱状图由Microsoft Excel绘制,酶活性与养分指标之间的关系由Canoco 5软件绘制冗余分析图(Redundancy analysis,RDA)来展示。
2 结果 2.1 不同改良措施下红壤pH及养分含量变化表 3和表 4分别为2019年和2020年不同改良措施下红壤pH和养分含量的变化。可以看出,不同改良措施对20~40 cm土层pH及养分含量的影响不显著,因此接下来主要对不同改良措施对0~20 cm土层pH及养分含量的影响进行分析。0~20 cm土层,无机肥配施生石灰(NPKL)改良后,土壤pH显著提高。无机肥配施其他改良剂(NPKA、NPKC和NPKS)后,土壤中有机质、全氮、全磷和有效磷含量显著高于CK。其中,NPKC处理2019年土壤有机质、全氮、全磷和有效磷含量分别较CK提高了46%、6%、35%和957%,2020年分别提高了73%、29%、61%和1 847%。连续两年改良后,土壤有机质含量均以NPKA处理中最高,分别为10.51 g·kg–1和12.00 g·kg–1。
|
|
表 3 2019年不同改良措施下红壤的pH和养分含量 Table 3 pH and nutrient content of red soil under different improvement measures in 2019 |
|
|
表 4 2020年不同改良措施下红壤的pH和养分含量 Table 4 pH and nutrient content of red soil under different improvement measures in 2020 |
多元方差分析比较处理、年际和土层及其交互作用对pH及养分含量的影响结果如表 5所示。从表中可以看出,处理与年际的交互以及处理、年际和土层三者交互对红壤pH及养分含量并无显著影响。处理、土层以及两者的交互作用可显著影响红壤中有机质、全氮、全磷、碱解氮和有效磷的含量(P < 0.05),而年际仅对全氮和碱解氮含量影响显著(P < 0.05)。这说明处理和土层对红壤pH及养分含量变化的影响程度大于年际。
|
|
表 5 多元方差分析比较处理、年际和土层及其交互作用对pH及养分含量的影响 Table 5 MANOVA analysis was used to compare the effects of treatments, interannual and soil layers and their interactions on pH and nutrient contents |
图 2是2019年和2020年两土层土壤酶活性的变化。在0~20 cm土层,NPKL中αG、βG、βX和CBH等碳循环酶活性显著低于NPK,氮循环LAP酶活性显著高于其他处理,磷循环ACP酶活性显著降低。NPKS中,碳循环αG、βG、βX和CBH酶,氮循环NAG酶和磷循环ACP酶活性均显著高于CK,其中CBH酶活性为CK的5.58倍(2019年)和4.93倍(2020年)。NPK、NPKA和NPKC处理均可显著提升土壤中碳循环αG、βG、βX和CBH酶活性,NPKA和NPKC还可提高土壤中氮循环NAG酶活性。

|
注:同一年同一土层柱上不同小写字母表示处理间差异显著(P < 0.05)。 Note: Different lowercase letters on the same soil column in the same year indicate significant differences between treatments(P < 0.05). 图 2 2019年和2020年两个土层土壤酶活性的变化 Fig. 2 Changes in the activity of soil enzymes in two soil layers in |
比较两土层酶活性发现,2019年0~20 cm土层NPKA和NPKC处理中CBH酶活性分别较CK提高了352%和142%,而在20~40 cm土层其CBH酶活性仅分别较CK提高了2%和29%。表 6结果进一步证实处理、土层、年际及其交互作用均可显著影响土壤中碳氮磷循环有关酶活性(P < 0.05)。将两年土壤酶活性进行独立性T检验发现,两年土壤中ACP酶活性差异显著(P < 0.05),随改良年限的增加,土壤ACP酶活性显著增加。综上可知,土壤酶活性对不同改良措施的响应不同,不同改良措施对0~20 cm土层的改良效果优于20~40 cm土层,且随改良时间的增加,改良效果逐渐显著。
|
|
表 6 多元方差分析比较处理、年际和土层及其交互作用对红壤酶活性的影响 Table 6 MANOVA analysis was used to compare the effects of treatments, interannual and soil layers and their interactions on soil enzyme activities |
表 7为不同改良措施对红壤酶活性化学计量的影响。根据酶活性化学计量的向量长度和向量角度可知,各处理土壤均受到碳养分和磷养分的限制,2019年0~20 cm土层NPK受碳养分和磷养分的限制程度显著大于添加改良剂的处理(NPKA、NPKL、NPKS、NPKC),但其受磷养分的限制程度显著小于CK;2020年0~20 cm土层中,NPKA和NPKS受碳素的限制程度较高,NPKL受氮素限制,NPK、NPKA、NPKS、NPKC、F和CK均受磷素的限制,且F中磷素限制最大。20~40 cm土层仍以F受磷素限制最大,相比于2019年,2020年添加改良剂的处理(NPKA、NPKL、NPKS、NPKC)中碳素和磷素养分的限制程度显著大于NPK处理,小于CK和F处理,说明施用改良剂后可以有效激活土壤0~20 cm土层的养分,但由于贫瘠红壤养分亏缺严重,连续3~4 a改良还不足以有效促进20~40 cm土层养分状况的改善。
|
|
表 7 不同改良措施对红壤酶活性化学计量的影响 Table 7 Effects of different improvement measures on the stoichiometry of enzyme activity of red soil |
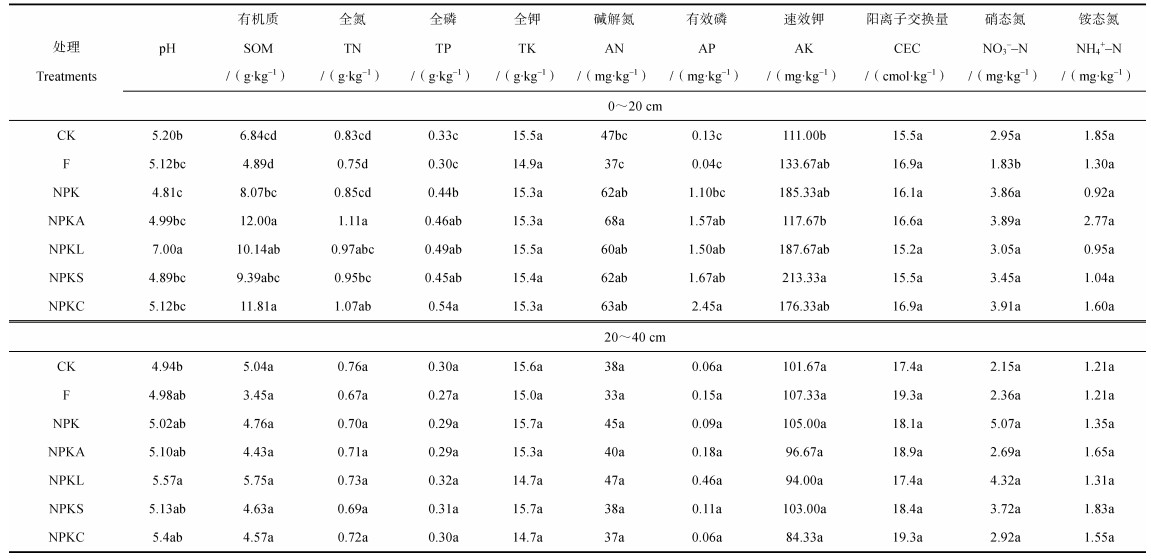
(1)土壤酶活性与土壤养分含量的RDA分析。图 3a和图 3b分别为0~20 cm和20~40 cm土层养分含量与土壤酶活性的冗余分析结果,探究影响土壤酶活性变化的关键因子。图 3a中解释变量可解释模型的52.48%(P < 0.05)。从图中可以看出,0~20 cm土层NPKA、NPKS和NPKC明显聚类且主要受土壤SOM(18.4%,F=9.0,P=0.002)、TP(22.3%,F=11.5,P=0.002)、AN(19.2%,F=9.5,P=0.002)等养分含量的影响,CK和F聚类,受土壤养分含量的影响较小,NPKL处理酶活性单独聚类主要受土壤pH变化的影响(20.8%,F=14.3,P=0.002)。图 3b中解释变量可解释模型的28.09%(P < 0.05)。从图中可以看出,20~40 cm土层各处理没有单独聚类,表明不同改良措施对该土层酶活性影响不显著。由RDA分析结果可知,不同改良措施对红壤0~20 cm土层中酶活性的影响更显著,添加石灰显著提高土壤的pH进而提高土壤中LAP活性,而其他改良措施则通过改变土壤养分状况来影响土壤酶活性。
|
图 3 0~20 cm(a)和20~40 cm(b)土层土壤养分含量与酶活性的RDA分析 Fig. 3 RDA analysis of soil nutrient content and enzyme activities in soil layers 0~20 cm(a)and 20~40 cm(b) |
(2)土壤酶活性与土壤养分含量的相关性。表 8是0~20 cm、20~40 cm土层酶活性与土壤养分含量的相关性分析,明确酶活性变化及土壤养分含量之间的相互关系。从表中可以看出,0~20 cm土层,αG、βG、βX、CBH、NAG与SOM、TP、AN、AP呈极显著正相关(P < 0.01),ACP和POX与NO3–-N极显著正相关(P < 0.01),LAP、ACP和PER与pH呈极显著(P < 0.01)或显著相关(P < 0.05)。与0~20 cm土层相比,20~40 cm土层仅βG和CBH活性与SOM、TP、AN、AP呈呈极显著正相关(P < 0.01),LAP活性只与AN具有显著相关性(P < 0.05),ACP和POX与AP呈显著负相关(P < 0.05)。两土层中碳循环βG和CBH酶连续两年均表现出主要受SOM、TP、AN和AP的影响,pH对其影响不显著。
|
|
表 8 0~20 cm和20~40 cm土层酶活性与土壤养分含量的相关性 Table 8 The correlation between soil enzyme activity and soil nutrient content in 0~20 cm and 20~40 cm soil layers |
通过对比休闲(F)、不施肥(CK)、单施无机肥(NPK)、无机肥配秸秆还田(NPKS)、无机肥配施生石灰(NPKL)、无机肥配施骨粉有机肥(NPKA)和无机肥配施生物有机肥(NPKC)等改良措施对红壤肥力的改良效果发现,与CK相比,不同改良措施对红壤20~40 cm土层pH及养分含量的影响并不显著,但却显著提高了贫瘠红壤0~20 cm土层有机质、全氮、全磷和有效磷的含量,且以NPKA和NPKC在提升土壤有机质方面发挥的作用最为重要。该结果与Ai等[30]的长期试验结果发现添加有机肥可以提高土壤中有机质含量相一致。与NPK相比,NPKA和NPKC也可以提高土壤pH,但效果不如NPKL显著,因为生石灰含有较高的CaO,主要通过酸碱中和提高土壤碱浓度以中和土壤酸性[31],而有机肥则通过其包含的具有羟基和羧基官能团的腐殖质中和土壤酸性[32],过程较缓慢,但具有一定的缓冲性和持久性。研究发现NPKS中有机质、全氮和全磷的含量也有所提升,与无机肥配施有机改良剂对比发现,三种改良措施对土壤中有机质、全氮和全磷含量的提升效果分别为:2019年,NPKA > NPKC≈NPKS;2020年,NPKA > NPKC > NPKS,这可能是由于生物有机肥分解速度快,可以迅速补充土壤中有机质、全氮和全磷含量,而秸秆的主要成分是纤维素和木质素,较难降解,但是秸秆本身含有丰富的氮磷钾等元素,因此秸秆还田仍能实现改善和提高土壤地力的目的,只是过程较缓慢。综上可知,NPKA和NPKC处理对酸性贫瘠红壤养分的提升效果好且更为持久。
3.2 不同改良措施对土壤酶活性的影响通过比较不同改良措施对酸性红壤酶活性的影响发现,与CK相比,NPKA和NPKC可显著提高土壤中碳氮循环αG、βG、βX、CBH和NAG酶活性。一方面是因为NPKA和NPKC中有机质含量显著高于CK,可以为土壤微生物提供充足的营养,使得微生物代谢旺盛进而提升土壤酶活性;另一方面则是因为有机物料可以缓解土壤酸化,改善土壤结构,提高土壤保水保肥能力和微生物的数量,进而提高酶活性[33]。与NPK相比,NPKA和NPKC处理对土壤碳循环αG、βG、βX和CBH酶活性的提升效果更好。可能是由于NPKA和NPKC处理除了增加了贫瘠红壤中的氮磷养分外,还以外源碳源的形式增加了土壤中有机质含量,而参与碳循环的水解酶能吸附于土壤有机质上,形成一种具有较强抗分解能力和热稳定性的“酶-腐殖质复合物”,更利于土壤酶的生存[34]。此外,NPKS也能显著提高土壤中碳循环相关的酶活性,NPKL则显著抑制αG、βG、βX和CBH酶活性,这可能与不同酶的底物和土壤pH有关。碳循环有关的βX参与水解木质素,αG、βG和CBH参与水解纤维素[35],秸秆的碳主要以纤维素和木质素的形式存在[18],因此对土壤进行秸秆还田使参与土壤碳循环的酶底物增多,从而提高碳循环有关酶的活性。但添加生石灰后,显著提升了红壤的pH,却超过了碳循环有关酶的最适pH范围[36-38],从而抑制了这些功能酶活性。结合不同改良措施对红壤养分含量影响的结果(表 3和表 4)来看,NPKA和NPKC处理对提升红壤功能酶活性、促进养分循环的效果更优。无机肥配施有机改良剂可以通过提高土壤肥力,促进土壤酶与有机质的结合,增强其在土壤中的稳定性[39],进而影响土壤酶活性,改善土壤养分循环状况,最终实现土壤改良的作用。
不同改良剂的添加除了对红壤表层酶活性产生影响外,也会对不同土层深度的酶有不同影响。本研究中对土壤0~20 cm表层土壤酶活性的改善状况显著高于20~40 cm土层,可能是因为土壤表层积累了较多的腐殖质从而使表层土壤的有机质含量高(表 3和表 4),养分状况良好,有利于土壤微生物的生存从而使表层土壤酶活性较高[40],随着土壤深度的增加,一方面土壤中空气、养分含量以及动植物残体等减少,土壤中有机质含量减少,使土壤酶活性降低;另一方面土壤容重增大,孔隙减小,微生物的代谢速率受限从而使酶活性降低[41]。
随着改良时间的延长,0~20 cm土层不同改良措施土壤中磷循环ACP酶活性增加,这可能是因为缺磷微生物分泌ACP酶以适应生存环境,但是因为本研究中全磷含量低于0.8 g·kg–1,土壤始终处于供磷不足的状态,因此土壤中全磷对ACP酶活性之间的相关性并不显著。相关性分析(表 8)表明ACP酶活性与全氮呈极显著正相关(P < 0.01),且Marklein和Houlton [42]的研究表明,氮肥可以增强土壤中ACP酶活性,可能因为氮循环和磷循环之间广泛耦合,ACP酶活性对氮和磷的变化高度敏感,随着土壤中全氮含量的升高,土壤中磷循环速度加快,从而使土壤中ACP酶活性增强。还有研究也表明在磷限制的环境中,随着氮含量的增加,ACP酶活性增强[43]。
3.3 土壤养分指标状况与土壤酶活性间的关系土壤养分含量与土壤酶活性可以共同表征土壤的肥力水平。由土壤酶活性与养分含量的RDA分析(图 3)和相关性分析(表 8)可知,在本研究中0~20 cm土层,碳氮循环αG、βG、βX、CBH和NAG酶与SOM呈极显著正相关,根据以往的研究可知土壤有机质是酶促反应的主要底物,当土壤中有机质含量增加时,可以极大地促进土壤微生物的系列活动从而使土壤酶活性提高[44-45]。此外,土壤酶也可以和有机质相结合增强其稳定性。很多研究还认为土壤pH也与酶活性的变化显著相关[46-47]。本研究中LAP和PER酶活性随pH的升高而增大,而磷循环ACP酶与pH则极显著负相关,推测一方面可能是因为土壤pH通过诱导酶结构的变化、酶活性部位催化基团的功能特性或者影响土壤中底物和酶辅助因子的可利用性进而对土壤酶活性产生影响[48];另一方面可能是因为pH通过影响土壤中微生物的群落组成、生态位和群落活性来影响酶活性。对比两土层土壤酶活与养分变化关系发现,20~40 cm土层土壤酶活性与土壤养分含量之间的相关关系不如0~20 cm土层显著,但两土层中酶活性与养分的变化趋势基本一致(表 8)。由于本研究的长期定位试验年限较短(2016年开始种作物),且研究红壤非常贫瘠,不同改良措施对土壤酶活性的影响仅在0~20 cm土层发生了显著变化,探究不同改良措施对20~40 cm土层酶活性的影响仍需进一步观察。
4 结论无机肥配施石灰能显著提高红壤的pH,改善红壤酸化状况,但其对提高土壤养分含量和土壤酶活性的促进作用不显著。而无机肥配施有机物料可通过显著提升贫瘠红壤中有机质、氮磷等养分含量,进而改善土壤中碳氮循环αG、βG、βX、CBH和NAG酶活性。因此,认为无机肥配施骨粉有机肥或生物有机肥可作为改善贫瘠红壤养分、提升土壤地力的可持续性改良措施。土壤中αG、βG、βX、CBH和NAG等参与碳氮循环的酶活性与土壤有机质含量密切相关。在磷供应不足的情况下,磷循环ACP酶与表层土壤氮含量显著相关(P < 0.01),LAP、PER和ACP可作为反映表层土壤pH变化的重要酶活指标。通过对部分酶活性指标的测定可以评价不同改良措施对酸性红壤的改良效果。
| [1] |
Cai Z J, Sun N, Wang B R, et al. Effects of long-term fertilization on pH of red soil, crop yields and uptakes of nitrogen, phosphorous and potassium (In Chinese)[J]. Plant Nutrition and Fertilizer Science, 2011, 17(1): 71-78. [长期施肥对红壤pH、作物产量及氮、磷、钾养分吸收的影响[J]. 植物营养与肥料学报, 2011, 17(1): 71-78.]
(  0) 0) |
| [2] |
Liu K L, Hu Z H, Ye H C, et al. Long-term fertilization changes soil nitrogen and phosphorus activation in red soil under double maize system (In Chinese)[J]. Journal of Soil and Water Conservation, 2016, 30(2): 187-192. [双季玉米种植下长期施肥改变红壤氮磷活化能力[J]. 水土保持学报, 2016, 30(2): 187-192.]
(  0) 0) |
| [3] |
Li X Y. Soil chemistry (In Chinese). Beijing: Higher Education Press, 2001: 218. [土壤化学[M]. 北京: 高等教育出版社, 2001: 218.]
(  0) 0) |
| [4] |
Yu T Y, Sun X S, Shi C R, et al. Advances in soil acidification hazards and control techniques (In Chinese)[J]. Chinese Journal of Ecology, 2014, 33(11): 3137-3143. [土壤酸化危害及防治技术研究进展[J]. 生态学杂志, 2014, 33(11): 3137-3143.]
(  0) 0) |
| [5] |
荀卫兵. 长期不同施肥下旱地红壤细菌群落结构特征及驱动因子的探究[D]. 南京: 南京农业大学, 2015. Xun W B. Upland red soil bacterial community structure under long-term different fertilizations and the driving factor[D]. Nanjing: Nanjing Agricultural University, 2015 (  0) 0) |
| [6] |
何翠翠. 长期不同施肥措施对黑土土壤碳库及其酶活性的影响研究[D]. 北京: 中国农业科学院, 2014. He C C. Effects of long-term fertilization on soil carbon pools and enzymes activity of black soil in cropland of northeast China[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014 (  0) 0) |
| [7] |
Sánchez M E, Lindao E, Margaleff D, et al. Pyrolysis of agricultural residues from rape and sunflowers: Production and characterization of bio-fuels and biochar soil management[J]. Journal of Analytical and Applied Pyrolysis, 2009, 85(1/2): 142-144.
(  0) 0) |
| [8] |
冀保毅. 深耕与秸秆还田的土壤改良效果及其作物增产效应研究[D]. 郑州: 河南农业大学, 2013. Ji B Y. Research on the effect of deep tillage and straw retained improve soil quality and enhance the yield of crop[D]. Zhengzhou: Henan Agricultural University, 2013 (  0) 0) |
| [9] |
Yang Y G, Wang S L, Liu G, et al. Effects of bio-organic fertilizer on yield and quality of flue-cured tobacco and soil improvement (In Chinese)[J]. Chinese Tobacco Science, 2012, 33(4): 70-74. [生物有机肥对烤烟产质量及土壤改良的影响[J]. 中国烟草科学, 2012, 33(4): 70-74.]
(  0) 0) |
| [10] |
于翔宇. 施用石灰与生物炭对酸性土壤竹豆生长及养分吸收的影响[D]. 重庆: 西南大学, 2018. Yu X Y. The effects of applying lime and biochar on the growth and nutrient uptake of phaseotus calcaltus roxb in acid soils[D]. Chongqing: Southwest University, 2018 (  0) 0) |
| [11] |
Liu S J, Xia X, Chen G M, et al. Study progress on functions and affecting factors of soil enzymes (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2011, 27(21): 1-7. [土壤酶的研究进展[J]. 中国农学通报, 2011, 27(21): 1-7.]
(  0) 0) |
| [12] |
Acosta-Martínez V, Moore-Kucera J, Cottona J, et al. Soil enzyme activities during the 2011 Texas record drought/heat wave and implications to biogeochemical cycling and organic matter dynamics[J]. Applied Soil Ecology, 2014, 75: 43-51. DOI:10.1016/j.apsoil.2013.10.008
(  0) 0) |
| [13] |
Bandick A K, Dick R P. Field management effects on soil enzyme activities[J]. Soil Biology & Biochemistry, 1999, 31(11): 1471-1479.
(  0) 0) |
| [14] |
Ndiaye E L, Sandeno J M, McGrath D, et al. Integrative biological indicators for detecting change in soil quality[J]. American Journal of Alternative Agriculture, 2000, 15: 26-36. DOI:10.1017/S0889189300008432
(  0) 0) |
| [15] |
Wang J Y, Hayes F, Turner R, et al. Effects of four years of elevated ozone on microbial biomass and extracellular enzyme activities in a semi-natural grassland[J]. Science of the Total Environment, 2019, 660: 260-268. DOI:10.1016/j.scitotenv.2019.01.040
(  0) 0) |
| [16] |
Acosta-Martínez V, Zobeck T M, Gill T E, et al. Enzyme activities and microbial community structure in semiarid agricultural soils[J]. Biology and Fertility of Soils, 2003, 38(4): 216-227. DOI:10.1007/s00374-003-0626-1
(  0) 0) |
| [17] |
Guan S Y. Soil enzymes and soil fertility (In Chinese)[J]. Chinese Journal of Soil Science, 1980, 11(6): 41-44. [土壤酶与土壤肥力[J]. 土壤通报, 1980, 11(6): 41-44.]
(  0) 0) |
| [18] |
Huang S S, Cheng Y H, Zhong Y J, et al. Effects of soil and water conservation measures on soil labile organic carbon and soil enzyme activity in gentle slope land of red soil (In Chinese)[J]. Acta Pedologica Sinica, 2016, 53(2): 468-476. [水土保持措施对红壤缓坡地土壤活性有机碳及酶活性的影响[J]. 土壤学报, 2016, 53(2): 468-476.]
(  0) 0) |
| [19] |
Deng X H, Yang Z Y, Li Y H, et al. Effects of amendment application on enzyme activities and nutrient contents in tobacco-planting soils (In Chinese)[J]. Tobacco Science & Technology, 2019, 52(2): 33-39. [施用改良剂对植烟土壤酶活性和养分含量的影响[J]. 烟草科技, 2019, 52(2): 33-39.]
(  0) 0) |
| [20] |
Ai C, Liang G Q, Sun J W, et al. The alleviation of acid soil stress in rice by inorganic or organic ameliorants is associated with changes in soil enzyme activity and microbial community composition[J]. Biology and Fertility of Soils, 2015, 51(4): 465-477. DOI:10.1007/s00374-015-0994-3
(  0) 0) |
| [21] |
Zeng X B, Li J M, Xu M G, et al. Fertility of red upland soil and effects of fertilization and utilization on its fertility (In Chinese)[J]. Chinese Journal of Soil Science, 2006, 37(3): 434-437. DOI:10.3321/j.issn:0564-3945.2006.03.005 [红壤旱地的肥力现状及施肥和利用方式的影响[J]. 土壤通报, 2006, 37(3): 434-437.]
(  0) 0) |
| [22] |
Zeng X B. Acidification of red soils and control methods (In Chinese)[J]. Chinese Journal of Soil Science, 2000, 31(3): 111-113. DOI:10.3321/j.issn:0564-3945.2000.03.005 [红壤酸化及其防治[J]. 土壤通报, 2000, 31(3): 111-113.]
(  0) 0) |
| [23] |
Bao S D. Soil agrochemical analysis (In Chinese). Beijing: China Agriculture Press, 2000: 25-100. [土壤农化分析[M]. 北京: 中国农业出版社, 2000: 25-100.]
(  0) 0) |
| [24] |
Qin Y N. Biocatalyst-Handbook of enzyme catalysis (In Chinese). Beijing: Chemical Industry Press, 2015: 228-270. [生物催化剂--酶催化手册[M]. 北京: 化学工业出版社, 2015: 228-270.]
(  0) 0) |
| [25] |
Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology & Biochemistry, 2002, 34(9): 1309-1315.
(  0) 0) |
| [26] |
Marx M C, Wood M, Jarvis S C. A microplate fluorimetric assay for the study of enzyme diversity in soils[J]. Soil Biology & Biochemistry, 2001, 33(12/13): 1633-1640.
(  0) 0) |
| [27] |
DeForest J L. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and l-DOPA[J]. Soil Biology & Biochemistry, 2009, 41(6): 1180-1186.
(  0) 0) |
| [28] |
Moorhead D L, Rinkes Z L, Sinsabaugh R L, et al. Dynamic relationships between microbial biomass, respiration, inorganic nutrients and enzyme activities: informing enzyme-based decomposition models[J]. Frontiers in Microbiology, 2013, 4: 223-234.
(  0) 0) |
| [29] |
Burpee B, Saros J E, Northington R M, et al. Microbial nutrient limitation in Arctic lakes in a permafrost landscape of southwest Greenland[J]. Biogeosciences, 2016, 13(2): 365-374. DOI:10.5194/bg-13-365-2016
(  0) 0) |
| [30] |
Ai C, Liang G Q, Sun J W, et al. Responses of extracellular enzyme activities and microbial community in both the rhizosphere and bulk soil to long-term fertilization practices in a fluvo-aquic soil[J]. Geoderma, 2012, 173/174: 330-338. DOI:10.1016/j.geoderma.2011.07.020
(  0) 0) |
| [31] |
Li P, Wang X X, Zhang T L, et al. Effects of several amendments on rice growth and uptake of copper and cadmium from a contaminated soil[J]. Journal of Environmental Sciences, 2008, 20(4): 449-455. DOI:10.1016/S1001-0742(08)62078-1
(  0) 0) |
| [32] |
Tan K H, Leonard R A, Bertrand A R, et al. The metal complexing capacity and the nature of the chelating ligands of water extract of poultry litter[J]. Soil Science Society of America Journal, 1971, 35(2): 265-269. DOI:10.2136/sssaj1971.03615995003500020026x
(  0) 0) |
| [33] |
Lu Y H, Yang Z P, Zheng S X, et al. Effects of long-term application of chemical fertilizer, pig manure, and rice straw on chemical and biochemical properties of reddish paddy soil (In Chinese)[J]. Chinese Journal of Applied Ecology, 2010, 21(4): 921-929. [长期施用化肥、猪粪和稻草对红壤水稻土化学和生物化学性质的影响[J]. 应用生态学报, 2010, 21(4): 921-929.]
(  0) 0) |
| [34] |
Huang Q Y, Li X Y. Effects of clay minerals and organic matter on enzyme activities (In Chinese)[J]. Progress in Soil Science, 1995, 23(4): 12-18. [粘粒矿物、有机质对酶活性的影响[J]. 土壤学进展, 1995, 23(4): 12-18.]
(  0) 0) |
| [35] |
Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798. DOI:10.1038/nature08632
(  0) 0) |
| [36] |
Liu Q, Li D J, Chen L L, et al. Cloning and expression of α-glucosidase gene from Thermotoga neapolitana and study on the enzymatic properties (In Chinese)[J]. Food and Fermentation Technology, 2013, 49(1): 4-7. [栖热袍菌α-葡糖苷酶的基因克隆表达及酶学性质[J]. 食品与发酵科技, 2013, 49(1): 4-7.]
(  0) 0) |
| [37] |
Zhou J, Yin P. Mechanisms of pH control on β-glucosidase produced in Trichoderma reesei (In Chinese)[J]. Journal of Tsinghua University: Science and Technology, 2012, 52(2): 271-276. [pH调控对里氏木霉菌产β-葡萄糖苷酶的影响机制[J]. 清华大学学报: 自然科学版, 2012, 52(2): 271-276.]
(  0) 0) |
| [38] |
Huang Y, Yao X Y, Liu T F, et al. Biochemical characterization of a novel thermostable β-1, 4-xylosidase from Caldicellulosiruptor owensensis OL (In Chinese)[J]. Acta Microbiologica Sinica, 2019, 59(4): 689-699. [新型耐热β-1, 4-木糖苷酶的重组表达及酶学性质[J]. 微生物学报, 2019, 59(4): 689-699.]
(  0) 0) |
| [39] |
Liang L, Ma C, Zhang R, et al. Improvement of soil nutrient availability and enzyme activities in rainfed wheat field by combined application of organic and inorganic fertilizers (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(4): 544-554. [有机无机肥配施提高旱地麦田土壤养分有效性及酶活性[J]. 植物营养与肥料学报, 2019, 25(4): 544-554.]
(  0) 0) |
| [40] |
Wang B, Xue S, Liu G B, et al. Changes in soil nutrient and enzyme activities under different vegetations in the Loess Plateau area, Northwest China[J]. Catena, 2012, 92: 186-195. DOI:10.1016/j.catena.2011.12.004
(  0) 0) |
| [41] |
Han X N. Briefly on soil enzyme's function and effect on the quality of soil environment (In Chinese)[J]. Inner Mongolia Agricultural Science and Technology, 2008, 36(4): 90-92. DOI:10.3969/j.issn.1007-0907.2008.04.045 [土壤酶对土壤环境质量的作用及影响[J]. 内蒙古农业科技, 2008, 36(4): 90-92.]
(  0) 0) |
| [42] |
Marklein A R, Houlton B Z. Nitrogen inputs accelerate phosphorus cycling rates across a wide variety of terrestrial ecosystems[J]. New Phytologist, 2012, 193(3): 696-704. DOI:10.1111/j.1469-8137.2011.03967.x
(  0) 0) |
| [43] |
Olander L P, Vitousek P M. Regulation of soil phosphatase and chitinase activity by N and P availability[J]. Biogeochemistry, 2000, 49(2): 175-191. DOI:10.1023/A:1006316117817
(  0) 0) |
| [44] |
Taylor J P, Wilson B, Mills M S, et al. Comparison of microbial of microbial numbers and enzymatic activities in surface and subsoils using various techniques[J]. Soil Biology & Biochemistry, 2002, 34: 387-401.
(  0) 0) |
| [45] |
Sui Y Y, Jiao X G, Gao C S, et al. The relationship among organic matter content and soil microbial biomass and soil enzyme activities (In Chinese)[J]. Chinese Journal of Soil Science, 2009, 40(5): 1036-1039. [土壤有机质含量与土壤微生物量及土壤酶活性关系的研究[J]. 土壤通报, 2009, 40(5): 1036-1039.]
(  0) 0) |
| [46] |
Liu H M, Zhou G F, Li J, et al. Effects of nitrogen deposition on soil enzyme activities of Stipa baicalensis steppe (In Chinese)[J]. Ecology and Environmental Sciences, 2018, 27(8): 1387-1394. [氮沉降对贝加尔针茅草原土壤酶活性的影响[J]. 生态环境学报, 2018, 27(8): 1387-1394.]
(  0) 0) |
| [47] |
Si G C, Yuan Y L, Wang J, et al. Microbial community and soil enzyme activities along an altitudinal gradient in Sejila mountains (In Chinese)[J]. Microbiology China, 2014, 41(10): 2001-2011. [藏东南森林土壤微生物群落结构与土壤酶活性随海拔梯度的变化[J]. 微生物学通报, 2014, 41(10): 2001-2011.]
(  0) 0) |
| [48] |
Yao H Y, Bowman D, Rufty T, et al. Interactions between N fertilization, grass clipping addition and pH in turf ecosystems: Implications for soil enzyme activities and organic matter decomposition[J]. Soil Biology & Biochemistry, 2009, 41(7): 1425-1432.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59